Анальгетическая эффективность поперечного плоскостного блока живота после кесарева сечения: рандомизированное контролируемое исследование
John G. McDonnell, MB, FCARCSI*, Gerard Curley, MB*,
John Carney, MB*,
Aoife Benton, MB, Joseph Costello,
MB, FCARCSI*, Chrisen H. Maharaj, MB, BSc,
FCARCSI, DPM*, and John G. Laffey, MD, MA, BSc, FCARCSI*
*Department of Anaesthesia, Clinical Sciences Institute,
Centre for Pain Research, National University of Ireland;
and Department of Anaesthesia and Intensive Care Medicine,
University Hospital Galway, Galway, Ireland.
Реферат живота (АР) блок является эффективным методом обеспечения послеоперационной аналгезии, у больных перенесших срединные лапаротомные разрезы. Мы оценивали его аналгетическую эффективность в первые 48 часов послеоперационно после родоразрешения путем кесарева сечения, выполненного через аздрез Pfannensteil , в рандомизированном, контролируемом, двойном слепом, клиническом исследовании.
МЕТОДЫ: Пятьдесят женщин, перенесших плановое родоразрешение путем кесарева сечения, были распределены, чтобы перенести ТАР блок ропивакаином (n = 25) против плацебо (n = 25), в дополнение к стандартной послеоперационной аналгезии, включающей управляемую пациентом IV аналгезию морфином и регулярный диклофенак и парацетамол. Все пациентки получали стандартную спинальную анестезию и, в конце операции, выполнялся двусторонний ТАР блок с использованием 1.5 мг/кг ропивакаина (в максимальной дозе 150 мг) или солевой раствор с каждой стороны. Каждая пациентка оценивалась послеоперационно исследователем, не знающим о групповом распределении: в отделении постнаркозного лечения через 2, 4, 6, 12, 24, 36, и 48 часов послеоперационно.
РЕЗУЛЬТАТЫ: ТАР блок ропивакаином по сравнению с плацебо снижал послеоперационную оценку боли по визуальной аналоговой шкале. Среднее значение (± sd) полной потребности морфина в первые 48 часов послеоперационно было также снижено (66±26 против 18±14 мг, P <0.001), как и расход морфина за 12-часовые интервалы в течение 36 часов послеоперационно. Частота развития седативного эффекта была снижена у больных, перенесших ТАР блок. Не было никаких осложнений, относящихся к ТАР блоку.
ЗАКЛЮЧЕНИЕ: ТАР блок, как компонент мультимодального аналгетического режима, обеспечивал превосходящий, при сравнении с плацебо, блок спустя 48 часов послеоперационно после планового родоразрешения путем кесарева сечения.
Родоразрешение путем кесарева сечения – основная операция в акушерстве, после которой может ожидаться реальный послеоперационный дискомфорт или боль.[1] Эффективная послеоперационная аналгезия имеет ключевое значение для облегчения ранней активизации, ухода за новорожденным (включая кормление грудью, связь матери с ребенком) и профилактики осложнений послеоперационного периода.[1] Целью аналгетического режима является обеспечение безопасной, эффективной аналгезии, с минимальными побочными эффектами для матери и ребенка.
Значительный компонент боли, испытываемой пациентами после абдоминальных операций, порождается разрезом передней брюшной стенки. Боковая брюшная стенка с обеих сторон состоит из трех слоев мышц: наружной косой, внутренней косой и поперечной мышцы живота и их фасциальных оболочек. Передняя брюшная стенка также включает прямую мышцу живота и ее фасциальную оболочку. Нервы, иннервирующие переднюю брюшную стенку проходят через нейро-фасциальную плоскость между внутренней косой мышцей и поперечной мышцей живота.[2] Основываясь на анатомических исследованиях, наша группа идентифицировала поясничный треугольник Petit как точку доступа к этой нейро-фасциальной плоскости (рис. 1).
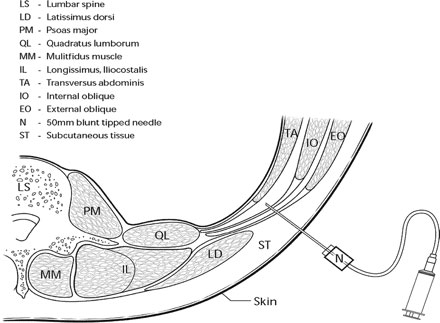 |
| Рисунок 1. Схема линии поперечного брюшной стенки на уровне поясничного треугольника Petit (ТОР). Дно треугольника представлено вглубь от поверхности фасциальной частью наружной косой, внутренней косой и поперечной мышцы живота соответственно и брюшиной. Игла введена через треугольник, используя методику потери сопротивления. Игла изображена в поперечной плоскости живота, а фасциальные слои разделились в результате иньекции местного анестетика. |
Этот треугольник ограничивается сзади широчайшей мышцей спины, спереди - наружной косой и снизу - подвздошным гребнем. Подвздошный гребень служит фиксированным и легко пальпируемым ориентиром.[3] Основание треугольника, от поверхностности глубь состоит из подкожной клетчатки и фасциальных границ наружной косой, внутренней косой и поперечной мышцы живота соответственно (рис. 1). Вводя местные анестетики в поперечную плоскость живота (ТАР) через треугольник Petit , зможно заблокировать чувствительные нервы передней брюшной стенки раньше, чем они оставят эту плоскость и проникнут в мускулатуру, чтобы иннервировать всю переднюю брюшную стенку. [4]
Мы недавно продемонстрировали эффективность ТАР блока в обеспечении послеоперационной аналгезии у пациентов, перенесших операцию через срединный лапаротомный разрез.[4] Кроме того, ТАР блок, как сообщалось, обеспечивал эффективную аналгезию среди пациентов, перенесших радикальную простатэктомию. [5] Мы выдвинули гипотезу, что ТАР блок, как часть мультимодального аналгетического режима, приведет к снижению расхода опиоидов и улучшению качества аналгезии в первые 48 часов после родоразрешения путем кесарева сечения по сравнению с блоком плацебо. Целью этого исследования была проверка этой гипотезы и наблюдение побочных эффектов, у больных перенесших плановое родоразрешение путем кесарева сечения через разрез брюшной стенки по Pfannenstiel .
МЕТОДЫ
После одобрения Госпитальным Комитетом по Этике и получения письменного согласия пациента на основе полной информированности, мы изучали 50 пациенток физического статуса ASA I - III , подвергнутых родоразрешению путем планового кесарева сечения через разрез Pfannenstiel , в рандомизированном двойном слепом контролируемом клиническом исследовании. Пациентки исключались, если в анамнезе была соответствующая лекарственная аллергия или они получали терапию, результатом которых была толерантность к опиатам.
Рандомизированно распределенные пациентки получали ТАР блок ( n = 25) 1.5 мг/кг 0.75 % ропивакаина (максимальная доза 150 мг) с обеих сторон или ТАР блок 0.9 % хлоридом натрия (контроль, n = 25). Последовательность распределения генерировалась таблицей случайных чисел, групповое распределение было скрыто запечатанным непрозрачным снимающимся защитным покрытием, которое не снималось до получения согласия пациентки. Пациентки, анестезиологи и персонал, обеспечивающий послеоперационную терапию, не знали о групповом распределении. Все пациентки получали стандартную спинальную анестезию 12 мг 0.5 % гипербарического бупивакаина с 25 µ g фентанила. Пациентки также получали 1 мг/кг диклофенака ректально до максимальной дозы 100 мг и 1 г парацетамола ректально в конце операции. Антиэметики профилактически не применялись.
ТАР блок выполнялся в конце операции одним исследователем (J. G. M.) с использование следующей методики.[4] 22- G 50 мм тупая игла для региональной анестезии (Plexufix ®, BBraun , Melsungen AG , Германия) была присоединена гибкой трубкой к шприцу, наполненному исследуемым раствором. Для локализации ТАР Использовалась методика потери сопротивления. Это возможно, потому что послойные фасциальные образования мышц брюшной стенки в пределах треугольника Petit создают легко ощущаемое повышение сопротивления продвижению иглы. У пациентки, лежащей на спине, исследователем, стоящим с контралатеральной стороны, пальпировался подвздошный гребень спереди назад, пока не определялся край широчайшей мышцы спины (рис. 1). Треугольник Petit пальпировался между передней границей широчайшей мышцы спины, задней границей наружной косой мышцы и подвздошным гребнем. В наружный слой треугольника Petit игла вводилась под прямым углом к поперечной плоскости. Игла стабилизировалась и продвигалась под прямым углом к наружному слою в поперечной плоскости до столкновения с сопротивлением. Это первое сопротивление указывало, что конец иглы пересекал фасциальное пространство наружной косой мышцы. Далее нежное продвижение игла сопровождалось потерей устойчивости, или ощущением "щелчка", поскольку игла входила в плоскость между фасциальными слоями наружной и внутренней косых мышц. Далее нежное продвижение сопровождалось ощущением увеличения сопротивления во второй раз, поскольку игла пересекала фасциальное пространство внутренней косой мышцы. Второй щелчок указывал на вступление в фасциальную плоскость поперечной мышцы живота. После тщательной аспирации для исключения внутрисосудистой инъекции вводилась тест-доза 1 мл. Наличие реального сопротивления этой инъекции указывало на то, что игла не находилась между фасциальными плоскостями, указывая на необходимость в репозиции иглы. После отрицательной тест-дозы в 1.5 мг/кг ропивакаина (максимальная доза 150 мг с каждой стороны) вводилось через иглу дискретно по 37.5 мг с наблюдением за проявлениями токсичности. ТАР блок выполнялся с противоположной стороны с использованием идентичной методики.
После завершения операции и выполнения блока, пациентки переводились в отделение лечения после анестезии (PACU). Стандартный послеоперационный аналгетический режим – назначение перорально 1 г парацетамола каждые 6 часов и ректально 100 мг диклофенака каждые 18 часов в комбинации с управляемой пациенткой в/в аналгезией морфином (PCA) (доза болюса - 1 мг, интервал ожидания - 6 минут, максимальная доза 40 мг за 4 часа), – начинался при поступлении в PACU в обеих группах. Наличие и выраженность боли, тошноты и седативного эффекта систематически оценивались исследователем, не знающим о групповом распределении. Эти исследования были выполнены в PACU через 2, 4, 6, 12, 24, 36 и 48 часов после ТАР блока. Всех пациенток попросили дать оценку в баллах их боли в покое и при перемещении (сгибание колена), а также для степени выраженности тошноты в указанных временных точках. Выраженность боли измерялась с использованием визуальной аналоговой шкалы (VAS , немаркированной линии длиной 10 см , в которой 0 см = отсутствие боли, а 10 см = максимальная вообразимая боль) и категорической системы оценки боли (нет = 0; слабая = 1; умеренная = 2; тяжелая = 3). Тошнота измерялась с использованием, используя категорической шкалы оценки (нет = 0; слабая = 1; умеренная = 2; тяжелая = 3). Наличие тошноты определялось как количество баллов > 0 в любой точке измерения. Оценка седативного эффекта исследовалась с использованием шкалы седативного эффекта (активная и тревожная = 0; спокойно бодрствующая = 1; дремлющая, но легко пробуждаемая = 2; глубоко спящая = 3). Наличие седативного эффекта определялось как количество баллов > 0 в любой точке измерения. Антиэметики предлагались любой пациентке немедленно, при появлении жалоб на тошноту или рвоту. Исследование заканчивалось через 48 часов после ТАР блока.
Основным критерием результата в этом исследовании был 48 часовой расход морфина. Вторичные результаты измерений включали в себя время до начального запроса морфина, количество баллов по ВАШ и побочные эффекты, связанные с использованием морфина. С целью вычисления объема выборки мы предположили, что клинически значимым снижением 48 часового расхода морфина будет абсолютное снижение на 25%. Основываясь вначале на предварительных исследованиях, мы спроектировали средную 48-часовую потребность морфина в 80 мг с допустимым отклонением 20 мг в контрольной группе. Мы вычислили, что в группу для экспериментального дизайна будут требоваться по 20 пациенток, обе группы были равноразмерными, с Р = 0.05 и ? = 0.2. Чтобы минимизировать любые эффект потери данных , мы включили в исследуемые группы по 25 пациенток.
Статистический анализ выполнялся с использованием стандартной статистической программы (Sigmastat 3.5, Systat Software , San Jose , CA). Демографические данные были разложены с использованием t -критерия Стьюдента или точного критерия Фишера. Данные были проверены на нормальность с использованием критерия нормальности Колмогорова-Смирнова. Повторяющиеся измерения (шкала выраженности боли, шкала выраженности тошноты) были разложены дисперсионным анализом повторных измерений при обычном распределении, с дальнейшими парными сравнениями, разделенными на интервалы, и использованием t -критерия. Для необычно распределяемых данных, межгрупповые сравнения были сделаны с использованием упорядоченного критерия суммы Уилкоксона. Категорические данные были разложены, используя ? 2 анализ или точный критерий Фишера. Время начального запроса морфина было разложено с использованием диаграммы rank test . Обычно распределяемые данные представлены как среднее значение ± sd (sd), необычно распределяемые данные представлены как медиана (вероятное отклонение), а категорические данные представлены как необработанные данные и частоты. Уровень достоверности для всех анализов был установлен как P <0.05, для множественных сравнений при необходимости использовались поправки Бонферрони.
РЕЗУЛЬТАТЫ
Пятьдесят две пациентки были включены в исследование. Две пациентки, по одной от каждой группы были исключены после сбора данных из-за отклонений от послеоперационного протокола аналгезии. Из оставшихся 50 пациенток, 25 были рандомизированы для проведения ТАР блока ропивакаином, а 25 были рандомизированы для проведения ТАР блока физиологическим раствором.
Группы были сопоставимы по возрасту, весу, росту и наличию предшествующих абдоминальных операций (Таблица 1). У всех пациенток треугольник Petit легко пальпировался, поперечная нейро-фасциальная плоскость живота была локализована после одной - двух попыток и блока выполнялся без осложнений.
Таблица 1. Основные характеристики пациентов.
| Группа | Контроль (n=25) | ТАР блок (n=25) |
| Возраст (лет) | 34±5 | 35±4 |
| Вес (кг) | 78±17 | 71±10 |
| Рост (м) | 1.65±0.06 | 1.64±0.06 |
| Индекс массы тела (кг/м2) | 28±6 | 26±3 |
| Предыдущие абдоминальные операции [n( % )] | 15(60) | 16(64) |
У пациенток, перенесших ТАР блок ропивакаином, отмечено уменьшение 48 –часовой потребности в морфине (Рисунок 2) и увеличение времени до первого запроса морфина в режиме PCA (Рисунок 2). Медиана (вероятное отклонение) времени до первого запроса морфина составила 90 (55, 190) минут в контрольной группе, по сравнению с 220 (150, 380) минутами у больных, получавших ТАР блок. При использовании ТАР блока ропивакаином уменьшался суммарный послеоперационный расход морфина по сравнению с блоком плацебо во всех временных точках (Рисунок 2). Расход морфина в интервалах был также значительно ниже через 12, 24, и 36 часов у пациенток, получивших ТАР блок (Рисунок 2).
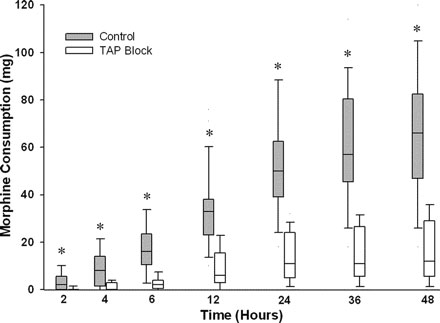 |
| Рисунок 2. График суммарного послеоперационного расхода морфина в каждой группе за первые 48 часов после операции. Линия в прямоугольниках, представляет средннее значение, внешние границы прямоугольников представляют вероятное отклонение, линейные отрезки представляют 10-ую и 90-ую процентиль в каждой временной точке. *Отмечен значительно более высокий расход морфина по сравнению с группой перечного плоскостного блока живота (ТАР блока) ( P <0.05, критерий Wilcoxon ' s ). |
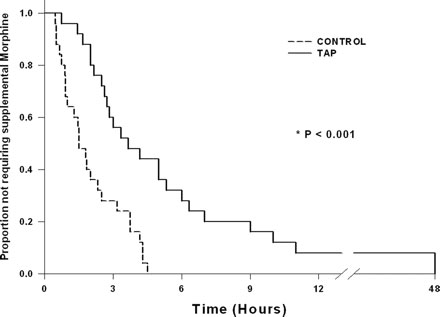 |
| Рисунок 3. Диаграмма Kaplan - Meier , отражает пропорцию пациентов в каждой группе, которые в течение длительного времени не требовали дополнительного морфина (P <0.001). |
Таблица 2. Послеоперационная потребность в анальгезии.
| Группа | Контроль (n=25) | ТАР блок (n=25) |
| Интервалы потребности в морфине (мг) | ||
| 0-12 ч | 33 (23,38) | 6 (3,15)* |
| 12-24 ч | 19 (11,25) | 3 (2,8) |
| 24-36 ч | 6 (1,15) | 26±3 |
| 36-48 ч | 0 (0,9) | 0 (0,3) |
| Данные представлены как медиана (межквартильное распределение) * p ? 0,001 (контроль против ТАР блока) |
Послеоперационная боль по ВАШ, измеренная в покое и при перемещении, была уменьшена после ТАР блока в некоторых, но не всех, оцениваемых временных точках (Рисунок 4). Категорическая оценка боли была ниже у больных, получавших ТАР блок во всех послеоперационных временных точках (данные не показаны).
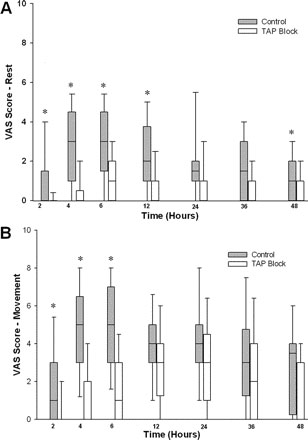 |
| Рисунок 4. Графики послеоперационной визуальной аналоговой шкалы (ВАШ) боли, определяемой в покое (A) и при перемещении (B) в каждой группе за первые 48 часов после операции. Линия в каждом прямоугольнике представляет среднее значение, внешние границы прямоугольника представляют вероятное отклонение, линейные отрезки представляют 10-ую и 90-ую процентиль в течение каждой временной точки. *Отмечен значительно более высокий расход морфина по сравнению с группой перечного плоскостного блока живота (АР блока) (P <0.05, критерий Wilcoxon's). |
У пяти пациенток в контрольной группе отмечена послеоперационная тошнота по сравнению ни с одной пациенткой из группы ТАР блока. Однако, не было никакой значительной разницы в частоте возникновения тошноты или оценке тошноты по шкале между группами в любой временной точке. ТАР блок значительно уменьшал частоту седативного эффекта, от 36 % в контрольной группе до 0% в группе ТАР блока. Послеоперационная оценка седативного эффекта была меньше у больных, получавших ТАР блок через 6 часах после операции, но не в других временных точках (данные не представлены).
ОБСУЖДЕНИЕ
Это рандомизированное, двойное слепое, контролируемое исследование продемонстрировало, что добавление в стандартный мультимодальный анальгетический режим ТАР блока, сопровождается уменьшением 48-часовой потребности в морфине и количества баллов при оценке боли, а так же позволяет отсрочить запрос о дополнительной аналгезии опиатами по сравнению с обычным стандартным режимом. Родоразрешение путем кесарева сечения - одна из рутинно выполняемых хирургических операций во всем мире, более одного миллиона пациенток переносят эту операцию ежегодно в одних только Соединенных Штатах. [6] Аналгетический режим должен обеспечить безопасную, эффективную аналгезию, с минимальными побочными эффектами для роженицы и новорожденного.
Мультимодальный аналгетический режим с высокой вероятностьб достигнет этих целей. Однако, оптимальные компоненты этого режима продолжают развиваться. Хотя однократные нейроаксиальные аналгетические методики с использованием опиатов длительного действия или контролируемое пациентом эпидуральное введение опиатов производят эффективную аналгезию, они связаны с частым развитием побочных эффектов, особенно тошноты, рвоты и зуда, которые снижают полную удовлетворенность пациента.[1] Кроме того, существует риск отсроченной депрессии дыхания у женщин из-за краниального распространения гидрофильных опиатов, таких как морфин.[7] Кроме того, не всегда возможно обеспечить нейроаксиальную аналгезию опиатами из-за логистических проблем и/или наличия медицинских противопоказаний.[8,9] Хотя в/в морфин в режиме PCA в большей степени облегчает ведение пациентов, и, таким образом способствует высокому уровню удовлетворения пациентов, произведенная аналгезия часто является неполной, а вызванные опиатами побочные эффекты обычно остаются. [1] Существует, также, беспокойство в отношении возможностей системно применяемых липофильных опиатов, таких как меперидин, проникать в грудное молоко и оказывать кратковременное неблагоприятное нейробихевиоральное влияние на новорожденного.[10] Данные проблемы, дают значительные возможности для региональных методик, таких как ТАР блок, для обеспечения эффективного мультимодального режима аналгезии после кесарева сечения.
Наше исследование демонстрирует, что ТАР блок сократил на всех этапах послеоперационную потребность в морфине более чем на 70 % за первые 48 часов после операции. Находка, что ТАР блок снижал потребность в морфине во всех 12-часовых интервалах до 36 часов, демонстрирует, что однократная методика ТАР блока может произвести эффективную аналгезию для 36 часов. Причины для длительной продолжительности аналгетического эффекта после ТАР блока могут определяться тем фактом, что ТАР относительно плохо васкуляризируется, и поэтому клиренс лекарственного средства может быть замедлен. Распределение лекарственного препарата, введенного в ТАР в настоящее время изучается. Частота седативного эффекта была снижена в группе ТАР блока, что совместимо с экономией морфина при ТАР блоке. ТАР блок легко выполнялся у этой группы пациенток, и методика не отличалась от используемой в нашем предыдущем исследовании пациентов, перенесших операцию через срединный лапаратомный разрез.[4] Поэтому, ТАР блок кажется эффективным для пациентов, перенесших операцию через срединный или нижний лапаротомный разрез.
Доза ропивакаина (3 мг/кг), используемая в этом исследовании, значительно более высока чем доза левобупивакаина, используемого в нашем предыдущем исследовании, [4] даже с учетом разницы в активности лекарственных средств. Наше объяснение использования более высокой дозы местного анестетика объясняется целью - обеспечить продленную аналгезию однократным ТАР блоком. Хотя и являясь относительно высокой, эта доза находится в пределах руководства изготовителя для инфильтрационной анестезии, таких как блок плечевого сплетения. Однако, доза более высока, чем рекомендованная изготовителем для инфильтрации или незначительной блокады нерва с целью послеоперационной аналгезии. Важно, что эта доза находится в пределах рекомендуемой безопасной амплитуды доз ропивакаина.[11] Однако, возможность системной токсичности при применении этой дозы местного анестетика средства должна быть принята во внимание, особенно после разрешения беременности (с увеличением общую васкуляризации) и при случайной внутрисосудистой инъекции. Риск проявления токсических реакций уже во время сестринского ухода сомнителен, хотя и вероятен. относительно низким. Дальнейшие исследования нашей группы будут включать плазменные концентрации как часть результирующих данных.
У этого исследования существует много ограничений. Во-первых, исследование ограничено послеоперационной аналгезией в первые 48 часов после операции. Однако, наши данные указывают, что серьезность боли в контрольной группе к этому времени в основном уменьшилась и большинство пациенток больше не требовали системной терапии опиатами. Во-вторых, есть трудности в адекватной ослепленности этого исследования из-за того, что ТАР блок вызывает потерю ощущения брюшной стенки. Хотя пациенты и исследователь, проводящий послеоперационные исследования, не знали о групповом распределении, истинная ослепленность, возможно, не была достигнута. В-третьих, все блоки были выполнены одним и тем же исследователем ( J . G . M ). Хотя это было сделано, чтобы уменьшить вариабельность в рабочих характеристиках блока, этот подход может ограничить объем распространения наших выводов. В- четвертых, исследование не было достаточно большим, чтобы оценить безопасность. Существует риск случайного перитонеального прокола при выполнении этого блока. Хотя частота развития не известна, но если блок будет выполняться как описано, то риск перитонеального прокола, вероятно, низок. Мы не столкнулись с осложнениями, касающимися перитонеального прокола при выполнении нескольких сотен ТАР блоков. Использование ультразвука, для подтверждения положения иглы является перспективным подходом, который должен далее снизить риск этого осложнения. Дальнейшее ограничение - то, что мы не оценивали частоту успеха блока или расширение сенсорной блокады брюшной стенки. Это было сделано, чтобы сохранить ослепленность эксперта. Требуются дальнейшие исследования, чтобы определить частоту успешных блоков, особенно когда они выполняются менее опытными пользователями. Наконец, мы не выполняли изучение дозозависимых реакций, чтобы определить, приведет ли более низкая доза ропивакаина к тем же самым результатам.
Мы пришли к заключению, что ТАР блок является многообещающим компонентом мультмодального режима аналгезии после родоразрешения путем кесарева сечения. ТАР блок легко выполнялся, обеспечивал достоверную и эффективную аналгезию в этом исследовании и никаких осложнений при выполнении ТАР блока не было обнаружено.
СПИСОК ЛИТЕРАТУРЫ
- Farragher RA, Laffey JG. Postoperative pain management following cesarean section. In: Shorten G, Carr D, Harmon D, et al., eds. Postoperative pain management: an evidence-based guide to practice. 1st ed. Philadelphia , PA : Saunders Elsevier, 2006:225–38
- Netter FH. Back and spinal cord. In: Netter FH, ed. Atlas of human anatomy. Summit, New Jersey: The Ciba-Geigy Corporation, 1989:145–55
- Netter FH. Abdomen posterolateral abdominal wall. In: Netter FH, ed. Atlas of human anatomy. Summit, New Jersey: The Ciba-Geigy Corporation, 1989:230–40
- McDonnell JG, O'Donnell B, Curley G, Heffernan A, Power C, Laffey JG. The analgesic efficacy of transversus abdominis plane block after abdominal surgery: a prospective randomized controlled trial. Anesth Analg 2007;104:193–7
- O'Donnell BD, McDonnell JG, McShane AJ. The transversus abdominis plane (TAP) block in open retropubic prostatectomy. Reg Anesth Pain Med 2006;31:91
- Gaiser RR. Changes in the provision of anesthesia for the parturient undergoing cesarean section. Clin Obstet Gynecol 2003;46:646–56
- Dahl JB, Jeppesen IS, Jorgensen H, Wetterslev J, Moiniche S. Intraoperative and postoperative analgesic efficacy and adverse effects of intrathecal opioids in patients undergoing cesarean section with spinal anesthesia: a qualitative and quantitative systematic review of randomized controlled trials. Anesthesiology 1999;91:1919–27
- Werawatganon T, Charuluxanun S. Patient controlled intravenous opioid analgesia versus continuous epidural analgesia for pain after intra-abdominal surgery. Cochrane Database Syst Rev 2005;CD004088
- Fotiadis RJ, Badvie S, Weston MD, Allen-Mersh TG. Epidural analgesia in gastrointestinal surgery. Br J Surg 2004;91:828–41
- Wittels B, Scott DT, Sinatra RS. Exogenous opioids in human breast milk and acute neonatal neurobehavior: a preliminary study. Anesthesiology 1990;73:864–9
- Sweetman SC , ed. Martindale: the complete drug reference. London : Pharmaceutical Press, 2007:1690–713
Anesth Analg 2008; 106:186-191