Регионарная анестезия при операциях кесарева сечения у женщин с заболеваниями сердца: проспективное исследование
E. Langesaeter, M. Dragsund, L.A. Rosselland
Отделение анестезиологии и интенсивной терапии, госпиталь университета Осло
Основание: Мы провели проспективное обсервационное исследование беременных женщин с заболеваниями сердца. Целью исследования был анализ и представление способа родоразрешения, исхода и гемодинамических изменений в ходе операции кесарева сечения с применением регионарной анестезии у женщин с болезнями сердца.
Методы. Все беременные женщины с сердечно-сосудистыми диагнозами, за исключением артериальной гипертензии, были включены в исследование. На основании кардиологических диагнозов и классификации New York Heart Association , мультидисциплинарная группа разработала рекомендации для каждой пациентки и определила метод родоразрешения. Были проанализированы и представлены данные продолжительного инвазивного мониторинга гемодинамики у пациентов группы среднего и высокого риска, перенесших операцию кесарева сечения с применением методов регионарной анестезии.
Результаты. В клинике прошло за период с ноября 2003 по апрель 2008 года около 9 000 родов. В исследование было включено 113 беременностей и 107 женщин. Тридцать две (28,3%) беременности были отнесены к категории высокого риска. Из 103 родов, в 59 случаях была выполнена операция кесарева сечения (52,2%), с использованием методов регионарной анестезии – у 51 пациентки (18 срочных случаев), под общей анестезией – у 8 пациенток (5 срочных случаев) и у 44 пациенток прошли запланированные вагинальные роды (через естественные родовые пути). Случаев смертности у родильниц и новорожденных за время пребывания в клинике и за первые полгода после родов не наблюдалось. Предоперационное стабильное состояние сердечно-сосудистой системы в ходе операции кесарева сечения поддерживалось объемом инфузионной терапии и инфузией фенилэфрина под контролем инвазивного мониторинга гемодинамических показателей.
Выводы. Наше исследование полагает, что беременные женщины с заболеваниями сердца могут безопасно родоразрешаться методом кесарева сечения под регионарной анестезией. В соответствии с нашими выводами, гемодинамическая стабильность достигается болюсным ведением регионарной анестезии, объемной внутривенной инфузией фенилэфрина, и малыми повторяющимися дозами окситоцина внутривенно под контролем инвазивного мониторинга.
Количество беременных женщин с заболеваниями сердца постоянно растет. Сведения о частоте случаев и эпидемиологии отражены в регистре Соединенного королевсктва по анестезии высокого риска (UK registry of high-risk anaesthesia)1, в Конфиденциальных Сведениях о материнской смертности в Соединенном королевстве (Confidentional Enquiries into Maternal Death in the United Kingdom)2,3 . Материнская смертность у женщин с заболеваниями сердца выросла с 7,6 случаев на 1 миллион беременностей в 1980 г . до 22 случаев на 1 миллион за период 2000 – 2002 4 . Заболевания сердца на сегодняшний день – наиболее частая косвенная причина смертности вообще и материнской смертности в частности3. В основном, было рекомендовано родоразрешение через естественные родовые пути5,6 , но были выдвинуты аргументы в пользу более частого применения операции кесарева сечения7 . Появился ряд сообщений о клинических случаях, но проведено лишь несколько исследований методов анестезии, мониторинга и практического ведения этих пациентов категории высокого риска4,81. Не было опубликовано релевантных рандомизированных клинических исследований.
Rikshospitalet (название клиники) – это национальный центр хирургии врожденных пороков сердца в Норвегии и третий по величине центр патологии беременности. Большинство женщин с беременностями высокого риска, связанного с заболеваниями сердца, поступают в этот госпиталь из всех учреждений родовспоможения Норвегии.
Мы провели проспективное обсервационное исследование беременных женщин с заболеваниями сердца, поступавших в наше отделение с ноября 2003 по апрель 2008. Целью исследования было проанализировать и представить ведение, выбор метода родоразрешения, гемодинамические изменения и исход в ходе операции кесарева сечения под регионарной анестезией у женщин с заболеваниями сердца.
Материалы и методы
Протокол исследования был утвержден Региональным комитетом этики медицинских исследований ( The Regional Medical Research Ethics Committee ) северной Норвегии, и пациентки дали информированное согласие. В исследование были включены все беременные женщины с заболеваниями сердца, родоразрешавшиеся в Rikshospitalet с ноября 2003 по апрель 2008. Роженицы с только лишь хронической артериальной гипертензией или гипертензией, вызванной беременностью, в исследование не включались. База данных содержала информацию о анамнезе пациенток, кардиологическом диагнозе и лечении, функциональной классификации согласно Нью-Йоркской Кардиологической Ассоциации ( New York Heart Association – NYHA ), и эхокардиографии4,9,10. Пациенты делились на основании руководств из публикаций Siu и Colman6 , и Dob и Yentis11 на группы высокого, среднего и низкого риска. Классификация NYHA основана на стандартном тесте на нагрузку. Женщины поднимались вверх по лестнице, с постоянным мониторингом сердечного ритма и насыщения кислородом, и останавливались, когда чувствовали необходимость, по причине дисапноэ (одышки). Тест повторяли в течение беременности у пациенток групп высокого и среднего риска.
В начале проведения исследования, в ноябре 2003, организованной мультидисциплинарной группы не было, но в ходе исследования она сформировалась. С 2005 года, мультидисциплинарная группа кардиологов, акушеров, акушерских анестезиологов, и кардиоанестезиологов проводила регулярные встречи для обсуждения всех беременных женщин с кардиологическими диагнозами, родоразрешение которых планировалось в нашем госпитале. Эта группа определяла индивидуальные рекомендации по каждой пациентке, включающие решение, будет ли женщина родоразрешена с помощью плановой операции кесарева сечения или через естественные родовые пути. Это решение принимало на основе оценки индивидуального риска. Центральным моментом в оценке рекомендуемого метода родоразрешения была функциональная классификация в соответствии с NYHA . Нашей рутинной стратегией у большинства пациенток группы высокого риска было родоразрешение методом избирательного кесарева сечения под регионарной анестезией, если не было такого противопоказания как антикоагуляция (несвертываемость крови). Пациенткам с неосложненными вагинальными родами в анамнезе, даже находящимся в группе высокого риска, назначались роды через естественные родовые пути.
Стандартный рутинный мониторинг для операции планового кесарева сечения включал в себя артериальную линию для всех пациентов группы высокого и среднего риска. В дополнение к инвазивному кровяному давлению, мы измеряли гемодинамические переменные (показатели), применяя LiDCOPlus (LiDCO Ltd , Cambridge , UK), прибор, которые представляет собой монитор, предоставляющий данные продолжительных измерений гемодинамики. Этот новая минимально инвазивная техника основана на двух методах: системы продолжительного анализа артериальной волны (PulseCO), соединенной с одноточечной системой литиевого индикатора растворения калибрации (LiDCO). Для измерения актуального сердечного выброса для калибрации, 0,3 ммоль хлорида лития вводятся по периферической линии и литий определяется внешним ион чувствительным электродом, соединенным с периферической артериальной линией. Доза лития не оказывает фармакологического влияния ни на женщину, ни на плод12. LiDCOPlus обеспечивает постоянное кровяное давление и поударное измерение СВ (сердечного выброса), ударный объем сердца (УО) и сосудистое системное сопротивление (ССС)13. Мы начали использовать этот монитор в нашем отделении анестезиологии в 2005 г . Монитор СВ был утвержден для других групп пациенток14 , и в последнем году появились публикации по его применению у беременных женщин15-17.
Профилактическая инфузия небольшой дозы фенилэфрина и когидратация кристаллоидами являлись частью стандартного протокола по профилактике гемодинамической нестабильности в ходе операции кесарева сечения, основанном на данных о здоровых женщинах17. Гемодинамической нестабильностью обозначался рост СВ до уровня 70% выше базисной линии, и систолическое кровяное давление (СД)<90 мм/Рт.ст., до родов.
Окситоцин (Syntocinon® , Новартис, Копенгаген, Дания) вводился болюсно по 5Е, что представляло собой стандартную дозировку в нашем отделении на 2003 г . Подход к использованию окситоцина в ходе исследования изменился. Мы сократили дозировку до неоднократных болюсов по 0,5Е в начале исследования. Основываясь на двух исследованиях Carvalho и коллег18,19, и на нашем собственном опыте в дальнейшем мы сократили дозировку до 0,1Е, неоднократно до достижения желаемого удовлетворительного эффекта по маточным сокращениям.
Мы регистрировали способ родоразрешения и вид анестезиологического пособия при операции кесарева сечения, использование фенилэфрина, использование окситоцина, кровотечения, концентрацию гемоглобина до и после родоразрешения, потребность в трансфузии и материнский исход у всех пациенток в течение 6 месяцев после родов. У новорожденных регистрировались показатели по шкале Апгар, уровни pH пупочной вены и артерии.
Данные по гемодинамике собирались в мониторе LiDCOPlus и загружались в виде текстовых файлов (формат csv) по каждой пациентке. Архитектура комплекта данных была представлена при помощи MATLAB версии R 2007а (Tha MathWorks , Natick , MA). Выбросы (резко выделяющиеся значения) были удалены, а поударный комплект данных был сконструирован с помощью концентрированной плавающей средней величины по 30 наблюдениям.
Результаты
Пациентки
В акушерском отделении Rikshospitalet с ноября 2003 по апрель 2008 прошло примерно 9000 родов. В исследование мы включили за этот период 113 беременностей у 107 женщин с заболеваниями сердца. Пациентки, после родов поступавшие в наш госпиталь по поводу кардиологических заболеваний из других госпиталей, не включались в исследование. Было 32 пациентки группы высокого риска, 31 пациентка – среднего риска, и 50 пациенток было отнесено к группе низкого риска. Таблица 1 показывает описательные данные 103 рожениц (данные10 пациенток с выкидышами не включены). Характеристики новорожденных указаны в таблице 2. Диагнозы и группы риска указаны в таблице 3.
Таблица 1. Характеристики пациенток*
| Возраст | 30,5 (20,0 – 42,5) |
| СГ (срок гестации) | 37,6 (24,9 – 42,5) |
| Вес (кг) | 77,6 (40,0 – 130,0) |
| Рост (см) | 167 (150 – 179) |
| ИМТ (кг/м 2 ) (индекс массы тела) | 27,9 (17,8 – 42,4) |
| Представлены средние данные (с указанием предельных значений) *10 пациенток с выкидышем не включены в исследование |
Таблица 2. Характеристики новорожденных
| Апгар 1 (спустя 1 минуту после рождения) | 9 | (2–10) |
| Апгар 2 (спустя 5 минут после рождения) | 9 | (6–10) |
| рH пупочной вены | 7,34 | (6,98 – 7,46) |
| рH пупочной артерии | 7,27 | (6,97 – 7,39) |
| Вес при рождении (г) | 3084 | (1300 – 4590) |
| Представлены средние данные (с указанием предельных значений) для шкалы Апгар или усредненные по pH и весу при рождении. |
Таблица 3. Кардиологические диагнозы и классификация степеней риска
| Диагноз | Группа высокого риска | Группа среднего риска | Группа низкого риска | Всего |
| Кардиомиопатия | ||||
| Распространенная | 10 | 0 | 1 | 11 |
| Обструктивная гипертоническая кардиомиопатия | 2 | 2 | 1 | 5 |
| Гипертрофическая кардиомиопатия | 0 | 0 | 4 | 4 |
| Стеноз аорты/недостаточность аорты/замещение аортального клапана | 1 | 6 | 2 | 9 |
| Митральная недостаточность/митральный стеноз, замещение митрального клапана | 1 | 5 | 12 | 18 |
| Легочная недостаточность/стеноз легочного ствола | 2 | 2 | 5 | 9 |
| Легочная гипертензия | 4 | 1 | 0 | 5 |
| Синдром Эйзенменгера | 3 | 0 | 0 | 3 |
| Пересадка сердца | 0 | 1 | 1 | 2 |
| Дефект межпредсердной перегородки | 1 | 0 | 3 | 4 |
| Дефект вентральной перегородки | 0 | 0 | 3 | 3 |
| Коарктация аорты | 2 | 1 | 0 | 3 |
| Смещение больших аорт, mustard | 3 | 4 | 0 | 7 |
| Тетрада Фалло | 0 | 6 | 4 | 10 |
| Аритмии | ||||
| Синдром удлинения от интервала QT | 0 | 0 | 6 | 6 |
| Желудочковая(вентрикулярная) тахикардия/синдром Вольфа-Паркинсона-Вайта | 0 | 0 | 9 | 9 |
| Миокардит | 1 | 0 | 0 | 1 |
| Аневризма грудной аорты | 0 | 1 | 0 | 1 |
| Коронарные (сосудистые) заболевания | 1 | 0 | 0 | 1 |
| Аномалия Эбштейна | 0 | 1 | 0 | 1 |
| Двухкамерный правый желудочек | 0 | 1 | 0 | 1 |
| ВСЕГО | 32 | 31 | 50 | 113 |
Таблица 4. Родоразрешение и анестезия
(случаи срочной операции кесарева сечения указаны в скобках)
| ВСЕГО: 113 | Группа высокого риска | Группа среднего риска | Группа низкого риска |
|
( n = 32) | ( n = 31) | ( n = 50) |
| Вид родоразрешения | |||
| Кесарево сечение ( n = 59) | 23 (8) | 16 (7) | 20 (8) |
| Вагинальные роды ( n = 44) | 5 | 11 | 28 |
| Аборт ( n = 10) | 4 | 4 | 2 |
| Анестезия | |||
| Общая анестезия | 5 (4) | 2 (1) | 1 |
| Регионарная анестезия | 18 (4) | 14 (6) | 19 (8) |
У десяти пациенток произошло прерывание беременности. Четырем пациенткам из группы высокого риска было рекомендовано прервать беременность. Двум пациенткам с синдромом Эйзенменгера и одной пациентке с обструктивной гипертонической кардиомиопатией (ОГК) беременность был сделан хирургический аборт под низкодозированной спинальной анестезией. Одной пациентке с тяжелым миокардитом беременность была прервана с применением мизопростола.
В соответствии с мультидисциплинарным подходом, 48 пациенткам была предписана плановая операция кесарева сечения и 55 пациенткам – родоразрешение через естественные родовые пути. Одиннадцать из планируемых вагинальных родов завершились срочной операцией кесарева сечения, а 12 из плановых операций кесарева сечения были передвинуты на более ранние сроки по акушерским показаниям. У нескольких пациенток из группы высокого риска не было зарегистрировано изменений в результатах эхокардиографии, хотя функциональный объем показал ухудшение за время беременности, согласно теста на нагрузку.
Регионарная анестезия была проведена 51 пациенткам ( из них 18 срочных случаев), а общая анестезия – 8 пациенткам (из них пять срочных случаев) из общего количества 59 операций кесарева сечения (57,3% родов) (см. Таблицу 4). В 20 из 23 случаев срочной операции кесарева сечения операция была сделана по акушерским показаниям. В группе высокого риска общее число операций кесарева сечения составило 82,1%.
Техника анестезии
Все плановые операции кесарева сечения производились под регионарной анестезией, за исключением трех случаев антикоагулянтной терапии. Для спинальной анестезии применялись стандартные дозы чистого бупивакаина 8–10 mg и суфентанила 5 μg или фентанила 20 μg при использовании спинальной или комбинированной спинально-эпидуральной анестезии (КСА) в 49 случаях. Одна пациентка получала эпидуральную анестезию дополнительными дозами ( top - up ) при операции кесарева сечения, а одна пациентка с тяжелой формой предродовой кардиомиопатией – продолжительную катетерную спинальную анестезию. Восемь пациенток получили общую анестезию пентоталом (Pehtothal) и суксаметониум (Suxamethonium) как часть быстрой последовательной индукции 20 . Ни у одной из пациенток, получавших регионарную анестезию, не возникло необходимости перехода на общую анестезию. У одной пациентки с комбинированной спинально-эпидуральной анестезией производилась инфильтрация кожи местным анестетиком и вводился фентанил внутривенно во время ожидания эффекта от дополнительной дозы (top - up) лекарства эпидурально.
Инвазивный мониторинг гемодинамики
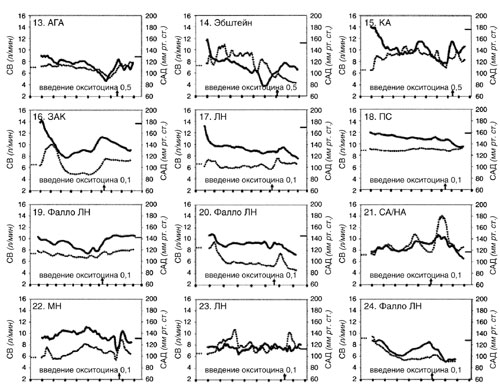
Мониторинг артериальной линии кровяного давления использовали у 49 пациенток в ходе операции кесарева сечения, у 4 при вагинальных родах, и у 6 при прерывании беременности. Тринадцати (13) пациенткам до операции кесарева сечения был установлен венозный катетер центрального доступа. Шести (6)пациенткам была катетеризирована легочная артерия. В ходе операции кесарева сечения у 33 пациенток мы использовали монитор LiDCOPlus . Профилактика и лечение гипотонии обеспечивались внутривенным введением раствора коллоидов и инфузии фенилэфрина. Средний объем назначения фенилэфрина во всех случаях операции кесарева сечения до операции составлял 140 μg (0 – 1960 μg). Двадцати (20) из 59 пациенток, перенесших операцию кесарева сечения, фенилэфрин не назначался. Гемодинамические изменения в ходе регионарной анестезии в 24 пациенток из группы среднего и высокого риска показаны на рисунке 1. У двух (2) пациенток (пациентка 6 и 14) систолическое артериальное давление (САД) на короткий период составляло менее 90 мм . рт. ст. У трех пациенток (пациентки 14, 20, и 24) было зарегистрировано падение сердечного выброса (СВ) на 70% ниже основной линии. В пациентки 2 изменения в СВ и САД на 18 минуте исследования произошли по причине, связанной с техническими проблемами с артериальной линией. Семь (7) пациенток из группы низкого риска, одна (1) пациентка из группы среднего риска, переносившая общую анестезию, и одна пациентка группы среднего риска с техническими проблемами с артериальной линией не отражены на рисунках. Гемодинамические изменения СВ и САД представлены после начала регионарной анестезии, когда пациентка размещалась латерально с наклоном влево и до исторжения плода, включая влияние окситоцина. Все пациентки переносили вызванные регионарной анестезией гемодинамические изменения без каких-либо клинических осложнений.
Применение оскитоцина
Окситоцин снижает ССС (системное сосудистое сопротивление) и увеличивает СВ (сердечный выброс)21. В этой гетерогенной группе пациенток гемодинамический эффект малых доз окситоцина отличался у разных пациенток, но при введении его малыми титрованными дозами, гемодинамические изменения проходили минимальными и непродолжительными, без ухудшения каких-либо симптомов. Только у одной пациентки (рис 1, пациентка 3) был краткий период одышки (дисапноэ) после введения 0,1 Ед. окситоцина. Гемодинамический эффект окситоцина у 24 пациенток групп высокого и среднего риска показан на рисунке 1. Этим пациенткам вводился окситоцин внутривенно болюсно дозами от 0,05 до 0,5 Ед.
Исход
В течение 6 месяцев после родов не было зарегистрировано ни материнской ни младенческой смертности. Количество баллов по шкале Апгар было 2 и 6 на 1 и 5 минуте жизни соответственно, мать одного младенца страдала обструктивной гипертонической кардиомиопатией и легочной гипертензией. Женщине была сделана экстренная операция кесарева сечения по причине появления сосудистой недостаточности (циркуляторного коллапса) в операционной во время установки катетера центрального венозного доступа, в ходе подготовки к регионарной анестезии, и до установки артериальной линии. Возможно, сочетание беспокойства, голодания с вечера накануне, и компрессия нижней полой вены и привели к брадикардии и потере сознания. Пациентка была подвержена случаям сердцебиения от 120 ударов в минуту с низким ударным объемом вследствие тяжелого гипертонического миокардита (мембрана >3 c м). Экстренная операция кесарева сечения была проведения под общей анестезией и удалось спасти как роженицу, так и новорожденного. Вторая пациентка со стенозом субклапанной артерии сохраняла гемодинамическую стабильность в ходе операции кесарева сечения под комбинированной спинально-эпидуральной анестезией (см. Рис. 1–3). Она скончалась спустя семь месяцев после родов, после повторной операции на сердце, так как страдала послеоперационным инфарктом миокарда с сердечной недостаточностью. Третья пациентка, с тяжелой формой сердечной недостаточности вследствие перипартальной кардиомиопатии (фракция выброса 15-20%, левый желудочек 9 см , сердечный ритм 150/мин), сохраняла стабильную гемодинамику в ходе операции кесарева сечения под длительной спинальной анестезией (см. Рис. 1 и 2). Этой пациентке профилактически были установлены аппликаторы для интрааортальной баллонной помпы (ИАБП) и катетера для легочной артерии. Легочный катетер был установлен после операции. В первый послеоперационный день ее состояние ухудшилось и потребовалось использование ИАБП и внутривенной инфузии нитропруссида. Коронарография, проведенная на 2 день после операции, показала рассечение проксимальной левой нисходящей коронарной артерии, стентирование которой и было проведено. Через 71 день пациентке успешно была проведена операция по пересадке сердца, а ИАБП была удалена. На протяжении этого периода пациентке не требовалась инвазивная поддержка дыхательных функций.
Восьми (8) пациенткам потребовалось переливание крови. Уровень гемоглобина до и после операции у паценток, перенесших операцию кесарева сечения, составлял 11,9 (SD 1,4) и 10,8 (SD 1,3) соответственно. Средняя ожидаемая кровопотеря составляла 500 мл (150 – 2500) у пациенток в группе операции кесарева сечения и 410 мл (150 – 2500) у пациенток из группы вагинальных родов. У одной пациентки после операции кесарева сечения проявилась послеоперационная инфекция раны.
 |
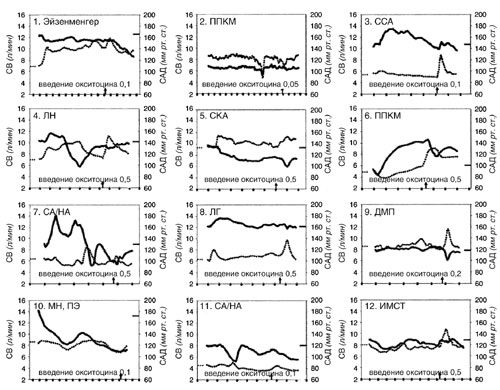 |
| Рисунок демонстрирует изменения в сердечном выбросе (СВ) и систолическом артериальном давлении (САД) крови в ходе регионарной анестезии у 24 пациентов группы высокого (1–12) и среднего (13–24) риска при операции кесарева сечения. Кривые регистрируют момент начала анестезии. Время показано на оси X с 2-минутным интервалом. Основная линия по сердечному выбросу (СВ) отмечена слева на оси Y . Основная линия по СД отмечена на оси Y справа. Стрелка на оси X отмечает введение окситоцина. ППКМ – перипартальная кардиомиопатия, ССА – стеноз субклапанной артерии, ЛН – легочная недостаточность, СКА – смещение крупных артерий, СА/НА – стеноз аорты/недостаточность аорты, ЛГ – легочная гипертензия, ДМП – Дефект межпредсердной перегородки, МН – митральная недостаточность, ПЭ – преэклампсия, ИМСТ – инфаркт миокарда с подъемом сегмента ST , КА – коарктация аорты, ЗАК – замещение аортального клапана, ПС – пересадка сердца, Фалло – тетрада Фалло, АГА – аневризма грудной аорты. |
Дискуссия
Вазодилятация, снижение кровяного давления и риск правого или левого шунтирования назывались причинами отказа от применения регионарной анестезии у беременных женщин с заболеваниями сердца. По нашему мнению, аргументы против регионарной анестезии несостоятельны, и множество сообщения о клинических случаях демонстрируют благоприятный исход22,23. Снижение ССС (системное сосудистое сопротивление) после индукции спинальной анестезии можно компенсировать введением малых доз спинального анестетика, когидрации кристаллоидами, и сопутствующей инфузией фенилэфрина17. Фенилэфрин признан безопасным для новорожденных и является вазопрессором выбора в ходе операции кесарева сечения под нейроаксиальным блоком при неосложненных беременностях24,25. исследования на животных продемонстрировали, что применение фенилефрина не в такой же степени может быть применимо в случаях осложнений плода (отягощенный анамнез)26. Его роль в клинической акушерской анестезиологии неясна. Фенилефрин ( phenylephrine ) оказывает негативное влияние на СВ (сердечный выброс) матери, а применение вазопрессора у беременной пациентки с гемодинамическими осложнениями должно проходить при мониторинге СВ, поскольку одно кровяное давление часто дает скудные указания по кровотоку в тканях. Мониторинг СВ рекомендован и у других групп пациентов с нарушениям кровообращения, и акушерские пациенты не должны быть исключением27.
Последняя работа показала, что титрованная спинальная анестезия с использованием спинального катетера у беременных пациенток с небольшими или средними признаками сердечной недостаточности вызывала симптоматичную краткую гипотензию на 18% 28. У этих пациенток проводился продолжительный инвазивный мониторинг кровяного давления. Средняя доза фенилэфрина, использованная в ходе этого исследования, составляла 550 μg , в сравнении с 140 μg – в нашем исследовании. Сниженную дозу фенилэфрина, использованная в нашем исследовании, в основном при однократной спинальной или комбинированной спинально-эпидуральной анестезии, можно объяснить применением длительного мониторинга СВ (сердечного выброса) для управления стабильностью гемодинамики и потребностью в вазопрессорах.
В начале данного исследования системный порядок отсутствовал, ныне мы проводим регулярные встречи мультидисциплинарных групп, принимающих решение по ведению рожениц с заболеваниями сердца. Основным ограничением данного исследования было то, что мы не могли проанализировать влияние различных методов анестезии на исход пациента. За время исследования мы приобрели опыт инвазивного мониторинга и сегодня он может быть применен в протоколах ведения пациентов для уменьшения нестабильности гемодинамики при операции кесарева сечения под регионарной анестезией.
По сравнению с недавно опубликованной статьей из Соединенного Королевства29, с всего лишь 5% пациенток высокого риска в группе беременных женщин с заболеваниями сердца, почти 30% наших пациенток входили в группу высокого риска. Это большое соотношение тяжелых случаев указывает на то, что наш госпиталь является третьестепенным центром по осложненным беременностям, и национальным центром по врожденным заболеваниям сердца.
Международные рекомендации указывают что, с малыми исключениями, этим женщинам можно планировать роды через естественные родовые пути4,6,11. Наша практика, когда у 82% случаев в группе высокого риска проводится операция кесарева сечения, отличается от подобной. Аргументами против операции кесарева сечения являются высокий риск инфицирования, кровотечения и возникновение анестезиологических осложнения. Однако, вагинальные роды могут вызвать сердечнососудистый стресс, даже если обеспечено оптимальное обезболивание 30 . Невелико количество источников в литературе по поводу гемодинамических изменений при вагинальном родоразрешении, особенно в ходе II периода, и это отношение не было основным объектом предыдущих работ, обсуждающих метод родоразрешения у этих пациенток группы высокого риска.
Плановая операция кесарева сечения имеет, по нашему мнению, массу преимуществ у рожениц группы высокого риска, особенно у первородящих. Одно может стать решающим в запланированный день, во время смены с опытным персоналом, с достаточным количеством времени для адекватного мониторинга и для обеспечения регионарной анестезии. Относительный риск (ОР) смертности при вагинальном родоразрешении в сравнении с плановой операцией кесарева сечения составляет 2,3. если сравнивать вагинальные роды с инструментально вагинальным родоразрешением, то ОР возрастает до 3,6, и до 12 в случае срочной операцией кесарева сечения31. По данным регистрации Соединенного королевства по акушерским пациентам группы высокого риска32, только 50 из 274 имели спонтанные роды через естественные родовые пути. Срочная операция кесарева сечения под общей анестезией также может нести риск неудачной интубации. Её (анестезию) часто выполняет малоопытный персонал, в неудобное время, при недостаточном мониторинге. Предыдущая публикация демонстрирует, что большого количества беременных группы высокого риска по заболеваниям сердца попытки естественных родов закончились срочной операцией кесарева сечения 1,33 . От неудачной интубации пациентки гибнут редко, но конфиденциальный опрос 2000 – 2002 2 информирует о 6 случаях гибели при общей анестезии пациенток без заболеваний сердца. Общая анестезия также может также вызвать спонтанный ответ с гипо- либо гипертензией и тахикардией, которые сложно поддаются контролю. Вентиляция избыточного давления может стать дополнительным поводом для беспокойства у некоторых пациентов. Если у пациентки нет нарушений кровообращения или она не получает высокие дозы антикоагулянтов, мы бы рекомендовали регионарную анестезию для операции планового кесарева сечения. По нашему мнению, общую анестезию стоит выбирать, только если существуют противопоказания к регионарной анестезии или в случае срочной операции кесарева сечения, когда для регионарной анестезии нет времени.
Кровопотеря в ходе операции кесарева сечения переоценивается как фактор риска в обсуждении способа родоразрешения. В данной популяции, среднее изменение гемоглобина до и после операции составило 1,1 г/дл. В двух исследованиях, где пациентки были рандомизированы по виду родоразрешения – вагинальные роды или кесарево сечение, не было обнаружено статистически достоверных отличий в кровопотере между этими двумя группами34,35.
Использование окситоцина – спорно. Некоторые авторы избегают назначения внутривенного окситоцина беременным с заболеваниями сердца 36 , а другие вводят окситоцин с помощью инфузионных насосов11,36,37. Однако, риск кровотечения, вызванного атонией матки, также повод для сомнений. В наших опытах мы применяли малые возрастающие дозы окситоцина и тонус матки был значительным. Мы не практикуем инфузионное применение окситоцина, как рекомендуют другие авторы11, потому что это может привести к ненужному увеличению объема после родов38,39. Для некоторых пациенток это может усугубить застойную сердечную недостаточность. В дополнение к этому, профилактическое наложение B-lynch швов для профилактики атонии матки и послеоперационного кровотечения может быть показано у ряда пациенток.
Carvalho и коллеги продемонстрировали в двух исследованиях что ED 95% окситоцина было 0,35 Ед при плановое операции кесарева сечения и 3,0 Ед в случае, если пациентка находилась в родах со стимуляцией окситоцином до срочной операции кесарева сечения18,19.
Мы нашли очень полезным периоперационное использование минимально инвазивной техники для мониторинга гемодинамики, и пригодным для беременных женщин группы высокого риска. По сравнению с мониторингом исключительно кровяного давления, мониторинг сердечного выброса и ССС предоставляют важную для проведения лечения информацию (объем, вазоактивное насыщение). Продолжение мониторинга послеоперационно обеспечивает предоставление пациенту оптимального ухода и позволяет избежать осложнений. Даже если наше обсервационное исследование невелико, наши открытия позволяют предположить, что гемодинамические изменения, вызванные регионарной анестезией, хорошо переносятся пациентами групп высокого и среднего риска. Мы сочли мониторинг СВ (сердечного выброса) полезным у пациенток группы высокого риска как в ходе операции кесарева сечения, так и послеоперационно для направления лечения. Необходимы дальнейшие исследования для определения пользы этой минимально инвазивной техники у акушерских пациентов.
Выводы
Наше исследование предполагает, что беременные женщины с заболеваниями сердца группы высокого риска могут безопасно родоразрешаться методом плановой операции кесарева сечения с применением регионарной анестезии. Нет доказательств повышенного риска кровотечения по сравнению с родоразрешением через естественные родовые пути. Окситоцин внутривенно, введенный небольшими повторными дозами, может использоваться с минимальным гемодинамическим эффектом. Стабильность гемодинамики достигается титрованием регионарной анестезии, в/в объемом, и инфузией фенилефрина при инвазивном мониторинге.
Заявление
Авторы благодарят Tor H . Hauge (Msc , Oslo , Norway) за обработку данных в программе MatLab , и Mike S . Dogson (MB ChB FRCA , консультирующий анестезиолог, отделение анестезиологии и интенсивной терапии, Rikshospitalet , Oslo , Norway) за лингвистические консультации.
Литература
- Lewis NL , Dob DP , Yentis SM . UK registry of high-risk obstetric anaesthesia: arrhythmias, cardiomyopathy, aortic stenosis, transposition of the great arteries and Marfan's syndrome. Int J Obstet Anesth 2003; 12: 28-34.
- deSwiet M, Nelson-Piercy C. Cardiac disease. In: Lewis G, ed. Why mothers die 2000-2002. Confidential enquiry into maternal and child health. 6th ed. RCOG Press, London , 2004: 137-50.
- Lewis G., ed. The Confidential Enquiry into Maternal and Child Health (CEMACH). Saving Mothers' Lives: reviewing maternal deaths to make motherhood safer-2003-2005. The Seventh Report on Confidential Enquiries into Maternal Deaths in the United Kingdom . London : CEMACH, 2007.
- Swan L. Controversies in Pregnancy and Congenital Heart Disease. Congen Heart Dis 2006; 1: 27-34.
- Oakley C, Bernard AC, Presbitero P, Tornos P. Expert consensus document on management of cardiovascular diseases during pregnancy. Eur Heart J 2003; 24: 761-81.
- Siu SC, Colman JM. Heart disease and pregnancy. Heart 2001; 85: 710-5.
- Oakley CM. Pregnancy and congenital heart disease. Heart 1997; 78: 12-4.
- Smith RL, Young SJ, Greer IA. The parturient with coronary heart disease. Int J Obstet Anesth 2008; 17: 46-52.
- Thorne S, MacGregor A, Nelson-Piercy C. Risks of contraception and pregnancy in heart disease. Heart 2006; 92: 1520-5.
- Siu SC, Sermer M, Colman JM, Alvarez AN, Mercier LA, Morton BC, Kells CM, Bergin ML, Kiess MC, Marcotte F, Taylor DA, Gordon EP, Spears JC, Tarn JW, Amankwah KS, Smallhorn JF, Farine D, Sorensen S. Prospective multicenter study of pregnancy outcomes in women with heart disease. Circulation 2001; 104: 515-21.
- Dob DP, Yentis SM. Practical management of the parturient with congenital heart disease. Int J Obstet Anesth 2006; 15: 137-44.
- Linton RA, Jonas MM, Tibby SM, Murdoch IA, O'Brien TK, Linton NW, Band DM. Cardiac output measured by lithium dilution and transpulmonary thermodilution in patients in a paediatric intensive care unit. Intensive Care Med 2000; 26: 1507-11.
- Morgan P, Al-Subaie N, Rhodes A. Minimally invasive cardiac output monitoring. Curr Opin Crit Care 2008; 14: 322-6.
- Costa MG, Delia RG, Chiarandini P, Mattelig S, Pompei L, Barriga MS, Reynolds T, Cecconi M, Pietropaoli P. Continuous and intermittent cardiac output measurement in hyperdynamic conditions: pulmonary artery catheter vs. lithium dilution technique. Intensive Care Med 2008; 34: 257-63.
- Dyer RA, Piercy JL, Reed AR, Lombard CJ, Schoeman LK, James MR Hemodynamic changes associated with spinal anesthesia for cesarean delivery in severe preeclampsia. Anesthesiology 2008; 108: 802-11.
- Dyer RA, James MR Maternal hemodynamic monitoring in obstetric anesthesia. Anesthesiology 2008; 109: 765-7.
- Langesaeter E, Rosseland LA, Stubhaug A. Continuous invasive blood pressure and cardiac output monitoring during cesarean delivery: a Randomized, double-blind comparison of low-dose versus high-dose spinal anesthesia with intravenous phenylephrine or placebo infusion. Anesthesiology 2008; 109: 856-63.
- Balki M, Ronayne M, Davies S, Fallah S, Kingdom J, Windrim R, Carvalho JC. Minimum oxytocin dose requirement after cesarean delivery for labor arrest. Obstet Gynecol 2006; 107: 45-50.
- Carvalho JC, Balki M, Kingdom J, Windrim R. Oxytocin requirements at elective cesarean delivery: a dose-finding study. Obstetr Gynecol 2004; 104: 1005-10.
- Rasmussen LS, Viby-Mogensen J. Rapid sequence intubation - how? Acta Anaesthesiol Scand 2007; 51: 787-8.
- 21. Langesaeter E, Rosseland LA, Stubhaug A. Hemodynamic effects of oxytocin during cesarean delivery. Int J Gynecol Obstet 2006; 95: 46-7.
- Olofsson C, Bremme K, Forssell G, Ohqvist G. Cesarean section under epidural ropivacaine 0.75% in a parturient with severe pulmonary hypertension. Acta Anaesthesiol Scand 2001; 45: 258-60.
- Landau R, Giraud R, Morales M, Kern C, Trindade P. Sequential combined spinal-epidural anesthesia for cesarean section in a woman with a double-outlet right ventricle. Acta Anaesthesiol Scand 2004; 48: 922-6.
- Lee A, Ngan Kee WD, Gin T. A quantitative, systematic review of randomized controlled trials of ephedrine versus phenylephrine for the management of hypotension during spinal anesthesia for cesarean delivery. Anesth Analg 2002; 94: 920-6.
- Ngan Kee WD, Khaw KS . Vasopressors in obstetrics: what should we be using? Curr Opin Anaesth 2006; 19: 238-43.
- Erkinaro T, Makikallio K, Acharya G, Pakkila M, Kavasmaa T, Huhta JC, Alahuhta S, Rasanen J. Divergent effects of ephedrine and phenylephrine on cardiovascular hemodynamics of near-term fetal sheep exposed to hypoxemia and maternal hypotension. Acta Anaesthesiol Scand 2007; 51: 922-8.
- Jhanji S, Dawson J, Pearse RM. Cardiac output monitoring: basic science and clinical application. Anaesthesia 2008; 63: 172-81.
- Dresner M, Pinder A. Anaesthesia for caesarean section in women with complex cardiac disease: 34 cases using the Braun Spinocath spinal catheter. Int J Obstet Anesth 2009; 18: 131-6.
- Curtis SL, Marsden-Williams J, Sullivan C, Sellers SM, Trinder J, Scrutton M, Stuart AG. Current trends in the management of heart disease in pregnancy. Int J Card 2009; 133: 62-9.
- 30. Langesaeter E. Hemodynamic changes during vaginal delivery in a parturient with no labor pain. Acta Anaes-thesiol Scand 2009; 53: 398-9.
- Cooper GM, Lewis G, Neilson J. Confidential enquiries into maternal deaths, 1997-1999. Br J Anaesth 2002; 89: 369-72.
- Dob DP, Yentis SM. UK registry of high-risk obstetric anaesthesia: report on cardiorespiratory disease. Int J Ob-stet Anesth 2001; 10: 267-72.
- Orbach-Zinger S, Friedman L, Avramovich A, Ilgiaeva N, Orvieto R, Sulkes J, Eidelman LA. Risk factors for failure to extend labor epidural analgesia to epidural anesthesia for Cesarean section. Acta Anaesthesiol Scand 2006; 50: 1014-8.
- The European Mode of Delivery Collaboration. Elective caesarean-section versus vaginal delivery in prevention of vertical HIV-1 transmission: a randomised clinical trial. The European Mode of Delivery Collaboration. Lancet 1999; 353: 1035-9.
- Hannah ME, Hannah WJ, Hewson SA, Hodnett ED, Saigal S, Willan AR. Planned caesarean section versus planned vaginal birth for breech presentation at term: a randomised multicentre trial. Term Breech Trial Collaborative Group. Lancet 2000; 356: 1375-83.
- Hamlyn EL, Douglass CA , Plaat F, Crowhurst JA, Stocks GM. Low-dose sequential combined spinal-epidural: an anaesthetic technique for caesarean section in patients with-significant cardiac disease. Int J Obstet Anesth 2005; 14: 355-61.
- Tamhane P, OSullivan G, Reynolds F. Oxytocin in parturients with cardiac disease. Int J Obstet Anesth 2006; 15:332-3.
- Vercauteren M, Palit S, Soetens F, Jacquemyn Y, Alahuhta S. Anaesthesiological considerations on tocolytic and utero-tonic therapy in obstetrics. Acta Anaesthesiol Scand 2009; 53: 701-9.
- Bergum D, Lonnee H, Hakli TF. Oxytocin infusion: acute hyponatraemia, seizures and coma. Acta Anaesthesiol Scand 2009; 53: 826-27.
Address:
Eldrid Langesaeter
Division of Anaesthesia and Intensive Care Medicine
Oslo University Hospital
Rikshospitalet
N-0027 Oslo Norway e-mail: eldrid.langesaeter@rikshospitalet.no
Acta Anaesthesia of Scand 2010: 54: 46–54