Грудная паравертебральная блокада при операциях в детской онкохирургии
Н. В. Матинян, Е. И. Белоусова, А. И. Салтанов, П. А. Керимов
«НИИ детской онкологии и гематологии»
ФГБНУ «Российский онкологический научный центр им. Н. Н. Блохина» РАМН
В детском возрасте легкие являются наиболее часто встречаемой мишенью метастазирования различных злокачественных опухолей [1]. Результаты современных исследований показывают, что полное удаление метастазов в легких является обязательным условием для выживания пациентов, в связи с чем онкологихирурги оправдывают целесообразность проведения оперативных вмешательств на легких в максимально полном объеме. Операции нередко носят длительный и травматичный характер, сопровождаются повреждением и раздражением обширных рефлексогенных зон, что требует адекватного обезболивания как во время оперативного вмешательства, так и в послеоперационный период [2].
Для блокады ноцицептивного потока из зоны операции в «НИИ детской онкологии и гематологии РОНЦ им. Н. Н. Блохина» при торакальных оперативных вмешательствах широкое распространение получила высокая грудная эпидуральная анальгезия (ЭА), эффективность которой многократно и достоверно подтверждена при сравнении с общей сбалансированной анестезией на основе анальгетиков центрального действия. Побочные эффекты системного применения наркотических анальгетиков в схеме общей комбинированной анестезии выражаются в депрессии дыхания и дозозависимом угнетении центральной нервной системы, что препятствует своевременной посленаркозной реабилитации пациента[3].
Хорошо известны данные о стимулированной самими опиоидами при их системном введении гиперактивации нейронов задних рогов спинного мозга с последующим усилением болевой чувствительности [4]. Показано, что интраоперационное внутривенное введение высоких доз фентанила индуцирует отсроченную (на 5—6 ч) послеоперационную гиперальгезию [5]. Более современным и эффективным выглядит подход, отвечающий принципам мультимодальной анальгезии и позволяющий обеспечить продленный эффект обезболивания на протяжении всего хирургического вмешательства с переходом на послеоперационный период.
В настоящее время не существует единого мнения о выборе регионарного компонента анестезии при операциях по поводу опухолей легкого у детей. Клиницисты продолжают дискуссию о том, какой из методов наиболее полно удовлетворяет сложным и противоречивым требованиям, предъявляемым к безопасности анестезии и переходу к качественной продленной послеоперационной анальгезии при таких операциях.
Грудную ЭА можно считать достаточно надежным методом в детской торакальной анестезиологии, т. к. она характеризуется высокой антиноцицептивной эффективностью. Однако помимо ЭА в торакальной онкохирургии все большее распространение получает грудная паравертебральная блокада(ПВБ) [6].
Выполнение продленной ПВБ может служить альтернативой ЭА, поскольку обеспечивает надежную афферентную защиту в условиях ипсилатерального ноцицептивного потока к задним рогам C7 —Th11 спинного мозга при торакальных оперативных вмешательствах, что показано в многочисленных исследованиях среди взрослых пациентов.
Торакальная ПВБ применяется при унилатеральных хирургических процедурах, таких как торакотомия, видеоассистированная торакоскопия, операции на молочной железе, при переломах ребер и т. д. ПВБ может использоваться при наличии противопоказаний к эпидуральной анальгезии (местное инфицирование, коагулопатия, неврологические заболевания, сложная торакальная спинальная анатомия), а также у пациентов, у которых желательно избежать артериальной гипотензии, связанной с двусторонней симпатической блокадой.
В таблице 1 представлены противопоказания к ПВБ.
Таблица 1. Противопоказания к ПВБАнатомия паравертебрального пространства

Анатомия паравертебрального пространства
Торакальная паравертебральная блокада по существу является проксимальной межреберной блокадой, при которой нервные корешки анестезируются непосредственно в паравертебральном пространстве, после их выхода из межпозвоночного отверстия. Торакальное паравертебральное пространство имеет клиновидную форму. Кпереди от него лежат париетальная плевра и легкое, медиально — тело позвонка, межпозвоночный диск и межпозвоночное отверстие, сзади — поперечный отросток и поперечнореберная связка. Проксимальная часть ребра лежит выше паравертебрального пространства [7]. В грудном отделе паравертебральное пространство включает соматические нервы, цепочку симпатических нервов, сосуды и рыхлую соединительную ткань.
Как правило, распространение местного анестетика при катетеризации паравертебрального пространства происходит на один сегмент выше места введения и на 4 сегмента ниже места введения местного анестетика (МА). В среднем количество позвоночных дерматомных сегментов с потерей холодовой чувствительности составляет 5—6 [8, 9]. При этом унилатеральное межреберное и переднее распространение раствора МА составляет 100%, а контрлатеральное распространение — только в 25% случаев [10].
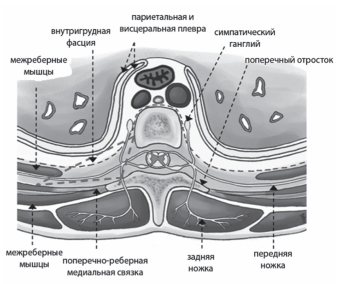
Рис. 1. Анатомия паравертебрального пространства
(NYSORA. 2013)
Ультразвуковая навигация паравертебрального пространства
Существуют два ограничения при проведении ПВБ классическим методом: наличие вариабельности расстояния от кожи до анатомических ориентиров и отсутствие контроля инъекции и распространения раствора МА. Поэтому у детей пункция, катетеризация паравертебрального пространства или одиночная инъекция должны выполняться в условиях ультразвуковой навигации (УЗ-навигации), что повышает эффективность блокады и уменьшает риск осложнений благодаря визуализации паравертебрального пространства, окружающих структур и пунктирующей иглы [11, 14].
По данным Renes S. H., методика УЗ-навигации имела 100%-ную эффективность, не сопровождалась осложнениями, гарантировала корректность нахождения паравертебрального катетера, что было подтверждено рентгенологически при введении контрастного вещества [12]. Из 36 пациентов только у одного больного помимо паравертебрального распространения выявлено эпидуральное затекание контрастного вещества.
Luyet C. et al. методом сканирования контролировали местонахождение кончика иглы и катетера в паравертебральном пространстве после установки катетера классическим способом и с применением УЗ-навигации [13]. Результаты показали, что цель была достигнута в 94 % случаев при использовании УЗ-навигации и в 50% случаев с применением приема «утрата сопротивления» при введении иглы.
На рисунках 2—4 представлены иллюстрации УЗИ паравертебрального пространства. Слева показаны анатомические ориентиры — париетальная плевра, поперечный отросток до введения МА, после введения МА и постановки катетера. На иллюстрациях справа линиями обозначены те же анатомические ориентиры [15].
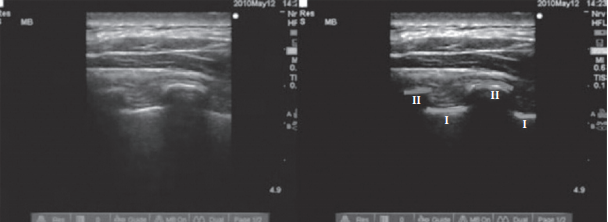
Рис. 2. Определение паравертебрального пространства УЗ-навигацией
(линии I — париетальная плевра, линии II — очертание поперечного отростка
(Medical Ultrasonography 2010; 12 (3): 223—227)
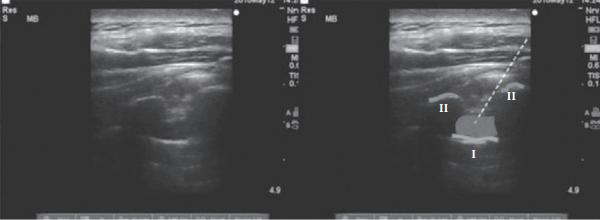
Рис. 3. УЗ-картина при проведении торакальной ПВБ после введения МА
(линия I — париетальная плевра, линии II — очертание поперечного отростка,
серым цветом обозначено введение МА
(Medical Ultrasonography 2010; 12 (3): 223—227)
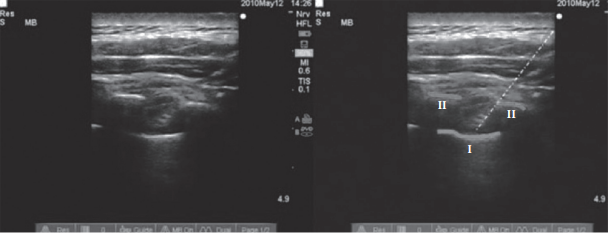
Рис. 4. УЗ-картина при проведении торакальной ПВБ (линия I — париетальная плевра,
линии II — очертание поперечного отростка, белая линия — паравертебральный катетер)
Medical Ultrasonography 2010; 12 (3): 223—227
Обращаем внимание на то, что УЗ-исследование и его трактовка — достаточно специфический навык, приобретаемый только путем многократных тренировок и практики.
Эффективность грудной ПВБ
Публикуется все больше данных, доказывающих, что ПВБ — менее инвазивный, но не менее эффективный регионарный метод обезболивания при торакальных операциях по сравнению с ЭА [16].Анестезия (или анальгезия), развивающаяся в результате ПВБ, схожа с односторонней ЭА. Болюсное введение МА без установки катетера в паравертебральное пространство обеспечивает хорошее обезболивание, но продолжительность анальгезии короче. Поэтому чаще применяется продленная ПВБ с катетеризацией паравертебрального пространства.
Можно с уверенностью сказать, что применительно к взрослым дозы МА отработаны достаточно строго. Вместе с тем в литературе можно найти достаточно много рекомендаций о дозировках МА при ПВБ у детей. В табл. 2 приведены данные о длительности анестезии и анальгезии при паравертебральном введении различных МА.
Таблица 2. Местные анестетики, применяемые в детском возрасте

Так, Cheung S. L. и соавт. сообщили о результатах использования длительной, непрерывной паравертебральной инфузии бупивакаина у 22 детей младенческого возраста с целью предотвращения постторакотомической боли [17]. Однократно вводили 0,25% бупивакаин 1,25 мг/кг, затем переходили к продленной инфузии 0,125% бупивакаина с адреналином 1:400000 со скоростью 0,2 мл/кг/ч в течение 48 ч. Эффективное послеоперационное обезболивание достигнуто у 86% больных. Осложнений, связанных с ПВБ, не отмечено.
Группой исследователей во главе с Shah R . проведено исследование среди детей в возрасте от 2 до 16 лет, которым в послеоперационный период проводилась непрерывная инфузия МА в паравертебральное пространство [18]. У всех больных был достигнут хороший обезболивающий эффект, отмеченный на основании выражения лица, визуальной аналоговой оценки боли и потребности в опиатах. Побочных явлений, связанных с непрерывной инфузией бупивакаина в паравертебральное пространство, не выявлено. Подобные результаты получены и другими авторами.
Известно, что ропивакаин имеет ряд преимуществ перед бупивакаином, в частности обеспечивает более дифференцированный блок и наделен меньшими миотоксическим эффектом и системной токсичностью.В рекомендациях указано, что скорость введения 0,2% ропивакаина у детей в возрасте от 1 до 12 лет можно при необходимости увеличивать до 0,4 мг/кг/ч. Длительная инфузия 0,2% ропивакаина с целью продленной послеоперационной блокады со скоростью от 0,125 до 0,25 мг/кг/ч, эффективна и безопасна, поскольку максимальная концентрация препарата в плазме не превышает 0,4 мг/мл, а средняя — 0,25 мг/мл.
Осложнения грудной паравертебральной блокады
Среди осложнений ПВБ описывают гипотонию, синдром Горнера (5—20% случаев), пневмоторакс (0,01—0,5%), пункцию сосуда и гемоторакс. Описан всего 1 случай гемоторакса. При болюсном введении МА в паравертебральное пространство может иметь место отклонение в его распределении. В 2011 г. Renes S. H. et al. описали отмеченное в двух наблюдениях развитие ипсилатерального блока плечевого сплетения с синдромом Горнера после проведении высокой (Th2—3) грудной ПВБ.
Такое осложнение, как гипотония, встречается реже при ПВБ, чем при ЭА. При эффективном паравертебральном блоке развитие гипотонии объясняется тем, что при введении большого объема МА в паравертебральное пространство может иметь место его частичное эпидуральное распространение (затекание).
В «НИИ детской онкологии и гематологии» ФГБНУ «РОНЦ им. Н. Н. Блохина» разработана «Методика сочетанной ПВБ при торакальных операциях у детей» [19].
Методика сочетанной паравертебральной блокады при торакальных операциях у детей
Предоперационное обследование включает сбор анамнеза, осмотр пациента, клинический анализ крови, биохимический анализ крови, электролиты, общий анализ мочи, расширенную коагулограмму. Проводятся компьютерная томография органов грудной клетки, исследование функции внешнего дыхания (у детей старше 7 лет), электрокардиография, эхокардиография, консультация кардиолога (у детей до 1 года желательно).
Премедикация проводится за 30 мин до подачи ребенка в операционную. В операционной после пункции периферической или катетеризации центральной вены начинается инфузия кристаллоидов.
После проведения индукции анестезии и интубации трахеи пациентам в условиях общей анестезии и ИВЛ проводят предварительное ультразвуковое исследование глубины расположения паравертебрального пространства (аппарат Logiq фирмы GE MEDICAL). У детей младшего возраста применяют высокочастотные линейные датчики 5—12,7—16 МГц, у детей старшего возраста и тучных пациентов — низкочастотные конвексные датчики 2—5 МГц.
Ребенок может лежать как на животе, так и в латеральной позиции с согнутыми ногами. В этом случае анестезиолог (оператор) может садиться напротив или стоять со стороны головы ребенка. Аппарат УЗИ должен находиться в прямой проекции от глаз (рис. 5). Сонографическое исследование начинается с позиционирования УЗ-датчика в поперечной плоскости над межреберным пространством, затем проводится его плавное перемещение по поверхности кожи (скольжение) пока не визуализируется гиперэхогенный поперечный отросток.
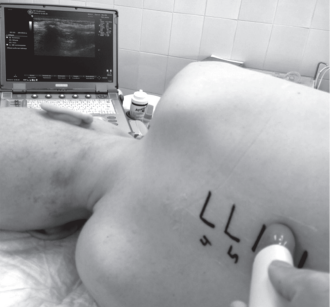
Рис. 5. Линейный датчик в поперечной плоскости
над межреберным пространством (собственные данные)
В асептических условиях выполняют пункцию паравертебрального пространства на уровне, соответствующем локализации операционной травмы (Th3—Th4), в положении на боку. С этой целью используют набор для проводниковой анестезии Minipack 18 G (у детей старше 5 лет), либо 19 G (у детей младше 5 лет). Приблизительное расстояние от кожи до паравертебрального пространства у детей (в мм) равняется 20 + (0,5 ? вес в кг). Место вкола, как правило, располагается на 1—2 см парамедиальнее остистого отростка. Пациент находится в положении на боку. Игла вводится перпендикулярно к коже и продвигается до контакта с поперечным отростком, после чего она выводится до кожи и перенаправляется выше или ниже, чтобы пройти за отросток. Траекторию введения иглы следует устанавливать по аваскуляризированному (под контролем допплерографии) участку.
При идентификации паравертебрального пространства, после выполнения аспирационной пробы вводят тестдозу 0,5—2 мл 2% лидокаина. Затем медленно вводят половину расчетной дозы (0,3 мл/кг) МА (ропивакаин 0,5%), болюсно, с проведением аспирационной пробы после введения каждых 1—2 мл. При введении МА наблюдается продвижение париетальной плевры в вентральном направлении. После этого устанавливают катетер, который проводится краниально на 2—3 см. В катетер вводят оставшуюся половину дозы также под контролем аспирационной пробы. Все этапы: пункция, катетеризация и введение МА — проводятся под УЗ-контролем. Рекомендуемые дозы для проведения ПВБ:
- ропивакаин в виде одномоментной инъекции (0,5 мл/кг) у детей младше 5 лет — 0,2—0,25%, старше 5 лет — 0,375—0,5%;
- для продленной инфузии рекомендуется использовать ропивакаин 0,2% со скоростью 0,2—0,25 мл/кг/ч.
В используемых дозах МА ропивакаин не оказывает при длительном введении системного влияния, миотоксического и кардио или нейротоксического действия.
При торакоскопических оперативных вмешательствах паравертебральный катетер не устанавливается. В этих случаях ограничиваются болюсным введением половины расчетной дозы МА на уровне Th3—Th4 и второй половины из того же вкола на уровне Th4—Th5.
Перед окончанием оперативного вмешательства при постановке плевральных дренажей выполняется межреберная блокада 0,5% ропивакаином в объеме 1,0—2,0 мл (т. к. область постановки плевральных дренажей не охватывается паравертебральной блокадой).
После завершения оперативного вмешательства в отделении реанимации подключают в катетер ропивакаин 0,2% (Наропин) и вводят перфузионно (0,2 мг/кг/ч). В рамках концепции мультимодальной сбалансированной анальгезии в послеоперационном периоде рекомендуется плановое назначение парацетамола (Перфалган) внутривенно в дозе 15 мг/кг каждые 8 ч при отсутствии противопоказаний, таких как заболевания печени.
Ранняя активизация и начало проведения дыхательной гимнастики не позднее вторых суток, эффективное обезболивание позволяют сократить время пребывания детей в отделении реанимации и количество легочных осложнений.
Выводы.
Таким образом, продленная торакальная паравертебральная блокада местными анестетиками в схеме общей анестезии обеспечивает высокий уровень анальгезии, сопоставимый с эффектом эпидуральной блокады. Применение методики торакальной паравертебральной анальгезии характеризуется минимальным воздействием на центральную гемодинамику, кислотнощелочное состояние, обеспечивает высокий уровень антистрессорной защиты, что позволяет проводить длительные и высокотравматичные торакальные операции у детей с онкологическими заболеваниями.
Применение продленной ПВБ для послеоперационного обезболивания у детей, перенесших оперативные вмешательства на легких, обеспечивает потребности больного в купировании боли, снижает потребление наркотических анальгетиков и количество легочных осложнений, не вызывая при этом депрессии гемодинамики и дыхания.
Литература
- Rodriguez M. A., Lugo-Vicente H. Pulmonary metastasectomy for children with malignant tumors. Bol Asoc Med PR. 2012; 104 (3): 35—40.
- Warmann S. W., Nourkami N. et al. Primary lung metastases in pediatric malignant non-Wilms renal tumors: data from SIOP 93-01/GPOH and SIOP 2001/GPOH. Klin Padiatr. 2012; 224(3): 148—152.
- Давыдов М. И., Полоцкий Б. Е. Рак легкого. М.: Радикс; 1994.
- Овечкин А. М. История нейроаксиальной анестезии в Рос-сии. В кн.: Овечкин А. М., Горобец Е. С., Шифман Е. М., ред. Избранные лекции по регионарной анестезии и лечению послеоперационной боли. Петрозаводск: ИнтелТек. 2009; 9—22.
- Woolf C. J., Chong M. S. Preemptive analgesia—treating post-operative pain by preventing the establishment of central sensitization. Anesth Analg. 1993; 77: 362—279.
- Helms O., Mariano J. et al. Intraoperative paravertebral block for postoperative analgesia in thoracotomy patients: a randomized, double-blind, placebo-controlled study. Eur J Cardiothorac Surg. 2011; 40(4): 902—906.
- Lonnqvist P. A., Hesser U. Location of the paravertebral space-in children and adolescent in relation to surface anatomy assessed by computed tomography. Paediatr Anaesth.1992; 2: 285—289.
- Saito T., Den S., Tanuma K., Tanuma Y., Carney E., Carlsson C. Anatomical bases for paravertebral anesthetic block: Fluid communication between the thoracic and lumbar paravertebral regions. Surg Radiol Anat. 1999; 21: 359—363. 32 Регионарная анестезия и лечение острой боли Том IX №1 2015
- De Bessa P. R., da Costa V. V., Arci E. C., Fernandes Mdo C., Saraiva R. A. Thoracic epidural block performed safely in anesthetized patients. A study of a series of cases. Rev Bras Anestesiol. 2008; 58(4): 354—362.
- Albokrinov А. А., Andrew A., Fesenko U. A., Ulbolgan A. Spread of dye after single thoracolumbar paravertebral injection in infants: A cadaveric study. EJA. 2014; 31.
- Cowie B., McGlade D., Ivanusic J. et al. US-Guided thoracic paravertebral blockade. Cadaveric study. Anesth. Analg.2010; 110: 1735—1739.
- Renes S. H., Bruhn J., Gielen M. J. et al. In-plane ultrasound-guided thoracic paravertebral block: a preliminary report of 36 cases with radiologic confirmation of catheterposition. Reg Anesth Pain Med. 2010; 35: 212—216.
- Luyet G., Herrmann S. et al. Ultrasound-guided thoracic paravertebral puncture and placement of catheters in human cadavers: where do catheters go? Br. J. Anaesth. 2011; 106(2): 246—254.
- The European Anaesthesiology Congress “Euroanaesthesia—2012”.Paris, June 9—12, 2012. Paris; 2012
- Bondar A., Szucs S., Iohom G. Thoracic paravertebral blockade. Medical Ultrasonography.2010; 12(3): 223—227.
- Scarci M., Joshi A., Attia R. In patients undergoing thoracic surgery is paravertebral block as effective as epidural analgesia for pain management? Interact Cardiovasc Thorac Surg. 2010; 10(1): 92—96.
- Cheung S. L., Booker P. D., Franks R., Pozzi M. Serum concentrations of bupivacaine during prolonged continuous paravertebral infusion in young infants. Br J Anaesth.1997; 79(1): 9—13.
- Shah R., Sabanathan S., Richardson J., Mearns A., Bembridge J.Continuous paravertebral block for post thoracotomy analgesia in children. J Cardiovasc Surg.1997; 38(5): 543—546.
- Белоусова Е. И., Матинян Н. В., Салтанов А. И. Роль проводниковой анальгезии в детской онкохирургии при торакальных оперативных вмешательствах. Онкопедиатрия. 2014; 2: 22—26.