Продленная эпидуральная блокада в комплексной интенсивной терапии тяжелого острого панкреатита
В. В. Фролков1, М. Я. Красносельский2, А. М. Овечкин2.
1ГБУЗ «Городская клиническая больница №23 «Медсантруд».
2ГБОУ ВПО «Первый московский государственный медицинский университет им. И. М. Сеченова» МЗ РФ.
Проспективное исследование, включившее 220 пациентов с тяжелым острым панкреатитом, 105 из которых проводилась продленная эпидуральная блокада (ЭБ) 0,2% р-ром ропивакаина на протяжении 3—7 сут. Остальные пациенты составили контрольную группу. Продленная ЭБ способствовала снижению внутрибрюшного давления, позволяла на 2—3 сут раньше начать энтеральное питание. У пациентов группы ЭБ было отмечено меньшее количество легочных осложнений в сравнении с контрольной группой: 15,6 и 23,5% соответственно. Общее количество гнойных интраабдоминальных осложнений на фоне ЭБ составило 20,0%, в контрольной группе — 51,3%. Проведение продленной ЭБ способствовало сокращению сроков пребывания в отделении реанимации и в клинике в целом. Летальность в группе ЭБ составила 11,4%, в контрольной группе — 15,6%. Применение на ранних сроках тяжелого острого панкреатита продленной ЭБ в качестве компонента интенсивной терапии приводит к уменьшению частоты жизнеугрожающих осложнений и летальности.
Ключевые слова: продленная эпидуральная блокада, тяжелый острый панкреатит.
Интенсивная терапия пациентов с тяжелым острым панкреатитом (ОП) и панкреонекрозом (ПН) представляет собой сложную комплексную проблему. Течение данного заболевания характеризуется частым развитием жизнеугрожающих осложнений и высокой летальностью. Несмотря на совершенствование методов лечения, частота летальных исходов при данной нозологии остается в пределах 15—30% [1—4]. Основными причинами летальности являются инфекционные осложнения и развитие полиорганной недостаточности [5, 6]. В ряде случаев необратимая органная недостаточность развивается уже в ранние сроки заболевания (в течение 72 ч), при этом летальность достигает 40—60% [7, 8].
В Москве на протяжении ряда лет пациенты с ОП занимают 3-е место (25%) в структуре острой абдоминальной хирургической патологии после острого аппендицита и острого холецистита [9].
При этом также отмечается рост больных с инфицированным ПН, что повышает послеоперационную и общую летальность [10, 11].
По мнению большинства специалистов, основной причиной смерти является развитие инфекционных осложнений. В то же время прогрессирующая полиорганная недостаточность (ПОН) определяет от 20 до 50% всех летальных исходов [3]. В последние годы синдром системной воспалительной реакции (ССВР) рассматривается как ключевой фактор системного повреждения органов и тканей при тяжелом ОП [12, 13]. Раннее (в течение 1-й нед заболевания) формирование ПОН обычно является следствием стерильного ПН. Считается, что неконтролируемый системный воспалительный гиперответ основной патофизиологический механизм, определяющий исход на ранней стадии заболевания, позднее основную роль играет инфицирование поджелудочной железы.
На сегодняшний день интенсивная терапия ОП и ПН основывается на последних международных рекомендациях [14], разработанных Международной ассоциацией панкреатологии (IAP) и Американской панкреатической ассоциацией (APA). Современные рекомендации предусматривают использование в лечении ОП методов, основанных на доказательной медицине. Несмотря на большое количество исследований, проведенных за последние 30 лет, консенсус экспертов признает, что в настоящий момент отсутствует специфическая терапия ОП [15].
В частности, данные доказательной медицины указывают на то, что назначение антисекреторных препаратов и ингибиторов протеаз не оказывает существенного влияния на состояние пациентов с тяжелым ОП. Основой современной терапии ОП и ПН являются: коррекция водно-электролитных расстройств и гликемии, анальгезия, коррекция органной дисфункции, антибиотикотерапия, энтеральное питание. Принципиально важно раннее начало энтерального питания, что позволяет сохранить функциональную активность энтероцитов и предупредить развитие ряда серьезных осложнений.
Продленная эпидуральная блокада (ЭБ)1 достаточно давно используется в качестве компонента интенсивной терапии ОП и ПН. Более того, приказ Департамента здравоохранения Москвы №320 от 13.04.2011 «О единой тактике диагностики и лечения острых хирургических заболеваний органов брюшной полости …» (первичная редакция — аналогичный приказ №181 от 22.04.2005) в разделе «острый панкреатит» указывает на необходимость проведения продленной эпидуральной анальгезии ропивакаином или бупивакаином в комплексной терапии пациентов с данной патологией.
Парадокс заключается в том, что в литературе практически отсутствуют клинические исследования, оценивающие эффективность применения продленной ЭБ при данной патологии.
Поиск в международной электронной базе данных «PubMed» по ключевым словам «тяжелый панкреатит, эпидуральная анальгезия» позволил найти 28 источников, из которых только 2 освещают опыт клинического применения ЭБ, остальные же имеют исключительно экспериментальный характер.
Данное обстоятельство и явилось мотивом предпринятого нами исследования.
Цель работы — оценка влияния эпидуральной блокады на течение острого периода тяжелого панкреатита, а также на выживаемость пациентов.
Материалом для проспективного клинического исследования явились результаты лечения 220 больных с различными формами тяжелого острого панкреатита в возрасте от 18 до 80 лет, госпитализированных в клинику на различных сроках заболевания и находившихся в отделении реанимации и интенсивной терапии ГКБ № 23 «Медсантруд» г. Москвы с 2006 по 2012 г.
Критерии включения больных в исследование: • клиническая картина острого тяжелого панкреатита;
- повышение амилазы крови более чем в 3 раза от нормы;
- продолжительность заболевания: менее 48 ч от манифестации до поступления в стационар;
- ультразвуковые признаки наличия изменений в поджелудочной железе и/или окружающих ее тканях.
Критерии исключения больных из исследования:
- клиническая картина шока при поступлении в стационар;
- сопутствующие психосоматические заболевания.
С учетом схемы терапии, тяжести течения и особенностей клинической картины ОП, больные были разделены на следующие группы:
1-я группа (основная) — 105 (47,7%) пациентов, в лечении которых наряду с традиционными методами проводилась продленная ЭБ 0,2% раствором ропивакаина и раннее энтеральное питание (ЭП). Уровень катетеризации эпидурального пространства — Th8—9, скорость инфузии ропивакаина — 5—8 мл/ч (10—16 мг/ч), длительность ЭБ определялась сроками пребывания пациента в отделении реанимации (в среднем от 3 до 7 сут).
2-я группа (контрольная) — 115 (52,3%) пациентов, которым продленная ЭБ по тем или иным причинам не проводилась. Сроки начала ЭП у этих больных зависели от клинической ситуации.
В свою очередь в обеих группах были выделены 2 подгруппы в зависимости от клинической формы ОП (по МКБ — 10):
1. Острый панкреатит, отечная форма — 56 (25,5%) пациентов в 1-й группе и 52 (23,6%) во 2-й группе.
2. Острый панкреатит, деструктивная форма — 49 (22,3%) пациентов в 1-й группе и 63 (28,6%) во 2-й группе.
Большую часть пациентов в основной и контрольной группах составляли мужчины. В 1-й группе мужчин было 73 (69,5%), а в контрольной группе — 76 (66,1%). В основной группе средний возраст больных колебался от 18 до 80 лет и составил 54±2,8 года. Возраст больных в контрольной группе варьировал от 20 до 80 лет, что в среднем составило 56±2,3 года. В контрольной группе больных старше 75 лет было 8, что составило 7%, а в основной группе — 10 (9,6%).
Подавляющее число пациентов с ОП (84,2%) были госпитализированы в течение первых 2 сут от начала проявления болезни.
Оценка степени тяжести больных тяжелым ОП проводилась по классическим шкалам: APACHE II, SAPS, Ranson. У 18 (17,1%) больных основной и 23 (20,0%) контрольной группы общее состояние при госпитализации по шкале SAPS было расценено как легкой степени. Большинство пациентов госпитализированы в состоянии средней тяжести — 63 (60%) в основной и 63 (54,8%) в контрольной группе. У 24 пациентов (22,9%) основной и у 29 (25,2%) контрольной группы состояние при госпитализации определено как тяжелое.
У всех больных проведен стандартный комплекс диагностического и клинико-лабораторного обследования. Для динамической оценки болевого синдрома использовали 10-балльную визуальноаналоговую шкалу (ВАШ).
Центральную гемодинамику и объемные показатели сердца (давление в легочной артерии, минутный объем кровообращения (МОК), объемы левого предсердия и левого желудочка, сердечный выброс, общее периферическое сосудистое сопротивление (ОПСС) оценивали при помощи метода импедансной кардиографии и ЭХО-КГ, аппаратами «Niccomo» фирмы «Medis» (Германия) и «Voluson E8» фирмы «General Electric» (США).
Внутрибрюшное давление (ВБД) определялось не менее 4 раз в сут всем больным с помощью системы «Urometer Safeti Plus», подсоединенной к уретральному катетеру Фоллея, введенному в мочевой пузырь больного. Снижение ВБД до величин, приближенных к физиологическим, позволяло начинать ЭП сбалансированными смесями через ранее установленный назоинтестинальный зонд в тощую кишку. В желудок устанавливали зонд для эвакуации отделяемого и контроля моторно-эвакуаторной функции ЖКТ.
Статистический анализ данных проводился при помощи лицензионного пакета программ Statistica (версия 6.1. фирмы StatSoft Inc.). Для оценки статистической значимости различий между сравниваемыми группами применяли параметрический критерий Стьюдента (t-критерий) и непараметрический критерий Манна-Уитни (U-критерий).
Однородность дисперсий оценивали с применением теста Фишера. Корреляционный анализ осуществлен методом Спирмена с расчетом коэффициента ранговой корреляции (r) и вычислением его средней ошибки.
Результаты и обсуждение
Выраженность болевого синдрома по ВАШ в группах с отечной и деструктивной формами ОП представлена на рис. 1 и 2.
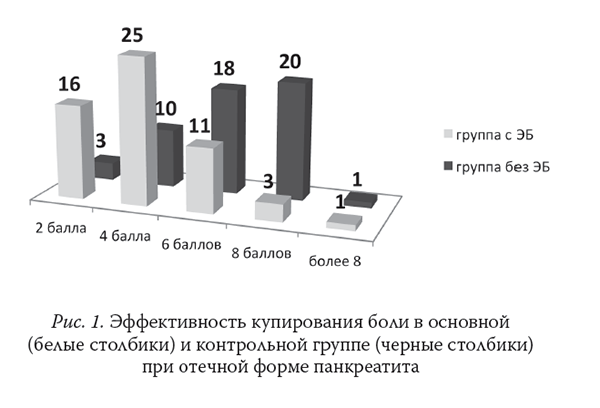
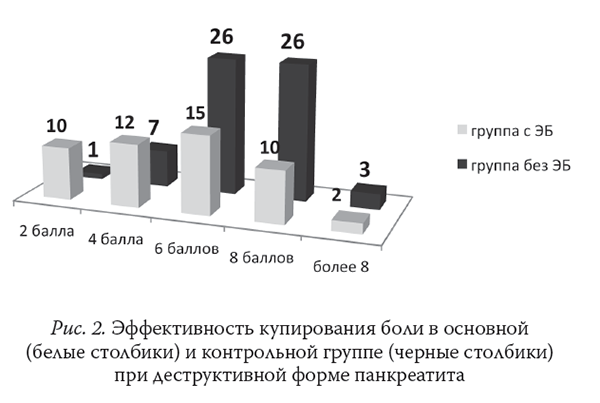
Проведение интенсивной терапии у больных с тяжелым ОП требует обязательного динамического контроля центральной гемодинамики. В результате проведенного исследования выявлено, что наиболее проблемным являлось проведение ЭБ в 1-е сут интенсивной терапии, на фоне развернутой картины системного воспалительного ответа, когда повышается вероятность развития гипотензии в ответ на введение растворов МА в эпидуральное пространство.
Мониторинг параметров ЦГД показал, что уже на 2-е сут у пациентов основной группы прослеживалась тенденция к увеличению величины сердечного индекса (СИ) от 2,15±0,24 до 2,36± 0,23 л/мин/м2 (р > 0,05) при отечной форме ОП и от 1,57±0,23 до 1,92±0,24 л/мин/м2 (р > 0,05) при деструктивной форме. Кроме этого, на этом фоне определялся рост индекса ОПСС от 1659±119 до 1667±218 дин × с/см5 (р > 0,05), что имело компенсаторный характер. К 3-м сут интенсивной терапии в контрольной группе достоверно (р < 0,05) против исходных величин уменьшился индекс ОПСС, достигнув физиологических значений (1502±231 при отечной форме ОП и 1700±238 дин × с/см5 при деструктивной форме ОП), СИ повысился с 2,2±0,28 до 2,3±0,13 л/(мин × м²) при отечной форме ОП и от 2,16±0,27 до 2,85± 0,14 л/(мин × м²) при деструктивной форме ОП.
В основной группе сроки начала энтерального питания через зонд, проведенный за связку Трейца, составляли 46±11 ч, в контрольной группе — 112±23 ч, что объяснялось выраженным парезом ЖКТ. Кроме того, у 28 пациентов контрольной группы уже начатое ЭП пришлось прервать из-за значительного сброса по желудочному зонду.
Проведение ЭБ и раннего сбалансированного ЭП способствовало более быстрой нормализации уровней общего билирубина и α-амилазы при отечной форме ОП в контрольной группе. Эти показатели к 3-м сут в основной группе снизились от исходных на 25,9 и 32,3% соответственно при отечной форме, а при деструктивной — на 11,7 и 28,2%.
Из экстраабдоминальных осложнений во время лечения в обеих группах доминировал синдром острого повреждения легких, причем частота его была выше в группе сравнения — 27 пациентов (23,5%), в основной группе — 18 пациентов (15,6%).
Появление и прогрессирование дыхательной недостаточности определило необходимость респираторной поддержки у ряда пациентов обеих групп. В основной группе, где ЭБ являлась компонентом интенсивной терапии, необходимость в проведении ИВЛ возникла у 9 больных (8,56%).
Длительность ИВЛ составила 2,1±1,9 сут. В контрольной группе ИВЛ потребовалась 30 больным (26,1%). Длительность ИВЛ составила 4,8±2,1 сут. При этом отмечалась существенная разница между группами по таким показателям, как общий комплайенс, индекс оксигенации и насыщение гемоглобина кислородом (сатурация, SpO2). Отмечено, что у больных основной группы быстрее нормализовались показатели биомеханики дыхания (податливость, объемные и скоростные показатели). У них выявлялась меньшая потребность в поддержании высокого давления в конце выдоха, быстрая нормализация индекса оксигенации, что отчасти можно объяснить улучшением состояния системы внешнего дыхания на фоне снижения ВБД.
К 3-м сут заболевания внутрибрюшное давление у больных в контрольной группе составляло в среднем 15,1±2,1 мм рт. ст. У пациентов основной группы удавалось снизить внутрибрюшное давление до 9,8±1,2 мм рт. ст. (р < 0,05).
Были выявлены существенные отличия в структуре и частоте гнойных осложнений острого панкреатита (острая инфицированная псевдокиста, гнойный перитонит, аррозивное кровотечение, панкреатогенный абсцесс, желудочно-кишечный и панкреатический свищ) между пациентами основной и контрольной групп. Так, общее количество гнойных интраабдоминальных осложнений в основной группе на фоне раннего применения ЭБ составило 20,0%, в то время как в группе сравнения — 51,3%, т. е. в 2,6 раза выше (р < 0,05).
При проведении анализа корреляционной связи между увеличением внутрибрюшного давления и тяжестью состояния по шкале APACHE II к 3-м сут r=0,6; р < 0,05, выявлена прямая взаимосвязь тяжести состояния больных ОП и уровня ВБД.
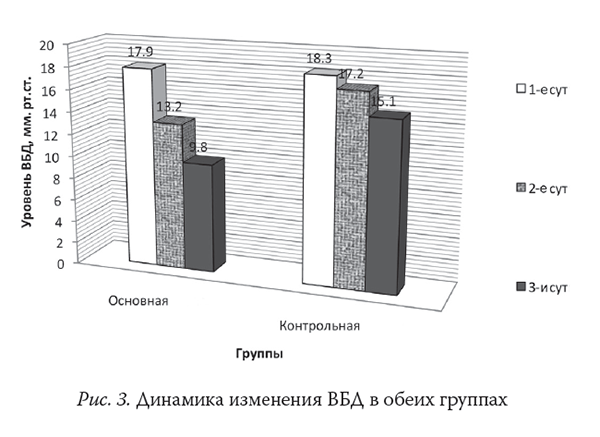
Из 220 пациентов были прооперированы 130 (59,1%). Основными показаниями к оперативному лечению были: гнойно-некротические процессы в поджелудочной железе и парапанкреатической клетчатке; клинические признаки перитонита.
В основной группе прооперировано 48 (45,7%) больных, в контрольной группе — 69 (60,0%). В основной группе повторных оперативных вмешательств не было. В контрольной группе 33% больных перенесли открытые вмешательства в связи с тяжестью и обширностью гнойного процесса.
В основной группе лапаротомным доступом было выполнено всего 11 оперативных вмешательств, преобладали малоинвазивные процедуры (n=37, дренирование жидкостных образований под УЗИконтролем, лапароскопическое дренирование).
Продолжительность госпитализации больных основной группы составляла в среднем 19,6±1,4 койко-дня, из них 3,5±1,6 в реанимационном отделении. Средняя продолжительность госпитализации больных контрольной группы составляла 23,8±1,2 койко-дня, из них 8,4±4,5 в реанимационном отделении.
При анализе летальности в обеих группах выявлено, что в контрольной группе она составила 15,6% — умерло 18 больных (см. таблицу).
Причинами смерти в этой группе были в основном гнойно-септические осложнения ОП и СПОН.

В основной группе летальность составила 11,4% (12 больных). Основными причинами смерти являлись: фульминантное течение острого геморрагического панкреатита, тяжелый сепсис с полиорганной недостаточностью, декомпенсация конкурирующих заболеваний (ХОБЛ и др.).
Выздоровели с сохранением качества жизни в основной группе 79 (79,1%) больных, временная или стойкая утрата трудоспособности осталась у 20 (20,8%) больных, аналогичные показатели в контрольной группе составили 51 (52,6%) и 26 (26,8 %) соответственно.
Таким образом, включение ЭБ в схему интенсивной терапии при тяжелом ОП оказывало позитивное влияние на течение острого периода и исход лечения в целом за счет:
- снижения внутрибрюшного давления;
- снижения частоты и тяжести поражения легких;
- снижения частоты гнойных осложнений ОП.
Как уже упоминалось, указанные эффекты выходят далеко за пределы анальгетического действия ЭБ. Каким образом можно их трактовать?
Как известно, развитие абдоминального компартмент-синдрома (АКС) является одним из тяжелых осложнений тяжелого ОП и ПН. При этом снижается сердечный выброс, прогрессирует олигурия, развивается гипоксия даже при нормальных показателях дыхательных объемов. При внутрибрюшной гипертензии страдают функции легких, сердца, почек и печени. Невозможность снизить давление в брюшной полости в течение 8—12 ч считается показанием к хирургической декомпрессии.
Основными причинами АКС являются асцит и парез кишечника. При лечении больных с АКС крайне важно восстановление нормальной функции ЖКТ. При нормализации функции ЖКТ снижается внутрибрюшное давление, восстанавливается барьерная функция кишечника, что снижает вероятность транслокации бактерий и эндотоксинов [16], ускоряется абсорбция асцитической жидкости. Раннее разрешение АКС существенно улучшает прогноз заболевания [8]. Значение ЭБ при этом неоспоримо. Однако позитивное влияние ЭБ на моторику ЖКТ и микроциркуляцию стенки кишечника достигается лишь при правильном выборе уровня пункции и катетеризации эпидурального пространства.
Для выбора оптимального уровня катетеризации эпидурального пространства у больных с ОП и ПН необходимо вспомнить иннервацию поджелудочной железы. Эфферентные симпатические волокна, иннервирующие поджелудочную железу, исходят из сегментов Th5—11. Висцеральные афферентные волокна входят в спинной мозг на уровне от Th6 до Th10 с двух сторон в составе висцеральных нервов, дальше они идут в составе блуждающих нервов.
Таким образом, оптимальным уровнем пункции и катетеризации эпидурального пространства у пациентов с ОП и ПН является уровень Th8—9 c краниальной ориентацией катетера. Следует помнить о том, что уровень симпатического блока всегда на 2—3 сегмента выше уровня сенсорного блока.
Любая катастрофа в брюшной полости, в том числе тяжелый ОП, вызывает снижение перфузии висцеральных органов на 65—70% от исходного уже в первые сутки заболевания. Ишемия кишечника способствует повышению проницаемости слизистой оболочки, развитию эндотоксинемии и формированию органной недостаточности.
В экспериментальном исследовании, посвященном измерению рН слизистой подвздошной кишки, было установлено, что ЭБ (кончик катетера на уровне Th8—10) препятствовала развитию ишемии кишки на фоне прогрессирующей гипоксии [16].
Кроме того, ЭА предупреждала повышение концентрации эндотоксинов в портальной вене.
Положительное влияние ЭБ на восстановление перистальтики кишечника отчасти объясняется системным противовоспалительным действием местных анестетиков, абсорбированных в кровоток из эпидурального пространства.
В экспериментальных условиях показано, что системное введение амидных МА или их аппликация на слизистую кишечника подавляет воспалительный ответ, что проявляется снижением секреции жидкости и экстравазации альбумина [17].
Как известно, тяжелый ОП и ПН являются одними из основных причин развития СОПЛ и ОРДС.
Полагаем, что снижение частоты и тяжести поражения легких на фоне продленной ЭБ, отмеченное в нашем исследовании, нельзя объяснить только снижением ВБД и увеличением податливости передней брюшной стенки. Вероятно, определенную роль играет системное противовоспалительное действие местных анестетиков. За счет медленной абсорбции из эпидурального пространства в плазме создаются микромолярные концентрации анестетика (0,5—5 мкг/мл). Доказано, что такие концентрации ограничивают перемещение нейтрофилов и моноцитов в зону воспаления, подавляют их адгезию к клеткам легочного эндотелия, снижают синтез токсических метаболитов кислорода, подавляют продукцию простагландинов и лейкотриенов [18, 19]. За счет этого ограничивается повреждение альвеоло-капиллярных мембран. Клинически данные наблюдения проявляются уменьшением интерстициального отека легких.
Нутритивная поддержка — один из основных компонентов комплексной терапии пациентов с ОП и ПН. Ее условием является восстановление моторики ЖКТ. Существуют серьезные возражения против проведения парентерального питания (ПП) пациентов данной категории. В частности, Савельев В. С. и соавт. полагают, что ПП у пациентов с панкреонекрозом способствует усилению энтерогенной транслокации бактерий, развитию ангиогенной инфекции и иммуносупресcии [20].
В то же время у пациентов с тяжелым ОП, получавших раннее ЭП, отмечают регрессию признаков полиорганной недостаточности и снижение количества послеоперационных осложнений, по сравнению с пациентами, которым проводилось ПП. В частности, в исследовании Austrums E. et al. легочные осложнения развились у 15,2% пациентов, получавших ЭП, по сравнению с 43,3% в группе ПП [21]. Раневые инфекции и ангиогенный сепсис чаще наблюдались в группе ПП (30%) по сравнению с группой ЭП (9,1%). В группе, получавшей ЭП, послеоперационная летальность составила 6,1%, в контрольной группе — 26,7%.
Таким образом, раннее энтеральное питание является эффективным компонентом послеоперационной терапии пациентов с тяжелым ОП, влияющим на исход заболевания. Основным условием раннего начала ЭП является восстановление моторики ЖКТ при помощи продленной ЭБ.
Заключение.
При анализе клинического течения тяжелого острого панкреатита выявлено, что в основной группе больных, которые получали в составе комплексной терапии продленную ЭБ и раннее сбалансированное энтеральное питание, течение острого периода болезни было более благоприятным. Отмечалась отчетливая тенденция к снижению частоты легочных осложнений, внутрибрюшного давления, частоты инфекционных осложнений. Включение продленной ЭБ и раннего ЭП в схему интенсивной терапии позволило снизить 30-суточную летальность с 15,6 до 11,4%.
Таким образом, применение на ранних сроках заболевания комплексной интенсивной терапии с продленной эпидуральной блокадой в качестве компонента приводило к уменьшению частоты жизнеугрожающих осложнений и летальности.
Литература
- Beger H., Isenmann R. Surgical management of necrotizing pancreatitis. Surg Clin North Am. 1999; 79: 783—800.
- Dugernier T., Laterre P., Reynaert M. Ascites fluid in severe acute pancreatitis: from pathophysiology to therapy. Acta Gastroenterol Belg. 2000; 63: 264—268.
- Dugernier T., Reynaert M., Laterre P. Early multi-system organ failure associated with acute pancreatitis: a plea for a conservative therapeutic strategy. Acta Gastroenterol Belg. 2003; 66: 177—183.
- Flint R., Windsor J., Bonham M. Trends in the management of severe acute pancreatitis: interventions and outcome. ANZ J Surg. 2004; 74: 335—342.
- Isenmann R., Rau B., Beger H. Bacterial infection and extent of necrosis are determinants of organ failure in patients with acute necrotizing pancreatitis. Br J Surg. 1999; 86: 1020—1024.
- Takeda K., Matsuno S., Sunamura M. Surgical aspects and management of actue necrotizing pancreatitis: recent results of a cooperative national survey in Japan. Pancreas. 1998; 16: 316—322.
- McKay C., Evans S., Sinclair M. High early mortality rate from acute pancrea-titis in Scotland, 1984—1995. Br J Surg. 1999; 86: 1302—1305.
- Hou-Quan Tao., Jing-Xia Zhang., Shou-Chun Zou. Clinical characteristics and management of patients with early acute severe pancreatitis: Experience from a medical center in China. World J Gastroenterol. 2004; 15: 919—921.
- Кузнецов Н. А., Аронов Л. С., Харитонов С. В., Бронтвейн А. Т. Возможности первичного экстренного ультразвукового исследования в диагностике и определении тактики лечения больных острым панкреатитом. Анналы хирургии. 2004; 2: 52—58.
- Ермолов А. С. и др. Основные причины летальности при остром панкреатите в стационарах г. Москвы. Диагностика и лечение гнойных осложнений панкреонекроза. Труды НИИ CП им. Н. В. Склифосовского. 2001; 153: 4—14.
- Жариков О. Г. Прогнозирование гнойно-септических осложнений тяжелого острого панкреатита. Новости хирургии. 2008; 16: 117—125.
- Савельев В. С., Гельфанд Б. Р., Гологорский В. А. и соавт. Системная воспалительная реакция и сепсис при панкреонекрозе. Анестезиол. и реаниматол. 1999; 6: 28—33.
- Wilmer A. ICU management of severe acute pancreatitis. Eur J Intern Med. 2004; 15: 274—280.
- Working Group IAP/APA Acute Pancreatitis Guidelines.IAP/ APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013; 13: 1—15.
- Kambhampati S., Park W, Habtezion A. Pharmacologic therapy for acute pancreatitis. World J. Gastroenterol. 2014; 20(45): 16868—16880.
- Ai K., Kotake Y., Satoh T. Epidural anesthesia retards intestinal acidosis and reduced port vein endotoxin concentrations during progressive hypoxia in rabbits. Anesthesiology. 2001; 94: 263—269.
- Rimback G., Cassuto J., Tolesson P. Treatment of postoperative paralytic ileus by intravenous lidocaine infusion. Anesth.Analg.
1990; 70: 414—419. - Hollmann M., Durieux M. Local anesthetics and the inflammatory response. Anesthesiology. 2000; 93: 858—875.
- Takao Y., Mikawa K., Nishina K et al. Lidocaine attenuates hyperoxic lung injure in rabbits. Acta Anaesth. Scand. 1996; 40: 318—325.
- Савельев В. С., Филимонов М. И., Гельфанд Б. Р. Острый панкреатит как проблема ургентной хирургии и интенсивной терапии. Consilium Medicum. 2000; 2; (9): 12—19.
- Austrums E., Pupelis G., Snippe K. Postoperative enteral stimulation by gut feeding improves outcomes in severe acute pancreatitis. Nutrition. 2003; 19: 487—491.
Регионарная анестезия и лечение острой боли Том IX №1 2015