Опыт применения рекомбинантного активированного фактора VII в лечении геморрагического цистита у пациента с экстранодальной лимфомой
Experience gained in the use of recombinant activated factor VII in therapy of hemorrhagic cystitis in a patient with extranodal lymphoma
Описан клинический случай лечения геморрагического цистита и тампонады мочевого пузыря, возникших в результате высокодозной химиотерапии у пациента с первичной диффузной В-клеточной крупноклеточной лимфомой головного мозга и сопутствующей тяжелой патологией сердечно-сосудистой системы. Пациенту были выполнены внебрюшинное вскрытие мочевого пузыря и удаление сгустков крови, заполнявших всю полость мочевого пузыря. В связи с неэффективностью традиционной гемостатической терапии, наличием признаков сердечной недостаточности и локализацией кровотечения, не позволяющей системно использовать ингибиторы фибринолиза, больному был назначен препарат с шунтирующим механизмом действия – рекомбинантный активированный фактор VII – rFVIIa (Коагил-VII). Однократное введение препарата в дозе 100 мкг/кг привело к полной остановке кровотечения. Эффективность препарата и отсутствие тромботических осложнений были доказаны с помощью одного из интегральных лабораторных тестов – тромбоэластографии. Данный клинический случай свидетельствует об эффективности и безопасности применения rFVIIa у пациентов, которым противопоказано введение традиционно используемых гемостатических средств в связи с особенностью клинической ситуации или наличием сопутствующей патологии.
Ключевые слова: лимфома, химиотерапия, геморрагический цистит, тампонада мочевого пузыря, рекомбинантный активированный фактор VII, тромбоэластография
Геморрагический синдром как осложнение химиотерапии встречается в 75–80% случаев, ранняя летальность отмечается у 30% больных [1–3]. Традиционная гемостатическая терапия не во всех случаях приводит к быстрой и эффективной остановке угрожающего жизни кровотечения. В подобных случаях может быть использован препарат с шунтирующим механизмом действия – рекомбинантный активированный фактор VII (rFVIIa), эффективность которого при кровотечениях различного генеза позволяет охарактеризовать его как универсальный гемостатический препарат [4–7]. В физиологических условиях FVIIa является ключевым фактором в инициации гемостаза. Повреждение стенки сосуда сопровождается выходом в кровь тканевого фактора (ТФ), последний связывается с FVIIа с образованием активного комплекса ТФ–FVIIа, который трансформирует FХ в активную форму. FХа, оставаясь на поверхности субэндотелиальных клеток, вместе со своим кофактором – FVa – образует протромбиназу, которая протеолитически расщепляет протромбин, в результате чего образуется тромбин с последующей активацией факторов свертывания крови V, VIII, IX и XI, а также тромбоцитов. Последние, активируясь, изменяют форму и экспонируют на своей поверхности отрицательно заряженные фосфолипиды, такие как фосфатидилсерин. На поверхности активированных тромбоцитов происходит активация FХ и образование большого количества тромбина, достаточного для превращения фибриногена в фибрин, а также активация ингибитора фибринолиза, так называемого тромбинактивируемого ингибитора фибринолиза – TAFI (thrombin-activable fibrinolysis inhibitor).
При введении избыточного количества rFVIIa пациенту, FVIIa продолжает активировать FX в течение всего времени существования rFVIIa в организме, и весь образующийся при этом FXa включается в протромбиновый комплекс. Прямая активация FX на активированных тромбоцитах в отсутствие ТФ значительно улучшает генерацию тромбина, что также объясняет механизм гемостатического действия rFVIIa при кровотечениях, возникающих у пациентов с нормальным содержанием факторов свертывания крови. Введенный больному rFVIIa обеспечивает дополнительный синтез тромбина на клетках, несущих ТФ, за счет увеличения количества активных комплексов TФ–FVIIa. Тромбин в свою очередь усиливает активацию тромбоцитов, компенсируя их недостаточное участие в активации гемостатических реакций. Таким образом, rFVIIa оказывает гемостатическое действие при кровотечениях различной этиологии именно в месте повреждения, не вызывая генерализованного тромбообразования. Осложнения тромботического характера при применении rFVIIa были зафиксированы в 0,2% наблюдений пациентов с ингибиторной формой гемофилии [8–13]. Вместе с тем авторы ряда публикаций указывают на то, что использование rFVIIа вне зарегистрированных показаний (off-label) увеличивает частоту тромбоэмболических осложнений [14–19]. Было зафиксировано статистически значимое (p = 0,003) увеличение частоты возникновения артериальных тромбозов при использовании rFVIIа по сравнению с плацебо, тогда как препарат практически не оказывал влияния на частоту венозных тромбозов [18].
При артериальных тромбозах чаще всего поражались коронарные сосуды. Авторы публикации обратили внимание на то, что вероятность тромбогенных осложнений увеличивается с возрастом пациента (особенно в возрасте старше 65 лет), по мере увеличения дозы препарата [18]. Другие исследователи при использовании rFVIIa в сердечно-сосудистой хирургии также высказали определенную озабоченность в отношении тромботических осложнений, указав на то, что тромбозы различной степени выраженности развивались в 13–27% случаев [20]. Однако в ходе самого большого на сегодняшний день плацебо-контролируемого исследования не было показано статистически значимого увеличения частоты тромбозов в результате применения rFVIIa при угрожающих жизни кровотечениях у больных с травмой [21]. Такие же результаты были получены у пациентов кардиохирургического стационара [22], а также при лечении массивного послеродового кровотечения [23]. Интересным и актуальным представляется вопрос о применении антикоагулянтных и дезагрегантных препаратов в сочетании с rFVIIa. Такого рода вопрос пришлось решать при хирургическом лечении аневризмы аорты у пациента 48 лет [24]. На первом этапе лечения возникла ятрогенная гипокоагуляция, которая привела к профузному кровотечению и необходимости введения rFVIIa. Кровотечение было остановлено, однако на 6-е сутки после операции диагностирован тромбоз дистальных отделов глубоких вен голени, после чего была усилена антикоагулянтная терапия. Подобная проблема анализируется и рядом других авторов [25]. Таким образом, вопрос о целесообразности применения rFVIIа вне зарегистрированных показаний обсуждается до сих пор, в том числе и при выраженном геморрагическом синдроме у больных с онкогематологическими заболеваниями. Это связано с тем, что патологические изменения в системе гемостаза при гемобластозах разнообразны по генезу и включают всю гамму патогенетических вариантов – от системной кровоточивости до тромбозов вен и облитерации артерий [26, 27].
Цель данной публикации: показать эффективность и безопасность применения препарата с шунтирующим механизмом действия для лечения геморрагического цистита у больного с лимфомой.
Клинический случай
Пациент Р., 65 лет, масса тела 73 кг, площадь поверхности тела 2 м2. Диагноз: диффузная В-клеточная крупноклеточная лимфома с поражением обоих полушарий мозжечка. Первыми признаками заболевания явились симптомы поражения мозжечка. В декабре 2011 г. больной был госпитализирован в клинику нервных болезней им. А.Я.Кожевникова Первого Московского государственного медицинского университета им. И.М.Сеченова (Москва). При обследовании обнаружено новообразование мозжечка, было выполнено частичное удаление опухоли левого полушария мозжечка. На основании гистологического и иммуногистохимического (экспрессия CD20, MUM.1, BCL-2, BOB.1, PAX5) исследований биоптата опухоли головного мозга был поставлен диагноз диффузной В-клеточной крупноклеточной лимфомы. Индекс пролиферативной активности Ki-67 составлял 80% положительных клеток. В январе 2012 г. пациент поступил в Гематологический научный центр Минздравсоцразвития России (Москва) для проведения химиотерапии. Учитывая тяжелую сопутствующую патологию сердечно-сосудистой системы (распространенный атеросклероз сосудов, сочетанный порок сердца, недостаточность митрального клапана III степени, стеноз и недостаточность аортального клапана III степени, значительная гипертрофия левого желудочка смешанного типа, снижение сократительной способности миокарда), было решено в качестве индукционной химиотерапии провести курс, содержащий высокие дозы цитозара (Ara-C) и этопозида (VP-16). Внутривенно были введены Ara-C в дозе 4 г/м2 в сутки в 1-й и 2-й дни (кумулятивная доза 8 г/м2 или 16 г), VP-16 в дозе 450 мг/м2 в сутки с 1-го по 4-й день (кумулятивная доза 1,8 г/м2 или 3,6 г). Объем инфузионной терапии был уменьшен до 2 л/м2 в сутки с учетом тяжелой сопутствующей патологии сердечно-сосудистой системы. На 4-й день после окончания курса химиотерапии была зафиксирована трехростковая цитопения, появились признаки диссеминированного внутрисосудистого свертывания (удлинение фибринолиза до 120 мин, снижение протромбинового индекса до 65%, снижение антитромбина III до 50%). Показатели гемограммы на 7-й день после окончания курса химиотерапии: количество лейкоцитов 0,4 × 109/л, количество тромбоцитов 22,0 × 109/л, концентрация гемоглобина 79 г/л. У пациента появилась клиническая картина геморрагического цистита. Несмотря на проводимую в течение 3 сут гемостатическую терапию (тромбоконцентрат 8 доз в сутки, свежезамороженная плазма 500 мл в сутки, криопреципитат 8 доз в сутки) и промывание мочевого пузыря через установленный катетер, кровотечение остановить не удалось. К концу 3-х суток была диагностирована тампонада мочевого пузыря, полное прекращение поступления мочи.
Растяжение стенок мочевого пузыря и отсутствие его сократительной способности явились отягчающими факторами, препятствующими гемостазу. Необходимо было в экстренном порядке одновременно решить две взаимосвязанные проблемы, каждая из которых представляла угрозу для жизни пациента, – остановить кровотечение и ликвидировать блок мочевыводящих путей. По неотложным показаниям пациенту была выполнена операция – внебрюшинное вскрытие мочевого пузыря, удаление сгустков крови, заполнявших всю полость мочевого пузыря. При ревизии мочевого пузыря обнаружены размягчение и множественные эрозии слизистой оболочки, которые и являлись источником кровотечения. Была наложена эпицистостома для исключения рецидива тампонады мочевого пузыря. Поскольку дальнейшая эскалация инфузионной терапии была нежелательна в условиях тяжелой сердечно-сосудистой патологии, было решено с гемостатической целью ввести пациенту rFVIIа из расчета 100 мкг/кг. Пациенту был внутривенно введен эптаког альфа (активированный) – препарат Коагил-VII (ОАО «Фармстандарт», Россия) в дозе 7,2 мг. Клиническое улучшение было зафиксировано в течение первых 2 ч после инъекции препарата: интенсивность кровотечения из мочевого пузыря уменьшилась вплоть до полной остановки. В дальнейшем рецидива кровотечения не отмечалось. Активное промывание мочевого пузыря было продолжено в течение 12 сут. Для объективной оценки гемостатического эффекта препарата мы использовали один из интегральных тестов – тромбоэластографию (ТЭГ), позволяющую получить информацию обо всем процессе свертывания, включая инициацию, скорость образования сгустка и плотность сгустка. Для выполнения ТЭГ использовали стабилизированную цитратом кровь. Измерение параметров ТЭГ проводили согласно стандартной методике на тромбоэластографе TEG 5000 (“Haemoscope Corporation”, США).
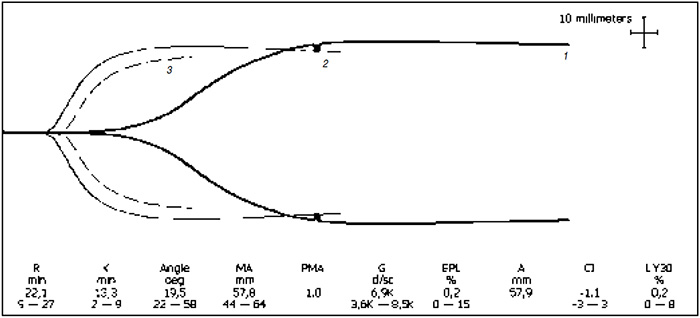 |
| Рисунок. Данные ТЭГ в результате введения препарата Коагил-VII. 1 – до введения препарата Коагил-VII; 2 – через 15 мин после введения препарата Коагил-VII; 3 – средняя графическая норма. |
На рисунке представлена динамика ТЭГ в результате проведенной терапии. Исходное состояние гемостаза пациента характеризовалось умеренной гипокоагуляцией, проявлявшейся уменьшением скорости достижения плотности сгустка и скорости укрепления сгустка, о чем свидетельствовали удлинение интервала K и уменьшение угла α. Введение препарата Коагил-VII привело к коррекции указанных нарушений, данных, свидетельствующих о наличии протромботических изменений, не выявлено.
Поражение слизистой оболочки мочевого пузыря и развитие геморрагического цистита являются одним из тяжелых осложнений химиотерапии онкогематологических заболеваний [28], морфологически характеризуются наличием участков десквамации слизистой оболочки с кровоизлияниями. Значимость геморрагического цистита определяется не только угрожающим жизни кровотечением, но и возможным развитием блока мочевыводящих путей в результате тампонады мочевого пузыря, что ведет к необходимости выполнения хирургического вмешательства. Применяя гемостатические препараты, необходимо учитывать склонность к гиперкоагуляции при гемобластозе на фоне химиотерапии. В представленном наблюдении клиническая ситуация развивалась драматически. Продолжающееся кровотечение привело к блоку мочевыводящих путей, что потребовало наряду с выполнением хирургического вмешательства действий, способных быстро дать стойкий гемостатический эффект. Наличие у пациента тяжелой сопутствующей патологии сердечно-сосудистой системы ограничивало объем инфузионной терапии, а локализация кровотечения не позволяла системно использовать ингибиторы фибринолиза. В подобных случаях, на наш взгляд, целесообразно применять препараты rFVIIa. Нам удалось добиться положительного результата после единственного введения препарата. Осложнений тромботического характера, несмотря на сопутствующую патологию сердечно-сосудистой системы и преклонный возраст пациента, не зафиксировано. Использование ТЭГ для контроля эффекта rFVIIa может в значительной степени снизить риск возникновения тромботических осложнений. ТЭГ позволяет в режиме реального времени оценить состояние гемостаза в целом, что дает возможность при необходимости своевременно принять меры, направленные на коррекцию нарушений системы свертывания крови.
Таким образом, описанный клинический случай показывает, что использование rFVIIa позволяет осуществить гемостаз у пациентов, которым противопоказано введение традиционно используемых гемостатических средств в связи с особенностью клинической ситуации или наличием сопутствующей патологии.
Литература
- Воробьев А.И., ред. Руководство по гематологии. т. 2. М.: Ньюдиамед; 2002.
- Волкова М.А., ред. Клиническая онкогематология. M.: Медицина; 2007.
- Румянцев А.Г. Острая кровопотеря. В кн.: Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях: Руководство для врачей. А.Г. Румянцев, A.A. Масчан, Е.В. Самочатова. М.: Медпрактика; 2009: 196–200.
- Плющ О.П., Копылов К.Г., Городецкий В.М., Шулутко Е.М., Якунина Л.Н., Вдовин В.В. и др. Новая технология остановки и профилактики кровотечений в клинической практике. Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2003; 2(2): 83–7.
- Ranucci M., Isgrò G., Soro G., Conti D., De Toffol B. Efficacy and safety of
recombinant activated factor vii in major surgical procedures: systematic
review and meta-analysis of randomized clinical trials. Arch Surg 2008; 143(3): 296–304. - von Heymann C., Jonas S., Spies C., Wernecke K.D., Ziemer S., Janssen D., et al. Recombinant activated factor VIIa for the treatment of bleeding in major abdominal surgery including vascular and urological surgery: a review and metaanalysis of published data. Crit Care 2008; 12(1): R14.
- Gill R., Herbertson M., Vuylsteke A., Olsen P.S., von Heymann C., Mythen M., et al. Safety and efficacy of recombinant activated factor VII: a randomized placebocontrolled trial in the setting of bleeding after cardiac surgery. Circulation 2009; 120(1): 21–7.
- Папаян Л.П. Особенности механизмов гемостаза при использовании рекомбинантного фактора VII у больных гемофилией. В кн.: Материалы I Всероссийского съезда гематологов, Москва, 16–18 апреля 2002 г. Проблемы гематологии и переливания крови 2002; 1: 67.
- Румянцев А.Г., Бабкова НВ., Чернов В.М. Применение рекомбинантного активированного фактора коагуляции VII в клинической практике обзор литера туры). Гематология и трансфузиология 2002; 47(5): 36–41.
- Плющ О.П., Андреев Ю.Н., Городецкий В.М. и др. Рекомбинантный активированный фактор VII в клинической практике: Пособие для врачейгематологов.
Проблемы гематологии и переливания крови 2004; 1: 5–10. Duchesne J.C., Mathew K.A., Marr A.B., Pinsky M.R., Barbeau J.M., McSwain N.E.
Current evidence based guidelines for factor VIIa use in trauma: the good, the bad, and the ugly. Am Surg 2008; 74(12): 1159–65. - Полянская Т.Ю., Зоренко В.Ю., Карпов Е.Е. Применение рекомбинантного активированного фактора VII при хирургических вмешательствах у больных с ингибиторной формой гемофилии. Гематология и трансфузиология 2008; 53(3): 3–5.
- Зоренко В.Ю., Полянская Т.Ю., Галстян Г.М., Сампиев М.С., Северова Т.В., Коняшина Н.И. и др. Опыт применения препарата Коагил VII при ортопедических операциях у больных с ингибиторной гемофилией А. Вопросы гематологии/онкологии и иммунопатологии в педиатрии 2011; 10(3): 35–40.
- O'Connell K.A., Wood J.J., Wise R.P., Lozier J.N., Braun M.M. Thromboembolic adverse events after use of recombinant human coagulation factor VIIa. JAMA 2006; 295(3): 293–8.
- Stanworth S.J., Birchall J., Doree C.J., Hyde C. Recombinant factor VIIa for the prevention and treatment of bleeding in patients without haemophilia. Cochrane Database Syst Rev 2007. (2):CD005011.
- Johansson P.I. Off-label use of recombinant factor VIIa for treatment of haemorrhage: results from randomized clinical trials. Vox Sang 2008; 95(1): 1–7.
- Zangrillo A., Mizzi A., Biondi-Zoccai G., Bignami E., Calabrò M.G., Pappalardo F., et al. Recombinant activated factor VII in cardiac surgery: a meta-analysis. J Cardiothorac Vasc Anesth 2009; 23(1): 34–40.
- Levi M., Levy J.H., Andersen H.F., Truloff D. Safety of recombinant activated factor VII in randomized clinical trials. N Engl J Med 2010; 363(19): 1791–800.
- Logan A.C., Yank V., Stafford R.S. Off-label use of recombinant factor VIIa in U.S. hospitals: analysis of hospital records. Ann Intern Med 2011; 154(8): 516–22.
- Hacquard M., Durand M., Lecompte T., Boini S., Briançon S., Carteaux J.P. Off-label use of recombinant activated factor VII in intractable haemorrhage after cardiovascular surgery: an observational study of practices in 23 French cardiac centres (2005-7). Eur J Cardiothorac Surg 2011; 40(6): 1320–7.
- Dutton R.P., Parr M., Tortella B.J., Champion H.R., Bernard G.R., Boffard K., et al. Recombinant activated factor VII safety in trauma patients: results from the CONTROL trial. J Trauma 2011; 71(1): 12–9.
- Chapman A.J., Blount A.L., Davis A.T., Hooker R.L. Recombinant factor VIIa (NovoSeven RT) use in high risk cardiac surgery. Eur J Cardiothorac Surg 2011; 40(6): 1314–8.
- Kalina M., Tinkoff G., Fulda G. Massive postpartum hemorrhage: recombinant factor VIIa use is safe but not effective. Del Med J 2011; 83(4): 109–13.
- Nagle E.L., Tsu L.V., Dager W.E. Bivalirudin for anticoagulation during hypothermic cardiopulmonary bypass and recombinant factor VIIa for iatrogenic coagulopathy. Ann Pharmacother 2011; 45(9): e47.
- Luporsi P., Chopard R., Janin S., Racadot E., Bernard Y., Ecarnot F., et al. Use of recombinant factor VIIa (NovoSeven®) in 8 patients with ongoing life-threatening bleeding treated with fondaparinux. Acute Card Care 2011; 13(2): 93–8.
- Баркаган 3.С. Нарушения гемостаза при онкогематологических заболеваниях. М.: Медицина; 2006.
- Лазарев А.Ф., Воробьев П.А., Ходоренко С.А., Баркаган З.С., Котовщикова Е.Ф., Буевич Е.И. Профилактика тромбозов у онкобольных: фармакоэкономический анализ. В кн.: Материалы съезда онкологов и радиологов СНГ. Ташкент, 14–16 мая 2008 г.: 375–6.
- Manikandan R., Kumar S., Dorairajan L.N. Hemorrhagic cystitis: A challenge to the urologist. Indian J Urol 2010; 26(2): 159–66.

