Гепарин-индуцированная тромбоцитопения и анестезиолог
Theodore E. Warkentin
Статья опубликована в журнале Can J Anesth 2002; 49: 6, p.p. S36-S49
Цель: Все врачи, применяющие гепарин, должны быть информированы об иммунной гепарин-индуцированной тромбоцитопении (ГИТ), включая анестезиологов, от которых может потребоваться обеспечение интраоперационной антикоагуляции у пациента, которому срочно требуется операция на сердце или сосудах при наличие острой ГИТ или ГИТ в анамнезе.
Источник: Проведен обзор литературы, касающийся ГИТ значимой для анестезиологов, включая обследования на антитела ГИТ после интраоперационного применения гепарина; острую остановку дыхания или остановку сердца после внутривенного болюсного введения гепарина, отражающую быстрое начало ГИТ; острую тромбоцитопению и тромбоз как осложнения интраоперационного применения гепарина; условия, при которых может быть допустимо назначение гепарина, несмотря на предшествующий анамнез иммунной ГИТ; а также альтернативные антикоагулянтные подходы, которые могут использоваться для ведения операций на сердце и сосудах у пациентов с острыми или перенесенными ГИТ.
Основные данные : Интраоперационное применение гепарина может запускать образование антител ГИТ и иногда даже приводить к ГИТ с «поздним началом». Острая остановка дыхания или сердца после болюсного введения гепарина или острый внезапный эпизод интраоперационного образования «белых сгустков» предполагает диагноз ГИТ с быстрым началом, особенно если пациент в настоящее время получает гепарин. Есть несколько подходов к ведению пациентов при операциях на сердце или на сосудах с острой или перенесенной ГИТ, так что выбор лечения зависит от местного опыта и возможностей мониторинга. Через несколько месяцев после острой ГИТ и особенно если антитела ГИТ больше не определяются возможно применение гепарина для интраоперационной антикоагуляции.
Вывод: ГИТ является нечастой, но важной проблемой для анестезиологов из-за срочности и сложности ведения.
Гепарин - индуцированная тромбоцитопения (ГИТ) это частая и специфическая неблагоприятная реакция на препараты . Парадоксально, но несмотря на снижение числа тромбоцитов и применение гепарина, у пациент ов с этим синдромом повыша е т ся риск тромбоза [1] . Иногда, пациент у с ГИТ требует ся срочн ая операция на серд ц е или на сосуд ах , но не льзя применить гепарин: например, эмболэктомия тромбоцитарных «белых сгустков», вызывающая острую окклюзию артерий конечностей . В этой ситуации анестезиолог может столкнуться с важной проблемой применения альтернативного антикоагулянтного подхода . В таблице 1 представлены несколько проблем ГИТ, значимых для анестезиолога, которые будут обсуждены в этом обзоре.
Таблица 1. Гепарининдуцированная тромбоцитопения (ГИТ) и анестезиолог:
темы, обсуждаемые в обзоре.
Интраоперационное применение гепарина и последующая ГИТАнтитела ГИТ после операции на сердце или на сосудахЦентральные венозные катетеры и тромбоз глубоких вен верхних конечностей Острая остановка дыхания и сердца после внутривенного болюсного введения гепарина Предотвращение случайного применения гепарина Острый интраоперационный «синдром белых сгустков» Операция на сердце или на сосудах у пациентов с предшествующей ГИТ Повторное применение гепаринаОперация на сердце у пациентов с острой или перенесенной ГИТ Гепарин плюс антитромбоцитарные препаратыАльтернативная антикоагуляция при операции на сердцеАналоги простациклина (илопрост, эпопростенол) ЛепирудинСосудистая операция у пациентов с острой или перенесенной ГИТ |
Что такое ГИТ?
Патогенез
ГИТ это иммунное опосредованное нарушение, при котором применение гепарина приводит к формированию гепарин-зависимых антител, распознающих «собственный» протеин, фактор тромбоцитов 4 (PF4) [2], обычно обнаруживаемый в тромбоцитарных гранулах. Когда полимолекулярные комплексы гепарина, PF4 и антитела класса IgG формируются на поверхности тромбоцитов, Fc «хвосты» антител ГИТ взаимодействуют с рецепторам Fc тромбоцитов (Fc?IIa), что приводит к активации тромбоцитов [3, 4]. Цепь гепарина, которая состоит из 12 сахаридных единиц или большей длины, плотн о связывается с PF4, возможно, это объясняет, почему нефракционированный гепарин (НФГ) с гораздо большей вероятностью вызывает ГИТ, чем низко-молекулярный гепарин (НМГ) [1]. За исключением активации тромбоцитов, антитела ГИТ вызывают гиперкоагулцию, что показано in vivo повышенным уровнем молекулярных маркеров продуктов тромбина [5]. Также, уменьшение фибриногена, указывающее на декомпенсацию диссеминированного внутрисосудистого свёртывания (ДВС), происходит у 5-10% пациентов [6]. Активация коагуляции происходит в результате прокоагулянтных изменений мембраны тромбоцитов [7]. Более того, исследования in vitro показывают, что антитела ГИТ вызывают повреждение и выработку тканевого фактора эндотелиальными клетками [8] и моноцитами [9]. Если эти механизмы запускаются, протромботический риск сохраняется от нескольких дней до недель, даже после прекращения применения гепарина [10, 11].
Клинический профиль
Типичные клинические проявления ГИТ – это падение числа тромбоцитов, которое начинается от пяти до десяти дней после начала курса гепарина [12]. Однако, «быстрое начало» ГИТ может происходить у пациента, который недавно получал гепарин. В этой ситуации, пациент уже имеет циркулирующие антитела ГИТ, которые возникают в результате недавнего курса гепарина. Таким образом, до повторного применения гепарина, происходит резкое снижение числа тромбоцитов. Однако оказалось, что риск быстрого начала ГИТ ограничен примерно первыми 100 днями после лечения любыми гепаринами. Это потому, что антитела ГИТ - временные и обычно не определяются через несколько недель [12]. Кроме того, антитела ГИТ необязательно повторно вырабатываются при последующем применении гепарина [12, 13].
ГИТ обычно вызывает только незначительную - умеренную тромбоцитопению: среднее снижение числа тромбоцитов составляет 60x109/л [6]. Примерно у 80% пациентов наименьшее число тромбоцитов находится в пределах 20 и 150x109/л, примерно у 10% пациентов число тромбоцитов составляет менее 20 или более 150x109/л.
Новый ГИТ-ассоциированный тромбоз происходит у основой массы пациентов с серологически-подтвержденной ГИТ [6, 10]. Риск тромбоза варьирует от 30 до 50% у пациентов с незначительной тромбоцитопенией, до более чем 90% у пациентов с тяжелой тромбоцитопенией и ДВС. Венозные тромбозы преобладают над артериальными (соотношение 4:1), с глубоким венозным тромбозом (ГВТ) и эмболией легких как наиболее частыми последствиями [6, 10]. Артериальные тромбозы, вовлекающие большие артерии ног, также относительно частые. Другие осложнения включают тромботический инсульт, острый инфаркт миокарда, тромбоз мезентериальных сосудов, тромбоз позвоночной артерии и так далее. Необычным, но важным последствием ГИТ является геморрагический некроз надпочечников, который может быть двусторонним, и приводит к острой или хронической надпочечниковой недостаточнсоти [6, 14]. Таким образом, необъяснимая гипотония особенно при боли в животе должна натолкнуть на терапию кортикостероидами у пациентов с клиническим подозрением на ГИТ.
«Изолированная» ГИТ диагностируется у пациентов, диагноз у которых установлен только на основе падение числа тромбоцитов, без новых тромбозов, происхождение которых связано с ГИТ [10, 11, 15]. До настоящего времени, считалось, что отмена применения гепарина может предотвращать ГИТ-ассоциированные тромбозы. Однако, растущие данные показывают, что отмена гепарина часто не несет успеха при предотвращении тромбоза у пациентов с изолированной ГИТ [10, 11, 16]. Таким образом, растет мнение, что гепарин должен быть заменен на альтернативную антикоагуляцию при ведении изолированной ГИТ [17, 18].
Частота
Частота ГИТ не может выражаться как простое значение . Это связано с тем, что частота заметно варьирует, главным образом в зависимости от использованного гепарина (НФГ легких быка > свиной НФГ слизистой кишечника > НМГ), характера популяции пациентов (хирургическая > терапевтическая ) и длительности применения гепарина [1, 15, 19]. Учитывая две крайности: подкожное профилактическое введение НФГ в течение 2 недель до послеоперационного введения у ортопедических пациентов, частота ГИТ составляет от 3 до 5% [1, 19]. И наоборот, ГИТ является редким осложнением у беременных, получающих НМГ для профилактики тромбозов или терапии [20]. Между этими крайностями, средний риск ГИТ (примерно 1-2%) наблюдается у пациентов после операции на сердце, получающих терапию НФГ [15] и менее 1% у кардиологических больных [21]. В среднем, ГИТ происходит в 8-10 раз реже, если применяются НМГ, а не НФГ [1, 15]. Таким образом, НМГ должны вводиться в ситуациях, где есть, по крайней мере, равная безопасность и эффективность НФГ, так как многие эпизоды ГИТ будут предотвращаться [22].
Лабораторное исследование
Иммуно-ферментный анализ - метод выявления антител ГИТ против PF 4-зависимого антигена – все чаще используется для подтверждения или исключения диагноза ГИТ. В «промышленном масштабе» на сегодняшний день есть два вида исследования [23, 24]: тест, представленный на рынок Diagnostica Stago (Франция) для определения антител против комплексов PF 4/гепарин, и тест от GTI (Брукфильд, штат Висконсин, США) использует PF 4 связанные с поливинилсульфонатом. Оба исследования определяют антитела IgG , IgM и IgA ; однако, это не может быть преимуществом, так как антитела ГИТ класса IgG объясняет большинство случаев [1, 19, 25]. Это помогает объяснить бoльшую специфичность методов определения точной активации тромбоцитов при клинически значимых антителах ГИТ. Например, исследование высвобождения серотонина тромбоцитами, оценивающее гепарин-зависимую активацию тромбоцитов, вызванную сывороткой пациента, будет лишь определять антитела ГИТ- IgG , найденные в соответствующем титре и с достаточной авидностью для комплексов PF 4/гепарин, чтобы вызвать активацию тромбоцитов in vitro . Эти свойства активированных in vitro тромбоцитов коррелируют более четко с риском ГИТ, чем антитела определяемые только методом иммуно-ферментного анализа [19]. Таким образом, отрицательные методы активации могут исключать ГИТ, даже если исследование антигена положительное [19, 23]. К сожалению, исследование активации тромбоцитов технически трудное и обычно выполняется лишь некоторыми лабораториями.
Интраоперационное применение гепарина и последующая ГИТ
Многие эпизоды ГИТ могут вызываться подкожной профилактикой гепарином, использованным для предотвращения тромбозов после ортопедических или обще-хирургических операций. Однако есть два типа операций, при которых интраоперационное действие НФГ обеспечивает большие иммуногенные стимулы.
Антитела ГИТ после операции на сердце и на сосудах
Операции на сердце и на сосудах – это две ситуации, при которых относительно высокие дозы НФГ применяются во время операции, обычно 300-400 Ед/кг при операции в условиях искусственного кровообращения (ИК) или 100-150 Ед/кг (операция на сердце, выполненная «без насоса», или операция на периферических сосудах). Хотя большинство больных, получающих во время операции на сердце или на сосудах НФГ, также получают дополнительно гепарин после операции, есть доказательства, что большинство случаев сероконверсии вызываются интраоперационным действием. Например, высокая частота сероконверсии (39-43% при иммуно-ферментном анализе) была получена в двух исследованиях, где гепарин не вводился после операции [26, 27]. Другое исследование нашло [28], что незначительно большее образование антител ГИТ, если НФГ, а не НМГ, был использован после операции (29 против 22%; P = 0,12), но в этих нерандомизированных исследованиях больные, которых рассматривали как пациентов высокого риска по развитию тромбозу, получали НФГ.
Даже если после операции на сердце НФГ применяется у пациентов, у которых выработались антитела ГИТ, тромбоцитопения обычно не развивается. В исследовании 100 пациентов [19], которые рутинно получали профилактику НФГ после операции на сердце, у 50 пациентов (50%) вырабатывались ГИТ- IgG , 20 из них также имели положительные результаты исследования на активацию тромбоцитов. Однако только у одного больного с положительными результатами обоих тестов развилась клиническая ГИТ. Таким образом, положительное прогностическое значение по развитию ГИТ при положительных результатах иммуно-ферментного анализа составляет лишь 2%!
Возможно, что высокие дозы НФГ, введенные во время операции на сердце или на сосудах, наряду с большим количеством PF 4, высвобождаемым из активированных тромбоцитов (особенно, если кровь контактирует с искусственными поверхностями во время ИК), вырабатывают большие количества иммуногенных комплексов PF 4/гепарин. Несмотря на эту высокую частоту иммунизации, остается загадкой, почему ГИТ относительно редко встречается у больных после операции на сердце, чем после ортопедической операции, где более чем у одной-трети больных со сформированными антителами ГИТ развивается тромбоцитопения [19].
«Животный источник» НФГ влияет на риск ГИТ. Мета-анализ [15] четырех рандомизированных клинических исследований [28-31], сравнивающих два различных источника НФГ (легкие быка против кишки свиньи) сделали вывод, что ГИТ происходит чаще при применении гепарин из легких быка (9/152 [5,9%] против 0/154 [0%]; P = 0,0059 согласно тесту Mantel - Haenszel ) [15]. Хотя применение бычьего гепарина снижается, некоторые кардиологические хирургические центры продолжают использовать этот гепарин, возможно, так как послеоперационное кровотечение может быть меньше [32, 33].
Konkle с коллегами [34] сравнили частоту образования антител ГИТ (дополнительный маркер, показывающий риск клинической ГИТ) при применении гепарина быка и свиньи в целях антикоагуляции при операции на сердце. Эти авторы не нашли значимых различий в частоте сероконверсии . Однако это было небольшое исследование (98 пациентов) и пациенты были исследованы только до пятого дня после операции (что слишком рано для определения случаев сероконверсии).
И наоборот, Francis с соавторами [35] в бoльшем исследовании (207 пациентов) наблюдали более высокую частоту образования антител у пациентов, которые получали бычий гепарин при сравнении со свиным гепарином во время ИК (45 против 34%: P < 0,05). Таким образом, животный гепарин, используемый во время ИК, может влиять на образование антител ГИТ, и, таким образом, на риск ГИТ после операции на сердце.
Позднее начало ГИТ после операции на сердце и на сосудах
Даже полностью избегая гепарин после операции на сердце, невозможно удалить риск развития ГИТ. Рисунок 1 показывает пациента, у которого развилась необъяснимая тромбоцитопения после выписки из стационара, где он находился в связи с операцией на сердце. ГИТ не была диагностирована до 38-го дня после операции, когда развился симптомный ГВТ, и быстрое снижение числа тромбоцитов произошло до повторного применения гепарина. Этот синдром «позднего начала ГИТ» описывает начало тромбоцитопении и тромбоза, начавшихся через несколько дней после отмены терапии гепарином [6, 36, 37]. Высокий титр антител IgG , который может активировать тромбоциты даже при отсутствии гепарина, был выявлен у этих больных [36].
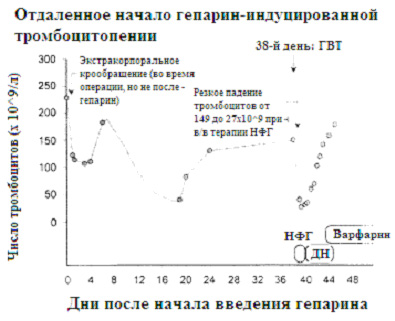 |
| Рисунок 1. Позднее начало гепарин-индуцированной тромбоцитопении (ГИТ) после операции на сердце. Несмотря на отсутствие введения гепарина после искусственного кровообращения (ИК), у пациента развилась необъяснимая тромбоцитопения на 19-й день после операции. ГИТ была диагностирована на 38-й день после операции, когда быстрое снижение числа тромбоцитов произошло при введении нефракционированного гепарина (НФГ) для лечения тромбоза глубоких вен (ГВТ), что ретроспективно было осложнением позднего начала ГИТ. (Напечатано с разрешения автора, ссылка 6). |
Анекдотический случай показывает, что небольшое количество НФГ, использованное во время операции для «промывания» сосудистого катетера иногда запускает образование клинически-значимых уровней антител ГИТ. Ling и я [38] сообщили о двух пациентах, которые получили гепарин «случайно» при использовании интраартериального катетера (оцененная доза НФГ 50 Ед). Хотя эти катетеры были удалены после операции и ни один из пациентов не получал антитромботическую профилактику гепарином после операции, применение терапевтических доз НФГ при ГВТ примерно через две недели после операции привело к быстрому развитию ГИТ. Наличие серии образцов крови от одного пациента доказало, что антитела ГИТ впервые стали определяться через 6 дней после операции.
Рандомизированное клиническое исследование [39], которое сравнивало промывание внутрисосудистых катетеров НФГ и солевым раствором нашло, что работа инфузионной системы была идентичной независимо от вида применяемого для промывания раствора. Это предполагает, что анестезиологи должны вводить солевые растворы для промывания, чтобы избежать сенсибилизации гепарином без необходимости. Однако, для больных, которые получают профилактику гепарином после операции, суммарный эффект малой дозы НФГ, введенной интраоперационно, неясен. По крайней мере, теоретически возможно, что промывание НФГ может очищать PF 4, высвобождаемые после операции, и таким образом снижать вероятность последующего образования антител ГИТ, когда бoльшие количества гепарина вводятся после операции.
Центральные венозные катетеры (ЦВК) и ГИТ-ассоциированный ГВТ верхних конечностей
Анестезиологи часто вводят ЦВК перед большими операциями. Текущее или одновременное применение ЦВК было основным фактором при объяснении ГВТ верхних конечностей, осложняющихся ГИТ [40]. Вероятно, локализованное сосудистое повреждение (применение ЦВК) и системное нарушение гиперкоагуляции (ГИТ) взаимодействуют при развития ГВТ верхних конечностей [40].
Респираторная или сердечная остановка после внутривенного болюсного введения гепарина
Во многих стационарах, анестезиологи участвуют в «команде помощи при остановке сердца». Анестезиолог может реанимировать пациента с острой остановкой дыхания или сердца после болюсного введения гепарина (рисунок 2) [41]. Быстрое начало ГИТ следует заподозрить у пациента, которому перед «остановкой» вводился внутривенно болюсно гепарин за 5 или 30 минут до этого эпизода [6]. В отличие от препарат-индуцированной анафилаксии, обычно есть время задержки от нескольких минут между назначением гепарина и признаками - симптомами, показывающими острую системную реакцию после болюса гепарина (таблица 2) [6]. Иногда, тяжелый респираторный дистресс неверно интерпретируется как острая эмболия легких («псевдо-легочная эмболия») и гепарин вводится снова [6, 42].
 |
| Рисунок 2. Быстрое начало гепарин-индуцированной тромбоцитопении (ГИТ) осложнилось остановкой дыхания . 67-летняя женщина получала гепарин во время операции по замене аортального клапана с последующим послеоперационным подкожным введением нефракционированного гепарина (отменен на 4-й день). Как ожидали, число тромбоцитов восстановилось после операции на сердце. На 28-й день после операции пациентка поступила для лечения «инфекции раны груди». На 32-й день периферически-введенный центральный катетер (« PICC система») был случайно «промыт» 30000-50000 Ед гепарина (планировалось 30-50 Ед). Через несколько минут после этого, у пациентки развилась остановка дыхания и генерализованное кровотечение. Число тромбоцитов резко упало от 270 до 32 x 109/л (падение на 88%). Лабораторные тесты показали сильные гепарин-зависимые тромбоцит-активирующие антитела в образце сыворотки, полученные за два дня до случайной передозировки гепарином; эти антитела, вероятно, выработались после операции на сердце. Антитела ГИТ не определялись через 100 дней после эпизода быстро развившейся ГИТ. Пациентка полностью восстановилась. (Напечатано с разрешения автора, ссылка 41). |
Таблица 2. Клинические признаки острых системных реакций
после введения внутривенного болюса гепарина.
|
|||||||||
| Напечатано с изменениями с разрешения автора, ссылка 6. |
Предотвращение непреднамеренного воздействия гепарином
Если заподозрена ГИТ, необходимо прекратить применение всех видов гепарина и в дальнейшем предотвратить случайное введение гепарина. Это не так легко, как может показаться на первый взгляд: есть многочисленные пути для случайного введения гепарина. Например, многие катетеры легочной артерии покрыты гепарином, как и различные медицинские устройства (например, артериальные фильтры с гепарином, используемые в аппаратах ИК). Протоколы стационаров могут включать рутинное промывание гепарином внутрисосудистых катетеров (интраартериальные и центральные венозные системы, устройства для центрального венозного доступа, используемые для химиотерапии при онкопатологии [43], периферические «гепариновые заглушки») или при ангиографических процедурах. Врачи могут рутинно промывать ЦВК гепаринизированным солевым раствором во время процедур введения. Определенные концентраты протромбиновых комплексов (например, Prothromplex - T TIM 4 TM ) иногда используется для реверсии выраженной коагулопатии, он также содержит небольшое количество гепарина. Влияние многих из этих препаратов даже может не регистрироваться в медицинской карте.
Острый интраоперационный «синдром белых сгустков»
Интраоперационное образование интраартериальных, богатых тромбоцитами «белых сгустков» во время операции, требующей НФГ (сосудистая или сердечная операция), может показывать острую ГИТ [44]. Обычно пораженные пациенты подвергаются срочной сосудистой операции по поводу острой артериальной тромбоэмболии, что действительно означает ГИТ, но которая не была выявлена во время или после тромбоэмболэктомии [44]. Возможно, интраоперационного или раннего послеоперационного (ре-)тромбоза можно избежать, если ГИТ диагностируется перед операцией и альтернативные антикоагулянты вводятся для интраоперационной антикоагуляции.
В редких случаях, у пациента может развиваться необъяснимый интраоперационный «синдром белух сгустков» без каких-либо предоперационных опасений по поводу возможной имеющейся ГИТ. Это может происходить, когда текущее воздействие гепарином приводит к формированию высоких уровней антител ГИТ (рисунок 3). Нет руководств по обеспечению этих необычных ситуаций, но логичный подход - это замена гепарина интраоперационно на другой парентеральный антикоагулянт. Например, у пациента с нормальной функцией почек может быть введен болюсно лепирудин (0,4 мг/кг) вместе с протаминсульфатом для нейтрализации гепарина (1 мг протамина на каждые 100 Ед НФГ). Лабораторное подтверждение этого необычного диагноза - острого интраоперационного ГИТ-ассоциированного тромбоза - должно проводиться путем тестирования предоперационного образца крови на антитела ГИТ (хотя не было данных для принятия решения по ведению во время операции). Заметное интраоперационное снижение числа тромбоцитов подтверждает диагноз острой ГИТ, хотя специфичность интраоперационной тромбоцитопении при выявлении острой ГИТ неизвестна. Теоретически, внезапное появление «острых сгустков» может иметь объяснение не только в пользу острой ГИТ [45].
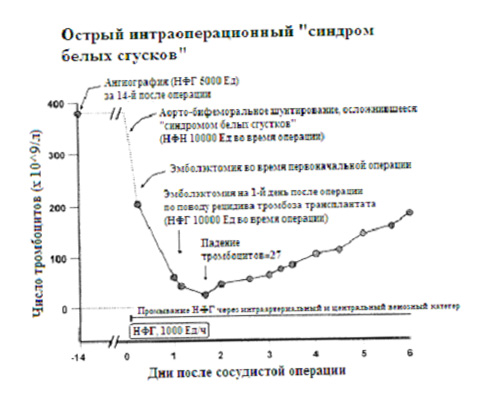 |
| Рисунок 3. Острый интраоперационный и послеоперационный «синдром белых сгустков». Внезапно «белые сгустки» богатые тромбоцитами сформировались во время плановой операции аорто-бифеморального шунтирования, выполненного с применением нефракционированного гепарина (НФГ; 10 000 Ед), что потребовало интраоперационного удаления эмбола. После операции был введен НФГ (1000 Ед/час) . Однако повторная эмболэктомия вновь потребовалась на следующей день в связи с рецидивирующим тромбозом трансплантата. Терапевтическая доза НФГ была отменена на 2-й день после операции, когда число тромбоцитов упало до 27x109/л. Однако НФГ не был удален из раствора для промывания, используемого для поддержания артериального и центрального венозных катетеров . Это могло способствовать фатальным осложнениям на 9-й день после операции (рецидивирующий тромбоз трансплантата и шок, с признаками двустороннего геморрагического некроза надпочечников, найденными после смерти). Быстрое начало ГИТ с острым интраоперационным тромбозом могло быть объяснено текущим предоперационным влиянием НФГ (5000 Ед), который был введен за 14 дней во время ангиографии аорты. |
Операция на сердце и на сосудах у пациентов с предшествующей ГИТ
Важная проблема - это интраоперационное и периоперационное проведение антикоагуляции у пациентов, которым требуется операция на сердце и на сосудах, но у которых в анамнезе была иммунная ГИТ. Повторное применение гепарина может рассматриваться у этих пациентов при определенных условиях.
Повторное воздействие гепарином
Повторное применение НФГ - это предпочтительный подход у пациентов с предшествующей ГИТ, которым требуется операция на сердце и на сосудах при условии, что антитела ГИТ больше не определяются одним или более чувствительными методами [12, 13, 46-48]. В настоящее время есть разумное биологическое объяснение этого подхода [12]. Антитела ГИТ - транзиторные и обычно больше не определяются в течение нескольких недель или месяцев после эпизода ГИТ. Кроме того, антитела ГИТ обычно не стимулируются снова, несмотря на повторное воздействие гепарином. В дальнейшем, в случае, если антитела ГИТ стимулируются повторно, нет быстрого проявления, а скорее всего при обычном временном отношении к воздействию гепарином (минимум, 5-дневный интервал).
Возможно, что риск повторной стимуляции антител ГИТ не выше чем у иммунологически «отрицательных» пациентов, которые никогда не получали гепарин ранее. Однако, если планируется намеренно повторное воздействие НФГ у пациента с предшествующей ГИТ, благоразумно любым способом избегать гепарин до операции (например, катетеризация сердца) или после операции и ограничить воздействие НФГ при самой операции. Альтернативно, для послоперационной антикоагуляции возможно следует использовать не-гепариновые антикоагулянты.
Операция на сердце у пациентов с острой или текущей ГИТ
Очень трудная проблема, с которой анестезиологи иногда могут столкнуться - это проблема интраоперационной антикоагуляции при операции на сердце у пациентов с острой ГИТ или с перенесенной ГИТ, при которой тромбоцит-активирующие антитела ГИТ все еще определяются («латентная ГИТ»). Эта ситуация может возникать внезапно и непредвиденно, особенно если жизнеугрожающие внутрисердечные или внутрикоронарные тромбоз(ы) происходят в результате острой ГИТ. К сожалению, нет идеальных альтернативных антикоагулянтов, так как в отличие от НФГ, такие препараты как данапароид, лепирудин и аргатробан нельзя нейтрализовать. Кроме того, нет единодушного мнения по оптимальному уровню антикоагуляции или по тому как лучше проводить контроль антикоагуляции во время операции с применением этих препаратов. Возможны два широких подхода: ( i ) намеренное повторное воздействие гепарином с сопутствующей антитромбоцитарной терапией, и ( ii ) применение альтернативного, негепаринового антикоагулянта.
Гепарин плюс антитромбоцитарная терапия
Многие авторы уже сообщали об использовании антикоагуляции гепарином в полной дозе при использовании ИК, обычно в сочетании с антитромбоцитарной терапией, такими препаратами как илопрост, эпопростенол, тирофибан или абциксимаб. Трудность интерпретации этой литературы заключается в том, что иногда непонятно, какая пропорция пациентов действительно имеет острую или перенесенную ГИТ, так как некоторые пациенты могут безопасно получать повторный курс гепарина (даже без антитромбоцитарной терапии), поскольку антитела ГИТ исчезают или значительно уменьшаются.
Гепарин плюс аналоги простациклина ( илопрост или эпопростенол )
Илопрост (стойкий аналог простациклина) и эпопростенол натрия ( Flolan , препарат простациклина) противодействует функции тромбоцитов путем стимуляции аденилат циклазы, увеличивая уровни циклического аденозин-монофосфата (ЦАМФ) тромбоцитов. Это предупреждает активацию тромбоцитов с помощью ГИТ- IgG и других агонистов тромбоцитов. Илопрост использовался в нескольких исследованиях в 1980-х годах для ведения острой ГИТ [49, 51].
Так как илопрост действует сразу же, лечение может быть начато за короткий период времени перед применением гепарина. Однако, инфузия илопроста обычно начинается за 0,5-1 час перед гепаринизацией, что позволяет лабораторным исследованиям показать, что тромбоциты пациентов не могли поддаваться агрегации гепарином ex vivo . Дозы в пределах 10-30 нг/кг/мин требовались для полного подавления гепарин-индуцированной агрегации тромбоцитов. Илопрост продолжали в течение 15 минут после применения протамина.
Заметная вазодилатация, дающая тяжелую гипотонию - это значительный недостаток илопроста. Хотя гипотония обычно купируется с помощью вазопрессоров [50], Kraenzler и соавторы [51] сообщили о тяжелой гипотонии устойчивой к большим дозам фенилэфрина. Из-за его короткого периода полувыведения (15-30 минут), реактивность тромбоцитов восстанавливается за три часа после прекращения применения препарата. Послеоперационное кровотечение обычно не является основной проблемой .
Более современный эпопростенол натрия ( Flolan , G 1 axoSmithKline , Канада) (период полувыведения от 3 до 6 минут) использовался для успешного ведения операции на сердце у 6 последовательных пациентов с острой ГИТ [52]. Относительно простой протокол был использован без мониторинга агрегации тромбоцитов: после индукции анестезии при внутривенном введении было использовано скачкообразное повышение доз эпопростенола: первоначальная скорость 5 нг/кг/мин, с последующим повышением по возрастанию 5 нг/кг/мин каждые 5 минут, пока не была достигнута целевая доза 30 нг/кг/мин. По мере необходимости норадреналин (0,05-0,1 мкг/кг/мин) вводился для поддержания среднего артериального давления выше 75 мм рт.ст. Когда целевая скорость инфузии достигалась, стандартная доза НФГ (300 Ед/кг) вводилась и применялось ИК, когда активированное время свертывания (АВР) было более 480 сек. После ИК и через 15 минут после замены НФГ на протамин (3 мг/кг), эпопростенол был снижен по этапам (5 нг/кг/мин каждые 5 минут). Послеоперационное кровотечение составило от 250 до 1100 мл, что было значительно меньше, чем эти исследователи наблюдали, когда они ранее использовали данапароид при ведении подобных случаев. Эпопростенол утвержден как в Канаде, так и в США для лечения первичной легочной гипертензии [53].
Гепарин плюс препараты, блокирующие тромбоцитарный гликопротеин IIb / IIIa ( GP )
Агрегация тромбоцитов вызывается фибриноген-связывающими рецепторами тромбоцитов, GPIIb / IIIa . В настоящее время, Koster с соавторами сообщили о применении тирофибана ( Aggrastat , Merck Frosst , Kirkland , Канада), антагониста GPIIb / IIIa , что позволяет повторно воздействовать гепарином у пациентов с перенесенной, текущей или острой ГИТ. Их первоначальный опыт был у пациентов с почечной недостаточностью [54, 55] (предотвращая интраоперационное применение лепирудина), но в более современном исследовании [56] эти авторы сообщили об опыте у 47 больных, большинство которых было с нормальной функцией почек. Период полувыведения тирофибана составляет примерно два часа [57].
За 10 минут до катетеризации по поводу ИК, тирофибан вводился в виде болюса 10 мкг/кг, с последующей длительной инфузией (0,15 мкг/кг/мин) [54, 55]. Впоследствии проводилась стандартная антикоагуляция НФГ в связи с ИК. Инфузия тирофибана прекращалась за 60 минут до окончания ИК. Позднее протамин вводился для реверсии НФГ. Выполнялся контроль функции тромбоцитов ex vivo (оценка АДФ-индуцированной агрегации тромбоцитов) [55], но это не упоминалось в их более позднем исследовании [56]. В среднем применение компонентов крови составило 5 Ед (эритро-масса и плазма).
Абциксимаб ( ReoPro , Eli Lilly , Скарборо, Канада) – это другой антагонист GPII 6/ IIIa широко используемый для подавления тромбоцитов при подкожных коронарных вмешательствах. Хотя период полувыведения из плазмы короткий (30 минут), его по существу необратимое связывание с GPIIb / IIIa дает более длительное подавление тромбоцитов, чем при применении тирофибана. По протоколу предполагается [58, 59] назначение перед индукцией анестезии болюса абциксимаба (0,25 мг/кг) с последующей инфузией (0,01 мг/кг/мин), с обычными дозами НФГ, водимыми при ИК. До реверсии НФГ протамином, инфузию абциксимаба останавливают и проводят трансфузию тромбоцитов при необходимости (если уровни в крови абциксимаба падают, перелитые тромбоциты функциональны). Однако есть немного опыта в отношении этого подхода [58].
Гепарин плюс другая антитромбоцитарная терапия
Предварительное лечение пациентов более традиционными антитромбоцитарными препаратами, таким как аспирин и дипиридамол, с последующим применением НФГ, успешно используется у пациентов с подтвержденным анамнезом ГИТ [60-62]. Однако, этот подход не годится при острой ГИТ, так как эти относительно слабые антагонисты тромбоцитов ненадежно подавляют активацию тромбоцитов путем ГИТ- IgG [63].
Предотвращение « rebound » эффекта гепарина после отмены протамина
Теоретически, « rebound » эффект гепарина после отмены протамина может приводить к ранним послеоперационным тромбозам, если эффекты антитромбоцитарной терапии прошли. Для снижения этой вероятности инфузия протамина (25 мг/час) должна продолжаться по крайней мере в течение 6 часов после операции. Однако, успех любого из этих подходов не установлен.
Альтернативная антикоагуляция при операции на сердце
Описаны два основных подхода: ( i ) данапароид (смесь антикоагулянтных гликозаминогликанов с преобладающей активностью анти- Xa фактора), и ( ii ) лепирудин (рекомбинантный гирудин). Для этих препаратов нет антидотов, и решение использовать каждый из них, как правило требует наличия соответствующей лабораторной поддержки для мониторинга.
Данапароид натрия
Данапароид натрия ( Orgaran , Скарборо, Канада) содержит преимущественно (низко-сульфатированный) сульфат гепарина и дерматан сульфат; с длинным периодом полувыведения - примерно 25 часов для анти- Xa эффекта и около 4 часов для его антитромботической активности [64-66]. Основной недостаток при его использовании при ИК – это повышенная кровопотеря, требующая немало продуктов крови у многих больных [52, 65, 66]. Также, рутинные тесты коагуляции, такие как активированное частичное тромбопластиновое время (АЧТВ) и АВР не могут быть использованы для контроля этих препаратов [67].
Бoльшее исследование [66] сообщило о результатах у 47 больных с ГИТ, получавших данапароид при операции на сердце. Интерпретация данных осложняется неоднородностью использованных протоколов лечения. У двух больных операция была отменена из-за сгустков, наблюдаемых в операционном поле или в контуре ИК. У других 16 пациентов были отмечены интраоперационные «сгустки», которые разрешились при применении повышенных доз данапароида . Тяжелое кровотечение было отмечено у 22% больных, с менее тяжелым кровотечением у других 33% больных. При 6-недельном наблюдении 77% пациентов были живы.
На основе этого опыта, эти авторы рекомендовали следующий протокол: ( i ) болюс данапароида после торакотомии (перед ИК) 125 Ед/кг; ( ii ) 3 Ед/мл внутривенно на исходном растворе; и ( iii ) внутривенная инфузия 7 Ед/кг/час, которая начиналась после применения ИК и продолжалась до 45 минут перед ожиданием прекращения применения ИК [66]. Контроль уровней анти-Xa фактора не требуется при применении этого режима. Однако, другие ученые, которые использовали этот протокол сообщили о сохраняющихся проблемах кровотечения или свертывания в пределах операционного поля [66]. На самом деле, другая группа [69] рекомендовала продолжить данапароид до окончания ИК, чтобы избежать интраоперационного свертывания.
Таблица 3 представляет другой протокол, рекомендованной Potzsch и Маdеner [47] для антикоагуляции во время ИК, использующей данапароид. Предполагается наличие контроля быстро обратимого анти- Xa фактора. Будет ли этот подход предотвращать некоторые проблемы кровотечения с данапароидом неизвестно.
Таблица 3. Протокол антикоагуляции с помощью данапароида натрия*
при искусственном кровообращении (ИК)
Первоначальная доза данапароида (перед ИК) Первоначальный внутривенный болюс данапароида: † 100 Ед/кг массы телаДанапароид, добавленный к основному раствору: 3000 Ед Первоначальная мишень уровень анти-Ха фактора: > 1,5 Ед/мл до начала ИК Дополнительная дозировка данапароида, если уровень анти-Ха фактора плазмы до ИК<1,5 Ед/мл: |
|
| Уровень анти-Ха фактора | Модификация дозы |
| < 1,2 Ед/мл | Контрольные измерения; если подтверждается, ввести дополнительно 1500 Ед болюса |
| 1,2-1,5 Ед/мл | Ввести дополнительно 750 Ед болюса |
Дозы и наблюдение при ИК Скорость инфузии данапароида в начале ИК: 200 Ед/часЧастота мониторинга анти-Ха фактора: каждые 15 минут Интраоперационная регулировка дозы, на основе уровня анти-Ха фактора плазмы: |
|
| Уровень анти-Ха фактора | Модификация дозы |
| >1,8 Ед/мл | Прекратить инфузию до уровня фактора анти-Ха < 1,5 Ед/мл |
| 1,2-1,8 Ед/мл | Скорость инфузии без изменений |
| <1,2 Ед/мл | Повысить скорость инфузии до 300 Ед/час |
| <1,0 Ед/мл | Назначить дополнительный внутривенный болюс 3000 Ед |
| Специальные шаги в конце ИК Прекратить инфузию данапароида за 30 минут перед ожидаемым окончанием ИК. |
|
| * Этот протокол основан на присутствии быстро обратимых уровней анти- Xa плазмы, наблюдаемых во время операции. Другой протокол, который не основан на интраоперационном мониторинге анти- Xa , и который приводит к немного большей дозировке данапароида, описывается в тексте [65]. † Первоначальный болюс данапароида не должен вводиться за 15-20 минут до начала ИК (обычно, это время вскрытия грудины). Напечатано с разрешения, ссылка 47. |
Острый интраоперационный и послеоперационный «синдром белых сгустков». Внезапно «белые сгустки» богатые тромбоцитами сформировались во время плановой операции аорто-бифеморального шунтирования, выполненного с применением нефракционированного гепарина (НФГ; 10 000 Ед), что потребовало интраоперационного удаления эмбола. После операции был введен НФГ (1000 Ед/час) . Однако повторная эмболэктомия вновь потребовалась на следующей день в связи с рецидивирующим тромбозом трансплантата. Терапевтическая доза НФГ была отменена на 2-й день после операции, когда число тромбоцитов упало до 27 x 109/л. Однако НФГ не был удален из раствора для промывания, используемого для поддержания артериального и центрального венозных катетеров . Это могло способствовать фатальным осложнениям на 9-й день после операции (рецидивирующий тромбоз трансплантата и шок, с признаками двустороннего геморрагического некроза надпочечников, найденными после смерти). Быстрое начало ГИТ с острым интраоперационным тромбозом могло быть объяснено текущим предоперационным влиянием НФГ (5000 Ед), который был введен за 14 дней во время ангиографии аорты.
В попытке снизить кровотечения при применении данапароида, мы [70] использовали стратегию шунтирования коронарных артерий «без насоса» у больного с перенесенной ГИТ, которому требовалась срочная коронарная реваскуляризация. Избегание ИК позволяет существенное снижение дозы данапароида: только 3375 Ед данапароида были необходимы во время операции для поддержания целевого интраоперационного уровня анти- Xa между 0,6-0,8 анти- Xa Ед/мл, примерно одна пятая дозы необходимой для ИК. Исход у больного был успешным, хотя были введены 5 Ед компонентов крови.
Лепирудин
Лепирудин ( Refludan , Berlex , Lachine , Канада) – это производное гирудина, прямой ингибитор тромбина, вырабатываемый естественным путем слюнными железами медицинских пиявок, Hirudo medicinalis . Однако, лепирудин синтезируется с помощью рекомбинантной технологии. 65-амино кислотный полипептид (~7000 Дальтон) отличаются незначительно по структуре от естественного препарата [71, 72]. Гирудин и его синтетические производные формируют нековалентные, но необратимые, 1:1 комплексы с тромбином, путем связывания с обоими активными местами тромбина, а также с местом связи фибриногена на тромбине. В отличие от гепарина, гирудин действует независимо от антитромбина. Гирудин также отличается от гепарина по его способности подавлять связанный со сгустком тромбин. Хотя лепирудин имеет короткий период полувыведения (80 минут), у него нет антидота и его период выведения значительно удлиняется при почечной недостаточности. Таким образом, этот препарат противопоказан даже при умеренной степени почечной недостаточности.
АЧТВ приемлем для рутинного наблюдения лечения лепирудином в терапевтических дозах при ГИТ-ассоциированных тромбозах. К сожалению, эта оценка не может применяться для наблюдения высоких доз необходимых для ИК, так как кривая АЧТВ выравнивается при использовании высоких концентраций лепирудина [47, 73]. Подобным образом, АВР также недостаточно чувствительна для использования при наблюдении [47, 73, 74], хотя предварительное доказательство предполагает, что модифицированная АВР может быть адаптирована для этих целей (хотя клиническая ратификация все еще остается) [74].
Однако, экариновое время свертывания цельной крови (ЭВС) может обеспечить быстрое и надежное антикоагулянтное наблюдение за лепирудином во время операции на сердце [47, 73]. Экарин –это фермент металлопротеиназы, найденный в естественных условиях в яде змей, Echis carinatus , он активирует протромбин в промежуточном ферменте, мейзотромбин, который нейтрализуется по мере формирования комплексов с гирудином (или любым производным гирудина). ЭВС, таким образом, удлиняется линейно по доза-зависимому типу с повышенной концентрацией лепирудина. Один пример протокола для определения ЭВС показан в таблице 4 [47]. При «добавлении» серии образцов цитрат-антикоагулированной цельной крови с различными концентрациями лепирудина, была построена калибровочная кривая.
| 50 мкл цитрата, антикоагулирующего цельную кровь было проанализировано* + 50 мкл стандартной нормальной плазмы человека† Выдерживать в термостате в течение 1 минуты при темперетуре 37°С + 50 мкл раствора экарина (20 Ед/мл), содержащего 0,025 М хлорида кальция Определение времени свертывания |
| * Калибровочная кривая построена путем добавления цитрат-антикоагулированных образцов цельной крови с лепирудином в концентрациях 0,5, 1,0, 1,5, 2,0, 3,0 и 4,0 мкг/мл (конечная). Обычная целевая ЭВС (в секундах) – это то, что соответствует концентрации лепирудина 3,5-4,5 мкг/мл. † Обеспечение нормальной плазмы человека предотвращает ЭВС от удлинения, из-за влияния гемодилюции, когда пациент находится на аппарате искусственного кровообращения. Напечатано с разрешения автора, ссылка 47. |
Как в Канаде, так и в США, промышленный метод ЭВС есть в наличии от компании PharmaNetics (Morrisville , США) в виде «гуманитарное устройство освобождения» ( H 990012) для отдельных ситуаций ИК, где гепарин противопоказан из-за ГИТ [75, 76]. Оценка выполняется с помощью методологии точка ухода ( Thrombolytic Assessment System [ TAS ]; выпускаемой PharmaNetics ; производимой на рынок как Rapidpoint Coag® by Bayer Diagnostics , Торонто, Канада и Тэрритаун, Нью-Йорк, США). Эта специальная программа ведется PharmaNetics , информацию можно получить на сайте компании ( pharma netics . com ). Для получения ЭВС карт в Канаде должны быть заполнены специальные документы, которые направляются в отделение исследований устройства Medical Device Bureau , Оттава. Кроме того, ордер покупки и соглашение компенсации должно быть получено PharmaNetics . Цена коробки 25 ЭВС карт составляет 750$ США . Для центров в США, должно быть получено информированное согласие одобрительным комитетом. PharmaNetics будет предоставлять TAS анализатор для тех центров, которые еще не используют это устройство.
Так как гемодилюция у пациенток происходит во время ИК (что само по себе пролонгирует ЭВС), разведение 50:50 крови пациента (собранной в трубки с голубой крышкой, содержащие цитрат натрия) сделаны также со « Specialty Assay Reference Plasma ( SARP )», « Factor Assay ConTrol ( FACT )» или объединенной нормальной плазмой (3,2% цитрата натрия). Из этой смеси 30-35 мкл закапывается на карту ЭВС для тестирования на анализаторе. С этим методом, уровень лепирудина 3,5-4,0 мкг/мл обычно соответствует ЭВС 350 - 400 секунд. Обычно, кровь пациента «добавляется» ex vivo с различными концентрациями лепирудина для получения стандартной кривой [77].
Таблица 5 представляет протоколы лечения с применением лепирудина при ИК.
| Первоначальная доза лепирудина (до ИК) Первоначальный внутривенный болюс лепирудина: 0,25 мг/кг веса Лепирудин, добавленный к первоначальному раствору: 0,20 мг/кг веса Контроль уровней лепирудина пазмы: > 2,5 мкг/мл в начале ИКДоза и контроль лепирудина при ИК Длительная внутривенная инфузия* в начале ИК |
|
| Уровень лепирудина плазмы | Изменение дозы |
| >4,5 мкг/мл | Снизить скорость инфузии на 10 мл/час |
| 3,5-4,5 мкг/мл | Не менять скорость инфузии |
| <3,5 мкг/мл | Увеличить скорость инфузии на 10 мл/час |
| Специальные шаги в конце ИК Прекратить инфузию лепирудина за 15 минут до ожидаемого окончания ИК После отключения ИК, назначить 5 мг гирудина для аппарата искусственногокровообращения, чтобы избежать образования сгустков |
|
| *50 мг лепирудина растворяют на 50 мл 0,9% хлорида натрия. ИК = экстракорпоральное кровообращение; ЭВС = экариновое время свертывания. Напечатано с разрешения, ссылка 47. |
Различные размышления
Аргатробан ( Novastan , G 1 axoSmithKline , Канада) это низко-молекулярный прямой ингибитор тромбина в настоящее время одобренный в Канаде и США для профилактики и лечения ГИТ-ассоциированных тромбозов. Более короткий период полувыведения аргатробана (40-50 минут) при сравнении с лепирудином (80 минут) – это относительное преимущество, так как ни один из препаратов не могут быть отменен [16, 78]. Аргатробан экскретируется через желчь и не аккумулируется при почечной недостаточности. Теоретически, это будет благоприятствовать его применению при кардиальной операции у больных с почечной недостаточностью. Также в отличие от лепирудина, ингибиторный эффект аргатробана на тромбин обратим, что может приводить к более быстрому восстановлению гемостаза, если кровоточивость требует прекращения введения аргатробана.
Аргатробан успешно позволяет проводить операцию на сердце с применением ИК у собак [79, 80]. Однако, нет опубликованных данных по применению аргатробана у больных с ГИТ, требующих операции на сердце. Есть анекдотический опыт использования аргатробана при операции на сердце у больного с дефицитом антитромбина [81]: доза, использованная для ИК была значительно выше, чем доза, которая применяется при антитромботической терапии при ГИТ (первоначальный болюс 0,1 мг/кг, без дополнительного препарата на первичном растворе, с последующей длительной инфузией со скоростью 5-10 мкг/кг/мин [целевая АВР, 300-400 секунд], с прекращением аргатробана в конце ИК). Ни одного тромба не было отмечено во время операции, но после ИК, небольшие тромбы наблюдались в резервуаре. Отмечено незначительное кровотечение. Будет ли подобный опыт происходить в результате ведения острой ГИТ, требующей операции на сердце, неизвестно.
Анкрод ( Arvin , Abbott Laboratories , Канада), дефибриногенированный змеиный яд, также используется для проведения операций на сердце требующих ИК [82, 83]. Однако, этот препарат не снижает выработку тромбина при ГИТ [17] и требует компонентов крови (криопреципитат) для обратимости. Трудно точно измерить фибриноген при низких целевых требуемых уровнях . Кроме того, риск микрососудистых тромбозов при быстром назначении означает, что анкрод должен вводиться по крайней мере в течение 24-48 часов, что ограничивает его применение при срочных ситуациях. Анкрод не рекомендуется для лечения ГИТ с или без операций на сердце [17].
Предотвращение случайного применения гепарина во время операции на сердце
Любой успех от точного выбора и введения альтернативного не-гепаринового антикоагулянта для обеспечения ИК у пациента с острой или перенесенной ГИТ может подрываться непреднамеренным периоперационным применением гепарина. Рутинное промывание гепарином инвазивных катетеров должно предотвращаться в операционной и во время послеоперационного ухода. Следует использовать не-гепариновый легочный сосудистый катетер и тщательный предоперационный просмотр с перфузиологом является основным для гарантии, что не произойдет другого случайного воздействия гепарина, например, применение гепарин-обработанного артериального фильтра в аппаратах ИК.
Операция на сердце и острая или перенесенная ГИТ: каков подход к применению?
Ни один терапевтический подход не годится для всех пациентов или для всех хирургических кардиологических центров. Решение предложить особое лечение зависит от центр-зависимых факторов. Есть ли особый препарат? Есть ли опыт его применения и обеспечение своевременного лабораторного контроля? Может ли согласованный подход, использующий опыт многих людей (анестезиолог, перфузиолог, гематолог, лаборанты, кардио-хирурги, кардиолог, реаниматологи, и так далее), быть организован? Более того, определенные пациент-зависимые факторы, такие как почечная недостаточность, могут нести относительные или абсолютные противопоказания для терапии. Иногда, уход может потребоваться для перевода в центр с соответствующей оценкой.
Исключение - острые ситуации: определение антител ГИТ должно быть выполнено у больных с острой или перенесенной ГИТ, у которых предполагается операция на сердце. Так как оценка антигена и активации обеспечивает точную, но дополнительную информацию [23, 24], она может быть полезной в отношении исследования крови острых случаев и при выздоровлении для лабораторной оценки с экспертизой по обоим типам исследований. Нерешенная проблема – ведение ситуации, при которой находят несоответствующие лабораторные результаты. Например, оценка активации тромбоцитов стала отрицательной, быстрее чем чувствительные методы оценки антигена после восстановления от ГИТ [19]. Так как положительные методы активации больше указывают на клинически-значимые антитела ГИТ [19], это предполагает, что данные отрицательных методов исследования, но слабо или умеренно положительные исследования на антиген, могут позволить безопасное повторное применение гепарина. При текущих доказательствах, если необходима срочная операция, то будет непонятно - что предпочтительнее: плановое повторное воздействие гепарином (с или без антитромбоцитарного препарата) или применение негепаринового антикоагулянта. По моему мнению, повторное применение гепарина, возможно, будет лучшим выбором, особенно если местный опыт работы с другими не-стандартными подходами ограничен.
Операция на сосудах у пациента с острой или перенесенной ГИТ
Таблица 6 представляет режимы дозирования двух антикоагулянтов, которые могут использоваться для обеспечения альтернативной антикоагуляции во время сосудистой операции [65, 71]. В схеме данапароида интраоперационная антикоагуляция достигается введением внутривенного болюса перед операцией, где как при схеме лепирудина, системная антикоагуляция достигается введением доз лепирудина. Сообщается небольшой опыт работы с аргатробаном при операции на периферических сосудах [84].
Таблица 6. Альтернативная интраоперационная антикоагуляция
терапевтическими дозами при операции на сосудах.
Лепирудин (рекомбинантный гирудин) Интраоперационное введение*: применяется до 250 мл раствора 0,1 мг/мл; после операции: 0,1 кг/кг веса (целевое соотношение АЧТВ 1,5-2,5)или Данапароид натрия Перед операцией: 2250 Ед внутривенный болюс†; интраоперационное введение: 750 Ед на 250 мл солевого раствора, используя до 50 мл; после операции: 750 Ед подкожно три раза в день (пациенты низкого риска) или 150-200 Ед/час (пациенты высокого риска), начиная по крайней мере через 6 часов после операции. |
| АЧТВ = активированное частичное тромбопластиновое время. * Раствор лепирудина может быть подготовлен добавлением одной ампулы 20 мг лепирудина на 200 мл солевого раствора; хотя вводимые дозы лепирудина могут достигать системных уровней антикоагуляции, пациенты могут также заново устанавливать лепирудин, введенный перед операцией (например, обычный болюс для достижения терапевтической антикоагуляции у пациентов с нормальной функцией почек, 0,4 мг/кг). † Урегулирование болюса данапароида по массе тела: < 60 кг = 1500 Ед; 60-75 кг = 2250 Ед; 75-90 кг = 3000 Ед; > 90 кг = 3750 Ед. |
Резюме
Иммунная ГИТ – это одна из наиболее важных неблагоприятных реакций на препарат в клинической медицине. Это нарушение может представлять почву для размышления анестезиологам, особенно когда антикоагуляция во время операции требуется у пациентов, которым предстоит срочная операция на сердце и на сосудах, но у которых ранее имела место острая ГИТ или есть циркулирующие ГИТ-антитела.
Ссылки
- Warkentin T.E., Levine M.N., Hirsh J., et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weight heparin or unfractionated heparin. N Engl J Med 1995; 332: 1330-5.
- Amiral J . , Bridey F . , Dreyfus M . , et al. Platelet factor 4 complexed to heparin is the target for antibodies generated in heparin-induced thrombocytopenia (Letter). Thromb Haemost 1992; 68: 95-6.
- Kelton J.G., Sheridan D., Santos A., et al. Heparin-induced thrombocytopenia: laboratory studies. Blood 1988; 72: 925-30.
- Newman P.M., Chong B.H. Heparin-induced thrombocytopenia: new evidence for the dynamic binding of purified anti-PF4-heparin antibodies to platelets and the resultant platelet activation. Blood 2000; 96: 182-7.
- Warkentin T.E., Elavathil L.J., Hayward C.P.M., Johnston M.A., Russett J.I.., Kelton J.G. The pathogenesis of venous limb gangrene associated with heparin-induced thrombocytopenia. Ann Intern Med 1997; 127: 804-12.
- Warkentin T.E. Clinical picture of heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker Inc., 2001: 43-86.
- Warkentin T. Е ., Hayward C.P.M., Boshkov U.K., et al. Sera from patients with heparin-induced thrombocytopenia generate platelet-derived microparticles with procoagulant activity: an explanation for the thrombotic complications of heparin-induced thrombocytopenia. Blood 1994; 84: 3691-9.
- Visentin G.P., Ford S.E., Scott J.P., Aster R.H. Antibodies from patients with heparin-induced thrombocytopenia/thrombosis are specific for platelet factor 4 complexed with heparin or bound to endothelial cells. J Clin Invest 1994; 93: 81-8.
- Arepally G.M., Maver I.M. Antibodies from patients with heparin-induced thrombocvtopenia simulate monocytic cells to express tissue factor and secrete interleukin8. Blood 2001; 98: 1252-4.
- Warkentin T.E., Kelton J.G. A 14-year study of heparin-induced thrombocy topenia. Am J Med 1996; 101: 502-7.
- Wallis D.E., Workman D.L., Lewis B.E., Steen L., Pifarre R., Moray J.F. Failure of early heparin cessation as treat ment fogy heparin-induced thrombocytopenia. Am J Med 1999; 106: 629-35.
- Warkentin T.E., Kelton J.G. Temporal aspects of heparin- i n duced thrombocytopenia. N Engl J Med 2001; 344: 1286-92.
- Potzsch B., Klovekorn W.P., Madlener K. Use of heparin during cardiopulmonary bypass in patients with a history of heparin-induced thrombocytopenia (Letter). N Engl J Med 2000; 343: 515.
- Bleasel J.F., Rasko J.E.J., Rickard K.A., Richards G. Acute adrenal insufficiency secondary to heparin-induced thrombocytopenia-thrombosis syndrome. Med J Aust 1992; 157: 192-3.
- Lee D.H., Warkentin T.E. Frequency of heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker, Inc., 2001: 87-121.
- Lewis B.E., Wallis D.E., Berkowitz S.D., et al. Argatroban anticoagulant therapy in patients with heparin- induced thrombocytopenia. Circulation 2001; 103: 1838-43.
- Greinacher A., Warkentin T.E. Treatment of heparin-induced thromboc y topenia: an overview. In: Warke n ti n T.E., Greinacher A. (Eds.). Heparin-induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker, Inc., 2001: 291-322.
- Warkentin T.E. Heparin-induced thromboc y topeni a: yet another treatment paradox? Thromb Haemost 2001; 85: 947-9.
- Warkentin T.E., Sheppard J.I., Horsewood P., Simpson P.J., Moose J.C., Kelton J.G. Impact of the patient population on the risk for heparin-induced thrombocytopenia. Blood 2000; 96: 1703-8.
- Lepercq J., Conard J., Borel -Derlon A., et al. Venous thromboembolism during pregnancy: a retrospective study of enoxaparin safety in 624 pregnancies. BJOG 2001; 108: 1134-40.
- Kappers-Klunne M.C., Boon D.M.S., Hop W.C.J., et al. Heparin-induced thrombocytopenia and thrombosis: a prospective analysis of the incidence in patients with heart and cerebrovascular diseases. Br J Haematol 1997; 96: 442-6.
- Diuguid D.L. Choosing a parenteral anticoagulant agent. N Engl J Med 2001; 345: 1340-3.
- Warkentin T.E., Greinacher A. Laboratory testing for heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker, Inc., 2001: 231-69.
- Warkentin T.E. Laboratory testing for heparin-induced thrombocytopenia. J Thromb Thrombolysis 2000; 10: 35-45.
- Lindhoff-Last E., Gerdsen F., Ackermann H., Bauersachs R. Determination of heparin-platelet 4-IgG antibodies improves diagnosis of heparin-induced thrombocytopenia. Br J Haematol 2001; 113: 886-90.
- Visentin G.P., Malik M., Cyganiak K.A., Aster R.H. Patients treated with unfractionated heparin during open heart surgery are at high risk to form antibodies reactive with heparin: platelet factor 4 complexes. J Lab Clin Med 1996; 128: 376-83.
- Bauer T.L., Arepally G., Konkle B.A., et al. Prevalence of heparin-associated antibodies without thrombosis in patients undergoing cardiopulmonary bypass surgery. Circulation 1997; 95: 1242-6.
- Ansell J., Slepchuk N. Jr., Kumar R., Lopez A., Southard L., Deykin D. Heparin induced thrombocytopenia: a prospective study. Thromb Haemost 1980; 43: 61-5.
- Green D., Martin G.J., Shoichet S.H., DeBacker N., Bomalaski J.S., Lind R.N. Thrombocytopenia in a prospective, randomized, double blind trial of bovine and porcine heparin. Am J Med Sci 1984; 288: 60-4.
- Powers P.J., Kelton J.G., Carter C.J. Studies on the frequency of heparin-associated thrombocytopenia. Thromb Res 1984; 33: 439-43.
- Bailey R.T. Jr., Ursick J.A., Heir K.L., Hilleman D.E., Reich J.W. Heparin-associated thrombocytopenia: a prospective comparison of bovine lung heparin, manufactured by new process, and porcine intestinal heparin. Drug Intell Clin Pharm 1986; 20: 374-8.
- Fiser W.P., Read R.C., Wright F.E., Vecchio T.J. A randomized study of beef lung and pork mucosal heparin in cardiac surgery. Ann Thorac Surg 1983; 35: 615-20.
- Iverson L.I., Duhaylongsod F.G., Young J.N., et al. Porcine heparin increases postoperative bleeding in cardiopulmonary bypass patients. Cardiovasc Drugs Ther 1990; 4: 269-72.
- Konkle B.A., Bauer T.L., Arepally G., et al. Heparininduced thrombocytopenia: bovine versus porcine heparin in cardiopulmonary bypass surgery. Ann Thorac Surg 2001; 71: 1920-4.
- Francis J.L., Drexler A., Moroose R., Palmer G.G. Comparative effects of bovine and porcine heparin on heparin antibody formation following cardiovascular surgery. Blood 2001; 98(Supрl. 1): 60b (abstract).
- Warkentin T.E., Kelton J.G. Delayed-onset heparin-induced thrombocytopenia and thrombosis. Ann Intern Med 2001; 135: 502-6.
- Rice L., Attisha W.K., Drexler A., Francis J.L. Delayed-onset heparin-induced thrombocytopenia. Ann Intern Med 2002; 136: 210-5.
- Ling E., Warkentin T.E. Intraoperative heparin flushes and subsequent acute heparin-induced thrombocytopenia. Anesthesiology 1998; 89: 1567-9.
- Warkentin T.E., Ling E., Ho A., Sheppard J.I. « Incidental» unfractionated heparin (UFH) vs normal saline (NS) flushes for intraoperative invasive catheters and the frequency of formation of heparin-induced thrombocytopenia IgG antibodies (HIT-IgG): a randomized, controlled trial. Blood 1998; 92(Suppl. 1): 91b (abstract).
- Warkentin T.E., Hong A.P. Frequency of upper limb deep venous thrombosis (UL-DVT) in relation to central venous catheter (CVC) use in patients with heparin-induced thrombocytopenia (HIT): evidence for interaction of systemic (HIT) and local (CVC) prothrombotic risk factors. Blood 1998; 92(Suppl. 1): 500a-1a (abstract).
- Warkentin T.E. Heparin-induced thrombocytopenia, Part 1: the diagnostic clues. J Crit Illn 2002 (in press).
- Popov D., Zarrabi M.H., Foda H., Graber M. Pseudopulmonary embolism: acute respiratory distress in the syndrome of heparin-induced thrombocytopenia. Am J Kidney Dis 1997; 29: 449-52.
- Kadidal W., Mayo D.J., Home M.K. Heparin-induced thrombocytopenia (HIT) due to heparin flushes: a report of three cases. J Intern Med 1999; 246: 325-9.
- Kapsch D.N., Adelstein E.H., Rhodes G.R., Silver D. Heparin-induced thrombocytopenia, thrombosis, and hemorrhage. Surgery 1979; 86: 148-55.
- Warkentin T.E. Pseudo-heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker, Inc., 2001: 271-89.
- Olinger G.N., Hussey C.V., Olive J.A., Malik M.I. Cardiopulmonary bypass for patients with previously documented heparin-induced platelet aggregation. J Thorac Cardiovasc Surg 1984; 87: 673-7.
- Potzsch B., Madlener K. Management of cardiopulmonary bypass anticoagulation in patients with heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker Inc., 2001: 429-44.
- Selleng S., Lubenow N., Wollert H.G., Mullejans B., Greinacher A. Emergency cardiopulmonary bypass in a bilaterally nephrectomized patient with a history of heparin-induced thrombocytopenia: successful reexposure to heparin. Ann Thorac Surg 2001; 71: 1041-2.
- Kappa J.R., Horn D., McIntosh C.L., Fisher C.A., Ellison N,. Addonizio V.P. Iloprost (ZK36374), a new prostacyclin analogue, permits open cardiac surgery in patients with heparin-induced thrombocytopenia. Surg Forum 1985; 36: 285-6.
- Addonizio V.P. Jr., Fisher C.A., Kappa J.R., Ellison N. Prevention of heparin-induced thrombocytopenia during open heart surgery with iloprost (ZK36374). Surgery 1987; 102: 796-807.
- Kr aenzler E.J., Starr N.J. Heparin-associated thrombocytopenia: management of patients for open heart surgery. Case reports describing the use of iloprost. Anesthesiology 1988; 69: 964-7.
- Aouifi A., Blanc P., Piriou V., et al. Cardiac surgery with cardiopulmonary bypass in patients with type II heparin-induced thrombocytopenia. Ann Thorac Surg 2001; 71: 678-83.
- McLaughlin W., Genthner D.E., Panella M.M., Rich S. Reduction in pulmonary vascular resistance with longterm epoprostenol (prostacyclin) therapy in primary pulmonary hyeprtension. N Engl J Med 1998; 338: 273-7.
- Koster A., Loebe M., Mertzlufft F., Kuppe H., Hetzer R. Cardiopulmonary bypass in a patient with heparin-induced thrombocytopenia II and impaired renal function using heparin and the platelet GP IIb/IIIa inhibitor tirofiban as anticoagulant. Ann Thorac Surg 2000; 70: 2160-1.
- Koster A., Kukucka M., Back F., et al. Anticoagulation during cardiopulmonary bypass in patients with heparin-induced thrombocytopenia type II and renal impairment using heparin and the platelet glycoprotein IIb-IIIa antagonist tirofiban. Anesthesiology 2001; 94: 245-51.
- Koster A., Meyer O., Fischer T., et al. One-year experience with the platelet glycoprotein IIb/IIIa antagonist tirofiban and heparin during cardiopulmonary bypass in patients with heparin-induced thrombocytopenia type II. J Thorac Cardiovasc Surg 2001; 122: 1254-5.
- McClellan K.J., Goa K.L. Tirofiban. A review of its use in acute coronary syndromes. Drugs 1998; 56: 1067-80.
- Follis F., Schmidt C.A. Cardiopulmonary bypass in patients with heparin-induced thrombocytopenia and thrombosis. Ann Thorac Surg 2000; 70: 2173-81.
- Von Segesser L.K., Mueller X., Marty B., Horisberger J., Corny A. Alternatives to unfractionated heparin for anticoagulation in cardiopulmonary bypass. Perfusion 2001; 16: 411-6.
- Long R.W. Management of patients with heparin-induced thrombocytopenia requiring cardiopulmonary bypass. J Thorac Cardiovasc Surg 1985; 89: 950-1.
- Palmer Smith J., Walls J.T., Muscato M.S., et al. Extracorporeal circulation in a patient with heparininduced thrombocytopenia. Anesthesiology 1985; 62: 363-5.
- Makhoul R.G., McCann R.I., Austin E.H., Greenberg C.S., Lowe J.E. Management of patients with heparin- associated thrombocytopenia and thrombosis requiring cardiac surgery. Ann Thorac Surg 1987; 43: 617-21.
- Kappa J.R., Cottrell E.D., Berko w it z H.D., et al. Carotid end a rtcr ec tom y in patients with heparin-induced platelet acti v ation: comparative efficacy of aspirin and ilop r ost (ZК36374). J Vasc Surg 1987; 5: 693-701.
- Warkentin T.E. , Barki n R.L. Newer strategies for the treatment of heparin -induced thrombocytopenia. Pharmacotherapy 1999; 19: 181-95.
- Chong B.H., Magnani H.N. Danaparoid for the treatment of heparin -induced thrombocytopenia. In: Warkentin T.E. , Greinacher A. (Eds.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker Inc., 2001: 323-47.
- M agnani H.N., Beijering R.J.R., ten Cafe J.W., Chong B.H. Orgaran anticoagulation for cardiopulmonary bypass in patients with heparin-induced thrombocytopenia. In: Pifarre R. (Ed.). New Anticoagulants for the Cardiovascular Patient. Philadelphia: Hanley & Belfus, Inc., 1997: 487-500.
- Gitlin S.D., Deeb G.M., Yann C., Schmaier A.H. Intraoperative monitoring of danaparoid sodium anticoagulation during cardiovascular operations. J Vasc Surg 1998; 27: 568-75.
- Olin D.A., Urdaneta F., Lobata E.B. Use of danaparoid during cardiopulmonary bypass in patients with heparin-induced thrombocytopenia. J Cardiothorac Vasc Anesth 2000; 14: 707-9.
- Fernandez P., Mayer R., MacDonald J.L., Cleland A., Hay-McKay C. Use of danaparoid sodium (Orgaran) as an alternative to heparin sodium during cardiopulmonary bypass: a clinical evaluation of six cases. Perfusion 2000; 15: 531-9.
- Warkentin T.E., Dunn G.L., Cybulsky I.J. Off-pump coronary artery bypass grafting for acute heparin-induced thrombocytopenia. Ann Thorac Surg 2001; 72: 1730-2.
- Greinacher A. Recombinant hirudin for the treatment of heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (ids.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker Inc., 2001: 349-80.
- Greinacher A., Lubenow N. Recombinant hirudin in clinical practice: focus on lepirudin. Circulation 2001; 103: 1479-84.
- Potzsch B., Madlener K., Seelig C., Riess C.F., Greinacher A., Muller-Berghaus G. Recombinant hirudin as an anticoagulant during cardiopulmonary bypass-assessment of the whole blood ecarin clotting time. Thromb Haemost 1997; 77: 920-5.
- Despotis G.J., Hogue C.W., Saleem R., et al. The relationship between hirudin and activated clotting time: implications for patients with heparin-induced thrombocytopenia undergoing cardiac surgery. Anesth Analg 2001; 93: 28-32.
- Fabrizio M.C. Use of ecarin clotting time (ECT) with lepirudin therapy in heparin-induced thrombocytopenia and cardiopulmonary bypass. J Extra Corpor Technol 2001; 33: 117-25.
- Nuttall G.A., Santrach P.J. Ecarin clotting time: a new tool for management of heparin induced thrombocytopenia in cardiac surgery. Last accessed Feb 15, 2002 at http://www.aacc.org/access/ecarin/default.stm
- Koster A., Hansen R., Grauhan O., et al. Hirudin monitoring using the TAS ecarin clotting time in patients with heparin-induced thrombocytopenia type II. J Cardiothorac Vasc Anesth 2000; 14: 249-52.
- Lewis B.E., Hursting M.J. Argatroban therapy in heparin-induced thrombocytopenia. In: Warkentin T.E., Greinacher A. (Eds.). Heparin-Induced Thrombocytopenia, 2nd ed. New York: Marcel Dekker Inc., 2001: 381-407.
- Walenga J.M., Koza M.J., Terrell M.R., Lonchyna V., Arcidi J., Pifarre R. Experimental evaluation of argatroban for cardiopulmonary bypass. In: Pifarr e R (Ed.). New Anticoagulants for the Cardiovascular Patient. Philadelphia: Hanley & Belfus, 1997: 251-63.
- Sakai M., Ohteki H., Narita Y., Naitoh K., Natsuaki M., Itoh T. Argatroban as a potential anticoagulant in cardiopulmonary bypass- studies in a dog model. Cardiovasc Surg 1999; 7: 187-94.
- Furukawa K., Ohteki H., Hirahara K., Narita Y., Koga S. The use of argatroban as an anticoagulant for cardiopulmonary bypass in cardiac operations. J Thorac Cardiovasc Surg 2001; 122: 1255-6.
- Demers C., Ginsberg J.S., Brill-Edwards P, et al. Rapid anticoagulation using ancrod for heparin-induced thrombocytopenia. Blood 1991; 78: 2194-7.
- Zulys V.J., Teasdale S.J., Michel E.R., et al. Ancord (Arvin) as an alternative to heparin anticoagulation for cardiopulmonary bypass. Anesthesiology 1989; 71: 870-7.
- Ohteki H., Furukawa K., Ohnishi H., Narita Y., Sakai M., Doi K. Clinical experience of argatroban for anticoagulation in cardiovascular surgery. Jpn J Thorac Cardiovasc Surg 2000; 48: 39-46.

