Beta-adrenergic receptors (bAR): role in modulating the host immune answer
Бета-адренорецепторы (b АР): роль в модулировании иммунного ответа
Jim Wong, MD, Ashwin Murthy, and Marissa Patterson
From the Department of Anesthesia, Stanford University, Stanford, California
Все больше появляется доказательств связи между автономной нервной системой и иммунной системой. В данном обзоре представлены данные о нынешнем понимании процесса регулирования и модулирования дифференцировки и функции клеток иммунного ответа организма «хозяина» симпатической нервной системой. Также будет представлена информация о связи симпатической нервной системы и ревматизма, и других воспалительных заболеваний.
Роль иммунного ответа в организме «хозяина» является двояким процессом. Основой функцией является определение и уничтожение чужеродного антигена. С другой стороны данная система должна узнавать свои белки. В данный момент известно, что иммунный ответ регулируется, как минимум, двумя нейрогормональными системами:
- Гипоталамус ® гипофиз ® надпочечники
- Автономная нервная система1, 2
Автономная нервная система состоит из симпатической и парасимпатической нервных систем. Классически, симпатическая нервная система (СНС) отвечает за работу сердечнососудистой системы (ССС). Она управляет «борьбой» и «полетом». Повышения ЧСС, сократимости сердечной мышцы и изменения вазомоторного тонуса происходит вследствие взаимодействия нейротрансмиттера норэпинефрина с адренорецепторами, среди которых выделяют два основных подкласса (a и b). Существует два типа aАР (a1 и a2) и три типа b АР (b1АР, b2 АР, b3 АР). В данном обзоре будет обращено внимание на роль b2 АР в дифференцировке и функции клеток, отвечающих за иммунный ответ. Авторы обращают внимание на то, что большинство исследований проводятся in vitro , что, однако, может быть полезным при изучении потенциальных механизмов.
Анатомия
Первичные лимфоидные органы представлены тимусом и костным мозгом. Вторичные лимфоидные органы представлены лимфатическими узлами, селезенкой и лимфоидной тканью кишечника ( GALT ). Различные исследования показали наличие симпатической иннервации не только в васкуляризации лимфоидных органов, но и в их паренхиме. 3-7
Хотя обсуждение пойдет вокруг эффектов адренергической стимуляции иммунных клеток и органов, необходимо отметить, что иммунный ответ может изменять системный и местный адренергический выход. Например, интрацеребровентрикулярное введение цитокинов Ил-1, Ил-6 и TNF - a может центрально активировать СНС, также как и привести к повышению метаболизма норэпинефрина. Периферическое введение интерферона-a или Ил-1 вызывает продолжительное повышение симпатической активности селезеночного нерва.13 Роль этой петли обратной связи может быть регулирующей, влияя на специфическую форму иммунного ответа.
Врожденный и приобретенный иммунитет
Иммунный ответ состоит из двух частей: врожденной и приобретенной (см. рисунок 1). Врожденный иммунный ответ посредством toll - like рецепторов (TLR) распознает различные микробные компоненты. В определении антигена данный вид является неспецифичным. Он не обладает функцией памяти. Основными компонентами врожденного иммунного ответа являются: макрофаги/моноциты, дендритные клетки, натуральные киллеры и нейтрофилы.
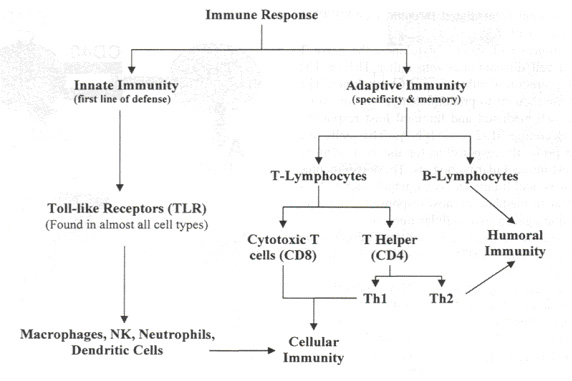 |
| Рисунок 1. Иммунный ответ состоит из двух частей: врожденной и приобретенной. Наблюдается четкая зависимость друг от друга. Антиген- презентирующие клетки (дендритные клетки) играю важную роль в дифференцировке Т лимфоцитов. |
Основной функцией врожденного иммунитета, осуществляемой Т и В лимфоцитами, является иммунный ответ и специфичность. Память дает возможность иммунной системе действовать быстрее при повторном появлении антигена. Специфичность позволяет разделять «свои» и «чужие» антигены.14 Т лимфоциты делятся на две основные группы клеток: CD 8+ цитотоксичные Т клетки и CD4+ Т хелперы. Выделяют два различных подкласса CD 4+ Т хелперов: тип 1 и тип 2 (см. рисунок 2).
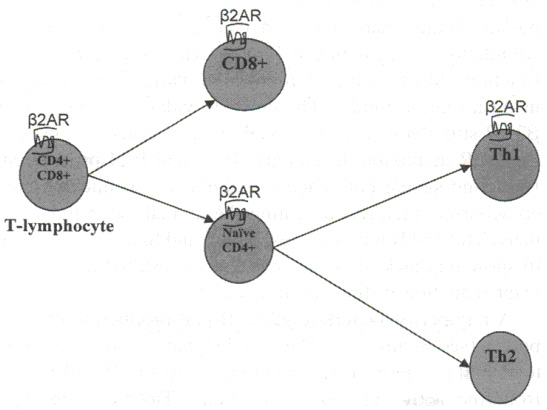 |
| Рисунок 2. Дифференцировка Т клеток (цветной вариант доступен online ). |
Хотя полезно различать врожденный и приобретенный иммунитет, существуют четкие связи между различными типами клеток. Например, как будет показано ниже, дифференцировка Т лимфоцитов и развитие специфичности зависит от представления антигенов клетками врожденного иммунитета.
Т лимфоциты и b2 АР
Все подклассы Т лимфоцитов, за исключением Т хелперов 2 типа, обладают b2 АР15 (см. рисунок 2). Важной функцией CD4+ Т лимфоцитов является возможность пролиферировать в месте презентации гена. При представлении с антигеном посредством комплекса MHC 2 класса, активированным Т лимфоцитам необходимо пролиферировать и выработать антиген специфичную популяцию Т клеток. Стимуляция b2 АР играет роль в пролиферации CD4+ клеток. Хотя данные противоречивы, большинство исследований сводятся к тому, что стимуляция b2АР ингибирует пролиферацию CD4+ Т лимфоцитов.16-18 Данный эффект можно наблюдать посредством увеличения уровня cAMP и протеин киназы А (PKA) в клетках,18, 19 тем самым предполагая, что ингибирование пролиферации Т клеток b2АР происходит через систему cAMP / PKA .
Под воздействием специфических цитокинов простые Т хелперы ( CD 4+) делятся на первый и второй тип. Посредством секреции подклассов специфических цитокинов клетки 1 и 2 типа управляют соответственно медиаторами и гуморальным иммунным ответом. Секретируя Ил-2 и IFN-g , клетки 1 типа являются ответственными перед первичным иммунным ответом на клеточные патогенные тела. К данным телам относятся бактерии, протозоа, грибы. Клетки 2 типа, которые секретируют Ил-4 и Ил-5 отвечают за выработку антител к внеклеточным микробам.14
Отмечая тот факт, что b2АР не экспрессируются на клетках 2 типа, в дальнейшем будет обсуждаться влияние стимуляции b2АР на продукцию цитокинов клеток 1 типа.
Регуляция b2АР продукции IFN-g не является простым моментом. Исследования in vitro показывают, что степень продукции IFN-g зависит от времени стимуляции b2АР в отношении к активации Т клеток. Клетки 1 типа, которые берут начало в простых Т хелперах, подвергаются воздействию агонистов b2АР и происходит повышение выработки IFN-g в ответ на действие норэпинефрина.20 Взаимодействие клеток 1 типа и норэпинефрина предшествующее активации проявляется в снижении выработки IFN-g. 15 Для сравнения, взаимодействие клеток 1 типа и норэпинефрина после клеточной активации приводит к незначительному снижению IFN-g . 21 Таким образом, степень выработки IFN-g зависит от стадии активации лимфоцитов 1 типа. Стимуляция b2АР на клетках, которые являются более зрелыми в процессе активации, приводит к снижению регуляции процесса клеточного иммунитета.
Стимуляция b2АР и выработка антигенов
Выработка антител В лимфоцитами является определяющим в защите организма от внеклеточных микробов. Существует небольшое количество исследований о роли стимуляции b2АР в регуляции дифференцировки и функции В лимфоцитов. Большинство исследований проводились на мышах. Эти данные показывают, что стимуляция b2АР сочетается с другими факторами, включая активацию BCR , для стимуляции выработки IgG1 и IgM . Снижая количество норэпинефрина в организме мышей с иммунодефицитом, а затем вводя им иммунизированные клетки 2 типа и В лимфоциты, Kohm и Sanders показали, что недостаточная стимуляция b2АР приводит к значительному снижению выработки IgG1.22
Выработку антител В клетками регулирует несколько факторов (см. рисунок 3А). Начальный сигнал возникает после соединения антигена с рецептором В клетки. Второй сигнал для В клеток идет от активированных CD4+ клеток 2 типа. Клетки 2 типа через экспрессию на поверхности молекул CD40 и CD28 взаимодействуют с CD40 L и CD86 рецепторами В клеток, генерируя сигнал внутри клетки, который регулирует продукцию антител.23-25 Ил-4, который вырабатывается активированными клетками 2 типа, связывается с Ил-4R на поверхности В клеток для осуществления дальнейшей регуляции продукции антител. Стимуляция b2АР В лимфоцитов модулирует этот процесс посредством нескольких механизмов. Стимуляция b2АР активированных В лимфоцитов через систему cAMP / PKA повышает уровень протеина IgG1 (см. рисунок 3В). Более того, стимуляция b2АР приводит к повышению экспрессии CD86 на поверхности молекулы, которая вырабатывается уровнем ниже.27 Стимуляция CD86 через систему PKC/NF-kB приводит к повышению уровня IgG1, в добавлению к стимуляции b2АР.
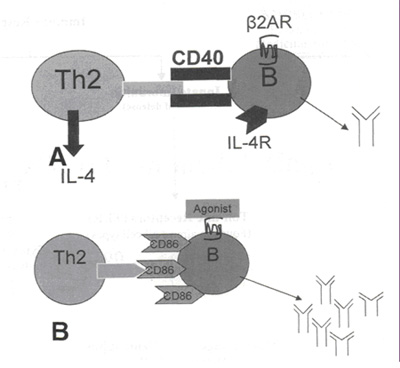 |
Рисунок 3. (А) Активация В лимфоцитов зависит от помощи активированных CD4+ клеток 2 типа. Связывание CD40 и CD40L наряду с соединением Ил-4R и Ил-4 приводит к рекомбинации, приводящей к продукции IgG1 В лимфоцитами. (В) Стимуляция В лимфоцитов агонистами b2АР повышает выработку антител через систему cAMP/PKA. Во-вторых, стимуляция b2АР также повышает экспрессию CD86. Связывание CD86 молекулами CD28 на клетках 2 типа приводит к повышению выработки антител посредством PKC/NF-kВ. |
Таким образом, кажется, что стимуляция b2АР В лимфоцитов приводит к усилению гуморального иммунного ответа.
Эффект стимуляции b2АР на дифференцировку Т хелперов
Как было описано выше, простые CD4+ Т хелперы делятся на клетки 1 и 2 типа (см. рисунок 4А). Сейчас будет произведена оценка влияния стимуляции b2АР на данный процесс. Во-первых, происходит презентация антигена на комплексах MHC II класса антиген презентирующими клетками (например, дендритными клетками). Данный процесс распознается рецептором Т клетки на простой CD4+ клетке Т хелпера. Стимуляция CD28 на простом Т хелпере молекулами CD 80/86, находящимися на антиген презентирующей клетке, приводит к выработке Ил-12 антиген продуцирующей клеткой. Ил-12 осуществляет дифференцировку простых CD4+ клеток на клетки 1 типа. Стимуляция b2АР ведет к снижению выработки Ил-12, подавляя условия, благоприятные для дифференцировки клеток 1 типа (см. рисунок 4В). Стимуляция b2АР модулирует иммунный ответ, снижая регуляцию клеточного иммунитета и повышая регуляцию гуморального иммунитета.
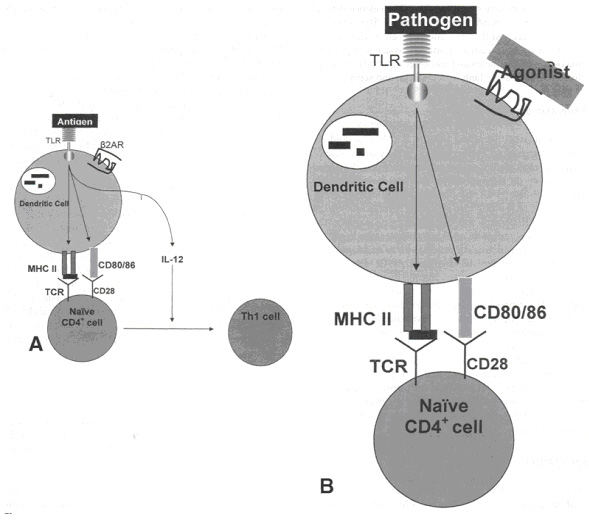 |
| Рисунок 4. (А) Антиген презентирующие клетки (АПК) и дифференцировка Т лимфоцитов. Процесс дифференцировки начинается когда АПК (в данном случае дендритные клетки) распознают антиген через toll - like рецепторы (TLR). Фагоцитоз и презентация антигена на комплексе MHC II позволяет выполнить распознавание TLR с простых СВ4+ клеток. Сочетание молекул CD80/86 и CD28 и презентация антигена приводит к выработке Ил-12 дендритными клетками. (В) Эффект стимуляции b2АР на дифференцировку Т клеток. Стимуляция b2АР на АПК ингибирует продукцию Ил-12, тем самым не создается благоприятной среды для дифференцировки простых CD4+ на клетки 1 типа. |
Стимуляция b2АР и клинические синдромы
Клиническое применение знаний о регуляции и модуляцией адренергической системой иммунного ответа ограничивается множеством факторов:
- Исследования, в большинстве своем, in vitro
- Ограниченное количество исследований на людях
Однако большинство исследователей пользуются полученными данными в свете специфических клинических синдромов. Наиболее распространенной патологии для исследования являются: ревматические болезни (ревматоидный артрит, системная красная волчанка, системный склероз) и другие воспалительные заболевания, включая астму, острое легочное повреждение/респираторный дистресс у взрослых, сепсис.
Ревматические заболевания
При небольшом исследовании пациентов с ревматоидным артритом, СКВ и системным склерозом, Wahle и коллеги обнаружили связь между снижением плотности b2АР на В лимфоцитах и наличием хронических ревматоидных заболеваний.31 В данном исследовании была обнаружена следующая закономерность: чем больше плотность b2АР на В лимфоцитах, тем ниже активность заболевания. Остается неясным существуют ли причинные взаимоотношения или снижение плотности b2АР является простым маркером наличия хронического ревматического заболевания.
Для определения функциональной значимости снижения количества b2АР на В лимфоцитах, в той же исследуемой группе определяли уровень катехоламинов вследствие апоптоза. Подвергая В лимфоциты воздействию различных доз изопротеренола, неспецифического агониста b2АР, Wahle и коллеги выявили снижение индукции апоптоза в клетках, взятых у пациентов с ревматоидным артритом, по сравнению с клетками здоровых людей.32 Данная информация подтверждает гипотезу, что модулирование адренергической системы может играть роль во влиянии на активность заболевания у пациентов с хронической ревматической патологией.
Сепсис/Респираторный дистресс синдром взрослых (РДС)
Недавно возник интересный вопрос о возможном влиянии стимуляции b2АР на острый респираторный дистресс синдром. Частично данный интерес возник вследствие влияния стимуляции b2АР на нейтрофилы. Нейтрофилы – это важные медиаторы воспалительного повреждения в экссудативной фазе острого легочного повреждения и РДС, которое характеризуется секвестрацией в альвеолярном пространстве нейтрофилов, макрофагов и воспалительных цитокинов.33
Barnett и коллеги показали, что сочетание нейтрофилов с изопротеренолом или аналогом аденилат циклазы форсоколином, понижает генерацию супероксида, который играет важную роль в бактерицидной активности.34 Стимуляция b2АР нейтрофилов также влияет на хемотаксис нейтрофилов, апоптоз и выделение медиатора. Большинство доказательств, полученных в ходе исследований in vitro , свидетельствуют о том, что стимуляция b2АР нейтрофилов пересекается с хемотаксисом нейтрофилов.35-37 Салметерол, агонист b2АР длительного действия, усиливает апоптоз в нейтрофилах, взятых у пациентов с астмой. 38 Агонисты b2АР влияют на адгезию лейкоцитов в дыхательных путях крыс.29,39 Исследования in vitro показали, что стимуляция b2АР снижает продукцию воспалительных цитокинов Ил-1, TNF -a, Ил-6 и Ил-8 в крови и моноцитах. 40-45 van der Poll и коллеги показали, что в моноцитах здоровых людей, которые получали 24 часовую инфузию эпинефрина 30 нг/кг/мин, наблюдалось значительное уменьшение TNF -a и повышения продукции Ил-10, который ex vivo воздействует на эндотоксин. 46 Эти данные свидетельствуют о том, что адренергическая система играет роль в частичной модуляции иммунного ответа, который рассматривается как медиатор таких заболеваний как сепсис и РДС. Однако авторы предупреждают, что данные получены в ходе исследований ex vivo . Существует две основные проблемы в интерпретации этих данных. Во-первых, концентрации катехоламинов, исследуемые ex vivo могут не оказывать влияние in vivo (например, в альвеолах и интерстициальном пространстве при РДС). Во-вторых, в ходе исследований не изучалась возможность различного «поведения» иммунной системы после стимуляции b и a АР. Таким образом, клиническое применение данной информации не совсем понятно, хотя потенциал адренергической модуляции иммунного ответа при лечении воспалительных заболеваний выглядит многообещающим. В заключении стоит указать на настоящее исследование эффекта ингаляционного албутерола, неспецифического агониста b1 и b2АР, у пациентов, страдающих острым легочным повреждением и РДС.
Заключение
Адренорецепторы и, особенно, b2АР находятся практически на всех клетках, участвующих в иммунном ответе. Сейчас мы понимаем, что иммунная система и автономная нервная система связаны друг с другом. Интерпретация полученных данных необходимо проводить с осторожностью, так как большинство информации было получено в ходе исследований in vitro, во время которых использовались клетки на различных стадиях дифференцировки и активации в сочетании с разными адренергическими препаратами различной концентрации. Несмотря на это, полученные данные свидетельствуют о роли b2АР в модулировании иммунного ответа.
При исследовании массы данных можно предположить, что стимуляция b2АР ингибирует клеточный иммунитет и стимулирует гуморальный. Является ли действие адренергической системы на иммунный ответ пагубной в отношении клеточных микробов и полезной в сфере внеклеточных агентов? Являются ли некоторые аутоиммунные заболевания, возникающие вследствие продукции антигенов к собственным белкам, следствием неадекватной автономной регуляции функции В лимфоцитов? Можно ли перенести эффекты b2АР на практику при лечении таких заболеваний как сепсис и СДР, возникающие, как считается, вследствие патологии иммунного ответа? На эти вопросы еще предстоит дать ответы.
Дополнительные материалы
- Ramer-Quinn D, Baker R, Sanders V: Activated T helper 1 and T helper 2 cells differentially express the b2- adrenergic receptor. J Immunol 159:4857-4867, 1997
- Maestroni G: Sympathetic nervous system influence on the innate immune response. Ann NY Acad Sci 1069: 195-207, 2006
- Kin N, Sanders V: It takes nerve to tell T and B cells what to do. J Leukoc Biol 79:1093-1104, 2006
- Perkins G, McAuley D, Richter A, et al: Bench-to-bed side review: j32-agonists and the acute respiratory distress syndrome. Crit Care 8:25-32, 2004
- Maestroni G: Sympathetic nervous system influence on the innate immune response. Ann NY Acad Sci 1069: 195-207, 2006
- Sanders V: Interdisciplinary research: noradrenergic reg ulation of adaptive immunity. Brain Behavior Immunity 20:1-8, 2006
- Sanders V, Straub R: Norepinephrine, the B-adrenergic receptor, and immunity. Brain Behavior Immunity 16: 290-332, 2002
- Moynihan J, Kruszewska B, Madden K, et al: Sympa thetic nervous system regulation of immunity. J Neuro - immunol 147:87-90, 2004
Список литературы
- Steinman L: Elaborate interactions between the immune and nervous systems. Nat Immun 5:575-581, 2004
- Elenkov I, Wilder R, Chrousos G, et al: The sympathetic nerve: an integrative interface between two supersystems: the brain and the immune system. Pharmacol Rev 52:595-638, 2000
- Felten D, Felten S, Carlson S, et al: Noradrenergic and peptidergic innervation of lymphoid tissue. J Immunol 135:755s-765s, 1985
- Bellinger D, Lorton D, Felten S, et al: Innervation of lymphoidorgans and implication in development, aging, and autoimmunity. Int J Im munopharmacol 14:329-344, 1994
- Felten D, Felten S, Bellinger D, et al: Noradrenergic sympathetic neural interactions with immune system: structure and function. Im munol Rev 100:225-260, 1987
- Felten D, Felten S: Sympathetic noradrenergic innervation of immune organs. Brain Behav Immun 4:293-300, 1998
- Reilly F, McCuskey P, Miller M, et al: Innervation of the periarteriolar lymphatic sheath of the spleen. Tissue Cell 11:121-126, 1979
- Berkenbosch F, van Oers J, del Ray A, et al: Corticotropin-releasing factor producing neurons in the rat activated by interleukin-1. Science 238:524-526, 1987
- Sapolsky R, River C, Yamamoto G, et al: Interleukin-1 stimulates the secretion of hypothalamic corticotrophin-releasing factor. Science 238:522-524, 1987
- unn A: Systemic interleukin-1 administration stimulates hypotha lamic norepinephrine metabolism paralleling the increased plasma corticosterone. Life Sci 43:429-435, 1988
- Elenkov I, Kovacs K, Duda E, et al: Presynaptic inhibitory effect of TNF-a on the release of noradrenaline in isolated median eminence. J Neuroimmunol 41:117-120, 1992
- Kovacs K, Elenkov I: Differential dependence of ACTH secretion induced by various cytokines on the integrity of the paraventricular nucleus. J Neuroendocrinol 7:15-23, 1995
- Katafuchi T, Hori T, Take S: Central administration of interferon- alpha enhances rat sympathetic nerve activity to the spleen. Neurosci Lett 125:37-40, 1991
- Paul W: Fundamental Immunology. Lippincott Williams & Wilkins, Philadelphia, PA. (ed 5) 2003
- Sanders V, Baker R, Ramer-Quinn S, et al: Differential expression of the b2-adrenergic receptor by Thl and Th2 clones. Implications for cytokine production and B cell help. J Immunol 158:4200-4210, 1997
- Feldman R, Hunningshake G, McArdle W: Beta-adrenergic receptor mediated suppression of interleukin 2 receptors in human lympho cytes. J Immunol 139:3355-3359, 1987
- Bartik M, Brooks W, Roszman T: Modulation of T cell proliferation by stimulation of the beta-adrenergic receptor: lack of correlation between inhibition of T cell proliferation and cAMP accumulation. Cell Immunol 148:408-421, 1993
- Bauman G, Bartik M, Brooks W, et al: Induction of cAMP-dependent protein kinase (PKA) activity in T cells after stimulation of the pros taglandin E2 or the beta-adrenergic receptors: relationship between PKA activity and inhibition of anti-CD3 monoclonal antibody-induced T cell proliferation. Cell Immunol 158:182-194, 1994
- Minakuchi R, Wacholtz M, Davis L, et al: Delineation of the mecha nisms of inhibition of T cell activation by PGE2. J Immunol 145:2616- 2625, 1990
- Swanson M, Lee W, Sanders V: IFN-y production by Thl cells generated from naive CD4 + T cells exposed to norepinephrine. J Im munol 166:232-240, 2001
- Kohm A, Sanders V: Suppression of antigen-specific Th2 cell-depen dent IgM and IgGl production following norepinephrine depletion in vitro. J Immunol 162:5299-5308, 1999
- Kasprowicz D, Kohm A, Berton M, et al: Stimulation of the B cell receptor, CD 86 (B7-2), and the j32-adrenergic receptor intrinsically modulates the level of IgGl and IgE produced per B cell. J Immunol 165:680-690, 2000
- Podojil J, Sanders V: Selective regulation of mature IgGl transcription by CD86 and b2 -adrenergic receptor stimulation. J Immunol 170: 5143-5151, 2003
- Podojil J, Kin N, Sanders V: CD86 and b2 -adrenergic receptor sig naling pathways, respectively increase Oct-1 and OCA-B expression and binding to the 3'-IgH enhancer in B cells. J Biol Chem 279:23394- 23404, 2004
- Roper R, Graf B, Phipps R: Prostaglandin E2 and cAMP promote B lymphocyte class switching to IgGl. Immunol Lett 84:191-198, 2002
- Galizzi J, Cabrillat H, Rousset F, et al: IFN-7 and prostaglandin E2 inhibit IL-4 induced expression of Fc epsilon R2/CD23 on B lymphocytes through different mechanism without altering binding of IL-4 to its receptor. J Immunol 141:1982-1988, 1988
- Kohm A, Mozaffarian A, Sanders V: B cell receptor and the b2 - adrenergic receptor-induced regulation of B7-2 (CD86) expression in B cells. J Immunol 168:6314-6322, 2002
- Podojil J, Sanders V: CD86 and /32-adrenergic receptor stimulation regulates B-cell activity cooperatively. Trends Immunol 26:180-185, 2005
- Bolton P, Lefevre P, McDonald D: Salmeterol reduces early and late-phase plasma leakage and leukocyte adhesion in rat airways. Am J Respir Crit Care Med 155:1428-1435, 1997
- Panina-Bordignon P, Mazzeo D, Lucia P, et al: /32-agonists prevent Thl development by selective inhibition of interleukin 12. J Clin Invest 100:1513-1519, 1997
- Wahle M, Kolker S, Krause A, et al: Impaired catecholaminergic signaling of B lymphocytes in patients with chronic rheumatic dis eases. Ann Rheum Dis 60:505-510, 2001
- Wahle M, Pierer M, Krause A, et al: Decreased catecholamine-induced cell death in B lymphocytes from patients with rheumatoid arthritis. Ann NY Acad Sci 966:425-428, 2002
- Pugin J, Verghese G, Widmer M, et al: The alveolar space is the site of intense inflammatory and profibrotic reactions in the early phase of acute respiratory distress syndrome. Crit Care Med 27:304-312, 1999
- Barnett C, Moore E, Patrick D, et al: /3-adrenergic stimulation down regulates neutrophil priming for superoxide generation, but not elas tase release. J Surg Res 70:166-170, 1997
- Harvath C, Robbins J, Russell A, et al: cAMP and human neutrophil chemotaxis. Elevation of cAMP differentially affects chemotactic responsiveness. J Immunol 146:224-232, 1991
- Silvestri M, Oddera S, Cantero S, et al: b2 agonist induced inhibition of neutrophil chemotaxis is not associated with modification of LFA-1 and MAC-1 expression or with impairment of PMN antibacterial activity. Resp Med 93:416-423, 1999
- Maris N, van der Sluijs K, Florquin S, et al: Salmeterol, a b2 -receptor agonist, attenuates lippolysaccharide-induced lung inflammation in mice. Am J Physiol Lung Cell Mol Physiol 286:L1122-L1128, 2004
- Lee E, Smith J, Robertson P, et al: Salmeterol and inhibitors of PDE4 induced apoptosis in neutrophils from asthmatics: b -adrenergic receptor mediated salmeterol activity and additive effects with PDE4 inhibitors, [abstract] Am J Resp Cell Mol Biol 159: A329, 1999
- Bowden J, Sulakvelidze I, McDonald: Inhibition of neutrophil and eosinophil adhesion to venules of rat trachea by b2 -adrenergic agonist formoterol. J Appl Physiol 77:397-405, 1994
- Zetterlund A, Linden M, Larsson K: Effects of beta2-agonist and bedesonide on interleukin-lbeta and leukotriene B4 secretion: studies of human monocytes and alveolar macrophages. J Asthma 35:565-573, 1998
- Severn A, Rapson N, Hunter C, et al: Regulation of tumor necrosis factor production by adrenaline and beta-adrenergic agonists. J Immu nol 148:3441-3445, 1992
- Gu Y, Seidel A: Influence of salbutamol and isoproterenol on the production of TNF and reactive oxygen species by bovine alveolar macrophages and calcitriol differentiated HL-60 cells. Immunopharmacol Immunotoxicol 18:115-128, 1996
- Monastra G, Secchi E: Beta-adrenergic receptors mediate in vivo the adrenaline inhibition of lipopolysaccharide-induced tumor necrosis factor release. Immunol Lett 38:127-130, 1993
- Sekut L, Champion B, Page K, et al: Anti-inflammatory activity of salmeterol: down-regulation of cytokine production. Clin Exp Immu nol 99:461-466, 1995
- van der Poll T, Jansen J, Endert E, et al: Noradrenaline inhibit lipopolysaccharide-induced tumor necrosis factor and interleukin 6 production inhuman whole blood. Infect Immun 62:2046-2050, 1994
- van der Poll T, Coyle S, Barbosa K, et al: Epinephrine inhibits tumor necrosis factor-a and potentiates interleukin 10 production during human endotoxemia. J Clin Invest 97:713-719, 1996

