Первый опыт послеоперационного обезболивания сочетанием нефопама и нестероидных противовоспалительных препаратов у больных, оперированных по поводу опухолей области головы и шеи.
В.В. БАЛАНДИН, Е.С. ГОРОБЕЦ
ФГБУ «Российский онкологический научный центр им.Н.Н.Блохина» РАМН
Актуальность — Многие операции, выполняемые по поводу злокачественных новообразований головы и шеи, высокотравматичны и сложны не только для хирурга, но и для анестезиолога. Богатая иннервация и васкуляризация тканей челюстно-лицевой области, близость рефлексогенных зон, расширенные и комбинированные объемы оперативных вмешательств, сопровождаются мощной афферентной болевой импульсацией и требуют надежного обезболивания не только во время операции, но и в послеоперационный период. Исходные нарушения проходимости дыхательных путей вследствие опухолевого роста, хирургические манипуляции в области верхних дыхательных путей и послеоперационный отек близлежащих тканей чреваты выраженными нарушениями дыхания и предъявляют особые требования к безопасности анестезии и адекватности выбранных для послеоперационного обезболивания анальгетиков. Общеизвестно, что послеоперационная боль приносит не только психоэмоциональный дискомфорт пациенту, но и за счет гиперактивации симпатоадреналовой системы, негативно воздействует на основные органные системы, приводя к их дисфункции [14]. Недостаточное обезболивание в первые часы после операции – ведущий пусковой механизм формирования послеоперационного хронического болевого синдрома [11]. Поэтому непосредственные и отдаленные результаты оперативного лечения больных напрямую зависят от качества послеоперационного обезболивания [4]. Наилучшие результаты дает так называемый, “мультимодальный” подход, подразумевающий многоуровневую антиноцицепцию, при которой максимальный анальгетический эффект нескольких препаратов за счет синергизма действия сочетается с минимумом побочных явлений вследствие снижения их дозы [7]. Классическая схема мультимодальной аналгезии предусматривает три основных компонента: опиоидные анальгетики + неопиоидные анальгетики (НПВП и парацетамол) + методы регионарной анальгезии [7,8]. Хорошо известны побочные эффекты наиболее сильных обезболивающих лекарств – наркотических анальгетиков, самое опасное из которых – депрессия дыхания, представляющая особый риск для больных с опухолевым поражением верхних дыхательных путей [15]. Включение в схему послеоперационного обезболивания НПВП, действующих на уровне трансдукции, патофизиологически обосновано и клинически эффективно. Ингибируя циклооксигеназы (ЦОГ) 1 и 2, эти препараты подавляют синтез простагландинов, что обеспечивает выраженный анальгетический, жаропонижающий и противовоспалительный эффекты [6]. К сожалению, побочные свойства значительно ограничивают применение НПВП у многих больных, во всяком случае, в виде высокодозной монотерапии. В первую очередь, речь идет об ульцерогенном действии НПВП на слизистую оболочку желудка и риске развития нефропатии, а также дезагрегации тромбоцитов, способной увеличивать кровоточивость. Нежелательные побочные эффекты НПВП дозозависимы [5,12]. Согласно данным отделения эндоскопии РОНЦ, массовое использование гастроскопии выявляет эрозивный гастрит либо язвенную болезнь до операции не менее чем у 60-70% онкологических больных при опухолях не желудочной локализации. Все это требует проводить тщательный отбор пациентов или снижать дозу НПВП, комбинируя их с анальгетиками, действующими на других уровнях. Что касается селективных ингибиторов ЦОГ-2, которые вызывают меньше побочных эффектов, то они уступают в анальгетической мощности неселективным НПВП. Ингибитор ЦОГ преимущественно центрального действия – парацетамол имеет ограниченное самостоятельное значение, обладая умеренным анальгетическим потенциалом, и может быть гепатотоксичным при форсировании дозировок и чрезмерно длительном применении. В итоге, круг анальгетиков, которые можно беспрепятственно применять в послеоперационный период, значительно сужается, а методы регионарной анестезии у больных с опухолевым поражением в области головы и шеи имеют ограниченное применение из-за высокого риска инфекционных осложнений в ранние сроки после операции. В связи с этим большой клинический интерес представляет разработка альтернативных схем послеоперационного обезболивания у данной категории больных. В качестве основы такой схемы нами был выбран ненаркотический анальгетик нефопам (акупан®, Биокодекс, Франция), структурно отличающийся от других анальгетиков. Препарат обладает уникальным для ненаркотических анальгетиков центральным действием, основанном на ингибировании обратного захвата дофамина, норадреналина и серотонина на уровне невральных синапсов [3,13]. Выбор препарата был обусловлен его способностью купировать болевые раздражители без угнетения дыхания, отсутствии влияния на агрегацию тромбоцитов, состояние слизистой оболочки и моторики ЖКТ. Для нефопама характерны низкий риск привыкания при длительном использовании, а также выраженное противоознобное действие, особо значимое на этапе пробуждения и в самый ранний посленаркозный период [1,9,10]. Синергизм действия нефопама и НПВП в послеоперационный период, продемонстрирован в рандомизированном контролируемом исследовании (Delage N et al., 2005), в котором комбинация анальгетиков привела к значительному снижению средней эффективной дозы (ED50) и побочных эффектов обоих препаратов [2].
Цель исследования — Оценить эффективность и безопасность послеоперационного обезболивания на основе нефопама и НПВС у онкологических больных, оперированных в области головы и шеи.
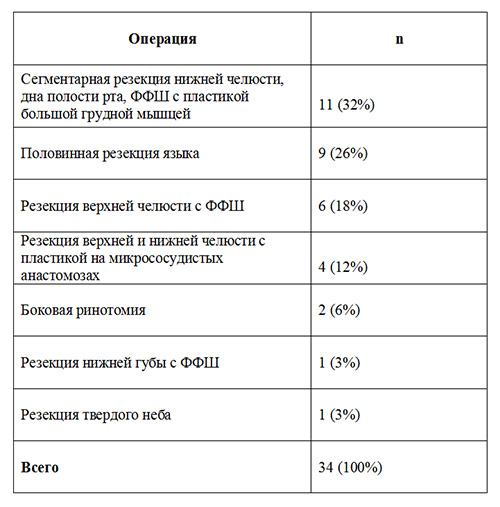
Материалы и методы. Исследование проведено у 83 пациентов отдела хирургии опухолей головы и шеи РОНЦ РАМН. В исследование включены больные 21-79 лет, I-III класса ASA, которые были разделены на группы, перенесшие: I - умеренно травматичные (табл. 1) и II - высокотравматичные (табл. 2) операции. Ни у кого из 83 больных не было клинических и анамнестических данных, указывающих на патологию почек и желудка.
Таблица 1. Умеренно травматичные онкологические вмешательства в области головы и шеи.
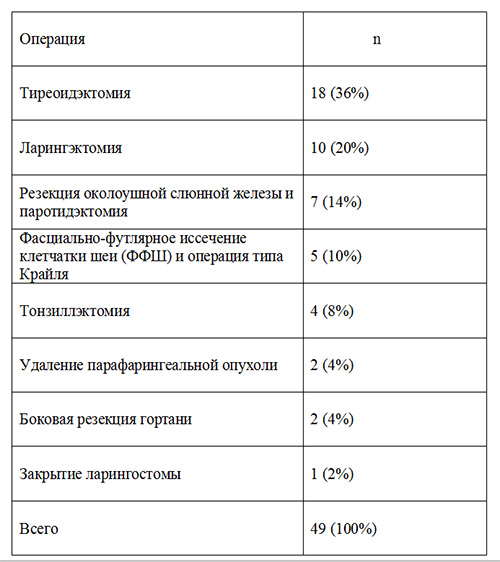
Таблица 2. Высокотравматичные онкологические вмешательства в области головы и шеи.
Средняя длительность умеренно травматичных вмешательств составила 2,42 ± 0,96 часа, высокотравматичных - 4,57 ±1,59 часа.
Оценку интенсивности боли проводили по визуально-аналоговой шкале (ВАШ), где 0 баллов – нет боли, 10 баллов – нестерпимая боль.
Этапы исследования: после экстубации в операционной, в палате пробуждения, далее в хирургическом отделении 3 раза в день на 1-е, 2-е и 3-и послеоперационные сутки.
Все больные получали премедикацию : диазепам 5 мг внутрь на ночь и мидазолам 2,5-5 мг в/м за 30 мин до операции. Индукция фентанилом 200 мкг и пропофолом 0,7-1,5 мг/кг. Эндотрахеальный наркоз севофлураном 1-1,5 МАК в сочетании с дробным в/в введением фентанила 572 ± 98 мкг, последнее введение за 30-50 мин до конца операции. Миоплегия рокуронием 50-140 мг.
Послеоперационное обезболивание: нефопам 20 мг в/м за 30 мин до завершения операции, далее каждые 8 ч в течение 1-х, 2-х и 3-х послеоперационных суток. В качестве второго компонента послеоперационной анальгезии, использовали НПВП: длительно (более 24 часов) действующий теноксикам (тексамен®, Асфарма), 20 мг однократно в/м после индукции, далее по 20 мг в/м каждые 24 ч (58 больных - 70%) или коротко действующий кетопрофен (кетонал®, Лек) по 100 мг в/в за 10 мин до завершения операции, далее каждые 8-12 ч трое суток после операции (25 больных - 30%).
Результаты исследования и их обсуждение. Послеоперационное обезболивание нефопамом в комбинации с НПВП оказалось весьма эффективным (рис. 1).
Рис 1. Средняя эффективность обезболивания в группах умеренно и высокотравматичных вмешательств по 10-балльной визуально-аналоговой шкале.
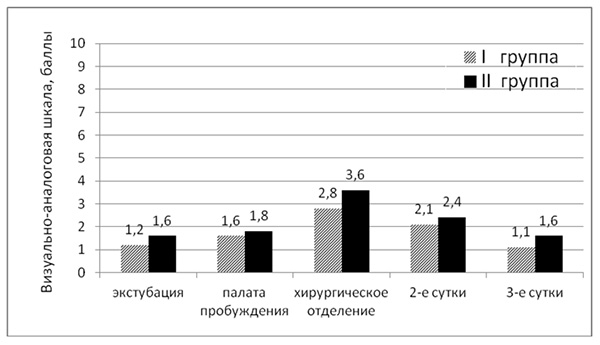
После операции интенсивность боли не превышала 2-х баллов в обеих группах. Пик боли был отмечен в конце 1-х послеоперационных суток и в среднем равнялся 2,8 ± 1,26 баллам у больных, перенесших умереннотравматичные и 3,6 ± 1,16 баллам - высокотравматичные вмешательства. На 2-е и 3-и послеоперационные сутки болевые ощущения в обеих группах не превышали 1,6 ± 0,86 и 2,5 ± 1,04 баллов соответственно.
Дополнительное обезболивание в 1-е послеоперационные сутки потребовалось 5 (10%) больным I группы и 7 (20%) больным II группы (рис. 2).
Рис 2. Дополнительное обезболивание в группах умеренно и высокотравматичных вмешательств в послеоперационном периоде.
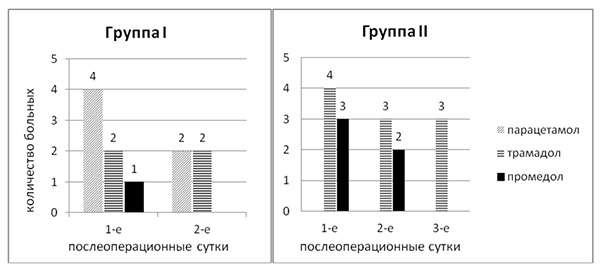
В I группе использовали парацетамол и трамадол. Во II – трамадол и промедол. На 2-е послеоперационные сутки дополнительное обезболивание понадобилось 4 (8%) больных I и 5 (15%) больным II группы. На 3-и послеоперационные сутки дополнительное обезболивание потребовалось только 3 (9%) больным II группы.
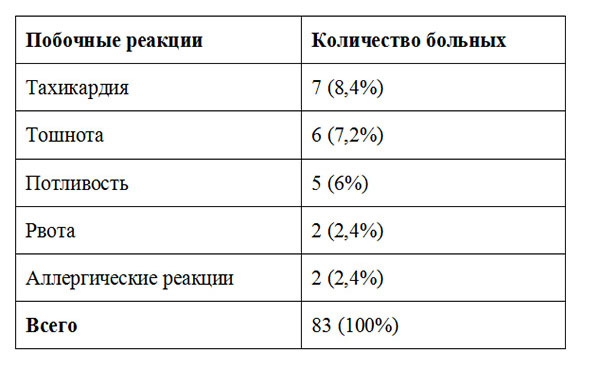
Нефопам не лишен побочных эффектов, которые проявляются в основном при быстром в/в введении и минимизируются при внутримышечном, который мы использовали (табл. 3). Чаще всего отмечали тахикардию, тошноту, и потливость. Аллергические реакции в виде крапивницы были у 2-х пациентов. Клинических признаков повышенной кровоточивости у исследуемых групп больных в раннем послеоперационном периоде отмечено не было.
Таблица 3. Побочные реакции в группах умеренно и высокотравматичных вмешательств в послеоперационном периоде.
У 81 (97%) больного после интраоперационного введения нефопама, посленаркозного озноба после пробуждения не было. У двух пациентов он был слабо выраженным.
Вывод. Послеоперационное обезболивание на основе нефопама в комбинации с НПВП у больных, оперированных по поводу опухолей головы и шеи, простой, достаточно надежный и безопасный метод, который можно широко применять непосредственно в хирургических отделениях.
ЛИТЕРАТУРА- Bilotta F., Pietropaoli P., Sanita R. Nefopam and tramadol for the prevention of shivering during neuroaxial anesthesia. // Reg.Anesth.Pain.Med. — 2002. — V.27. — P.380-384.
- Delage N., Maaliki H., Beloeil H. Median effective dose (ED50) of nefopam and ketoprofen in postoperative patients. // Anesthesiology.-2005. — V.102. — P. 1211—1216.
- Fernandez-Sanchez М., Diaz-Trelles R., Groppetti A. Nefopam, an analogue of or-phenadrine, protects against both NMDA receptor-dependent and independent vera-tridine-induced neurotoxicity. // Amino Acids. — 2002. — V.23. —P.31-36.
- Ferrante F.M., VadeBoncouer T.R. Postoperative Pain Management // Послеоперационная боль. — М.: Медицина, 1998. — 640 c.
- Girard P., Verniers D., Coppe M-C. Nefopam and ketoprofen synergy in rodent models of antinociception. // Eur.J.Pharm. —2008. — V.584. — P.263-271.
- Gordon S., Brahin J., Rowan J. Peripheral prostanoid levels and nonsteroidal antiflammatory drug analgesia: replicate clinical trials in a tissuе injury model// Clin. Pharmacol. Ther. —2002, 72: 175-183.
- Kehlet H., Dahl J.B. The value of “multimodal” or ”balanced analgesia” in postoperative pain treatment//Anesth. Analg. —1993; —77:1048-1056.
- Kehlet H. Labat Lecture 2005. Surgical stress and postoperative outcome — from here to where? // Reg. Anesth. Pain Med. — 2006. — 31. — 47-52.
- Piper S., Suttner S., Schmidt S. Nefopam and clonidine in the prevention of postanesthetic shivering. // Anaesthesia. — 1999. — V.54. — P.695-699.
- Piper S., Rohm K., Suttner S. A comparison of nefopam and clonidine for the prevention of postanaesthetic shivering: a comparative, double-blind and placebo-controlled dose-ranging study. // Anaesthesia. — 2004. — V.59— P.559-564.
- Rawal N. Analgesia technique and post-operative morbidity // Eur. J. Anaesthesiol. Suppl. — 1995 May. — 10. — 47-52.
- Strom B., Berlin J., Kinman J. Parenteral ketorolac and risk of gastrointestinal and operative site bleeding // JAMA. —1996; —275: 376-382.
- Verleye M, Andre N, Heulard I, Gillardin J. Nefopam blocks voltagesensitive sodium channels and modulates glutamatergic transmission in rodents. // Brain Res — 2004 —V. 1013— P.249-255.
- Warfield C., Kahn C. Acute pain management. Programs in U.S. hospitals and experiences and attitudes among U.S. adults //Anesthesiology. — 1995. — V. 83. — P. 1090-1094.
- Осипова Н.А., Новиков Г.А., Прохоров Б.М. Хронический болевой синдром в онкологии. — М.: Медицина, — 1998.
АиР, 2013

