Применение анальгетика центрального действия нефопама для послеоперационного обезболивания у кардиохирургических больных
А. А. Еременко, Л. С. Сорокина, М. В. Павлов
В рандомизированном проспективном сравнительном исследовании использовали 3 схемы анальгезии: 1) контролируемую пациентом анальгезию (КПА) тримеперидином в сочетании с постоянной инфузией нефопама; 2) КПА тримеперидином в сочетании с болюсным дробным введением нефопама; 3) изолированную КПА тримеперидином в раннем послеоперационном периоде у кардиохирургических больных. В исследование включены 60 пациентов в возрасте от 40 до 65 лет по 20 человек в каждой группе. Эффективность обезболивания оценивали по 5-балльной вербальной шкале интенсивности боли и максимальной инспираторной емкости легких, измеренной методом побудительной спирометрии. Показана безопасность использования нефопама в раннем послеоперационном периоде у кардиохирургических пациентов. Сочетание КПА тримеперидином с нефопамом приводило к наиболее выраженному анальгетическому эффекту. Расход тримеперидина в группах с использованием нефопама был достоверно ниже, чем в группе изолированной КПА. В целом нежелательные эффекты были связаны с тримеперидином и зависели от его дозы. В группе изолированной КПА частота тошноты, рвоты, головокружения, слабости, пареза кишечника была достоверно выше, чем в двух других группах.
Ключевые слова: послеоперационная боль у кардиохирургических больных, контролируемая пациентом анальгезия, нефопам, тримеперидин.
Проблема послеоперационного обезболивания не теряет своей актуальности. В последние годы принята концепция мультимодальной анальгезии, задачей которой является применение комбинации различных неопиоидных анальгетиков с целью улучшения качества обезболивания, снижения доз сильных опиоидов (обеспечение его опиоидсберегающего эффекта) и ограничения нежелательных осложнений всех компонентов анальгезии [1, 13—15].
В мультимодальных схемах применяются различные ненаркотические анальгетики (парацетамол, нестероидные противовоспалительные препараты) [2]. Среди анальгетиков особое место занимает препарат нефопам, представляющий собой рацемическую смесь двух энантиомеров и относящийся к ненаркотическим анальгетикам центрального действия [3]. Являясь ингибитором моноаминов, как, например, трамадол, нефопам отличается от него отсутствием морфиноподобного эффекта. Нефопам оказывает мультимодальное воздействие благодаря своему влиянию на многие мишени нейропластики, в отличие от трамадола его действие не нарушается антагонистами серотониновых 5HT3-рецепторов (например, ондансетроном) [4, 5]. К преимуществам относят также отсутствие влияния нефопама на агрегацию тромбоцитов и угнетающего воздействия на центральную нервную систему [6, 7].
Существуют многочисленные исследования по применению нефопама в абдоминальной хирургии, ортопедии и травматологии [8—10]. В то же время его эффективность для послеоперационного обезболивания у кардиохирургических больных не изучена.
Цель работы — оценка обезболивающего, опиоидсберегающего и нежелательных побочных эффектов нефопама в раннем послеоперационном периоде у кардиохирургических больных.
Материал и методы. В исследование включены 60 больных, перенесших различные операции на сердце. Средний возраст пациентов 50,8 ± 10,8 года (от 40 до 65 лет). Дизайн исследования — рандомизированное проспективное сравнительное исследование. Все больные методом случайных чисел были распределены на 3 группы.
1-я группа: контролируемая пациентами анальгезия (КПА) тримеперидином в комбинации с нефопамом. Первую инъекцию нефопама (20 мг в течение 30 мин) вводили внутривенно за 30 мин до экстубации, далее осуществляли постоянную инфузию в дозе до 120 мг в сутки.
2-я группа: КПА тримеперидином в комбинации с дробным внутривенным введением 20 мг нефопама длительностью 30 мин каждые 4 ч. Первую инфузию нефопама в дозе 20 мг проводили за 30 мин до экстубации в течение 30 мин.

3-я группа: КПА тримеперидином в виде монотерапии. Использовали акупан (нефопам) фирмы "Биокодекс" (Франция) и промедол (тримеперидин) фирмы "Сотекс" (Россия).
КПА тримеперидином начинали через 2 ч после экстубации.
Введение тримеперидина осуществляли в режиме "по требованию" на фоне постоянной инфузии (комбинированный режим).
При этом концентрация этого препарата составила 2 мг/мл, начальная или насыщающая доза — 5 мг, болюсная доза — 3 мг, локаут-интервал — 6 мин, 4-часовая максимальная доза — 20 мг, скорость постоянной инфузии — 0,1 мг/ч.

По возрасту, полу, антропометрическим данным, видам оперативного вмешательства, особенностям интраоперационной общей анестезии, длительности ИК, ишемии миокарда и операции, продолжительности послеоперационной ИВЛ больные трех групп не отличались (табл. 1).
Операции производили под общей анестезией с использованием ИК и без него. Пациенты получали сбалансированную общую анестезию с применением севофлурана, пропофола, кетамина и фентанила при 40—60% содержании кислорода во вдыхаемой смеси. По дозам кетамина и фентанила пациенты сравниваемых групп не различались.
В ОРИТ всем больным проводили стандартные мероприятия интенсивной терапии и мониторинга. Длительность ИВЛ после операции составила от 5 до 10 ч и не различалась в сравниваемых группах. Время нахождения дренажей в полости средостения, перикарда и плевральных полостях составило в среднем 20,2 ± 2,1 ч. Согласно стандартному протоколу, все пациенты перед операцией и в послеоперационном периоде получали Н2-блокаторы.
Критерии включения пациентов в исследование: срединная стернотомия, ранний послеоперационный период, уровень сознания — ясное или легкое оглушение, 14—15 баллов по шкале комы Глазго, возраст старше 12 лет.
Критерии исключения: наличие в анамнезе психических заболеваний и противопоказаний к назначению нефопама и индивидуальная непереносимость препаратов этой группы, печеночно-почечная недостаточность, периоперационные поражения головного мозга (ОНМК, постгипоксическая или метаболическая энцефалопатия), послеоперационное кровотечение более 1,4 мл/кг/ч, выраженная сердечно-сосудистая и/или дыхательная недостаточность, требующая проведения длительной ИВЛ (более 2 сут).
Интенсивность боли оценивали по 5-балльной вербальной шкале в покое и при глубоком вдохе и кашле.
В качестве дополнительного объективного критерия эффективности анальгезии использовали метод побудительной спирометрии. Максимальную инспираторную емкость легких (МИЕЛ) измеряли с помощью объемного спирометра Coach 2® (Intersurgical).
Первую оценку интенсивности боли и МИЕЛ проводили сразу после экстубации, затем каждые 2 ч в течение первых послеоперационных суток. Одновременно фиксировали показатели гемодинамики (АД и ЧСС).
Статистическую обработку проводили с помощью стандартного пакета Статистика 7, данные представлены в виде среднего значения со стандартным отклонением. Сравнение количественных показателей в двух группах проводили методом дисперсионного анализа. Для сравнения долей использовался критерий z с поправкой Йетса на непрерывность. Для определения зависимости использовали коэффициент корреляции Пирсона. Значение р < 0,05 считалось статистически значимым.
Результаты исследования и их обсуждение. У больных 1-й и 2-й групп экстубацию трахеи выполняли на фоне терапевтических доз нефопама. Пациентам всех 3 групп введение тримеперидина во избежание депрессии дыхания на фоне остаточного действия общей анестезии начинали через 2 ч после экстубации.
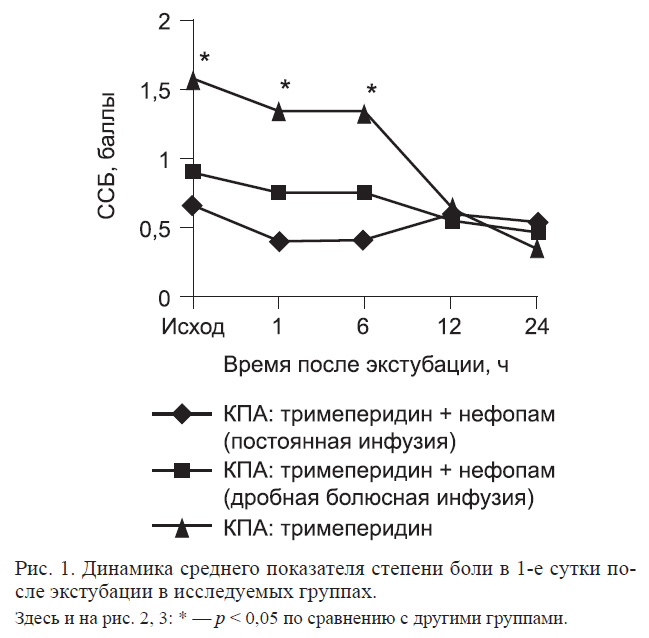
Сравнение динамики выраженности болевого синдрома (рис. 1) показало, что непосредственно после экстубации и через 1 ч интенсивность боли в 3-й группе была значительно выше, так как пациенты этой группы не получали дополнительного обезболивания в отличие от двух других групп, в которых за 30 мин до экстубации внутривенно вводили нефопам. Различия в 3-й группе по сравнению с двумя другими были статистически достоверны на первых трех этапах исследования, достоверных различий между 1-й и 2-й группой не отмечено. Вместе с тем уже после 6 ч отмечалось снижение интенсивности боли в 3-й группе, достоверно не отличающееся от двух других групп уже к 12-му часу. К концу 1-х суток интенсивность боли снижалась во всех 3 группах.
В проведенных нами ранее исследованиях было обнаружено, что если перед экстубацией трахеи пациентам не вводили анальгетических препаратов, они испытывали выраженную боль, степень которой достигала 3—4 баллов. В 1-й и 2-й группах активизации больных предшествовало введение нефопама, в результате чего выраженность болевого синдрома была значительно меньшей, чем в 3-й группе, где нефопам перед экстубацией не вводили.
Это подтверждает и оценка эффективности обезболивания пациентами.
Таким образом, полученные данные демонстрируют важность обезболивания перед началом активизации пациентов и возможность использования в этих целях внутривенную инфузию нефопама.
Поскольку боль при стернотомии и дренировании плевральных полостей приводит к ограничению экскурсии грудной клетки, анальгетический эффект нефопама оказывал положительное влияние на функцию внешнего дыхания, что отражает динамика максимальной инспираторной емкости легких, представленная на рис. 2. После экстубации трахеи в 1-й группе МИЕЛ составила в среднем 1555 ± 238 мл, к концу 2-го часа возросла до 1670 ± 245 мл, к концу 12-го часа — до 2150 ± 258 мл и к концу 1-х суток — до 2175 ± 216 мл. Во 2-й группе МИЕЛ составила в среднем 1475 ± 216 мл, через 1 ч — 1550 ± 229 мл, к концу 12-го часа — 1770 ± 211 мл и к концу 1-х суток — 1968 ± 211 мл. В 3-й группе средняя МИЕЛ после экстубации трахеи составила 1110 ± 620 мл, к концу суток — 1600 ± 592 мл. Таким образом, средние значения МИЕЛ в 3-й группе достоверно отличались от полученных в двух других группах на первом этапе исследования, в дальнейшем различия были незначительными.
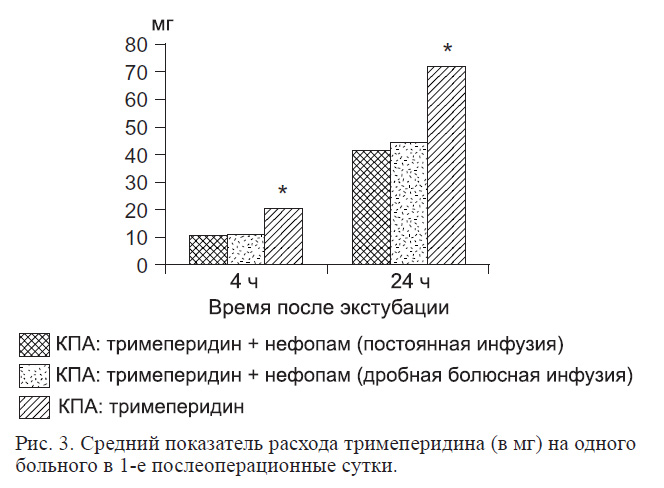
Наше исследование показывает, что нефопам обеспечивает достоверный опиоидсберегающий эффект, при этом побочные эффекты, связанные с нефопамом, отсутствуют. По данным различных исследований [11], общий морфинсберегающий эффект нефопама варьирует от 20 до 50% в зависимости от вида хирургического вмешательства и методологии применения и соответствует таковому для других ненаркотических анальгетиков, таких как нестероидные противовоспалительные препараты [12]. В нашем исследовании опиоидсберегающий эффект нефопама в 1-й и 2-й группах составил 42 и 38% соответственно. Расход тримеперидина на одного больного в сутки в 1-й группе в среднем составил 41,85 мг, во 2-й группе — 44,7 мг и в 3-й группе — 72,3 мг (рис. 3).
Таким образом, обнаружено, что применение схем с использованием анальгетика центрального действия нефопама вызывает выраженный опиоидсберегающий эффект. Расход тримеперидина в 1-й группе был в 1,7 раза меньше (p < 0,05), а во 2-й группе — в 1,6 раза (p < 0,05) меньше, чем в 3-й.
Известно, что побочные эффекты различных обезболивающих препаратов могут приводить к осложнениям, увеличивающим продолжительность госпитализации, что может превосходить положительный эффект от обезболивания на хирургический стрессовый ответ [9].
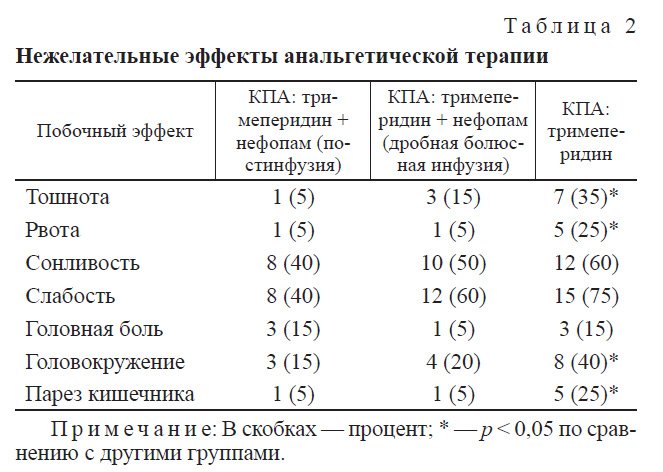
Ранее с применением нефопама связывали 15—30% частоту возникновения побочных эффектов, особенно тошноты и головокружения [12]. Несмотря на то что данные побочные явления были связаны с быстрым введением препарата, эти явления, даже будучи незначительными, привели к некоторой настороженности при использовании этого препарата, когда он появился в 1970-х годах во Франции. Наши данные не подтверждают высокую частоту возникновения данных побочных явлений, поскольку частота тошноты, рвоты и головокружения в группах, где применялся нефопам, достоверно ниже, чем в группе изолированной КПА тримеперидином.
Результаты оценки побочных эффектов в трех исследуемых группах представлены в табл. 2. В 1-й группе у 1 (5%) больного, во 2-й группе у 3 (15%) была отмечена тошнота, у 1 (5%) и 1 (5%) больного соответственно — рвота. Причиной указанных побочных эффектов могло быть последействие общей анестезии и других препаратов, применявшихся во время операции и в раннем послеоперационном периоде. Эти же побочные эффекты наблюдали и в 3-й группе, в которой тошнота была отмечена у 7 (35%) пациентов, рвота — у 5 (25%), т. е. частота тошноты и рвоты в 3-й группе достоверно отличалась от двух других.
Такие побочные эффекты, как слабость и сонливость, наблюдались в равной степени у больных всех трех групп.
Они отмечались у 8 (40%) больных 1-й группы, у 10 (50%) 2-й группы и у 12 (60%) больных 3-й группы. Парез кишечника в 1-й группе и во 2-й отмечен соответственно у 1 (5%) и 1 (5%) пациента, а в 3-й группе данный симптом наблюдался у 5 (25%) больных, что, с нашей точки зрения, также объясняется побочным эффектом тримеперидина, поскольку его количество у больных, получавших нефопам, было минимальным. В 3-й группе головокружение встречалось в 2,6 раза чаще, чем в 1-й группе, и в 2 раза чаще, чем во 2-й, что также обусловлено побочным эффектом высоких доз тримеперидина.
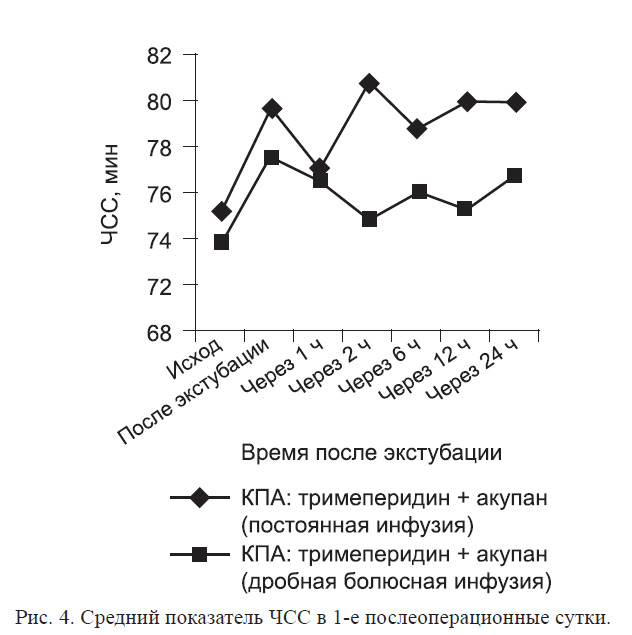
Динамика ЧСС в 1-е послеоперационные сутки представлена на рис. 4. Динамика изменения ЧСС в 1-й группе имеет плавный характер, отмечается незначительный ее подъем после 1-го болюсного введения нефопама. При дробном болюсном режиме у 20 (50%) больных 1-й и 2-й групп на каждое введение отмечалось повышение ЧСС (на 7—25 в минуту, в среднем с 71 ± 1,4 до 81 ± 1,3, причем этот прирост был статистически значимым; р < 0,001).
У остальных пациентов ЧСС при дробном введении либо не менялась, либо незначительно снижалась.
Однако следует отметить, что изменение средних значений частоты пульса в ответ на введение препарата в сравниваемых группах было недостоверно. При опросе среднего медицинского персонала было выяснено, что медсестры считают более удобной постоянную инфузию нефопама. Это связано со сниженной нагрузкой на персонал (отсутствие необходимости организации и проведения 40-минутных инфузий каждые 4 ч). Не было обнаружено статистически значимых различий в динамике артериального давления, а также в анализах свертывающей системы крови и объеме послеоперационной кровопотери в течение всего периода наблюдения.
ВЫВОДЫ
- Проведенное исследование продемонстрировало безопасность использования анальгетика центрального действия нефопама в раннем послеоперационном периоде у кардиохирургических пациентов.
- Сочетание КПА тримеперидином с нефопамом приводило к наиболее выраженному анальгетическому эффекту. Расход тримеперидина в группах с использованием нефопама был достоверно ниже, чем в группе изолированной КПА.
- Введение нефопама перед экстубацией больных приводит к снижению выраженности болевого синдрома в среднем на 90% и делает возможной раннюю активизацию пациентов.
- В целом нежелательные эффекты были связаны с тримеперидином и зависели от его дозы. В группе изолированной КПА частота тошноты (на 30 и 20%), рвоты (на 20%), пареза кишечника (на 20%) была достоверно выше, чем в 1-й и 2-й группах соответственно.
- Учитывая тот факт, что у 50% пациентов дробное внутривенное введение нефопама сопровождалось возрастанием ЧСС в среднем на 10 в минуту, а также результаты опроса среднего медицинского персонала, у кардиохирургических больных предпочтительна постоянная инфузия нефопама.
- Kehlet Н., Dahl J. B. The value of "multimodal" or "balanced analgesia" in postoperative pain treatment. Anesth. Analg. 1993; 77: 1048—56.
- Marret E., Kurdi O., Zufferey P. et al. Effects of non-steroidal antiinfammatory drugs on PCA morphine side-effects: meta-analysis of randomized controlled trials. Anesthesiology 2005; 102: 1249—60.
- Elia et al. Does multimodal analgesia with acetaminophen, nonsteroidal antiinfl ammatory drugs, or selective cyclooxygenase-2 inhibitors and patient-controlled analgesia morphine offer advantages over morphine alone? Anesthesiology 2005; 103: 1296—304.
- Stamer U. M. et al. Impact of CYP2D6 genotype on posroperative tramadol analgesia. Pain 2003; 105: 231—8.
- Arcioni R. et al. Ondansetron inhibits the analgesic effects of tramadol: a possible 5-HT(3) spinal receptor involvement in acute pain in humans. Anesth. Analg. 2002; 94: 1553—7.
- Bhatt A. M., Pleuvry B. J., Maddison S. E. Respiratory and metabolic effects of oral nefopam in human volunteers. Br. J. Clin. Pharmacol. 1981; 11: 209—11.
- Dordoni P. L., Della Ventura M., Stefanelli A. et al. Effect of ketorolac, ketoprofen and nefopam on platelet function. Anaesthesia 1994; 49: 1046—9.
- Tirault M. et al. The effect of nefopam on morphin overconsumption induced by large-dose remifentanil during propofol anaesthesia for major abdominal surgery. Anesth. Analg. 2006; 102: 110—7.
- Du Manoir B. et al. Randomized prospective study of the analgesic effect of nefopam after orthopaedic surgery. Br. J. Anaesth. 2003; 91: 836—41.
- McLintock T. T., Kenny G. N., Howie J. C. et al. Assessment of the analgesic effi cacy of nefopam hydrochloride after upper abdominal surgery: a study using patient controlled analgesia. Br. J. Surg. 1988; 75: 779—81.
- Heel R. C., Brogden R. N., Pakes G. E., Speight T. M., Avery G. S. Nefopam: a review of its pharmacological properties and therapeutic effi cacy. Drugs 1980; 19: 249—67.
- Hyllested M., Jones S., Pedersen J. L., Kehlen H. Comparative effect of paracetamol, NSAIDs or their combination in postoperative pain management: a qualitative review. Br. J. Anaesth. 2002; 88: 199—214.
- Еременко А. А., Аветисян М. И. Применение комбинированных анальгетиков в ранние сроки после кардиохирургических операций. Consilium Medicum. 2005; 2: 28—32.
- Еременко А. А., Урбанов А. В., Аветисян М. И. Обезболивание при помощи трансдермальной терапевтической системы бупренорфина после кардиохирургических операций. Здравоохранение и медицинская техника. 2006; 4 (28): 4—7.
- Лебедева Р. Н., Никода В. В. Фармакотерапия острой боли. М.: Аир-Арт; 1998.
- Еременко А. А., Сорокина Л. С. Исследование контролируемой пациентом анальгезии тримеперидином в сочетании с кетопрофеном в послеоперационном периоде у кардиохирургических больных. Анестезиология и реаниматология. 2011; 6: 43—6.
АНЕСТЕЗИОЛОГИЯ И РЕАНИМАТОЛОГИЯ № 2, 2013

