Российский реестр лекарственных препаратов,
применяемых у больных с нарушениями порфиринового обмена
ПУСТОВОЙТ Я.С., СУРИН В.Л., ЗИНГЕРМАН Б.В., ГОРГИДЗЕ Л.А., ГЕМДЖЯН Э.Г., ГАЛСТЯН Г.М.
ФГБУ Гематологический научный центр Минздрава России, Москва
Резюме. Прием порфириногенных лекарственных препаратов является причиной развития приступов острой порфирии (ОП) в 18% случаев. Индуцированные лекарствами приступы ОП отличаются более тяжелым течением, чем приступы порфирии, обусловленные другими факторами. При провокации ОП лекарствами в 100% случаев отмечалось тяжелое течение болезни, а у 45% больных потребовалось длительное, более 2 мес, лечение в стационаре. За 20 лет мы наблюдали 163 больных ОП, и наш перечень порфириногенных препаратов не всегда совпадает со списками, предлагаемыми зарубежными авторами. До 15% препаратов, которые считали безопасными, по нашим данным, провоцировали приступы ОП. Разработана собственная интернет-версия реестра опасных и безопасных для больных порфирией лекарственных препаратов, размещенная на сайтах http://www. blood.ru и http://www.critical.ru. За основу взят электронный справочный модуль лекарственных препаратов издания «Видаль». Красным цветом выделены порфириногенные лекарственные средства, зеленым – безопасные препараты, желтым – лекарства, порфириногенность которых до конца не выяснена. Предлагаемый реестр порфириногенных лекарственных препаратов носит рекомендательный характер. По мере появления дополнительной информации планируется обновлять реестр, вносить в него дополнения.
Ключевые слова: гем; порфирины; цитохром; лекарственная порфириногенность.
Порфирии – группа генетически детерминированных заболеваний, ассоциированных с циклом биосинтеза гема [1, 2] (рис. 1). Развитие любой нозологической формы порфирии является следствием снижения активности одного из ферментов цикла биосинтеза гема, в результате мутации в патогномоничном гене [2]. Согласно современной классификации [2], порфирии подразделяются:
- по месту преимущественного нарушения метаболизма порфиринов – на эритропоэтические и печеночные порфирии (табл. 1);
- по клиническим проявлениям – на острые формы, протекающие с преимущественным поражением нервной системы, и формы, протекающие с поражением кожи (см. табл. 1).
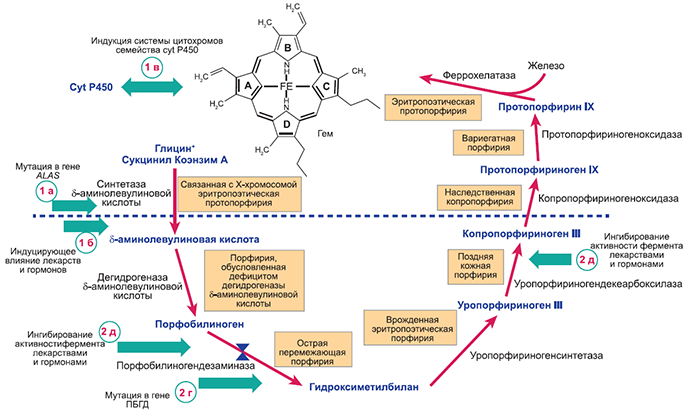
Рис. 1. Схема цикла биосинтеза гема [9] с указанием возможных точек реализации порфириногенных эффектов лекарственных препаратов.
Эти эффекты опосредованы через возможные пути (1а–1в; 2г–2д) влияния на синтетическую активность цикла.
Таблица 1

Различия в клинических проявлениях при различных нозологических формах зависят от уровня цикла биосинтеза гема, на котором функционирует фермент со сниженной активностью, определяющий, какая фракция порфиринов будет преобладать в формирующемся избытке метаболитов [3]. Если обмен гема заблокирован на высокой ступени цикла, происходит накопление изомеров собственно порфиринов, тропных к дерме и приводящих к фотодерматозу. При ферментативном дефекте, находящемся на начальных этапах цикла биосинтеза гема, среди метаболитов будут преобладать предшественники порфиринов (порфобилиноген и d-аминолевулиновая кислота, d-АЛК), обладающие нейротоксическим, демиелинизирующим воздействием, приводящим к сенсорно-моторной полинейропатии [4].
Независимо от тканевой принадлежности или особенностей клинического течения для всех форм порфирий характерны общие звенья патогенеза [5].
Для клинической манифестации любой формы порфирии необходимо, чтобы произошло избыточное накопление порфиринов, как правило, являющееся следствием (см. рис. 1):
1. Повышения активности синтетазы δ-АЛК – первого фермента в цикле биосинтеза гема, причинами которого могут быть:
а) наличие мутации в гене синтетазы δ-АЛК, приводящей к увеличению ее активности;
б) непосредственное индуцирующее воздействие на фермент факторов эндогенной или экзогенной природы, например, повышение уровня эндогенного прогестерона [6];
в) повышенное потребление гема – конечного продукта цикла биосинтеза гема, приводящее к активации синтетазы δ-АЛК по принципу обратной связи [6].
2. Частичное или полное снижение активности одного из ферментов цикла биосинтеза гема, приводящее к накоплению продуктов порфиринового обмена. Возможны следующие причины снижения активности энзима:
г) наличие патологической мутации в гене фермента [1, 2];
д) ингибирующее влияние на фермент экзогенных или эндогенных факторов (например, изолированное снижение активности уропорфириногендекарбоксилазы, приводящее к дебюту спорадической формы поздней кожной порфирии) [7].
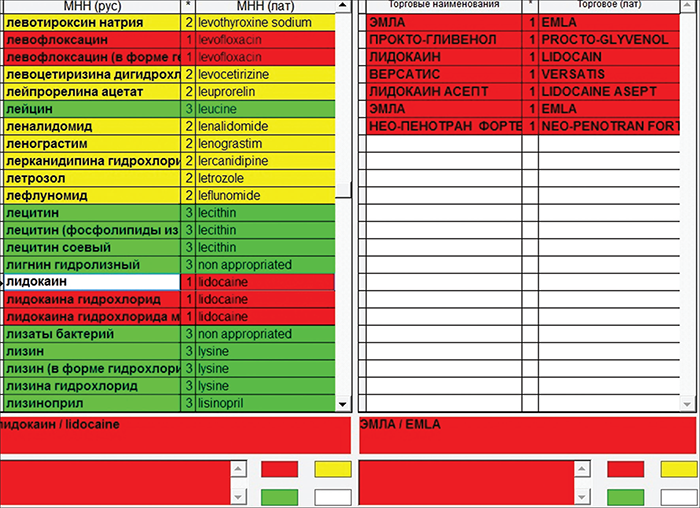
Рис. 2. Скриншот реестра, на основе модуля лекарственной базы издания «Видаль».
Зеленым цветом выделены разрешенные лекарственные препараты, красным – с высокой порфириногенной активностью, желтым – с недостаточными сведениями о порфириногенности
Действие известных порфириногенных факторов (табл. 2), приводящее к эскалации синтеза порфиринов, может быть опосредовано через описанные выше пути [8]. Одним из наиболее значимых порфириногенных факторов являются лекарственные препараты [4]. Прием порфириногенных лекарственных препаратов является причиной развития приступов острой порфирии (ОП) в 18% случаев (собственные неопубликованные данные). Индуцированные лекарствами приступы ОП отличаются более тяжелым течением, чем приступы, обусловленные другими факторами. По нашим данным, при провокации ОП лекарствами в 100% случаев отмечалось тяжелое течение болезни, а у 45% больных потребовалось длительное, более 2 мес, лечение в стационаре. У больных с нозологическими формами, протекающими с поражением кожных покровов, прием порфириногенных препаратов приводит к эскалации синтеза порфиринов и последующей манифестации фотодерматоза.
Порфириногенность лекарств реализуется через механизмы, оказывающие влияние на разные звенья порфиринового обмена (см. рис. 1).
Наиболее частым является триггерный механизм, активирующий систему цитохромов P450. Половина лекарств подвергаются окислительному метаболизму в печени с участием системы детоксикации, в которой задействованы ферменты системы цитохрома P450 (CYP). Они катализируют реакции гидроксилирования, эпоксидирования, N-, S-, O-деалкилирования, N-окисления, сульфоокисления, дегалогенирования и другие реакции, приводящие к образованию водорастворимых метаболитов [8]. В системе CYP существует 30–100 подтипов ферментов. Изоферменты, участвующие в метаболизме ксенобиотиков, относятся к 1, 2, 3 и 4 семействам CYP. Продукция апопротеинов CYP на уровне транскрипции гена координируется с продукцией фермента ALAS1, необходимого для гема, входящего в состав холофермента CYP.
Следовательно, лекарства, вызывающие индукцию CYP, активируют транскрипцию гена ALAS1. У человека транскрипция почти всех ферментов CYP, вызванная действием лекарств, опосредуется конститутивным активным рецептором – андростановым рецептором (constitutively active receptor, CAR) и прегнановым Х рецептором (pregnane xenobiotic receptor, PXR). Лекарственное вещество, которое является лигандом для PXR или CAR, сразу же должно рассматриваться как потенциально порфириногенный препарат [8]. Для проявления порфириногенного действия лекарственного препарата нужно, чтобы индуцируемый им объем апофермента CYP был достаточен, чтобы вызвать ALASl-катализ в митохондриях для продукции гема, необходимого для образования холофермента, а также достаточен, чтобы вызывать значительный расход гема в гепатоцитах. Помимо количества вещества, инициирующего этот процесс, большое значение имеет, какие подклассы CYP будут индуцироваться. Практически все порфириногенные лекарства являются индукторами CYP3A4 и/или CYP2C9, например противоэпилептические препараты, блокатор кальциевых каналов нифедипин, сульфадиазин, сульфаметоксазол и рифампицин, фунгицид кетоконазол, прогестерон, тестостерон [8].
В то же время мощные индукторы CYP2E1, 2C19 и 1A1/1A2, например, циметидин, ацетилсалициловая кислота и омепразол, не представляют опасности для больных ОП. Некоторые порфириногенные вещества являются индукторами множества микросомальных ферментов печени, включая изоферменты CYP и уридиндифосфат-глюкуронозилтрансферазы (фенобарбитал, фенитоин, карбамазепин). Они воздействуют более чем на одну систему, поэтому их назвали многофункциональными индукторами [8].
Их порфириногенность объясняется интенсивной транскрипцией гена ALAS1, запускаемой одновременной индукцией нескольких подклассов CYP.
Таблица 2

Лекарственные препараты могут оказывать непосредственное влияние на синтетическую активность первого фермента цикла биосинтеза гема, в частности гормональные препараты [6]. Например, такие препараты, как производное дезогестрела – регулон.
Лекарственные препараты могут ингибировать активность ферментов цепи биосинтеза. Например, уже упоминавшиеся, оральные контрацептивы.
Кроме перечисленных механизмов действия лекарственных препаратов существуют также разные пути регуляции активности системы биосинтеза гема как в целом, так и отдельных ее частей, что находит отражение в суточных колебаниях экскреции порфиринов и предшественников в моче у больных ОП [2]. Это, в свою очередь, может временно создать более благоприятные предпосылки для реализации лекарственно-индуцированных порфириногенных эффектов.
Для проявления порфириногенности лекарственных препаратов необходимо, чтобы их концентрация в гепатоцитах была не ниже микромолярных.
Следовательно, при суточных дозах в миллиграммовом диапазоне и ниже оказываемое воздействие на печень будет недостаточным, чтобы запустить порфириногенную транскрипцию ALAS1.
Поэтому имеет значение не только сам факт назначения порфириногенного препарата, но и его дозы, а также путь введения [8]. При пероральном приеме, например аминогликозидных антибиотиков, системное воздействие незначительное и не вызывает приступа ОП. Кроме того, после перорального приема лекарственный препарат подвергается метаболизму в кишечной стенке, что также уменьшает количество неметаболизированного вещества, попадающего в печень через воротную вену. Существуют значительные индивидуальные различия в степени метаболизма ксенобиотика в кишечной стенке, что затрудняет прогноз нагрузки на печень на основании информации о дозе. Примерами таких лекарств служат сальбутамол, верапамил и лидокаин [8]. Препараты попадают в кровь при аппликации на поверхность кожи, местном использовании: нанесении на поверхность кожи, конъюнктивального мешка, роговицы или слизистой оболочки влагалища, прямой кишки, рта или носа. Степень всасывания лекарственного препарата через слизистую прямой кишки, как правило, непредсказуема. Системное воздействие лекарств, которые не вводятся непосредственно в сосудистое русло, в большей степени зависит от васкуляризации ткани, т.е. от места инъекции.
Подкожные и однократные периневральные инъекции в этом отношении эквивалентны. Ингаляционное введение препаратов, например жидких испаряющихся анестетиков и лекарств для лечения дыхательных путей, также может привести к попаданию в кровь липофильных веществ. Нерастворимые в воде вещества, применяемые в форме аэрозольного порошка, такие как кромогликат натрия, слабо абсорбируются, и их системным воздействием можно пренебречь [8]. Скорость системной резорбции из спинномозговой жидкости зависит от степени связывания препарата с белками, которая различна у разных веществ. При эпидуральном введении концентрация локального анестетика в спинномозговой жидкости намного выше, чем в плазме, а при интратекальном введении концентрация в плазме может не достичь предела определения.
Таким образом, эффекты всасывания и распределения могут уменьшить порфириногенность лекарств.
Вопросы подбора лекарственной терапии при ОП актуальны не только в период лечения острого приступа болезни, основной целью которого является профилактика повторных атак на фоне лечения, но и на амбулаторном этапе. По нашим данным, до 40% случаев амбулаторных обращений больных ОП продиктованы появлением вопросов, связанных с лекарственной терапией, таких как: – подбор лекарственных средств для лечения конкурирующих заболеваний и отсроченных осложнений ОП;
- подбор лекарственного обеспечения при беременности;
- подбор безопасных препаратов для проведения анестезии при плановых оперативных вмешательствах.
Таким образом, информация о порфириногенности различных лекарственных препаратов имеет важное значение. И здесь возможны две крайности. С одной стороны, незнание, недооценка или игнорирование порфириногенности препарата при его назначении могут привести к развитию острого приступа порфирии. С другой стороны, отказ от назначения иногда заведомо порфириногенного препарата по жизненным показаниям может нанести больший ущерб больному, чем его применение (например, назначение онкологических препаратов, в ряде случаев антибиотических препаратов и т.д.).
В этих случаях порфириногенные препараты могут назначаться одновременно с аргинатом гема, что позволит уменьшить продукцию токсичных метаболитов порфиринового обмена либо может быть выбран альтернативный путь их введения, что уменьшит их системное действие (ингаляции, инстилляции и др.).
К сожалению, в настоящее время попытки прогнозировать порфириногенность того или иного лекарственного препарата лишь на основании знаний о его метаболизме не всегда успешны. Поэтому создаются списки порфириногенных и безопасных при порфирии препаратов на основании не только участия в их обмене системы цитохрома Р450, но и отдельных клинических сообщений, наблюдений.
Эти списки публикуются в печати [6] (http://www.porphyriafoundation.com/drug-database, http://www.porphyria-europe.com/02-for-healthcare/Abstracts/AbstractList.asp, http://porphyriadrugs.com) в виде баз данных, размещенных в интернете [2, 6].
В ФГБУ Гематологический научный центр Минздрава РФ (ФГБУ ГНЦ МЗ РФ) накоплен один из самых больших клинических опытов лечения и наблюдения за больными ОП. За почти 20-летний период в ФГБУ ГНЦ МЗ РФ наблюдалось 163 больных с этим орфанным заболеванием, отмечено множество случаев провокации ОП различными лекарственными препаратами, и наш перечень порфириногенных препаратов далеко не всегда совпадает со списками, предлагаемыми зарубежными авторами. В ряде случаев до 15% препаратов, которые авторы (http://porphyriadrugs.com/search/?q=cefo, http://porphyriadrugs.com/search/?q=lido) считают безопасными, по нашим данным, провоцируют приступы ОП. Например, такие препараты, как кетонал, лидокаин, цефтриаксон, по данным сайта (http://porphyriadrugs.com) считаются безопасными при ОП, по нашим же данным, как и по данным ряда других авторов [8], эти препараты обладают сильным порфириногенным действием. Поэтому мы разработали собственную интернет-версию реестра опасных и безопасных для больных порфирией лекарственных препаратов, доступную для всех врачей, которая размещена на сайте ФГБУ ГНЦ МЗ РФ (http://www. blood.ru и сайте http://www.critical.ru). За основу создаваемой базы был взят электронный справочный модуль лекарственных препаратов, любезно предоставленный редакцией издания «Видаль». Было проанализировано более четырёх тысяч наименований лекарственных средств, из которых отобраны препараты, использовавшиеся в лечении больных в ФГБУ ГНЦ МЗ РФ. Все препараты в зависимости от их порфириногенности выделены разными цветами.
Красным цветом выделены лекарственным средства с высокой порфириногенностью, зеленым – безопасные препараты. Желтым цветом окрашены названия лекарств, порфириногенность которых до конца не выяснена. Их приема лучше избегать при наличии безопасного аналога. В базе данных возможен поиск, как по патентованным названиям лекарственных средств, так и по международным неторговым наименованиям (рис. 2).
При назначении того или иного препарата необходимо учитывать, что по витальным показаниям заведомо порфириногенные препараты могут быть назначены одновременно с аргинатом гема. Степень риска гибели от заболевания не должна превышать степень риска развития приступа ОП при использовании порфириногенного средства [6]. В первую очередь это касается терапии шоковых состояний, оказания реанимационного пособия, лечения онкологических заболеваний.
Порфириногенные препараты могут использоваться локально (аппликации, орошения, ингаляции). Поскольку многие инфекционные процессы имеют локальный характер, допустимо успешное использование, в том числе порфириногенных противомикробных средств.
Вакцины, сыворотки, моноклональные антитела считаются непорфириногенными, однако возникающие при их введении иммунологические реакции организма могут спровоцировать приступ ОП.
Предлагаемый реестр порфириногенных лекарственных препаратов носит рекомендательный характер. Принять окончательное решение о назначении того или иного препарата, проанализировав течение заболевания, может только лечащий врач. По мере появления дополнительной информации планируется обновлять реестр, вносить в него дополнения.
ЛИТЕРАТУРА- Kappas A., Sassa S., Galbraith R., Nordmann Y. The porphyrias. In: Scriverer C.R., Beaudet A.L., Sly W.S., Valle D., eds. Metabolic basis of inherited disease. 7th ed. New York: McGrawHill; 1995: 2103–59. 2Moore M.R., McColl K.E.L., Rimington C., Goldberg A.
- Disorders of porphyrin metabolism. New York: Plenum Co; 1987: 144–54.
- Карпова И.В., Пустовойт Я.С., Пивник А.В. Порфириновый обмен у больных острой перемежающейся порфирией на разных стадиях течения заболевания. Гематология и трансфузиология. 2004; 2: 21–6. [Karpova I.V., Pustovoit Ya.S., Pivnik A.V. Porphyrin metabolism in patients with acute intermittent porphyria at different stages of the disease. Gematologiya i transfuziologiya. 2004; 2: 21–6]. (in Russian)
- With T.K. A short history of porphyrins and the porphyrias. Int. J. Biochem. 1980; 11: 189–200.
- Пустовойт Я.С., Пивник А.В., Карпова И.В. Клинические проявления и диагностика острых порфирий. Терапевтический архив. 1999; 7: 76–80. [Pustovoit Ya.S., Pivnik A.V., Karpova I.V. Clinical manifestation and diagnosis of acute pophiria. Terapevticheskiy arkhiv. 1999; 7: 76–80]. (in Russian)
- Wetterberg L. Report on an international survey of safe and unsafe drugs in acute intermittent porphyria. In: Porphyrins in Human Diseases – Reports of the Discussions. Doss M., Nawrocki P., eds. S. Karger; 1976: 191–202.
- Bygum A., Christiansen L., Petrsen N.E., Horder M., Thomsen K., Brandrup F. Familial and sporadic porphyria cutanea tarda: clinical, biochemical and genetic features with emphasis on iron status. Acta Derm. Venerol. 2003; 83(2): 115–20.
- Thunell S., Pomp E., Brun A. Guide to drug porphyrogenicity prediction and drug prescription in the acute porphyrias. Br. J.
Clin. Pharmacol. 2007; 64(5): 668–79. - Singal A.K., Parker C., Bowden C., Thapar M., Liu L., McGuire1 B.M. Liver transplantation in the management of porphyria.
Hepatology. 2014; 60(3): 1082–9. doi: 10.1002/hep.27086. - Stein J.A., Tschudy D.P. Acute intermittent porphyria. A clinical and biochemical study of 46 patients. Medicine (Baltimore).
1970; 49(1): 1–16.
Гематология и трансфузиология. 2015