Фармакоэпидемиологический анализ лечения пациентов с хирургическим сепсисом в ОРИТ. Результаты многоцентрового исследования.
В.А.Руднов (1) , С.Н.Ложкин (1), Ф.С.Галеев (2), И.Б.Заболотских (3), Е.М.Кон (6), М.И.Неймарк (4), М.И.Челюк (5), В.В.Голубцов (3), В.А.Мартыненко (4), А.Ю.Елизарьев (4), А.И.Меркулов (4), А.В.Николенко (6), Ю.А.Антонов (5), Ю.М.Федотова (5), И.В.Кикомбан (5) , Ю.С.Калашникова (1)
(1) Уральская государственная медицинская академия, г.Екатеринбург
(2) Башкирский государственный медицинский университет, г.Уфа
(3) Кубанская медицинская академия, г.Краснодар
(4) Алтайский государственный медицинский университет,г.Барнаул
(5) Тюменская государственная медицинская академия, г.Тюмень
(6)Пермская государственная медицинская академия г.Пермь
Статья опубликована в сборнике материалов конгресса
анестезиологов-реаниматологов Центрального федерального округа
Ретроспективно изучены подходы к фармакотерапии тяжелого сепсиса и септического шока в 7 стационарах 6 городов России. В исследование включены 288 пациентов в возрасте от 16 до 75 лет. Преобладали больные с абдоминальным сепсисом (63,9%). Наиболее часто назначаемыми группами лекарственных средств (ЛС) были антибиотики для системного применения (100%), нефракционированный гепарин (63,9%), глюкокортикоиды (35,1%), ингибиторы протеаз (26,8%). Искусственные коллоидные растворы (96% составляли декстраны) включались в схему лечения у 57,9% пациентов, свежезамороженная плазма - у 45,2%, альбумин - у 24,3%.
Среди антибактериальных препаратов (АБП) чаще применялись аминогликозиды (28,2%), пенициллины (24,7%) и цефалоспорины I поколения (9,7%). Комбинации АБП использовались в 96% случаев. Выбор стартовой схемы антимикробной терапии и число используемых ЛС в центрах существенно отличались. Смена первоначальной схемы терапии и повторные ее курсы проведены у 63,9% пациентов.
Установлены значительные отличия между реальной практикой фармакотерапии сепсиса в ОРИТ и отечественными и международными рекомендациями: неоптимальный выбор стартовой схемы антимикробной терапии и режима дозирования АБП, широкое использование ЛС с недоказанной клинической эффективностью.
Ключевые слова: фармакоэпидемиология, сепсис, ОРИТ, антибиотикотерапия.
Контактный адрес: Владимир Александрович Руднов. Эл. почта: rudnov@newhospital.ru
Клиническая микробиология и антимикробная химиотерапия, 2003 № 2, том 5.
Treatment of Sepsis in Intensive Care Units - Pharmacoepidemiological Study
V.A. Rudnov (1), S.N. Lozhkin (1), F.S. Galeev (2), I.B. Zabolotskih (3), E.M. Kon (6), M.I. Neymark (4), M.I. Tchelvuk (5), V.V. Golubtzov (3), V.A. Martynenko (4), A.Yu. Elisariev (4), A.I. Merkulov (4), A.V. Nikolenko (6), Yu.A. Antonov (5), Yu.M. Fedotova (5), I.V. Kikomban (5), Yu.S. Kalashnikova (1), V.I. Smytchkov (3)
(1) Ural State Medical Academy, Ekaterinburg, Russia
(2) Bashkortostan State Medical University, Ufa, Russia
(3) Kuban Medical State Academy, Krasnodar, Russia
(4) Altai State Medical University, Barnaul, Russia
(5) Tyumen State Medical Academy, Tyumen, Russia
(6) Perm State Medical Academy, Russia
This paper presents retrospective analysis of currently existing approaches to the medical treatment of severe sepsis and septic shock in patients from 7 hospitals' in 6 Russian cities. Two hundreds and eighty eight patients aged 16 to 75 years were included in this study. The most common diagnosis was sepsis associated with intra-abdominal infections (63,9%). Systemic antimicrobials (100%), unfractionated heparin (63,9%), corticosteroids (35,1 %), protease inhibitors (26,8%) were the most frequently administered medications. Artificial colloidal solutions, primarily a dextrans (96% of cases), fresh frozen plasma and albumin were added to treatment regimens in 57,9%, 45,2% and 24,3% of patients, respectively.
The most commonly administered antimicrobials were aminoglycosides (28,2%), penicillins (24,7%) and first-generation cephalosporins (9,7%). Combination regimens were used in 90% of patients. Choice of empiric antimicrobials and a number of used medications varied in different hospitals. Change of empiric regimens and multiple courses of antimicrobial therapy were experienced in 63,9% of cases.
There have shown to be great differences between the currently existing practice of medical treatment of sepsis in Russian ICUs and national and international guidelines. These include inadequate initial antimicrobial therapy and dosing regimens as well as unjustified use of medications with unproven clinical efficacy.
Key words: pharmacoepidemiology, sepsis, ICU, antimicrobial treatment.
Введение
Сепсис с органной дисфункцией и септический шок являются общепринятыми показаниями к госпитализации в отделение реанимации и интенсивной терапии (ОРИТ). Данная тактика обусловлена высоким риском летального исхода и необходимостью органно-системной поддержки и мониторинга ряда параметров гомеостаза [1-5].
Длительность пребывания пациента с сепсисом и полиорганной недостаточностью (ПОН) в ОРИТ по меньшей мере в 3 раза превышает средний показатель для всех категорий больных, госпитализированных в данное отделение [3, 5]. В этих условиях выбор оптимальной фармакотерапии представляется крайне важным не только с точки зрения улучшения конечных результатов лечения, но и с точки зрения экономических расходов. Последнее обстоятельство особо значимо для отечественного здравоохранения в связи с сохраняющимся остаточным принципом финансирования лечебно-профилактических учреждений (ЛПУ) и преобладанием расходов на медикаменты в общей структуре материальных затрат в ОРИТ [6].
Уточнение механизмов патогенеза сепсиса и формирование идеологии медицины, основанной на доказательствах, привели к пересмотру ряда традиционных подходов к лечению сепсиса. В частности, появились рекомендации таких авторитетных международных организаций, как Европейское общество интенсивной терапии и Европейское общество медицины критических состояний [7].
Между тем в России до последнего времени не проводились фармакоэпидемиологические исследования, которые давали бы реальные преставления о том, какова ситуация с лекарственной терапией сепсиса и насколько повседневная врачебная практика соответствует современным рекомендациям.
Цель исследования
Цель настоящего исследования - получение объективных данных о применении лекарственных средств (ЛС) при лечении сепсиса в ОРИТ в различных регионах России и оценка рационального их использования с точки зрения современных рекомендаций.
Таблица 1. Распределение пациентов в зависимости от
локализации первичного очага инфекции
|
Локализация |
Число пациентов |
|
|
абс. |
% |
|
|
Брюшная полость |
185 |
64,2 |
|
Кожа и мягкие ткани |
41 |
14,2 |
|
Легкие |
29 |
10,1 |
|
Костная система |
14 |
4,9 |
|
Матка |
13 |
4,5 |
|
Другая |
6 |
2,1 |
Материал и методы исследования
В исследовании участвовали 7 стационаров Екатеринбурга, Барнаула, Уфы (2 центра), Тюмени, Перми и Краснодара. В анализ включены пациенты, соответствовавшие критериям «тяжелый сепсис» и «септический шок» согласно классификации R . Bone и соавт. (1992) [8] и лечившиеся в ОРИТ многопрофильных ЛПУ в 2000-2001 гг.
В каждом центре отмечали ретроспективно в специально разработанных регистрационных картах локализацию первичного очага, структуру органной дисфункции, режим дозирования, путь и длительность введения ЛС. Анализировали соответствие избранной схемы АБТ локализации очага инфекции, дозы и кратность введения.
Из других ЛС оценивали назначение иммуноглобулинов, гепарина, ингибиторов протеаз, глюкокортикоидов, препаратов и компонентов крови, искусственных коллоидов. Частоту назначения анальгетиков, нейролептиков, антигистаминных препаратов и миорелаксантов не учитывали.
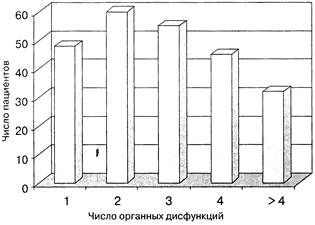
Распределение больных с сепсисом и шоком в зависимости от числа органных дисфункций
Из немедикаментозных манипуляций фиксировали искусственную респираторную поддержку, методы экстракорпоральной детоксикации (плазмаферез, гемосорбция, гемофильтрация, ксеноспленоперфузия), ультрафиолетовое облучение (УФО) и внутрисосудистое лазерное облучение крови. Выживаемость больных в зависимости от терапии не оценивали.
Полученные данные обработаны с помощью специальной компьютерной программы (С. Н. Ложкин). Статистический анализ проводили путем вычисления стандартного набора показателей, используемых в описательной статистике, с помощью компьютерной программы Excel для Windows 98.
Результаты использования ЛС сопоставляли с рекомендациями Европейского общества медицины критических состояний [7], отечественных экспертов по антимикробной терапии [9], результатами контролируемых исследований, включенными в электронные базы данных (Cochrane Database of Systematic Reviews, Medline; Embase).
Результаты исследования
В анализ включены 288 пациентов (46 ± 4 регистрационные карты из каждого центра) в возрасте от 16 до 75 лет, в том числе 48,9% женщин и 51,1% мужчин. Из них с тяжелым сепсисом было 213 пациентов (73,9%), с септическим шоком - 75 (26,1%). В 55 (19,1%) случаях сепсис классифицирован как нозокомиальный. Распределение пациентов по локализации первичного очага представлено в табл. 1.
На тяжесть состояния больных и степень риска развития неблагоприятного исхода указывало число органно-системных дисфункций, развившихся в результате прогрессирования системного воспалительного ответа (СВО), отражавших спектр функциональных нарушений и формировавших синдром ПОН.
Распределение количества пациентов по числу органных дисфункций отображено на рисунке. Среднее число дисфункций в расчете на одного пациента по всем центрам составило 2,8 ± 0,1 (1-6), что соответствовало прогнозируемой летальности 50-65% [3]. В структуре синдрома ПОН доминировала острая дыхательная недостаточность, наблюдавшаяся у 229 (79,5%) больных, тяжесть которой у 183 (63,5%) пациентов потребовала искусственной респираторной поддержки. Частота развития отдельных патологических синдромов представлена в табл. 2.
Таблица 2. Структура синдрома полиорганной недостаточности
у пациентов с тяжелым сепсисом
| Патологический синдром |
Частота развития, абс. число (%) |
| Острая дыхательная недостаточность |
229 (79,5) |
| Энцефалопатия |
135 (46,9) |
| Острая дисфункция: печеночная почечная |
106 (36,8) 106 (36,8) |
| Коагулопатия потребления |
96 (33,3) |
Таблица 3. Частота назначения некоторых групп
лекарственных средств и препаратов крови, %
| Группа препаратов |
Частота |
| Системные антибиотики |
100,0 |
| Нефракционированный гепарин |
63,9 |
| Искусственные коллоиды (декстраны, желатиноль, гидроксиэтилкрахмал) |
57,9 |
| Свежезамороженная плазма |
45,2 |
| Глюкокортикоиды |
35,1 |
| Ингибиторы протеаз |
26,8 |
| Альбумин |
24,3 |
| Рибоксин |
20,1 |
| Гемодез |
18,8 |
| Иммуноглобулин G |
18,4 |
| Пентоксифиллин |
17,6 |
| Пирацетам |
14,1 |
| Эссенциале |
10,6 |
| Актовегин |
7,0 |
| Эритроцитарная масса |
5,0 |
| Препараты вилочковой железы |
4,9 |
| Даларгин |
4,2 |
| Кокарбоксилаза |
4,2 |
Для лечения сепсиса и септического шока использовали ЛС 34 фармакологических групп. В схему терапии сепсиса и септического шока помимо АБП наиболее часто включали: гепарин - у 63,9% больных, глюкокортикоиды - у 35,1%, ингибиторы протеаз - у 26,8% (табл. 3). Из препаратов крови применяли свежезамороженную плазму (45,2%) и альбумин (24,3%).
Результаты анализа структуры ЛС, использованных для терапии тяжелого сепсиса, указывают на определенные локальные особенности и приоритеты их выбора. Так, в Барнауле все пациенты получали гепарин и инфузии свежезамороженной плазмы, а 57,4% - ингибиторы протеаз (апротинин, ингитрил).
В Краснодаре применяли наибольшее количество адъювантных ЛС: рибоксин - у 15 (34,9%) больных, даларгин - у 12 (28,6%), галидор - у 8 (18,6%), пирацетам - у 9 (21,0%), азатиоприн - у 5 (11,6%), тимоген - у 5 (11,6%), цитохром с - у 3 (7%), актовегин - у 2 (4,6%), сульфокамфокаин - у 2 (4,6%).
В Уфе наиболее активно в схему терапии включали иммуноглобулин. Его получали 35 пациентов, что составило 74,5% от числа всех его назначений в центрах, включенных в исследование. Высокой была частота назначения и некоторых других ЛС: эссенциале - у 24,4% пациентов, пирацетам - у 15,6%, актовегин - у 15,6%, рибоксин - у 37,8%.
Во время пребывания в ОРИТ пациентам с сепсисом сделано 872 назначения 26 различных антибактериальных препаратов (АБП). Наименьшее число антибиотиков использовалось в Перми - 12 наименований. В среднем каждый больной получал 3,2 ± 0,7 АБП. Самыми часто применяемыми антибиотиками оказались: аминогликозиды - 28,2% от числа всех назначений, пенициллины - 24,7% и цефалоспорины - 21,2% (табл. 4).
Кроме того, в схему терапии включали: линкосамиды (линкомицин) - 40 (4,6%) случаев, макролиды - 18 (2,1%), диоксидин - 5 (0,6%), ко-тримоксазол - 2 (0,2%).
В связи с тем, что выбор схемы антибактериальной терапии (АБТ) во многом определяется локализацией первичного очага инфекции, для вынесения последующих заключений об адекватности назначений приводим данные анализа применения антибиотиков в зависимости от клинической формы сепсиса. Однако в силу неравномерного распределения пациентов анализ касался следующих локализаций: брюшной полости, кожи и мягких тканей.
Таблица 4. Общая частота назначения антибактериальных
препаратов при сепсисе и септическом шоке, абс. число (%)
| Группа препаратов | Частота |
|
Пенициллины
Цефалоспорины
Карбапенемы
Аминогликозиды
Фторхинолоны
Нитронидазолы (метронидазол) Линкосамиды (линкомицин) Макролиды (эритромицин) Диоксидин Ко-тримоксазол |
215 (24,7)
49 (5,6) 58 (6,7) 54 (6,2) 48 (5,5) 6 (0,7) 185 (21,2) 85 (9,7) 9 (1,0) 58 (6,7) 9 (1,0) 9 (1,0) 12 (1,4) 3 (0,3) 15 (1,7) 11 (1,3) 4 (0,4) 246 (28,2) 205 (23,5) 23 (2,6) 12 (1,4) 4 (0,5) 2 (0,2) 40 (4,6) 23 (2,6) 17 (1,9) 106 (12,2) 40 (4,6) 18 (2,1) 5 (0,6) 2 (0,2) |
Сепсис, связанный с интраабдоминальными инфекциями
Комбинированную АБТ использовали у 95,1% пациентов с абдоминальным сепсисом (табл. 5).
Выбор АБП в отдельных центрах существенно различался. В Тюмени и Перми чаще назначали полусинтетические пенициллины (27,5 и 28,2% соответственно) или бензилпенициллин (22,2 и 41% соответственно), а в Уфе - оксациллин (27,9%) или комбинацию его с ампициллином (22,9%) и цефазолин (19,7%). Только в Екатеринбурге применяли для стартовой терапии цефалоспорины II поколения - цефуроксим у 8 (33,2%) пациентов.
Зарегистрированы единичные случаи назначения ципрофлоксацина - 1 (0,5%), пефлоксацина - 1 (0,5%), амоксициллина/клавуланата - 1 (0,5%), линкомицина - 8 (4,3%), амикацина - 2 (1,1%), стрептомицина -2 (1,1%), канамицина - 6 (3,2%).
В целом во всех центрах чаще всего (47,1%) назначали комбинацию полусинтетических пенициллинов (ампициллин, оксациллин, ампиокс) или бензилпенициллина с гентамицином. Комбинацию цефалоспорин III поколения + метронидазол + аминогликозид применяли у 38 (20,7%) больных.
Частота использования аминогликозидов и метронидазола в схемах АБТ абдоминального сепсиса также не была однородной и варьировала в различных городах от 30 до 100% и от 5,6 до 81,8% соответственно. В Перми в качестве препарата с антианаэробным эффектом часто назначали линкомицин (25,6%).
Смена стартового режима и проведение нескольких курсов АБТ (от 2 до 5) осуществлены у 63,9% больных (от 54,1 до 90% в различных центрах). Чаще корректировали терапию в Краснодаре (90%) и Барнауле (72,7%).
В качестве препаратов второй линии чаще применяли: цефазолин - у 32,0% пациентов, цефалоспорины III поколения - у 26,9%, ципрофлоксацин - у 28,2%, карбапенемы - у 7,7%. В единичных случаях препаратами альтернативной терапии были линкомицин, цефепим или амоксициллин/клавуланат. Аминогликозиды, как правило, не отменяли.
Сепсис, связанный с инфекциями кожи, мягких тканей, костей и суставов
Комбинированную АБТ назначали 100% пациентам. В связи с тем, что инфекция, первично локализованная в костях, как правило, сопровождалась вовлечением в процесс мягких тканей, обе эти локализации при анализе выбора АБП были объединены. Из антибиотиков, использованных для стартовой терапии, преобладали: аминогликозиды - 83,3%, метронидазол - 46,3%, полусинтетические пенициллины - 37,0%. Среди последних 75% назначений приходилось на оксациллин. Цефалоспорины III поколения применяли у 13% пациентов, цефазолин - у 11,1%, фторхинолоны - у 7,4%.
Таблица 5. Частота применения антибиотиков при стартовой терапии
абдоминального сепсиса в различных центрах, %
|
Препараты |
Тюмень, |
Барнаул, |
Краснодар, |
Уфа, |
Екатеринбург, |
Пермь, |
|
Бензилпенициллин |
22,2 |
- |
- |
3,3 |
- |
41,0 |
|
Ампициллин |
5,5 |
27,3 |
5,0 |
9,5 |
20,8 |
25,6 |
|
Оксациллин |
11,0 |
- |
- |
27,9 |
- |
2,6 |
|
Ампициллин / оксациллин |
11,0 |
- |
10,0 |
22,9 |
- |
- |
|
Цефазолин |
- |
13,6 |
10,0 |
19,7 |
8,3 |
28,2 |
|
Цефуроксим |
- |
- |
- |
- |
33,2 |
- |
|
Цефотаксим |
16,7 |
45,5 |
20,0 |
4,9 |
16,6 |
2,6 |
|
Цефтриаксон |
5,5 |
- |
- |
1,6 |
16,6 |
- |
|
Цефоперазон |
- |
- |
20,0 |
1,6 |
- |
- |
|
Цефтазидим |
- |
- |
10,0 |
- |
- |
- |
|
Гентамицин |
94,4 |
100,0 |
30,0 |
100,0 |
100,0 |
93,8 |
|
Метронидазол |
5,5 |
81,8 |
60,0 |
49,2 |
72,0 |
20,5 |
|
Прочие |
18,1 |
15,6 |
25,0 |
8,6 |
4,5 |
12,8 |
Таким образом, наиболее часто стартовая схема АБТ предусматривала комбинацию оксациллин + гентамицин + метронидазол, составившую в структуре назначений 27,7%.
Для коррекции терапии и при повторных курсах АБТ использовали преимущественно линкомицин (29,6%), цефотаксим (24,1%) и фторхинолоны (22,2%). Карбапенемами (имипенемом) лечили 5 пациентов, ванкомицином - 2, рифампицином - 1.
Пути введения антибиотиков
Из 872 назначений АБП наряду с внутривенным введением в 128 (14,7%) случаях препараты вводили внутримышечно, у 6 (0,7%) пациентов - перорально, у 3 (0,3%) - местно.
Внутримышечно чаще всего использовали аминогликозиды (52,8%) и полусинтетические пенициллины (22,4%). Перорально назначали такие препараты, как нистатин и эритромицин (3 и 1 пациент соответственно). Местно (в брюшную или плевральную полость) применяли канамицин, цефтазидим и метронидазол (по 1 пациенту).
Режим дозирования антибиотиков
Полусинтетические пенициллины более чем у 90% пациентов назначали в разовой дозе 1 г, которую вводили 4-6 раз в сутки. Цефазолин, цефотаксим и цефтазидим применяли в дозе по 1 г 3-6 раз в сутки. В Барнауле (в отличие от других центров) разовая доза ампициллина и оксациллина составила 2 г, суточная - 8-12 г; режим дозирования цефотаксима и цефтазидима - 2-3 г 3 раза в сутки.
При назначении гентамицина суточная доза варьировала от 160 до 240 мг, амикацина - от 1 до 1,5 г.
Практически у всех пациентов аминогликозиды вводили 2-3 раза в сутки. Однократно всю суточную дозу вводили в единичных случаях.
Обсуждение результатов исследования
Анализ результатов фармакоэпидемиологического исследования показал, что подходы к выбору АБП при сепсисе и септическом шоке заметно отличаются от российских и международных рекомендаций.
Основными критериями эмпирического выбора АБП при сепсисе являются:
• локализация инфекционного очага;
• активность препарата в отношении потенциальных возбудителей;
• тяжесть состояния и прогнозируемый риск летального исхода;
• способность АБП проникать в места локализации возбудителя;
• минимальная токсичность [7, 9, 10].
Интраабдоминальные инфекции, как и инфекции органов малого таза у женщин, в подавляющем большинстве случаев имеют полимикробную этиологию. В спектре возбудителей инфекций ведущую роль играют энтеробактерии (прежде всего Escherichia coli ) и неспорообразующие анаэробы (чаще Bacteroides fragilis ).
Частота выделения грамположительных бактерий составляет около 30% [9, 10]. В микробиологической структуре абдоминального сепсиса, развивающегося в послеоперационный период, главное значение приобретают нозокомиальные штаммы энтеробактерии, Enterococcus spp ., Pseudomonas aeruginosa . Тяжесть состояния пациентов и высокий риск развития неблагоприятного исхода диктуют необходимость использования максимально надежной в этих условиях АБТ.
Важность максимально раннего назначения адекватных АБП при тяжелых инфекциях убедительно доказана результатами контролируемых исследований [11-15]. Уровень снижения летальности при оптимальной «стартовой программе» АБТ для разных категорий больных составляет 19-25%.
По современным представлениям и рекомендациям, при внебольничном происхождении сепсиса следует отдавать предпочтение следующим схемам:
• цефалоспорины III - IV поколений + метронидазол;
• ципрофлоксацин + метронидазол;
• тикарциллин/клавуланат или пиперациллин/тазобактам ± аминогликозиды II - III поколений;
• клиндамицин + аминогликозиды II-Ш поколений.
При нозокомиальной природе сепсиса приоритеты меняются в пользу цефепима и карбапенемов. С учетом локальных данных могут быть использованы отмеченные ранее ингибиторозащищенные пенициллины и фторхинолоны [9]. Соответствие стартовой АБТ национальным и международным рекомендациям в разных центрах не превышало 50%, а при нозокомиальном сепсисе - 28,6% (в Тюмени - 22,2%, Барнауле - 49,1%, Краснодаре - 50%, Уфе - 8,1%, Екатеринбурге - 33,2%, Перми - 2,6%).
Количество включенных больных с нозокомиальным сепсисом заметно отличалась в разных центрах, поэтому сопоставление адекватности АБТ не проводилось. В некоторых центрах в структуре АБП применяли устаревшие препараты, потерявшие свое клиническое значение, такие как ампиокс.
Еще одной из особенностей АБТ сепсиса явилось полное отсутствие в перечне препаратов ингибиторозащищенных пенициллинов. В этих условиях, а также при крайне редком использовании карбапенемов следует обратить внимание на необоснованно низкую частоту назначения метронидазола (46%), как того требовала этиологическая структура абдоминального сепсиса.
ри сепсисе, развившемся на фоне инфекций кожи, ведущее значение имеют такие возбудители, как Staphylococcus aureus, Streptococcus pyogenes, неспорообразующие анаэробы. Реже, при особых обстоятельствах (тяжелая ишемия тканей, сахарный диабет, нейтропения), возрастает роль грамотрицательных аэробов. При сопоставлении клинических особенностей кожной формы сепсиса у больных, включенных в анализ с назначенными схемами терапии, обнаружилось соответствие рекомендациям в 42% случаев и увеличение этого показателя до 61,5% после изменения лечения со 2-го по 10-й день.
Важная установленная особенность АБТ сепсиса независимо от первичного очага инфекции - широкое использование аминогликозидов, прежде всего гентамицина - от 93 до 100% клинических ситуаций в 5 центрах. В свете современных данных показания к их назначению должны быть ограничены [7].
Во-первых, это связано с отсутствием аргументированных доказательств повышения выживаемости при добавлении аминогликозидов к цефалоспоринам III - IV поколений, ингибиторозащищенным пенициллинам или карбапенемам [7]. Добавление аминогликозидов к полусинтетическим пенициллинам и цефазолину теоретически оправдано, но сами схемы лечения неприемлемы при абдоминальной форме сепсиса или сепсисе, возникшем на фоне метроэндометрита.
Во-вторых, увеличение объема распределения аминогликозидных антибиотиков в связи с высокой сосудистой проницаемостью при сепсисе неизбежно снижает концентрацию препаратов в очаге инфекции и, следовательно, отношение пиковой концентрации препарата или площади под фармакокинетической кривой к минимальной подавляющей концентрации (Сmах /МПК, ПФК/МПК), являющихся основными критериями бактерицидности.
В-третьих, низкая широта терапевтического действия и нестабильность фармакокинетики аминогликозидов требуют терапевтического лекарственного мониторинга, необходимого прежде всего пациентам с тяжелым состоянием. Однако его реализация невозможна в подавляющем большинстве ЛПУ.
В-четвертых, чрезмерное применение гентамицина в ОРИТ и других лечебных подразделениях ЛПУ уже привело к формированию высокорезистентных штаммов бактерий - возбудителей нозокомиальных инфекций.
Таким образом, высокая активность аминогликозидов в отношении внебольничных штаммов энтеробактерий не может служить основанием к их обязательному включению в схему терапии всех пациентов. Использование аминогликозидов (конкретно - амикацина) оправданно для терапии нозокомиального сепсиса, вызванного проблемными грамотрицательными бактериями, и исключительно в качестве дополнительного компонента в общей схеме АБТ.
Применение гентамицина возможно в комбинированной терапии инфекций внебольничного происхождения с нетяжелым течением, когда базовым препаратом являются полусинтетические пенициллины или цефалоспорины I — II поколений у пациентов, не госпитализированных в ОРИТ.
Следует обратить внимание и на тот факт, что у 46,3% пациентов аминогликозиды применяли в течение более 10 сут, а у каждого третьего - 20 сут. В то же время продолжительность курса не должна превышать 10 сут. Единственное исключение сделано для инфекционного эндокардита [16]. Подобной тактики твердо придерживались только в ЛПУ Барнаула и Перми.
Использование внутримышечного пути введения при тяжелом сепсисе и шоке недопустимо в силу разных обстоятельств, главным образом из-за нарушений периферического кровообращения и ограничения всасывания. Особенно трудно рассчитывать на эффект от внутримышечного введения аминогликозидов. На их долю приходилось более 50% назначений.
При отсутствии данных о клиренсе креатинина об адекватности режима дозирования АБП можно судить лишь косвенно. Тем не менее, учитывая низкую частоту гемодиализа (4 пациента) и гемофильтрации (5 пациентов), а также рекомендации по коррекции доз пенициллинов и цефалоспоринов [9, 16], следует признать, что назначение цефотаксима и цефтазидима в дозе 3 г/сут при грамотрицательном сепсисе, оксациллина по 4-6 г/сут и цефазолина по 4 г/сут при стафилококковом сепсисе недостаточно для данных клинических ситуаций и не гарантирует создания необходимой концентрации b-лактамов в крови и тканях, которая должна в 4-5 раз превышать значения минимальной подавляющей концентрации (МПК) в отношении потенциальных возбудителей.
В соответствии с рекомендациями оптимальными являются следующие режимы назначения препаратов [9, 16]:
• цефтазидим и цефотаксим - по 2 г 3 раза в сутки;
• оксациллин - по 2 г 6 раз в сутки;
• цефазолин - по 2 г 3 раза в сутки.
Итак, результаты нашего исследования свидетельствуют о серьезных проблемах в использовании АБП при лечении тяжелого сепсиса и септического шока. Прежде всего это необоснованный выбор антибиотиков и неоптимальные режимы их дозирования.
Безусловно, немаловажное значение в создавшейся ситуации имел многолетний дефицит финансирования здравоохранения. Это обстоятельство негативно сказывалось на работе подразделений, оказывавших неотложную помощь, в первую очередь на деятельность ОРИТ. В то же время нельзя не обратить внимание на использование в некоторых центрах ЛС, эффективность которых не только при сепсисе, но и при других критических состояниях не доказана (цитохром, актовегин, инстенон, ингибиторы протеаз и др.), или на применение свежезамороженной плазмы при отсутствии коагулопатии потребления.
Однако представляется, что финансовые трудности не являются единственной причиной. И в этом убеждают результаты эксперимента, проводимого на территории Свердловской области. Его суть заключается в финансировании реанимационного этапа пребывания больного через систему территориального фонда обязательного медицинского страхования. С ее внедрением в практику применительно к назначению АБП ситуация заметно улучшилась, но следование рекомендациям на всей территории достигло только 50%, хотя в отдельных ОРИТ эта величина была близка к 100%.
Опыт стран, занимающихся стандартизацией лечебного процесса в широкой клинической практике, свидетельствует о том, что ценность формуляров и рекомендаций значительно снижается, если отсутствует информированность врачей на всех уровнях о предлагаемых принципах выбора [17,18]. Очевидно, что существующая система подготовки и повышения квалификации врачей не обеспечивает необходимый базовый уровень знаний вопросов АБТ широкому кругу специалистов в различных регионах России. Полагаем, что полученные данные могут служить еще одним аргументом в пользу необходимости ее совершенствования.
Заключение.
Фармакоэпидемиологический анализ лечения сепсиса в ряде регионов России свидетельствует о необходимости решения серьезных проблем, связанных с назначением АБП для лечения тяжелого сепсиса и септического шока.
Их устранение может быть достигнуто посредством распространения современных знаний о природе сепсиса, критериях тяжести его течения и прогноза и перераспределения финансовых ресурсов в пользу этапа оказания неотложнй помощи, в том числе реанимационного, и ЛС с доказанной эффективностью. Обучение различным аспектам антибактериальной терапии сепсиса должно проводиться с учетом проблем конкретных ЛПУ или отделений.
Для реализации указанных направлений крайне важны административная поддержка и формирование системы аудита.
Список литературы
-
Deitch E.A., Vincent J.-I., Windsor A. Sepsis and multiple organ dysfunction: a multidisciplinary approach. Philadelphia: W.B. Saunders Company;2002.
-
Руднов В.А. Сепсис. Эволюция представлений, необходимость унификации терминологии и критериев диагноза. Хирургия 2000;4:36-40.
-
Руднов В.А. Пути оптимизации диагностики, прогноза и интенсивной терапии сепсиса с органной дисфункцией [автореф. дис]. Екатеринбург; 1995.
-
Гельфанд Б.Р., Гологорский В.А., Бурневич С.З. Абдоминальный сепсис: современный взгляд на нестареющую проблему. Вестн интенсив тер 1997; 1-2:73-9.
-
Лейдерман И.Н. Ранняя диагностика и методы коррекции синдрома гиперметаболизма у больных с полиорганной недостаточностью [автореф. дис]. Екатеринбург; 1998.
-
Воробьев П.А., Авксентьева М.В. Сравнительная фармакоэкономическая оценка применения цефепима
(максипима) и имипенема/циластатина (тиенама). Инфекции и антимикроб тер 2000;2:139-53. -
Bochud P.Y., Glauser M.P., Calandra T. Antibiotics in sepsis. Intensive Care Med 2001; 27(Suppl l):33-48.
-
Bone R.C., Balk R.A., Cerra F.B. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis: the ACCP/SCCM consensus conference committee. Chest 1992; 101:1644-55.
-
Страчунский Л.С, Белоусов Ю.Б., Козлов С.Н. Антибактериальная терапия. Практическое руководство. М.: Фармединфо; 2000.
-
Solomkin J.S., Hemsell D.L., Sweet R., Tally F., Bartlettj. Общее руководство по оценке новых противоинфекционных лекарственных средств для лечения интраабдоминальных инфекций. Европейское руко водство по клинической оценке противоинфекцион- ных лекарственных средств. Пер. с англ. Под ред. Т.В. Beam , D . N . Gilbert , C . M . Kunin . Смоленск: Ами-пресс;1996.с. 63-71.
-
Bryant R.E., Hood A.F., Hood C.E., Koeming M.G. Factors affecting mortality of gram-negative rod bacteremia. Arch Intern Med 1971; 127:120-8.
-
Young L.S., Martin W.J., Meyer R.D., et al. Gram-negative rod bacteremia: microbiologic, immunologic and therapeutic considerations. Ann Intern Med 1977; 86:456-71.
-
Montravers P., Gauzit R., Muller C, et al. Emergence of antibiotic-resistant bacteria in cases of peritonaitis after intraabdominal surgery affects the efficacy of empirical antimicrobial therapy. Clin Infect Dis 1996;23:486-94.
-
Kollef M.H., Sherman G., Ward S., Fraser V.J. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999;115:462-74.
-
Dupont H., Paugam-Burtz C, Muller-Serieys C, et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Arch Surg 2002;137:1341-6.
-
Gilbert D.N., Moellering R.C., Sande M.A., editors. The Sanford guide to antimicrobial therapy. Hyde Park: Antimicrobial Therapy; 2002.
-
Chase S.L, Petersen A.M., Wordell CJ. Therapeuticintercharge program for histamine H2-receptor antagonist. Am J Health Syst Pharm 1998;55:1382-6.
-
Lutters M., Hermann F., Dayer P., Vogt N. Utilisation ds antibiotiques dans un hopital universitaire de geriatrie et formulares des medicaments. Schweiz Med Wochenschr 1998;128:268-71.

