British Journal of Anaesthesia 83 (1): 16–28 (1999)
Preoperative preparation and premedication
C. J. Cote
Department of Pediatric Anesthesiology,
Children s Memorial Hospital and Northwestern University Medical School,
2300 Children’s Plaza, Chicago, IL 60614, USA
Предоперационная подготовка и премедикация
(продолжение)
Специальные педиатрические задачи, связанные с подготовкой к анестезии
Инфекции верхних дыхательных путей
Значительной проблемой для всех анестезиологов является вопрос «как безопасно обезболить ребенка с острой респираторной вирусной (ОРВИ)?».29, 43, 114 Существуют значительные противоречия окружающие анестезию у детей с ОРВИ . Нет никаких сомнений в том, что у детей, больных ОРВИ и подвергнутых общей анестезии, снижен кислородный резерв.56, 131 и более высока частота развития ларингоспазма (впятеро выше; 96/1000 против 17/1000)88, бронхоспазма (10-кратное превышение; 41/1000 против 4/1000)86, десатурации и других неблагоприятных респираторных явлений.15,56,64,86,100 Обычно эти задачи легко решаются при помощи множества доступных препаратов. Бета-агонисты и/или ингаляционные препараты и могут применяться ингаляционно, чтобы купировать бронхоспазм, а сукцинилхолин или другой миорелаксант для коррекции ларингоспазма. Увеличение концентрации кислорода во вдыхаемой смеси применяется для борьбы с десатурацией. Хотя эти неблагоприятные клинические явления вызывают опасения, подавляющее большинство из них не представляют опасности для жизни, если они быстро распознаны и начато их лечение. Наиболее тяжелый броноспазм, который я наблюдал, встретился у ребенка, у которого не было ни очевидных проявлений ОРВИ, ни реактивных заболеваний верхних дыхательных путей в анамнезе.
Очевидно, что перед анестезиологом, готовящим ребенка к анестезии, стоит вопрос о балансе между риском респираторных осложнений и фактом, что многие дети болеют ОРВИ, особенно зимой. Кроме того, уменьшение раздражения слизистой оболочки дыхательных путей может занять 6-8 недель.27 Зимой это ставит педиатрического пациента в уязвимое положение. Несколько исследований продемонстрировали увеличенную частоту респираторных проблем у детей, которые выздоравливали после ОРВИ.15,112 О бщая политика отмены ребенка и возвращения его спустя 2 недели после того, как симптомы простуды прошли, не разрешает полностью проблем, связанных с дыхательными путями. Я подвергаю сомнению утверждение, что каждый ребенок, у которого есть симптомы ОРВИ, должен быть отменен. Моя концепция более либеральна для ребенка, который должен быть подвергнут плановой амбулаторной хирургической операции; то есть для ребенка , который не будет после операции госпитализирован. Ребенок с ОРВИ, госпитализированный после операции , доставляет беспокойство. Я волнуюсь, что он заразит других детей, у которых менее крепкая иммунная система. Именно это, а не ОРВИ, проблема для ребенка, который подвергнут анестезии, в действительности больше проблем возникает для других детей.
Мой подход ребенку с ОРВИ начинается с дифференцирования симптоматики аллергического ринита от ринита при ОРВИ. Если у ребенка есть кашель, но он легко проходит (это кашель без мокроты), то я обычно продолжаюсь. Если у ребенка наличествует гнойный ринит и его состояние быстро ухудшается или если у ребенка есть лихорадка, я обычно его откладываю. Напротив, если ребенок простудился за неделю или две перед плановой операцией, а симптоматика у ребенка прошла или улучшается, то этот ребенок может перенести анестезию без серьезных осложнений. Все дети с хрипами должны быть отменены, пока бронхоспазм не станет контролируемым.
К сожалению, теории, которые применялись при исследовании детей с ОРВИ, были менее чем адекватны. У каждого учреждения и каждого врача есть различные определения ОРВИ. Основываясь на критериях Tait и Knight , почти каждый ребенок с ринитом соответствовал бы критериям умеренного ОРВИ.113 Каждый всегда сталкивается с дилеммой, решая эту задачу. Клиническое суждение кажется столь же важным, как и любая изданная литература, при условии, что всегда есть полное осознание хирургом и семьей опасности развития респираторных проблем у детей с подобными симптомами.
Реактивные заболевания дыхательных путей
Количество детей с реактивными заболеваниями дыхательных путей быстро увеличивается в Северной Америке.79 Дети с подобным анамнезом могут часто подвергаться экстренным или плановым оперативным вмешательствам. Обычно я прошу, чтобы родители продолжали применять обычные бронходилятаторы, включая утро в день операции . Если ребенок лечился с помощью ингалятора, приемлемо, чтобы применить ингаляционную дозу перед индукцией анестезии так, чтобы достигнуть максимального эффекта лечения был на месте во время манипуляции на дыхательных путях.132 Однако, даже при профилактическом назначении бронхолитиков, возможно развитии бронхоспазма в ответ на введение эндотрахеальной интубационной трубки. Необходимо всегда балансировать между потребностью в интубации трахеи у таких пациентов и повышенным риском бронхоспазма. Есть данные, полученные на взрослых, предполагающие, что пропофол имеет преимущество перед тиопенталом в этой группе больных.93 Важно иметь в наличии в операционной средство бета-агонист, эффективный при введении через интубационную трубку.
Лучшее способ лечения этих детей состоит в том, чтобы контролировать состояние дыхательных путей совместно с аллергологом пациента. Часто, несколько дней пероральной терапии кортикостероидами оптимизируют астму. Такая терапия в нашем учреждении проводилась только у трех из 437 пациентов, требующих лечения интраоперационного бронхоспазма, который легко купировали ингаляцией бета-2 агонистов.132
Серповидноклеточные заболевания/признаки
Эта группа больных требует специального внимания. Очень важна консультация с детским гематологом, знакомым с лечением этой проблемы.1,14,39,42,57,105,118,119,121 Гомозиготы, особенно нуждающиеся в больших операциях, требуют, чтобы дооперационными трансфузиями концентрацию гемоглобина довели до 10 или более г дл-1.119 изучений Мультицентровое исследование показало сходную частоту развития осложнений у тех, кому трансфузия проводилась до концентрации гемоглобина 10 г дл-1 по сравнению с теми, кто был подвергнут «гипертрансфузии» или с теми, кому проводилось обменное переливание.1 Детей с серповидноклеточными признаками не требуют специального лечения, кроме обычных замечаний об избегании гипоксии и гипотензии, и поддержке их хорошо гидратированными. Однако, дети с серповидноклеточной патологией могут быть особенно уязвимыми для эффектов гипоксемии, при пропущеном диагнозе, поскольку как концентрация гемоглобина, обычно, близка к нормальной.82,98
Недоношенные дети
К следующей группе, требующей особого внимания до операции, относятся недоношенные дети. Несколько исследований показали, что дети различного срока после родов подвергаются риску послеоперационного апноэ.59,60,68,123,126-129 Проблемным в этих исследованиях является ограниченность количества пациентов , поэтому достоверность научных заключений должна быть подвергнута сомнению.
Я получил первоначальные базы данных от каждого из исследователей, которые выполнили проспективные исследования . Изучались данные восьми исследований , выполненные в четырех учреждениях за 6 – летний период.59,60,74,123,126-129 Я сосредоточился на детях, перенесших одну операцию - ушивание паховых грыжевых ворот под общей анестезией без любого другого лечения, такого как назначение кофеина или использование регионарной анестезии.19 Использовалось единое определение апноэ (s =15 с или <15 с, но сопровождаемое брадикардией). Брадикардия определялась как 80 ударов в минуту или менее. Совокупность восьми исследований включала 255 пациентов. Мы нашли, что первоначальный прогноз Kurth с соавторами был приемлемо точным отражением всей базы данных.60 Убедительным в этом анализе, было то, что в двух учреждениях, выполнявших фиксацию апноэ постоянно регистрирующими устройствами по Welborn и Kurth,59,60,126-129 частота апноэ фактически отличалась от двух учреждений, которые не использовали такого мониторинга по Warner и Malviya,74,123 там использовалась импедансная пневмография (рис. 4).19 Частота апноэ была выше в тех госпиталях, где использовался постоянный мониторинг.
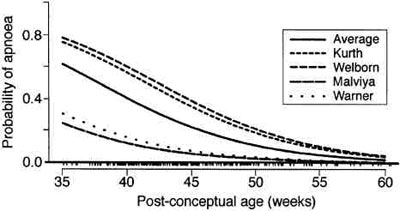 |
| Рис. 4 Прогонозируемая вероятность апноэ в палате постнаркозного пробуждения и послеоперационной палате отделения в зависимости от срока после рождения у всех пациентов в каждом исследовании. На оси ординат указано количество случаев относительно возраста. Заметьте, что кривые в двух учреждениях почти идентичны в верхней амплитуде и в двух других учреждениях в нижней амплитуде; между учреждениями была значительная вариабельность. Причины этого неясны, но могут быть вызваны разницей в технике мониторинга и группах пациентов, поскольку исследования с самой высокой частотой случаев апноэ встречались там, где использовались непрерывные устройства для постоянной регистрации. (Воспроизведено с разрешения ем Cote? с соавторами19) |
Анализ популяции в целом показал, что риск апноэ был обратно пропорционален и сроку гестации и сроку после родов . Например, если наблюдаются два младенца, один из которых родился в 28 недель и другой в 34 недели, и у обоих срок после родов 50 недель во время операции; то ребенок, родившийся в 28 недель, подвергается большему риску апноэ, чем ребенок, родившийся в 34 недели (рис. 5).19
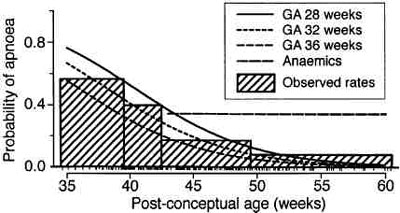 |
| Рис. 5 Предсказанная вероятность апноэ у всех пациентов в зависимости от возраста и срока доношенности; пациенты с анемией показаны как горизонтальная пунктирная линия. На оси ординат указано количество случаев относительно возраста. Заметьте, что риск остановки дыхания уменьшается у детей с большим сроком доношенности. Заштрихованные квадраты атененные коробки представляют общую частоту случаев апноэ у детей в пределах этой амплитуды сроков доношенности. Заметьте, что вероятность остановки дыхания была той самой независимо от возраста и срока доношенности у детей с анемией (горизонтальная пунктирная линия). (Воспроизведено с разрешения ем Cote? с соавторами19) |
Точно так же, если наблюдаются два младенца родившиеся в 28 недель, и у одного срок после родов составляет 45 недель, а у другого 55 недель во время операции; то ребенок постконцептуального возраста 45 недель подвергается большему риску послеоперационного апноэ. Были исследованы восемь отдельных факторов риска, включая некротический энтероколит, легочную дисплазию, респираторный дистресс-синдром, использование опиоидов или миорелаксантов, вес при рождении, продолжающиеся случаи апноэ дома, апноэ при рождении в анамнез, анемию (гематокрит <30 %) и срок гестации относительно срока после родов . Единственным независимым фактором риска (кроме срока гестации и постконцептуального возраста ) была анемии, что подтверждает первоначальное наблюдение Welborn с соавторами (рис.5). 19,128 У д венадцати из 35 наблюдавшихся младенцев с анемией были эпизоды апноэ . Этот риск не изменялся при увеличении или уменьшении срока доношенности и срока после родов у детей старше 45 недель. Весь контингент, включая детей с анемией и с очевидным апноэ, был выписан, оставлено только 77 пациентов. У одного из этих 77 был эпизод апноэ после перевода из послеоперационной палаты, несмотря на отсутствие эпизодов апноэ в палате или анемии.
Мы пришли к выводу, что существует значительная вариабельность между учреждениями в частоте развития апноэ, а также вариабельность в пределах учреждений. Склонность к апноэ снижается до менее, чем 5%-ой статистической вероятности приблизительно к 48 неделе после родов, если дети с очевидными эпизодами апноэ в палате послеоперационного наблюдения и дети с анемией выписываются. Однако, нельзя иметь 95%-ую статистическую достоверность, что эта оценка точки апноэ составит менее 1 %, пока недоношенные дети не достигнут 56 недель постконцептуального возраста (рис. 6).19
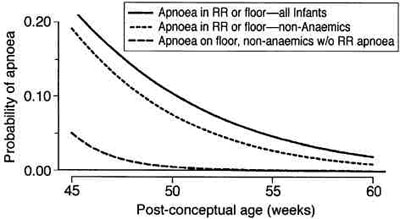 |
| Рис. 6 Прогонозируемая вероятность апноэ в палате постнаркозного пробуждения в зависимости от возраста у детей, у которых не было апноэ в палате постнаркозного пробуждения или анемии (модель 3). На оси абсцисс указан постконцептуальный возраст. Заметьте, что риск остановки дыхания уменьшается у детей с большим сроком доношенности. Заметьте, что риск не уменьшается ниже 1 % при 95%-ой достоверности до возраста 56 недель после родов. (Воспроизведено с разрешения ем Cote? с соавторами19) |
Поэтому, кажется приемлемым госпитализировать всех недоношенных младенцев с очевидными эпизодами апноэ, младенцев с анемией и детей младше 56 недель. Об этом нужно сообщить семье и страховщику перед плановой операцией. Дети должны мониторироваться пульсоксиметрами и мониторами апноэ, поскольку стандартная импедансная пневмография может пропустить серьезные эпизоды десатурации.70,94
Частота эпизодов апноэ может быть снижена путем применения любых препаратов, использующихся для лечения апноэ. Это является важной частью подготовки детей к операции (например гарантия продолжения получения перорального кофеина или пероральных препаратов теофиллина). Если ребенок получает теофиллин или кофеин дома, это должно быть продолжено до- и во время операции. Другой возможный метод подготовки этих детей состоит в применении цитрата кофеина 10 мг кг-1 в/в во время операции, чтобы снизить частоту развития послеоперационного апноэ.127 Однако, это не должно применяться как средство для выписки домой этих детей без дальнейшего контроля. Кинетика кофеина так заметно различается у недоношенных детей старшего возраста, что неизвестно, как долго длится фармакодинамический эффект снижения частоты апноэ.24,92,95
Один из аспектов в дальнейшей подготовке таких детей к операции состоит в планировании и получении согласие для использования регионарной анестезии. Несколько исследований продемонстрировали, что частота апноэ у недоношенных детей может быть снижена при использовании с регионарной анестезией без дополнения седативных препаратов.19,58,104,125 Однако, при добавлении седативных препаратов (мидазолама или кетамина) частота развития апноэ увеличивается. 109,129 В особенности кетамин заметно увеличивают склонность к апноэ.129 Поэтому, может быть полезно обсудить с родителями преимущества регионарной анестезии у этих детей, предупредив их, что ребенок будет госпитализирован и мониторирован, потому что у детей, которых произошла неполная регионарная анестезия, согласно сообщениям развивалось апноэ после операции.20,47,97,124
Полный желудок
Еще одной проблемой, доставляющей беспокойство, является вопрос, как вести ребенка с полным желудком. Нужно определить, является ли операция неотложной или срочной. Если это срочная операция (возможна задержка на 1 или 2 часа без медицинского риска для пациента), то есть время для назначения прокинетиков, таких, как метоклопромид 15 мг кг–1 2,87 и гистамин-2 блокирующих препаратов, таких, как циметидин или ранитидин; что позволяет снизить остаточный объем желудка и повысить pH желудочного содержимого.37 Этих пациентов нужно вести, как пациентов «с полным желудком», но потенциальный риск может быть снижен. Если бы ребенок нуждается в неотложной или срочной операции , ему необходимо проводить такую же быструю последовательную индукцию, как и оторая взрослому. Она включает в себя премедикацию атропином 0.02 мг кг–1, назначение кислорода; 4-6 мг кг–1 тиопентала, 2-3 мг кг–1 пропофола или 2 мг кг–1 кетамина для индукции, в сопровождении 2.0 мг кг–1 сукцинил холина.40,84,108,130 Можно предложить 1.2 мг кг–1 рокурониума как вариант для быстрой последовательной индукции, потому что начало блока нейро-мышечной передачи наступает почти столь же быстро, как при использовании сукцинил холина , и интубацию можно начинать через 30-45 с после идентичной индукции.76 Однако, быстрота начала действия рокурониума – дозозависимый эффект, и должен быть учтен факт, что доза, необходимая для достижения быстрого начала блока может привести к длительному блоку. Если ожидается короткая операция, то это может привести к неоправданному удлинению времени анестезии.
Список литературы
- Adams RJ, McKie VC, Hsu L, et al. Prevention of a first stroke by transfusions in children with sickle cell anemia and abnormal results on transcranial Doppler ultrasonography. N Engl J Med 1998; 339 : 5–11
- Adelhoj B, Petring OU, Pedersen NO, Andersen RD, Busch P, Vestergard AS. Metoclopramide given pre-operatively empties the stomach. Acta Anaesthesiol Scand 1985; 29 : 322–5
- Alderson PJ, Lerman J. Oral premedication for paediatric ambulatory anaesthesia: a comparison of midazolam and ketamine. Can J Anaesth 1994; 41 : 221–6
- American Academy of Pediatrics, Section on Anesthesiology. Evaluation and preparation of pediatric patients undergoing anesthesia. Pediatrics 1996; 98 : 502–8
- Audenaert SM, Montgomery CL, Thompson DE, Sutherland J. A prospective study of rectal methohexital: efficacy and side effects in 648 cases. Anesth Analg 1995; 81 : 957–61
- Audenaert SM, Wagner Y, Montgomery CL, et al. Cardiorespiratory effects of premedication for children. Anesth Analg 1995; 80 : 506–10
- Beebe DS, Belani KG, Chang PN, et al. Effectiveness of preoperative sedation with rectal midazolam, ketamine, or their combination in young children. Anesth Analg 1992; 75 : 880–4
- Bennie RE, Boehringer LA, Dierdorf SF, Hanna MP, Means LJ Transnasal butorphanol is effective for postoperative pain relief in children undergoing myringotomy. Anesthesiology 1998; 89 : 385–90
- Buckley MM, Benfield P. Eutectic lidocaine/prilocaine cream. A review of the topical anaesthetic/analgesic efficacy of a eutectic mixture of local anaesthetics (EMLA). Drugs 1993; 46 : 126–51
- Buhrer M, Maitre PO, Crevoisier C, Stanski DR. Electroencephalographic effects of benzodiazepines. II. Pharmacodynamic modeling of the electroencephalographic effects of midazolam and diazepam. Clin Pharmacol Ther 1990; 48 : 555–67
- Chang PC, Goresky GV, O'Connor G, et al. A multicentre randomized study of single-unit dose package of EMLA patch vs EMLA 5% cream for venepuncture in children. Can J Anaesth 1994; 41 : 59–63
- Choonara IA. Giving drugs per rectum for systemic effect. Arch Dis Child 1987; 62 : 771–2
- Cioaca R, Canavea I. Oral transmucosal ketamine: an effective premedication in children. Paediatr Anaesth 1996; 6 : 361–5
- Cohen A. Management issues for collaborative study in hematology. Sickle cell anemia, hemophilia, and ITP. Clin Pediatr (Phila) 1987; 26 : 615–19
- Cohen MM, Cameron CB. Should you cancel the operation when a child has an upper respiratory tract infection? Anesth Analg 1991; 72 : 282–8
- Committee on Drugs American Academy of Pediatrics. Alternate routes of drug administration—advantages and disadvantages. Pediatrics 1997; 100 : 143–52
- Cote? CJ. NPO after midnight for children—a reappraisal. Anesthesiology 1990; 72 : 589–92
- Cote? CJ, Kauffman RE, Troendle GJ, Lambert GH. Is the ‘therapeutic orphan' about to be adopted? Pediatrics 1996; 98 : 118–23
- Cote? CJ, Zaslavsky A, Downes JJ, et al. Postoperative apnea in former preterm infants after inguinal herniorrhaphy. A combined analysis. Anesthesiology 1995; 82 : 809–22
- Cox RG, Goresky GV. Life-threatening apnea following spinal anesthesia in former premature infants. Anesthesiology 1990; 73 : 345–7
- Cray SH, Dixon JL, Heard CM, Selsby DS. Oral midazolam premedication for paediatric day case patients. Paediatr Anaesth 1996; 6 : 265–70
- Daniels AL, Cote? CJ, Polaner DM. Continuous oxygen saturation monitoring following rectal methohexitone induction in paediatric patients. Can J Anaesth 1992; 39 : 27–30
- Davis PJ, Tome JA, McGowan FX jr, Cohen IT, Latta K, Felder H. Preanesthetic medication with intranasal midazolam for brief pediatric surgical procedures. Effect on recovery and hospital discharge times. Anesthesiology 1995; 82 : 2–5
- De Carolis MP, Romagnoli C, Muzii U, et al. Pharmacokinetic aspects of caffeine in premature infants. Dev Pharmacol Ther 1991; 16 : 117–22
- Dsida RM, Wheeler M, Birmingham PK, et al. Premedication of pediatric tonsillectomy patients with oral transmucosal fentanyl citrate. Anesth Analg 1998; 86 : 66–70
- Eichhorn JH. Effect of monitoring standards on anesthesia outcome. Int Anesthesiol Clin 1993; 31 : 181–96
- Empey DW. Effect of airway infections on bronchial reactivity. Eur J Respir Dis Suppl 1983; 128 : 366–8
- Epstein RH, Mendel HG, Witkowski TA, et al. The safety and efficacy of oral transmucosal fentanyl citrate for preoperative sedation in young children. Anesth Analg 1996; 83 : 1200–5
- Fisher QA. ‘Clear for surgery': current attitudes and practices of pediatricians. Clin Pediatr (Phila) 1991; 30 : 35–41
- Frayling IM, Addison GM, Chattergee K, Meakin G. Methaemoglobinaemia in children treated with prilocaine– lignocaine cream. BMJ 1990; 301 : 153–4
- Friesen RH, Lockhart CH. Oral transmucosal fentanyl citrate for preanesthetic medication of pediatric day surgery patients with and without droperidol as a prophylactic anti-emetic. Anesthesiology 1992; 76 : 46–51
- Geldner G, Hubmann M, Knoll R, Jacobi K. Comparison between three transmucosal routes of administration of midazolam in children. Paediatr Anaesth 1997; 7 : 103–9
- Gillerman RG, Hinkle AJ, Green HM, Cornell L, Dodge CP. Parental presence plus oral midazolam decreases frequency of 5% halothane inductions in children. J Clin Anesth 1996; 8 : 480–5
- Gingrich BK. Difficulties encountered in a comparative study of orally administered midazolam and ketamine. Anesthesiology 1994; 80 : 1414–15
- Goldstein-Dresner MC, Davis PJ, Kretchman E, Siewers RD, Certo N, Cook DR. Double-blind comparison of oral transmucosal fentanyl citrate with oral meperidine, diazepam, and atropine as preanesthetic medication in children with congenital heart disease. Anesthesiology 1991; 74 : 28–33
- Goresky GV, Whitsett SF. Psychological preparation of children for surgery. Can J Anaesth 1994; 41 : 1033–5
- Goudsouzian NG, Cote? CJ, Liu LM, Dedrick DF. The dose– response effects of oral cimetidine on gastric pH and volume in children. Anesthesiology 1981; 55 : 53–6
- Green MC, McNiece WL. Preoperative evaluation and preparation of the pediatric patient. Semin Pediatr Surg 1992; 1 : 4–10
- Griffin TC, Buchanan GR. Elective surgery in children with sickle cell disease without preoperative blood transfusion. J Pediatr Surg 1993; 28 : 681–5
- Gronert BJ, Brandom BW. Neuromuscular blocking drugs in infants and children. Pediatr Clin N Am 1994; 41 : 73–91
- Gutstein HB, Johnson KL, Heard MB, Gregory GA. Oral ketamine preanesthetic medication in children. Anesthesiology 1992; 76 : 28–33
- Halvorson DJ, McKie V, McKie K, Ashmore PE, Porubsky ES. Sickle cell disease and tonsillectomy. Preoperative management and postoperative complications. Arch Otolaryngol Head Neck Surg 1997; 123 : 689–92
- Hannallah RS. Selection of patients for paediatric ambulatory surgery. Can J Anaesth 1991; 38 : 887–90
- Hannallah RS. Who benefits when parents are present during anaesthesia induction in their children? Can J Anaesth 1994; 41 : 271–5
- Hannallah RS. Pediatric ambulatory anesthesia: role of parents. J Clin Anesth 1995; 7 : 597–9
- Hannallah RS, Patel RI. Low-dose intramuscular ketamine for anesthesia pre-induction in young children undergoing brief outpatient procedures. Anesthesiology 1989; 70 : 598–600
- Harnik EV, Hoy GR, Potolicchio S, Stewart DR, Siegelman RE. Spinal anesthesia in premature infants recovering from respiratory distress syndrome. Anesthesiology 1986; 64 : 95–9
- Hunt JN, MacDonald M. The influence of volume on gastric emptying. J Physiol 1954; 126 : 459–74
- Kain ZN, Ferris CA , Mayes LC, Rimar S. Parental presence during induction of anaesthesia: practice differences between the United States and Great Britain . Paediatr Anaesth 1996; 6 : 187–93
- Kain ZN, Mayes LC, Bell C, Weisman S, Hofstadter MB, Rimar S. Premedication in the United States: a status report. Anesth Analg 1997; 84 : 427–32
- Kain ZN, Mayes LC, Caramico LA. Preoperative preparation in children: a cross-sectional study. J Clin Anesth 1996; 8 : 508–14
- Kain ZN, Wang SM, Caramico LA, Hofstadter M, Mayes LC. Parental desire for perioperative information and informed consent: a two-phase study. Anesth Analg 1997; 84 : 299–306
- Karl HW, Keifer AT, Rosenberger JL, Larach MG, Ruffle JM. Comparison of the safety and efficacy of intranasal midazolam or sufentanil for preinduction of anesthesia in pediatric patients. Anesthesiology 1992; 76 : 209–15
- Karl HW, Pauza KJ, Heyneman N, Tinker DE. Preanesthetic preparation of pediatric outpatients: The role of a videotape for parents. J Clin Anesth 1990; 2 : 172–7
- Karl HW, Rosenberger JL, Larach MG, Ruffle JM. Transmucosal administration of midazolam for premedication of pediatric patients. Comparison of the nasal and sublingual routes. Anesthesiology 1993; 78 : 885–91
- Kinouchi K, Tanigami H, Tashiro C, Nishimura M, Fukumitsu K, Takauchi Y. Duration of apnea in anesthetized infants and children required for desaturation of hemoglobin to 95%. The influence of upper respiratory infection. Anesthesiology 1992; 77 : 1105–7
- Koshy M, Weiner SJ, Miller ST, et al. Surgery and anesthesia in sickle cell disease. Cooperative Study of Sickle Cell Diseases. Blood 1995; 86 : 3676–84
- Krane EJ, Haberkern CM, Jacobson LE. Postoperative apnea, bradycardia, and oxygen desaturation in formerly premature infants: prospective comparison of spinal and general anesthesia. Anesth Analg 1995; 80 : 7–13
- Kurth CD, LeBard SE. Association of postoperative apnea, airway obstruction, and hypoxemia in former premature infants. Anesthesiology 1991; 75 : 22–6
- Kurth CD, Spitzer AR, Broennle AM, Downes JJ. Postoperative apnea in preterm infants. Anesthesiology 1987; 66 : 483–8
- Lawson RA, Smart NG, Gudgeon AC, Morton NS. Evaluation of an amethocaine gel preparation for percutaneous analgesia before venous cannulation in children. Br J Anaesth 1995; 75 : 282–5
- Lejus C, Renaudin M, Testa S, Malinovsky JM, Vigier T, Souron R. Midazolam for premedication in children: nasal vs. rectal administration. Eur J Anaesthesiol 1997; 14 : 244–9
- Levine MF, Spahr-Schopfer IA, Hartley E, Lerman J, MacPherson B. Oral midazolam premedication in children: the minimum time interval for separation from parents. Can J Anaesth 1993; 40 : 726–9
- Levy L, Pandit UA, Randel GI, Lewis IH, Tait AR. Upper respiratory tract infections and general anaesthesia in children. Anaesthesia 1992; 47 : 678–82
- Lin YC, Moynihan RJ, Hackel A. A comparison of oral midazolam, oral ketamine, and oral midazolam combined with ketamine as preanesthetic medication for pediatric outpatients. Anesthesiology 1993; 79 : A1177
- Litman RS, Berger AA, Chhibber A. An evaluation of preoperative anxiety in a population of parents of infants and children undergoing ambulatory surgery. Paediatr Anaesth 1996; 6 : 443–7
- Litman RS, Berkowitz RJ, Ward DS. Levels of consciousness and ventilatory parameters in young children during sedation with oral midazolam and nitrous oxide. Arch Pediatr Adolesc Med 1996; 150 : 671–5
- Liu LM, Cote? CJ, Goudsouzian NG, et al. Life-threatening apnea in infants recovering from anesthesia. Anesthesiology 1983; 59 : 506–10
- Liu LM, Gaudreault P, Friedman PA, Goudsouzian NG, Liu PL. Methohexital plasma concentrations in children following rectal administration. Anesthesiology 1985; 62 : 567–70
- MacFayden UM, Borthwick G, Simpson H, McKay M, Neilson J. Monitoring for central apnoea in infancy—limitations of single channel recordings. Arch Dis Child 1988; 63 : 282–7
- Malinovsky JM, Cozian A, Lepage JY, Mussini JM, Pinaud M, Souron R. Ketamine and midazolam neurotoxicity in the rabbit. Anesthesiology 1991; 75 : 91–7
- Malinovsky JM, Lepage JY, Cozian A, Mussini JM, Pinaudt M, Souron R. Is ketamine or its preservative responsible for neurotoxicity in the rabbit? Anesthesiology 1993; 78 : 109–15
- Malinovsky JM, Populaire C, Cozian A, Lepage JY, Lejus C, Pinaud M. Premedication with midazolam in children. Effect of intranasal, rectal and oral routes on plasma midazolam concentrations. Anaesthesia 1995; 50 : 351–4
- Malviya S, Swartz J, Lerman J. Are all preterm infants younger than 60 weeks postconceptual age at risk for postanesthetic apnea? Anesthesiology 1993; 78 : 1076–81
- Malviya S, Voepel-Lewis T, Huntington J, Siewert M, Green W. Effects of anesthetic technique on side effects associated with fentanyl Oralet premedication. J Clin Anesth 1997; 9 : 374–8
- Mazurek AJ, Rae B, Hann S, Kim JI, Castro B, Cote? CJ. Rocuronium vs. sucinylcholine: Are they equally efficacious during rapid sequence induction? Anesth Analg 1999; 87 : 1259–62
- McCormick AS, Spargo PM. Parents in the anaesthetic room: a questionnaire survey of departments of anaesthesia. Paediatr Anaesth 1996; 6 : 183–6
- McMillan CO, Spahr-Schopfer IA, Sikich N, Hartley E, Lerman J. Premedication of children with oral midazolam. Can J Anaesth 1992; 39 : 545–50
- Mielck A, Reitmeir P, Wjst M. Severity of childhood asthma by socioeconomic status. Int J Epidemiol 1996; 25 : 388–93
- Molodecka J, Stenhouse C, Jones JM, Tomlinson A. Comparison of percutaneous anaesthesia for venous cannulation after topical application of either amethocaine or EMLA cream. Br J Anaesth 1994; 72 : 174–6
- Moran TJ. Milk-aspiration pneumonia in human and animal subjects. Arch Pathol 1953; 55 : 286–301
- Neumayr L, Koshy M, Haberkern C, et al. Surgery in patients with hemoglobin SC disease. Preoperative Transfusion in Sickle Cell Disease Study Group. Am J Hematol 1998; 57 : 101–8
- O'Hare B, Lerman J, Endo J, Culz E. Acute lung injury after instillation of human breast milk or infant formula into rabbits' lungs. Anesthesiology 1996; 84 : 1386–91
- O'Kelly B, Fiset P, Meistelman C, Ecoffey C. Pharmacokinetics of rocuronium bromide in paediatric patients. Eur J Anaesthesiol Suppl 1994; 9 : 57–8
- Olkkola KT, Aranko K, Luurila H, et al. A potentially hazardous interaction between erythromycin and midazolam. Clin Pharmacol Ther 1993; 53 : 298–305
- Olsson GL. Bronchospasm during anaesthesia. A computer- aided incidence study of 136 929 patients. Acta Anaesthesiol Scand 1987; 31 : 244–52
- Olsson GL, Hallen B. Pharmacological evacuation of the stomach with metoclopramide. Acta Anaesthesiol Scand 1982; 26 : 417–20
- Olsson GL, Hallen B. Laryngospasm during anaesthesia. A computer-aided incidence study in 136 929 patients. Acta Anaesthesiol Scand 1984; 28 : 567–75
- Patel D, Meakin G. Oral midazolam compared with diazepam– droperidol and trimeprazine as premedicants in children. Paediatr Anaesth 1997; 7 : 287–93
- Patel RI, DeWitt L, Hannallah RS. Preoperative laboratory testing in children undergoing elective surgery: analysis of current practice. J Clin Anesth 1997; 9 : 569–75
- Patel RI, Hannallah RS. Preoperative screening for pediatric ambulatory surgery: Evaluation of a telephone questionnaire method. Anesth Analg 1992; 75 : 258–61
- PiaDeCarolis M, Romagnoli C, Muzil U, et al. Pharmacokinetic aspects of caffeine in premature infants. Dev Pharmacol Ther 1991; 16 : 117–22
- Pizov R, Brown RH, Weiss YS, et al. Wheezing during induction of general anesthesia in patients with and without asthma. A randomized, blinded trial. Anesthesiology 1995; 82 : 1111–16
- Poets CF, Stebbens VA, Richard D, Southall DP. Prolonged episodes of hypoxemia in preterm infants undetectable by cardiorespiratory monitors. Pediatrics 1995; 95 : 860–3
- Pons G, Carrier O, Richard MO, et al. Developmental changes of caffeine elimination in infancy. Dev Pharmacol Ther 1988; 11 : 258–64
- Rice LJ. Common problems in pediatric ambulatory surgery: upper respiratory infection, heart murmur, or sickle-cell disease. J Clin Anesth 1994; 5 : 34–8S
- Rice LJ, Broadman LM. Caudal anesthesia and cardiovascular collapse in an infant. Anesth Analg 1987; 66 : 694–4
- Rockoff AS, Christy D, Zeldis N, Tsai DJ, Kramer RA. Myocardial necrosis following general anesthesia in hemoglobin SC disease. Pediatrics 1978; 61 : 73–6
- Rockoff MA, Goudsouzian NG. Seizures induced by methohexital. Anesthesiology 1981; 54 : 333–5
- Rolf N, Cote? CJ. Frequency and severity of desaturation events during general anesthesia in children with and without upper respiratory infections. J Clin Anesth 1992; 4 : 200–3
- Roy WL, Lerman J, McIntyre BG. Is preoperative haemoglobin testing justified in children undergoing minor elective surgery? Can J Anaesth 1991; 38 : 700–3
- Russell SC, Doyle E. A risk–benefit assessment of topical percutaneous local anaesthetics in children. Drug Saf 1997; 16 : 279–87
- Ryder IG, Spargo PM. Parents in the anaesthetic room: A questionnaire survey of parents' reaction. Anaesthesia 1991; 46 : 977–9
- Sartorelli KH, Abajian JC, Kreutz JM, Vane DW. Improved outcome utilizing spinal anesthesia in high-risk infants. J Pediatr Surg 1992; 27 : 1022–5
- Scott-Conner CE, Brunson CD. The pathophysiology of the sickle hemoglobinopathies and implications for perioperative management. Am J Surg 1994; 168 : 268–74
- Sekerci C, Donmez A, Ates Y, Okten F. Oral ketamine premedication in children (placebo controlled double-blind study). Eur J Anaesthesiol 1996; 13 : 606–11
- Selby IR, Bowles BJ. Analgesia for venous cannulation: a comparison of EMLA (5 minutes application), lignocaine, ethyl chloride, and nothing. J R Soc Med 1995; 88 : 264–7
- Sparr HJ, Mitterschiffthaler G. Are only large doses of rocuronium an alternative to succinylcholine for rapid-sequence induction? Anesthesiology 1994; 80 : 1411–12
- Spear RM, Deshpande JK, Maxwell LG. Caudal anesthesia in the awake, high-risk infant. Anesthesiology 1988; 69 : 407–9
- Steward DJ. Screening tests before surgery in children. Can J Anaesth 1991; 38 : 693–5
- Suresh S, Cohen IJ, Matuszczak M, et al. Dose ranging, safety, and efficacy of a new oral midazolam syrup in children. Submitted for publication
- Tait AR, Knight PR. Intraoperative respiratory complications in patients with upper respiratory tract infections. Can J Anaesth 1987; 34 : 300–3
- Tait AR, Knight PR. The effects of general anesthesia on upper respiratory tract infections in children. Anesthesiology 1987; 67 : 930–5
- Tait AR, Reynolds PI, Gutstein HB. Factors that influence an anesthesiologist's decision to cancel elective surgery for the child with an upper respiratory tract infection. J Clin Anesth 1995; 7 : 491–9
- van Hoogdalem EJ, De Boer AG, Breimer DD. Pharmacokinetics of rectal drug administration, Part I. General considerations and clinical applications of centrally acting drugs. Clin Pharmacokinet 1991; 21 : 11–26
- Vessey JA, Bogetz MS, Caserza CL, Liu KR, Cassidy MD. Parental upset associated with participation in induction of anaesthesia in children. Can J Anaesth 1994; 41 : 276–80
- Vetter TR. A comparison of EMLA cream versus nitrous oxide for pediatric venous cannulation. J Clin Anesth 1995; 7 : 486–90
- Vichinsky EP. Comprehensive care in sickle cell disease: its impact on morbidity and mortality. Semin Hematol 1991; 28 : 220–6
- Vichinsky EP, Haberkern CM, Neumayr L, et al. A comparison of conservative and aggressive transfusion regimens in the perioperative management of sickle cell disease. The Preoperative Transfusion in Sickle Cell Disease Study Group. N Engl J Med 1995; 333 : 206–13
- Waisel DB, Truog RD. Informed consent. Anesthesiology 1997; 87 : 968–78
- Ware RE, Filston HC. Surgical management of children with hemoglobinopathies. Surg Clin N Am 1992; 72 : 1223–36
- Warner DL, Cabaret J, Velling D. Ketamine plus midazolam, a most effective paediatric oral premedicant. Paediatr Anaesth 1995; 5 : 293–5
- Warner LO, Teitelbaum DH, Caniano DA, Vanik PE, Martino JD, Servick JD. Inguinal herniorrhaphy in young infants: perianesthetic complications and associated preanesthetic risk factors. J Clin Anesth 1992; 4 : 455–61
- Watcha MF, Thach BT, Gunter JB. Postoperative apnea after caudal anesthesia in an ex-premature infant. Anesthesiology 1989; 71 : 613–15
- Webster AC, McKishnie JD, Kenyon CF, Marshall DG. Spinal anaesthesia for inguinal hernia repair in high-risk neonates. Can J Anaesth 1991; 38 : 281–6
- Welborn LG, De Soto H, Hannallah RS, Fink R, Ruttimann UE, Boeckx R. The use of caffeine in the control of post-anesthetic apnea in former premature infants. Anesthesiology 1988; 68 : 796–1006
- Welborn LG, Hannallah RS, Fink R, Ruttimann UE, Hicks JM. High-dose caffeine suppresses postoperative apnea in former preterm infants. Anesthesiology 1989; 71 : 347–9
- Welborn LG, Hannallah RS, Luban NLC, Fink R, Ruttimann UE. Anemia and postoperative apnea in former preterm infants. Anesthesiology 1991; 74 : 1003–6
- Welborn LG, Rice LJ, Hannallah RS, Broadman LM, Ruttimann UE, Fink R. Postoperative apnea in former preterm infants: prospective comparison of spinal and general anesthesia. Anesthesiology 1990; 72 : 838–42
- Wright PM, Caldwell JE, Miller RD. Onset and duration of rocuronium and succinylcholine at the adductor pollicis and laryngeal adductor muscles in anesthetized humans. Anesthesiology 1994; 81 : 1110–15
- Xue FS, Luo LK, Tong SY, Liao X, Deng XM, An G. Study of the safe threshold of apneic period in children during anesthesia induction. J Clin Anesth 1996; 8 : 568–74
- Zachary CY, Evans R. Perioperative management for childhood asthma. Ann Allerg Asthma Immunol 1996; 77 : 468–72
- Zedie N, Amory DW, Wagner BK, O'Hara DA. Comparison of intranasal midazolam and sufentanil premedication in pediatric outpatients. Clin Pharmacol Ther 1996; 59 : 341–8
- Zsigmond EK, Kovacs V, Fekete G. A new route, jet-injection for anesthetic induction in children—II. ketamine dose-range finding studies. Int J Clin Pharmacol Ther 1996; 34 : 84–8

