ИНФОРМАТИВНОСТЬ БИОХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПЛАЗМЫ ПРИ ГЕСТОЗАХ
Мороз В.В., Щербакова Л.Н., Назаров Б.Ф., Галушка С.В.,
Молчанова Л.В.
ГУ НИИ общей реаниматологии РАМН, Москва
ГКБ им С.П.Боткина, Москва.
Статья опубликована в журнале «Общая реаниматология», Том I, №4, с.6-10
Одним из важнейших факторов, определяющих материнскую и детскую заболеваемость и смертность при беременности являются гестозы и их крайняя степень – преэклампсия и эклампсия [1].
Существует несколько теорий возникновения гестоза, однако механизмы их развития и детали патогенеза изучены недостаточно. Большая часть исследований внутренней среды организма посвящена периоду гестации. Предполагается, что в послеродовом периоде происходит регресс симптомокомплекса гестоза [2]. Однако клинические и биохимические изменения, вызванные гестозом, не заканчиваются с момента родоразрешения. В литературе имеются сообщения о наличии гуморальных, иммунных и ферментных сдвигов у родильниц в раннем и отдаленном послеродовом периоде, требующих своевременной лабораторной диагностики, интенсивной терапии и профилактики осложнений [3].
Цель работы: изучение закономерностей изменения основных биохимических показателей плазмы крови у родильниц с гестозом и оценка их информативности.
Материалы и методы. Обследовали 35 женщин в возрасте от 25 до 35 лет в послеродовом периоде. Группу 1 составили 6 женщин с физиологическим течением беременности и срочными родами через естественные родовые пути. Пациентки после нормальной беременности, разрешенной посредством кесарева сечения (КС), составили группу 2 – 12 человек. В группу 3 вошли 12 женщин с гестозами средней тяжести, преэклампсией, как после естественных родов, так и после кесарева сечения. Кроме того, были обследованы 5 родильниц с гестозами тяжелой степени (эклампсия). Оценка тяжести гестоза проводилась по шкале Г.М.Савельевой.
Забор крови для исследования производили из локтевой вены в 1-е и 3-4-е сутки после родов. В плазме определяли активность аланин-, аспартат-, гамма-глутамиламинотрасфераз (АЛТ, АСТ, ГГТ) и щелочной фосфатазы (ЩФ), а также концентрацию билирубина, общего белка, мочевины, креатинина и общего кальция. Для оценки состояния липидного обмена определяли концентрацию триглицеридов (ТГ), общего холестерина (ХС) и холестерина высокой, низкой и очень низкой плотности (ХС ЛПВП, ХС ЛПНП и ХС ЛПОНП).
Статистическую достоверность результатов оценивали по критерию Стьюдента.
Результаты и их обсуждение. Существуют различные теории патогенеза гестозов. Ведущая роль в развитии гестоза отводится ишемии плаценты, возникновению системной воспалительной реакции и, в наиболее тяжелых случаях - полиорганной недостаточности (ПОН) [4]. Формирование ПОН при гестозе происходит аналогично течению этого процесса при других критических состояниях. В литературе имеются сообщения об участии специфических белков, синтезируемых плацентой, в развитии гестоза [5].
Согласно данным литературы, при гестозах отмечается повышение активности печеночных ферментов и концентрации билирубина, особенно при наличии сопутствующих заболеваний печени [6]. Для оценки функционального состояния печени при гестозах в послеродовом периоде проводили определение активности АЛТ, АСТ, ГГТ и концетрации билирубина.
Активность АЛТ у всех обследованных трех групп на протяжении всего периода наблюдения оставалась в пределах нормы. Повышение активности АСТ относительно физиологической нормы было достоверно выражено лишь у пациенток группы 1 (после нормальной беременности и родов). У пациенток групп 2 и 3 обнаруживалась лишь тенденция к изменению этого показателя (табл.1).
Активность ГГТ у пациенток группы 1, оставаясь в пределах нормальных значений, в 1-е сутки после родов достоверно превышала значения этого показателя у пациенток групп 2 и 3. К 3-4-м суткам эти различия нивелировались (табл.1). Динамика активности ГГТ свидетельствует о более высокой детоксицирующей активности печени у женщин после нормальной беременности и самостоятельных родов, чем при гестозах и после КС. Уровень концентрации билирубина у всех обследованных трех групп сохранялся в пределах физиологической нормы в течение всего периода наблюдения (табл.1).
Многократное повышение активности АЛТ (до 100 МЕ/л) и АСТ (до160 МЕ/л) наблюдали только при гестозах тяжелой степени при наличии у больных ПОН. Повышенная концентрация билирубина в крови при эклампсии (50-60 мкмоль/л) снижалась до нормы лишь к концу второй недели после родов. Таким образом, данные об активности трансаминаз и билирубина подтверждают наличие печеночной недостаточности в послеродовом периоде при гестозах тяжелой степени.
Изменения в обмене веществ при беременности в первую очередь направлены на обеспечение оптимального маточно-плацентарного кровотока и достаточной концентрации пластических и энергетических материалов в притекающей крови. Концентрация общего белка у всех обследованных в первые сутки послеродового периода определялась у нижней границы нормы. К 3-4-м суткам после родов у пациенток группы 1 (после нормальной беременности и срочных родов через естественные родовые пути) обнаруживалась тенденция роста этого показателя до 75,8±3,1 г/л, у пациенток после КС (группа 2) его значение оставалось на уровне 65,2±2,3 г/л. При преэклампсии (группа 3) наблюдалась обратная тенденция. Уровень общего белка у родильниц с гестозом средней тяжести к 3-4-м суткам после родоразешения опускался ниже физиологической нормы и был достоверно ниже, чем у родильниц после нормальной беременности и составлял 54,3±3,2 г/л (табл. 1).
При условии нормальной диеты гипопротеинемия может быть следствием как недостаточности белоксинтезирующей функции печени, так и результатом почечной недостаточности, сопровождающейся протеинурией [7,8]. Определение концентрации мочевины в плазме крови родильниц трех обследуемых групп не выявило отклонений от нормы. Однако в течение всего периода наблюдения уровень концентрации мочевины при наличии преэклампсии находился на достоверно более высоком уровне, чем при ее отсутстви (табл.1).
Концентрация креатинина у пациенток с преэклампсией до 3-4-х суток послеродового периода была достоверно выше, чем у женщин после нормальной беременности, оставаясь при этом в пределах физиологической нормы (табл.1).
Сопоставление данных о концентрации белка, мочевины и креатинина у пациенток групп 1 и 2 и больных с преэклампсией позволяет предположить наличие у последних некоторого снижения функции почек, что и может быть одной из причин появления у них гипопротеинемии.
Таблица 1. Показатели белкового и минерального обмена в послеродовом периоде при гестозах средней тяжести.
Исследуемые показатели (норма) |
Группы исследования |
Значения показателей на этапах исслед. |
|
1сутки |
3-4сутки |
||
| АЛТ (МЕ/л, женщины 9 -36) |
1 2 3 |
26 ± 3 (n=6) 12 ± 2 (n=8) 16 ± 3 (n=8) |
12 ± 6 (n=5) 12 ± 6 (n=8) 11 ± 6 (n=6) |
| АСТ (МЕ/л, женщины, 10 -36) |
1 2 3 |
70 ± 12 (n=6) 52 ± 10 (n=7) 50 ± 12 (n=12) |
39 ± 3 (n=5) 64 ± 8 ( n =5) 34 ± 7 ( n =6) |
ГГТ |
1 2 3 |
29 ± 2 (n=6) 5 ± 1 (n=7)* 13 ± 3 (n=12)* , |
10 ± 2 (n=5) 9 ± 1 (n=8) 15 ± 5 (n=5) |
| ЩФ (МЕ/л, 31-108) |
1 2 3 |
140 ± 35 (n=6) 112 ± 10 (n=10) 114 ± 8 (n=7) |
109 ± 13 (n=5) 96 ± 4 (n=7) 159 ± 34 (n=5) |
| Билирубин (мкмоль/л, < 25,7) |
1 2 3 |
7,7 ± 5,4 (n=5) 15,9 ± 3,0 (n=8) 9,5 ± 2,2 (n=9) |
5,2 ± 0,5 (n=5) 6,6 ± 1,7 (n=8)# 3,9 ± 2,8 (n=5) |
Мочевина |
1 2 3 |
2,43 ± 0,30 (n=6) 2,47 ± 0,29 (n=9) 3,63 ± 0,28 (n=7)*, |
3,24 ± 0,60 (n=5) 3,35 ± 0,43 (n=8) 5,49 ± 0,30 ( n =5)* |
| Креатинин (мкмоль/л, 55 - 80) |
1 2 3 |
74 ± 4 (n=6) 70 ± 7 (n=8) 91 ± 5 (n=8)*, |
63 ± 2 (n=6) 66 ± 3 (n=6) 78 ± 3 (n=5)*, |
| Общий белок (г/л, 66 - 83) |
1 2 3 |
66,3 ± 3,6 (n=6) 62,7 ± 4,2 (n=10) 65,5 ± 4,3 (n=6) |
75,8 ± 3,1 (n=5) 65,2 ± 2,3 (n=5) 54,3 ± 3,2( n =5)*, |
| Общий кальций (ммоль/л, 2,25-2,75) |
1 2 3 |
1,93 ± 0,09 (n=6) 1,80 ± 0,06 (n=9) 1,56 ± 0,08 (n=7)* |
1,96 ± 0,08 (n=5) 1,66 ± 0,10 (n=9) 1,90 ± 0,07 (n=5) |
*- достоверные различия с соответствующими показателями группы 1
![]() - достоверные различия с соответствующими показателями группы 2
- достоверные различия с соответствующими показателями группы 2
#- достоверные различия с исходным уровнем
При эклампсии в случае благоприятного исхода уровень концентрации креатинина не отличался от его значений у пациенток с гестозом средней тяжести. Значительное повышение концентрации креатинина ( в 1-е сутки послеродового периода до 250 мкмоль/л, к 3-4-м суткам до 380 мкмоль/л) у родильниц с эклампсией свидетельствовало о критическом повреждении выделительной системы. Таким образом, данные о концентрации креатинина в крови при эклампсии с летальным исходом подтверждают снижение у этих больных функции почек в послеродовом периоде.
При недостаточной концентрации белка в крови потребности плода обеспечиваются в первую очередь за счет низкомолекулярных белков – альбуминов. Снижение альбумина в крови повышает чувствительность беременных женщин к действию токсических веществ и может служить основой развития синдрома эндогенной интоксикации. В качестве токсических веществ могут служить продукты обмена в высоких концентрациях, медиаторы воспаления, бактериальные токсины и т.д. Эндотоксикоз может быть вызван также нарушением равновесия между веществами-антагонистами. Доказано, что наличие корреляции между концентрацией общего белка в плазме крови и тяжестью эндотоксикоза можно использовать как маркер эндотоксикоза [5,9]. Полученные нами данные свидетельствуют о сохранении признаков эндотоксикоза при гестозах средней тяжести в послеродовом периоде.
Наряду с общей интенсификацией метаболизма при беременности происходит активация минерального обмена. У пациенток всех трех групп уровень общего кальция был ниже физиологической нормы в течение всего периода наблюдения. В 1-е сутки послеродового периода концентрация общего кальция у пациенток группы 1 регистрировалась на уровне 1,93 ммоль/л, кесарево сечение не вызывало существенных изменений этого показателя. У больных с преэклампсией содержание общего кальция в плазме в 1-е сутки послеродового периода составляло лишь 1,56 ммоль/л, то есть было достоверно ниже, чем после нормальных беременности и родов. Но эти различия имели преходящий характер и нивелировались к 3-4-м суткам восстановительного периода (табл.1).
К дисфункции кальций-фосфорного обмена может привести функциональная перестройка эндокринной системы. Патогенетическим фактором нарушений минерального обмена могут служить также скрытые гипопаратиреоидные состояния [10]. Снижение концентрации общего кальция может быть связано и с отклонениями в функциональном состоянии печени и почек. В этих органах происходит обмен витамина D и образование его активных метаболитов, недостаток которых приводит к уменьшению всасывания кальция в кишечнике. Гипокальциемия может являться следствием угнетения белоксинтезирующей функции печени и снижения синтеза альбуминов, связывающих и транспортирующих около половины кальция плазмы [11]. Регистрируемое нами снижение концентрации общего кальция при преэклампсии сочетается со снижением уровня концентрации общего белка в крови. Снижение уровня общего кальция в сочетании с гипопротеинемией можно расценивать как свидетельство снижения белоксинтезирующей функции печени при гестозах средней тяжести, не обнаруживаемого по данным об уровне активности трансафераз и концентрации билирубина.
Активность щелочной фосфатазы у всех обследованных несколько превосходила норму, что можно расценивать как компенсаторную реакцию, направленную на повышение уровня кальция в крови (табл.1).
По данным литературы при гестозах имеет место перегрузка клеток кальцием, что играет существенную роль в патогенезе артериальной гипертензии. В свою очередь повышение содержания кальция внутри клетки связывают с изменением проницаемости для кальция клеточных мембран вследствие нарушения работы ионных насосов из-за уплотнения липидного бислоя за счет повышения в нем содержания холестерина [12]. Наши исследования показали, что концентрация общего ХС у всех обследованных была значительно выше рекомендуемой нормы, но достоверной разницы в содержании общего ХС в крови родильниц с гестозами по сравнению с пациентками после нормальной беременности [13,14] не выявлено (табл. 2).
Определенные особенности обнаруживались в профиле липопротеидов при преэклампсии. В пределах физиологической нормы определялась лишь концентрация ХС ЛПВП у пациенток группы 1 (после нормальных беременности и родов) и составляла в 1-е сутки послеродового периода 1,0 ммоль/л; содержание ХС ЛПВП в общем ХС достигало при этом 18%. У пациенток групп 2 и 3 значения этого показателя были в 1,6 раза ниже и составляли лишь 11-12% от общего ХС, что позволяет отнести этих больных к группе риска (табл.2) [14]. Концентрация ХС ЛПНП в общем холестерине у родильниц с преэклампсией составляла лишь 62% против 68% у пациенток группы 2 (после кесарева сечения).
Уровень ТГ в крови у всех обследованных значительно превосходил возрастную норму [13,14]. У родильниц с преэклампсией содержание триглицеридов и ХС ЛПОНП было достоверно повышено по сравнению с уровнем этого показателя у пациенток групп 1 и 2 (примерно в 1,5 раза) (табл.2).
Таблица 2. Показатели липидного обмена в послеродовом периоде при гестозах средней тяжести.
Исследуемые показатели |
Группы исследования |
Значение показателей на этапах исследования |
|
1сутки |
3-4сутки |
||
| ТГ (ммоль/л, женщины, 0,40 – 1,54) |
1 2 3 |
2,40 ± 0,23 (n=6) 2,73 ± 0,29 (n=10) 3,62 ± 0,18 (n=9)*, |
2,54 ± 0,16 (n=5) 2,61 ± 0,27 (n=10) 3,42 ± 0,09 ( n =5)*, |
| ХС общий (млмоль/л, < 5,2) |
1 2 3 |
6,08 ± 1,03 (n=5) 6,03 ± 0,47 (n=9) 6,10 ± 0,49 (n=9) |
6,52 ± 0,44 (n=5) 5,56 ± 0,46 (n=9) 6,34 ± 0,20 (n=5) |
| ХС ЛПВП (ммоль/л, женщины, 1,2 – 1,7) |
1 2 3 |
1,09 ± 0,14 (n=5) 0,67 ± 0,05 (n=9)* 0,66 ± 0,05 (n=9)* |
0,97 ± 0,20 (n=5) 0,70 ± 0,05 (n=9) 0,76 ± 0,17 (n=5) |
| ХС ЛПНП | 1 2 3 |
3,89 ± 0,20 (n=5) 4,12 ± 0,27 (n=9) 3,79 ± 0,33 (n=9) |
4,27 ± 0,11 (n=5) 3,67 ± 0,28 (n=9) 4,03 ± 0,32 (n=5) |
| ХС ЛПОНП | 1 2 3 |
1,09 ± 0,10 (n=6) 1,24 ± 0,14 (n=10) 1,65 ± 0,08 (n=9)*, |
1,28 ± 0,08 (n=5) 1,19 ± 0,12 (n=10) 1,55 ± 0,05 (n=5)*, |
*- достоверные различия с соответствующими показателями группы 1
![]() - достоверные различия с соответствующими показателями группы 2
- достоверные различия с соответствующими показателями группы 2
Было выявлено, что соотношения ХС ЛПВП:ХС ЛПНП:ХС ЛПОНП у пациенток 1-й, 2-й и 3-й групп в 1-е сутки послеродового периода были представлены соответственно выражениями 18:64:18 (группа 1); 11:68:20 (группа 2) и 11:62:27 (группа 3). К 3-4-м суткам ситуация мало изменялась: в группе 2 сохранялся сниженный уровень ХС ЛПВП, а в группе 3, наряду с заниженным содержанием ХС ЛПВП, концентрация ЛПОНП и ТГ оставалась значительно выше, чем у женщин после физиологической беременности (табл.2), (рис.1).
В литературе имеются сведения о полуторакратном возрастании концентрации карнитина и ацилкарнитина в плазме крови при преэклампсии [15]. Поскольку карнитин обеспечивает транспорт жирных кислот в митохондрии, где происходит их окисление, то накопление в крови карнитина и ацилкарнитина означает снижение скорости утилизации жирных кислот и снижение уровня энергообеспечения. Накопление жирных кислот стимулирует синтез ЛПОНП в печени и повышение концентрации ЛПОНП и ТГ в крови, что согласуется с нашими данными о повышенном содержании ТГ и ХС ЛПОНП в крови родильниц с преэклампсией.
Причиной накопления ТГ и ЛПОНП в крови при гестозе может быть и развитие системной воспалительной реакции (СВР), сопровождающейся повышением уровня цитокинов. Повышение уровня цитокинов при гестозе настолько характерно, что его определение предлагается для ранней диагностики гестоза [4]. Развитие СВР, способствует возникновению ПОН, которая существенно меняет все виды обмена. Рост уровня цитокинов может и непосредственно влиять на обменные процессы. Фактор некроза опухолей-альфа (ФНО-a), в частности, ингибирует липопротеинлипазу и тормозит тем самым распад ЛПОНП [14]. Таким образом, накопление ЛПОНП при гестозе средней тяжести может быть связано с непосредственным воздействием ФНО-a. Поэтому регистрируемое в крови беременных резкое стойкое повышение уровня ТГ и ХС ЛПОНП может служить признаком вероятности развития гестоза.
В случае эклампсии с летальным исходом к 3-4-м суткам послеродового периода нами отмечено повышение концентрации общего ХС при одновременном росте концентрации ХС ЛПВП (до 30% в общем ХС). При этом у 50% больных наблюдался гемолиз. Возможно, в данном случае имел место HELLP-синдром, который в современной литературе рассматривается как осложнение гестоза или вариант его течения со всеми признаками ПОН, присоединение которого указывает на крайнюю степень дезадаптации систем организма матери при попытке обеспечить потребности плода [16].
Таким образом, до 3-4 суток послеродового периода как при эклампсии, так и при преэклампсии появляются признаки гестоза, обнаруживаемые характерными изменениями биохимических показателей плазмы.
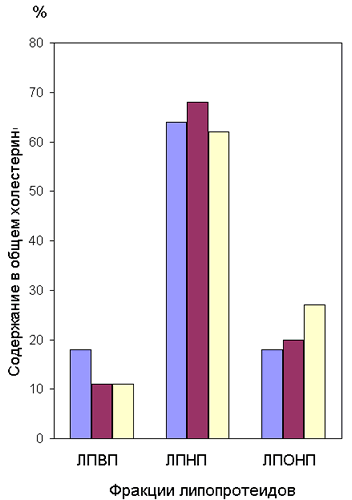
Рис.1. Спектр липопротеидов плазмы крови у женщин в послеродовом периоде.
Ряд 1- группа 1 (норма)
Ряд 2- группа 2 (кесарево сечение)
Ряд 3- группа 3 (гестозы средней тяжести)
Выводы
1.У больных с гестозами в послеродовом периоде сохраняются признаки эндотоксикоза, проявляющиеся гипопротеинемией, гиперферментемией, гипербилирубинемией.
2.У родильниц с преэклампсией в 1-е сутки после родов наблюдается гипокальциемия, свидетельствующая о сохранении нарушений минерального обмена в раннем послеродовом периоде.
3.При гестозах средней тяжести наблюдается резкое повышение концентрации триглицеридов и липопротеидов очень низкой плотности с одновременным снижением концентрации липопротеидов высокой плотности.
4.Содержание холестерина липопротеидов высокой плотности в общем холестерине ниже 12% характерно для гестозов средней тяжести, что позволяет отнести этих больных к группе риска.
Литература
1.Савельева Г.М., Шалина Ф.И. Гестоз в современном акушерстве Русский медицинский журнал. 2000; 6:50-53.
2.Медвединский И.Д., Юрченко Л.Н., Пестряева Л.А. с соавт. Современная концепция полиорганной недостаточности при гестозе. В кн.: Перинатальная анестезиология и интенсивная терапия матери и новорожденного. Екатеринбург; 1999,25 – 32.
3.Мороз В.В. Теоретические и клинические проблемы современной реаниматологии. В кн.: Материалы междунар. симп., посвященного 90-летию со дня рождения Неговского В . А : М .,1999, 2-6.
4.Conrad K.P., Benyo D.F. Placentar cytokines and the pathogenesis of preeclampsia Am. J. Reprod. Immunol . 1997;37 (3):240-249.
5.Ветров В.В. Гестоз и эфферентная терапия. СПб: 2000.
6.Михайленко Е.Т., Закревский А.А. Беременность и роды при заболеваниях гепатобиллиарной системы. В кн.:9 съезд акушеров-гинекологов УССР. 1991.88-89.
7.Broun M.A. The physiology of preeclampsia. Clin . Pharm . Phys . 1995; 22 (11): 781 – 791.
8.Dekker G.A., Sibai B.M. Etiology and pathogenesis of preeclampsia: current concepts. Amer. J. Obstet. Gynecol. 1998 ; 179 : 1379 – 1385 .
9. Черный В . И ., Галолу С . И ., Кабанько Т . П . с соавт . Лабиринты гестоза. К., ”Здоровья”; 2001.
10.Танаков А.Н., Айламазян Э.К. Обмен кальция во время беременности. Вестник Российских акушеров-гинекологов. 1996; 4: 32 - 37.
11.Сидорова И.С. Поздний токсикоз. М:1996.
12.Sattar N., Caw A., Packard C.S. et al. Potencial pathogenic roles of aberrant lipoprotein and fatty acid metabolism in preeclampsia. Brit . J . Obstet . Gynecol . 1996; 103 (7):614 – 621.
13. Меньшиков В.В., Делекторская Л.Н., Золотницкая Р.П. с соавт Лабораторные методы исследования в клинике. М: Медицина; 1987.
14.Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований. М : Медицина ; 2002.
15.Thiele J.G., Niezen-Koning K.E., van Gennip A.H. et al. Increased plasma carnitine concentration in preeclampsia. Obstet. Gynecol. 2004; 103(5 Pt 1):876 - 880.
16.Weinstein L. Preeclampsia/eclampsia with hemolysis, elevated ensymes and thrombocytopenia. Obstet . Gynecol .1985;66:657-660.

