Влияние различных типов коллоидных объемозамещающих растворов на измененную систему гемостаза
В клинической практике для коррекции гипо-волемии, проведения гемодилюции и т. д. широко применяются синтетические коллоидные объемо-замещающие растворы (КОР). Их использование может сопровождаться побочными эффектами, наиболее серьезным из которых является модифицирующее действие на систему гемостаза. Эти эффекты КОР по сути являются основным фактором, лимитирующим применение данных препаратов.
Из механизмов действия синтетических коллоидов на систему гемостаза можно выделить несколько основных, наиболее изученных: гемодилюция — снижение числа тромбоцитов, концентрации белков системы гемостаза за счет разведения, непосредственное взаимодействие с мембранами форменных элементов крови и клетками эндотелия сосудов, специфическое взаимодействие с факторами свертывания и другими компонентами системы гемостаза и являющаяся следствием последнего интеграция в структуру тромба [2, 8, 9, 12, 13, 20, 25, 29-31, 36].
Гемодилюции подвержены все компоненты системы гемостаза, однако в ряду других известных механизмов она клинически наименее значима [20, 25, 34].
Специфическим взаимодействием определяется наибольшее повреждающее действие КОР на гемостаз. Данный механизм описан для нескольких компонентов системы гемостаза.
1. Комплекс VIII фактора свертывания1. По данным разных исследователей [2, 11, 12, 30, 31, 33] возможно преимущественное взаимодействие с прокоагулянтом или собственно VIII фактором, либо фактором Виллебранда, или же оно может охватывать весь комплекс фактора VIII. Снижение активности фактора Виллебранда косвенно отражается и на функции тромбоцитарного звена, что проявляется снижением ристоцетинзависимой агрегации тромбоцитов.
2. Фибронектин2. Молекула КОР связывается с фибронектином, образовавшийся комплекс встраивается в структуру тромба. При этом тромбообразование ускоряется, но формирующийся тромб получается более рыхлым и легче подвергается деструкции [10, 20, 26, 32].
1 Фактор VIII представлен комплексом белковых молекул, выполняющих в гемостазе различную функцию. В него входят фактор VIII: С (прокоагулянт, антигемофильный глобулин) — коагуляционный компонент фактора, ускоряющий активацию фактора IX, и фактор Виллебранда — крупномолекулярный белок, контролирующий тромбоцитарный гемостаз [1].
2 Фибронектин — гликопротеид, участвующий в образовании ковалентных и нековалентных связей между молекулами фибрина [1].
3. Плазмин — третий компонент системы гемостаза (как системы поддержания состояния крови), подверженный действию обсуждаемого механизма, При применении декстрана рядом авторов отмечено укорочение времени урокиназозависимого лизиса эуглобулинового сгустка, что говорит об активации фибринолиза. Причина этого — взаимодействие молекулы декстрана с фибрином и плазмином с образованием комплекса между ними, который препятствует ингибированию плаз мина a2-антиплазмином, т. е. ослабляет действие физиологических антифибринолитиков [24]. Аналогичное действие описано и для производных гидроксиэтилкрахмала (ГЭК) [31, 32].
Непосредственное взаимодействие с мембранами тромбоцитов наряду с предыдущим механизмом играет существенную роль в гемостазиологических эффектах КОР, хотя распространено не так широко. Речь идет о так называемом "силиконизирующем" или "обволакивающем" действии, проявляющемся образованием пленки из молекул КОР, препятствующей адгезии и агрегации тромбоцитов. Этот механизм описан преимущественно для декстранов [2, 6, 9, 20, 21], но не исключается (менее выраженный) и для препаратов ГЭК [2, 21, 25].
Вообще, проблема влияния синтетических КОР на систему гемостаза волнует исследователей не одно десятилетие. В литературе приведено множество подчас противоречивых данных различных исследований на эту тему. Данные практически всех опубликованных исследований получены у пациентов с исходно нормальным гемостазом. Основной общий вывод этих исследований — свойство в той или иной степени изменять состояние гемостаза присуще всем синтетическим КОР [2]. При этом слабыми звеньями системы гемостаза, наиболее чувствительными к действию коллоидов, являются комплекс VIII фактора свертывания и сосудисто-тромбоцитарное звено.
В связи с этим представляет интерес изучение гемостазиологических эффектов различных коллоидов у пациентов с исходными нарушениями гемостаза, причем именно с изолированной патологией вышеуказанных звеньев.
Таблица 1.
Характеристика групп пациентов.
| Группа больных | Гемофилия А | Тромбоцитопения | Доноры костного мозга | средний объем коллоидного раствора, мл/кг | число больных | средний объем коллоидного раствора, мл/кг |
| число больных | средний объем коллоидного раствора, мл/кг | число больных | ||||
| 1-я (ГЭК 200/0.5) | 19 | 12,4 ± 3,24 | 10 | 9,35 ± 2,3 | 10 | 13,8 ± 2,46 |
| 2-я (декстран) | 8 | 7,67 ± 1,5 | 7 | 7,45 ± 0,88 | 5 | 11,6 ± 4,35 |
| 3-я (МЖ) | 14 | 10,2 ± 3,58 | 14 | 11,7 ±0,67 | 8 | 15,3 ± 4,01 |
| 4-я (ГЭК 130/0.4) | 10 | 13,74 ± 2,43 | 10 | 12,5 ± 2,04 | 6 | 15,9 ± 2,31 |
| 5-я (солевые растворы) | 12 | — | 8 | — | 7 | — |
Состояние проблемы определило цель исследования и выбор контингента исследуемых больных.
Цель исследования - сравнить выраженность модифицирующего действия различных типов синтетических КОР на систему гемостаза у пациентов с исходной его патологией.
Материалы и методы.
Проспективное рандомизированное исследование проведено у больных с изолированной патологией VIII фактора свертывания — тяжелой формой гемофилии А (исходный уровень VIII фактора менее 1%) и у пациентов с тромбоцитопенией (исходный уровень тромбоцитов 70·109/л). В исследование включено 63 больных гемофилией А (средний возраст 16,2 ± 7,65 года) и 49 пациентов с тромбоцитопенией (34 больных идиопатической тромбоцитопенической пурпурой и 15 — апластической анемией; средний возраст 37,23 ± 15,46 года). Для сравнения обследовали 36 доноров костного мозга3(средний возраст 37,2 ± 9,0 года).
3 Одним из методов лечения гемобластозов является аллогенная трансплантация костного мозга, неотъемлемая часть которой — эксфузия костного мозга у доноров. Объем эксфузируемой костно-мозговой взвеси составляет в среднем 800—1000 мл и колеблется от 300 до 2500 мл. Для восполнения удаленного объема применяются коллоидные и кристаллоидные кровозаменители и аутоэритроциты [4, 5].
Инфузионная терапия с использованием синтетических КОР и солевых растворов проводилась с целью восполнения интраоперационной кровопотери. Больным гемофилией выполнялись синовэктомия коленного сустава (49 пациентов), корригирующая остеотомия бедренной кости (6) или эндопротезирование коленного сустава (8), пациентам с тромбоцитопенией — спленэктомия лапаротомным (32) или лапароскопическим (17) доступом. Средняя кровопотеря у больных гемофилией составила 728 ± 199,4 мл (22,4 ± 3,2% объема циркулирующей крови — ОЦК), у пациентов с тромбоцитопенией — 462,3 ± 156,2 мл (17,9 ± 4,1% ОЦК). Объем эксфузированной костно-мозговой взвеси у доноров составил 1422 ± 249,7 мл, или в среднем 29 ± 7,154% (от 16 до 43%).
По характеру объемозамещающей терапии все пациенты каждой из нозологий были разделены на 5 групп. В 1-й группе восполнение кровопотери проводилось 6% раствором ГЭК 200/0.5 (Инфукол, "Serum Werk Bernburg AG", ХАЕС-стерил, "Fresenius Kabi") в соотношении 1:2, во 2-й группе — раствором декстрана (полиглюкин, "Биохимик") в том же соотношении с солевыми растворами, в 3-й группе — препаратом модифицированного желатина — МЖ (гелофузин, "В. Brawn") с солевыми растворами в соотношении 1:1,5, в 4-й группе — 6% раствором ГЭК 130/0.4 (волювен, "Fresenius Kabi") с солевыми растворами (1:2). Пациентам 5-й (контрольной) группы восполнение кровопотери осуществлялось только солевыми растворами. Объем инфузионной терапии в I, 2, 3 и 4-й группах составлял 130—150% объема кровопотери, в 5-й группе — 150—200%. Число обследованных в группах и объем коллоидного компонента представлены в табл. 1.
Обеспечение гемостаза осуществлялось у больных гемофилией препаратом VIII фактора свертывания в дозе 56,34 ± 8,71 ед/кг. У пациентов с тромбоцитопенией при исходном уровне тромбоцитов менее 50·109/л и/или выраженном геморрагическом синдроме при условии отсутствия антитромбоцитарных антител проводилась трансфузия концентрата донорских тромбоцитов.
Исследование показателей сосудисто-тромбоцитарного (число и индуцированная агрегация тромбоцитов, уровень фактора Виллебранда) и коагуляционного гемостаза (активированное частичное тромбопластиновое время - АЧТВ, тромбиновое время, протромбиновый индекс, концентрация фибриногена, VIII и IX факторов свертывания), противосвертываюших механизмов (уровень антитромбина-Ш) и системы фибринолиза (ХПа-зависимый фибринолиз) осуществляли до операции (после проведения гемостатической терапии), в конце операции, через 8 и 24 ч после оперативного вмешательства.
Статистическая обработка результатов осуществлялась методом дисперсионного анализа с помощью программы "Biostat 4.03". Данные представлены в виде среднее ± стандартное отклонение
Результаты и их обсуждение.
Наиболее выраженное действие на систему гемостаза выявлено при использовании препаратов декстрана и ГЭК 200/0.5. Действие проявлялось у всех исследуемых категорий пациентов угнетением и коагуляционного, и сосудисто-тромбоцитарного звеньев (табл. 2, 3, рис. 1, 2). При этом ряд показателей (уровень VIII фактора и индуцированная агрегация тромбоцитов у больных гемофилией, индуцированная агрегация тромбоцитов у доноров костного мозга) при исходно нормальных значениях снижалась до субнормальных цифр. Наиболее грубые нарушения гемостаза отмечены в группах пациентов, у которых протокол объемозамещения предусматривал использование декстрана. Снижение показателей функции тромбоцитов, уровня VIII фактора (см. рис. 1) и удлинение связанного с ним временного показателя коагулограммы АЧТВ в данных группах превышали в среднем в 1,5 раза динамику показателей в близких к ним группах, в которых использовали ГЭК 200/0,5.
У пациентов с тромбоцитопенией как проявление эффекта выполненной спленэктомии к концу суток наблюдения отмечен значительный прирост числа тромбоцитов с тенденцией к восстановлению их функцию. Исключение составила группа пациентов, получавших декстран. Прирост тромбоцитов в данной группе был существенно меньше, чем в других, и функция страдала: индуцированная агрегация тромбоцитов к концу суток наблюдения была ниже исходных показателей и достигала практически нулевых значений (с АДФ 27,5 ± 11,75%, с ристоцетином 11,23 ±9,2%, с коллагеном 6,32 ± 2,23%).
Подобный эффект декстрана можно было ожидать, так как он является признанным лидером среди КОР по влиянию на систему гемостаза у пациентов без ее исходной патологии [2, 6, 12, 21]. Выраженность модифицирующего действия декстрана связана с присущими ему специфическими эффектами — взаимодействие с комплексом VIII фактора и силиконизирующий эффект, что обсуждалось ранее.
Таблица 2.
Динамика сосудисто-тромбоцитарного гемостаза у больных гемофилией А
| Группа больных | До операции | Конец операции | |||
| число тромбоцитов, ·109/л | агрегация тромбоцитов, % (АДФ, ристоцетин, коллаген) | число тромбоцитов, ·109/л | агрегация тромбоцитов, % (АДФ, ристоцетин, коллаген) | ||
| 1-Я (ГЭК 200/0.5) | 159 ± 58,45 | 63,4 ± 10,98 67,4 ± 10,59 55,89 ± 9,53 |
213,7 ± 46,5 | 51,2 ± 8,9 56,7 ± 12,86 38,33 ± 17,4 |
|
| 2-я (декстран) | 250,8 ± 45,7 | 58 ± 18,13 68,5 ± 7,5 60,4 ± 13,32 |
212 ± 33,03 | 39,5 ± 8,55 49 ± 8.832 33,4 ± 6,189 |
|
| 4-я (ГЭК 130/0.4) | 243,9 ± 44,8 | 47,71 ± 9,41 53,29 ± 11,2 50,86 ± 9,31 |
201,6 ± 47,5 | 43,86 ± 11,3 51,57 ± 14,1 45,43 ± 4,19 |
|
Таблица 3.
Динамика сосудисто-тромбоцитарного гемостаза у доноров костного мозга
| Группа больных | До операции | Конец операции | ||
число тромбоцитов, ·109/л |
агрегация тромбоцитов, % |
число тромбоцитов, ·109/л |
агрегация тромбоцитов, % |
|
| 1-Я (ГЭК 200/0.5) | 263 ± 42.74 | 62,33 ± 2.08 62,75 ± 24,9 69 ± 17,06 |
196,6 ± 31,1 | 43,33 ± 13,6 48,75 ± 12,8 53,33 ± 23,9 |
| 2-я (декстран) | 196,7 ± 20,5 | 69,75 ± 24,8 62,33 ± 1,15 62,5 ± 6,364 |
163,7 ± 15,1 | 40,75 ± 3,2 41 ± 8,89 50 ± 8,435 |
| 3-я (МЖ) | 280 ± 84,9 | 61,83 ±8,99 76,67 ± 7,53 67,8 ± 12,21 |
249,2 ± 63,1 | 76,17 ± 15,2 88,17 ± 11,4 66,4 ± 10,45 |
| 4-я (ГЭК 130/0.4) | 258 ± 48,8 | 57,5 ± 16,86 68 ± 21,53 57 ± 10,71 |
244 ± 42,17 | 73 ± 13,74 84,5 ± 18,48 76,75 ± 12,8 |
При исследовании схемы восполнения кровопотери, основанной на препарате МЖ, выявлено разнонаправленное его действие на гемостаз в зависимости от категории больных [3].
У 62% больных гемофилией (подгруппа а) применение МЖ сопровождалось лабораторными признаками тяжелого синдрома Виллебранда [28]. При этом у других больных гемофилией (38%) (подгруппа б) подобных изменений не отмечено: уровень фактора Виллебранда не менялся и функция тромбоцитов не страдала (рис. 3). В литературе есть описания подобных изменений, выявленных в клинике при применении производных желатина у пациентов без патологии гемостаза [15, 34, 35].
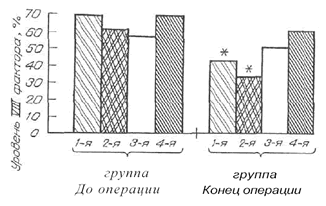 |
| Рис. 1. Динамика уровня VIII фактора у больных гемофилией А. |
Здесь и на рис. 2—4 "*" — р < 0,05.
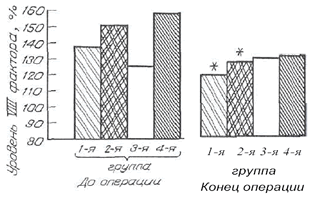 |
| Рис. 2. Динамика уровня VIII фактора у доноров костного мозга. |
N. Tabuchi и соавт. [34] после инфузии раствора желифундола (производного оксиполижелатина) в группе из 36 пациентов выявили достоверное (р < 0,05) снижение ристоцитинзависимой агрегации и активности плазменного фактора Виллебранда, Авторами обнаружена зависимость выраженности эффекта от примененной дозы КОР — лабораторные признаки синдрома Виллебранда отмечены только при использовании высоких доз препарата — более 3 л, или 40 мл/кг в сутки [34]. В отличие от наших данных авторы приводимых работ не отмечают описанной выше гетерогенности действия: если подобные эффекты выявлялись, то у всех исследуемых пациентов.
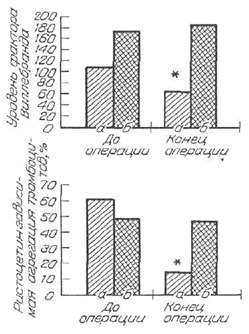 |
| Рис. 3. Проявления синдрома Виллебранда у больных гемофилией А при применении МЖ. |
При отсутствии или снижении фактора Виллебранда развивается литология тромбоцитарного гемостаза — синдром или болезнь Виллебранда. Главный лабораторный признак — снижение ристоцетинзависимой агрегации тромбоцитов.
Неоднородность изменений, установленных нами, труднообъяснима. Возможно, учитывая данные о дозозависимости действия МЖ на тромбоцитарный гемостаз, у меньшей части пациентов доза препарата оказалась недостаточной для проявления эффекта. Можно также предположить, что у большей части пациентов обсуждаемой группы дефицит VIII фактора сочетался со скрытой патологией фактора Виллебранда.
У больных тромбоцитопенией значимого влияния МЖ на сосудисто-тромбоцитарный гемостаз не отмечено, а при исследовании показателей свертывания крови обнаружена тенденция к гиперкоагуляции, что проявлялось достоверным (р < 0,05) укорочением АЧТВ на 5 с по сравнению с контролем при исходной нормокоагуляции.
При применении МЖ у доноров костного мозга выявлено стимулирующее действие как на коагуляционный гемостаз, проявляющееся достоверным (р < 0,05) укорочением АЧТВ на 7 с и тромбинового времени на 5 с по сравнению с контролем при исходной нормокоагуляции, так и на тромбоцитарный — достоверное (р < 0,05) усиление индуцированной агрегации тромбоцитов с АДФ (рис. 4). Представленные данные говорят о тенденции к увеличению гемостатического потенциала крови у пациентов обсуждаемых категорий при применении МЖ.
Данных об усилении агрегационных свойств тромбоцитов, связанных с инфузией препаратов желатина, в доступной литературе мы не встретили, однако некоторые авторы отмечают тромбогенность желатинов. S. Karoutsos и соавт. при анализе динамики тромбоэластограмм на фоне применения раствора МЖ у 42 пациентов выявили увеличение коагуляционного потенциала крови, при этом у одного больного отмечено развитие тромбоза глубоких вен голени. G. A. Egli и соавт. [13] получили аналогичные данные — увеличение коагуляционного потенциала крови в эксперименте in vitro.
Наименее выраженное действие на гемостаз у исследуемых категорий пациентов оказал препарат ГЭК 130/0.4 [8, 19, 24]. По данным большинства исследователей [7, 8, 18, 19], из всех приведенных выше механизмов воздействия КОР на гемостаз для ГЭК 130/0.4 отмечена только гемодилюция, что отличает его от других препаратов ГЭК. A. Franz и соавт. [16] показали, что ГЭК 130/0.38-0.45 единственные из модельного ряда крахмалов, включающего также ГЭК 450/0.7-0.8, 200/0.5-0.66 и 70/0.5-0.55, не влияют на функцию тромбоцитов [16], что подтверждено и исследованием Е. К. Епtholzner и соавт. [14]. Ряд исследователей выявили повышение активности фактора Виллебранда, связанное с инфузией данного препарата [8, 18]. Однако не все исследователи единодушны в оценке гемостазиологических эффектов Волювена. М. Jamnicki и соавт. [20] обнаружили равную степень повреждения системы гемостаза при применении ГЭК 200/0.5 и 130/0.4 в плане активации фнбринолиза: для обоих препаратов выявлено укорочение времени лизиса эуглобулинового сгустка.
В нашем исследовании влияния 130/0.4 на систему фибринолиза при применении ГЭК не отмечено. Однако следует обратить внимание на то, что активации фибринолиза мы не выявили ни в одной из групп пациентов, включая группу декстрана. Возможно, это обусловлено слабой чувствительностью применяемого в исследовании теста — определение ХIIа-зависимого фибринолиза.
По влиянию на другие показатели состояния системы гемостаза наши данные не противоречили результатам других исследований, полученным у пациентов с исходно интактным гемостазом. У пациентов с тромбоцитопенией отмечено достоверное повышение уровня фактора Виллебранда на 19,2% от исходного. Динамика других коагулологических тестов, включая уровень фактора Виллебранда у больных гемофилией и доноров костного мозга, не выходила за пределы гемодилюции и не сопровождалась изменением временных показателей.
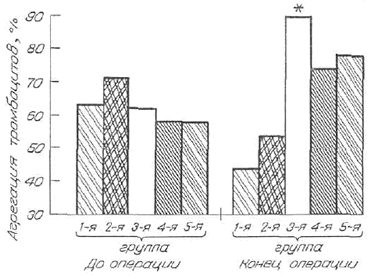 |
| Рис. 4. Динамика АДФ-индуцированной агрегации тромбоцитов у доноров костного мозга. |
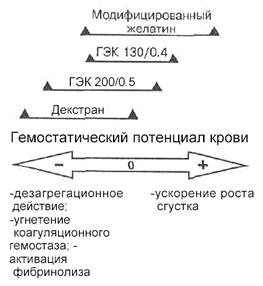 |
| Рис. 5. Сравнительная схема влияния различных синтетических КОР на гемостатический потенциал крови. |
Таким образом, в результате исследования при: применении препаратов МЖ и ГЭК 130/0.4, помимо гипокоагуляционного действия, у одних категорий пациентов выявлены и эффекты, свидетельствующие о повышении гемостатического потенциала крови у больных других групп. Более ярко такая разнонаправленность действия проявилась при использовании производных МЖ.
В литературе практически не освещен факт двоякого действия синтетических КОР на систему гемостаза. Большинство исследователей обсуждают гипокоагуляциоиные и дезагрегационные эффекты объемозамещающих препаратов. Есть отдельные работы, выявившие возможность увеличения гемостатического потенциала крови под воздействием КОР. Но в целом указанные эффекты никем не сопоставлены.
Разнонаправленность касается в большинстве случаев фактора Виллебранда и функционально связанного с ним тромбоцитарного гемостаза и отмечается как эффект производных желатина [13, 15, 28, 34, 35]. Е. Macintyre и соавт. [26] выявили укорочение тромбинового времени при использовании ГЭК 200/0.5. Наши данные свидетельствуют об активации как сосудисто-тромбоцитарного гемостаза (усиление индуцированной агрегации тромбоцитов, повышение активности фактора Виллебранда), так и системы свертывания (укорочение АЧТВ) главным образом при использовании МЖ у пациентов с тромбоцитопенией и доноров костного мозга.
Наиболее вероятная причина обсуждаемых изменений — взаимодействие молекул коллоида с фибронектином, отмечаемое и для декстранов, и для препаратов ГЭК, и для производных желатина [3], т. е. растворы всех обсуждаемых препаратов вызывают сходные изменения структуры и свойств тромба. Однако по данным тромбоэластограммы гиперкоагуляционный эффект отмечен только при применении желатинов [28] (исследований, основанных на проведении тромбоэластографии при применении ГЭК 130/0.4 в литературе не представлено). Таким образом, все синтетические КОР обладают свойством встраиваться в структуру тромба, однако только в случае желатина это сопровождается повышением гемостатического потенциала крови. Вероятно, при применении препаратов ГЭК групп hetastarch и pentastarch, а также декстранов указанный гиперкоагуляциониый эффект нивелируется снижением активности факторов свертывания, в первую очередь VIII, и угнетением функциональной активности тромбоцитов. В итоге действие, снижающее коагуляционный потенциал крови, преобладает. Угнетающее влияние желатина на активность системы гемостаза в большинстве случаев минимально (в нашем исследовании проявлялось только у больных гемофилией), в связи с чем, по-видимому, у них преобладает гиперкоагуляционное действие, связанное с непосредственным участием в образовании сгустка.
Схематически изложенное представление продемонстрировано на рис. 5. Данные, полученные D. Fries и соавт. [17] при комбинированном использовании синтетических КОР различных типов, косвенно подтверждают предложенную схему. По результатам упомянутого исследования при анализе тромбоэластограмм выявлено меньшее повреждающее влияние на систему гемостаза раствора ГЭК 200/0.5 в комбинации с раствором МЖ, чем при изолированном применении [17J. Применительно к нашей схеме: очевидно, в данном случае общий эффект влияния двух препаратов на систему гемостаза равнялся короткому общему для них отрезку. Гиперкоагуляционные эффекты желатина в определенной степени нивелировали гипокоагуляционное действие крахмала.
Выводы.
1. Наименьшее модифицирующее действие на гемостаз характерно для препарата ГЭК 130/0.4 — "Волювен". Это касается как меньшей выраженности гипокоагуляционного и дезагрегационного действия в сравнении с производными декстрана и другими среднемолекулярными крахмалами (ГЭК 200/0.5), так и меньшего диапазона от эффектов, снижающих коагуляционный потенциал крови, до эффектов, его повышающих в сравнении с препа ратами МЖ.
Волювен может быть назван препаратом выбора у пациентов с патологией гемостаза, а также для клинических ситуаций, когда влияние инфузионной терапии на систему гемостаза должно быть строго ограничено.
2. Наиболее грубые изменения в системе гемостаза характерны для производных декстрана, что не позволяет рекомендовать их применение у больных с патологией как коагуляционного, так и сосудисто-тромбоцитарного гемостаза.
3. Действие растворов МЖ на систему гемостаза оказалось различным по направленности. С одной стороны, применение растворов МЖ у больных ге мофилией А сопровождалось развитием синдрома Виллебранда с риском появления повышенной кровоточивости, с другой - у пациентов с исходно интактным гемостазом приводило к гиперкоагуляции и активации тромбоцитов. Проведение инфузионной терапии с применением МЖ привело к большему повышению гемостатического потенциала крови, чем инфузия только солевых растворов (см. рис. 5). Известно, что влияние последних на гемостаз минимально, и изменения в системе гемостаза в случае их использования обусловлены только операционной травмой и кровопотерей.
С точки зрения системы гемостаза терапевтическая ниша для препаратов МЖ довольно узка — это больные без патологии гемостаза и пациенты с изолированной патологией сосудисто-тромбоцитарного звена. Применение МЖ не может быть рекомендовано при недостаточности системы свертывания и у пациентов с высоким риском тромботических осложнений.
Литература
- Баркаган 3. С, Момот А. П. Диагностика и контролируе мая терапия нарушений гемостаза. — М., 2001.
- Буланов А. Ю., Городецкий В. М., Шулутко Е. М. // Рос. журн. анестезиол. и интенсив, тер. — 1999. — № 2. — С. 25-30.
- Буланов А. Ю., Городецкий В. Л/., Шулутко Е. М. и др. // Вестн. интенсив, тер. — 2002. — № 4. — С. 91—93.
- Красилышков О. А. Трансплантация костного мозга в кли нике и эксперименте. — М., 1984.
- Селидовкин Т.Д. // Гематол. и трансфузиол. — 1991. — № 12. - С. 32-34.
- Молчанов И. В., Гольдииа О. А., Горбачевский Ю. В. Раство-ры гилроксиэтилированного крахмала — современные и эффективные плазмозамещающне средства инфузионной терапии: Монографический обзор. — М., 1998.
- Asskali F., Lehmann G., Forster H. // Anasthesiol. Intensivmed. Notfallmed. Schmcrzther. - 2002. - Bd. 37. - S. 258-266.
- Baron J. F. И Tranfus. Aiternat. Transfus. Med. - 2000. -Vol.2. - № 2 . - P. 13-21.
- Boldt J., Midler M., Heesen M, et at. // Intensive Care Med. — 1996. - Vol. 22. - P. 1075-1081.
- Brodin В., Hesselvik P., von Schenck H. // Scand. J. Clin. Lab. Invest. - 1984. - Vol. 44. - P. 529-533.
- Brodman R. F., Sarg M., Veith F. J. et al. // Arch. Surg. -1977. - Vol. 49- - P. 24-27.
- De Jonge ?., Levi M. // Crit. Care Med. - 2001. - Vol. 29, N 6. - P. 1261-1267.
- Egli G. A., Zotlinger A., Seifert B, et al. // Br. J. Anaesth. -1997,- Vol. 78.- P. 684-689.
- Entholmer E. R., Mielke L. L, Calatzis A. N. et al. // Acta An-aesthesiol. Scand. - 2000. -Vol. 44, N 9. - P. 1 1 1 6 — 1 1 2 1 .
- Evans P. A., Glenn J. R., Heptinstall S., Madira // Br. J. Anaesth. - 1998. - Vol. 81. - P. 198-202.
- Franz A., Braunlich P., Gamsjager T. et al. // Anesth. Analg. —2001. - V o l. 9 2 . - P . 1 4 0 2 - 1 4 0 7 .
- Fries D., Innerlwfer P., Klingler A. et al. // Anesth. Analg. — 2002. - Vol, 94, N 5. - P. 1280-1287.
- Gailandat Hue! R. C. G., Siemens A. W., Bans D. et al. // Can. J. Anaesth. - 2000, - Vol. 47, N 12. - P. 1207-1215.
- Haisch G., Botdt J., Krebs S. et al. // J. Cardiothorac. Vase. Anesth. - 2001. - Vol. 15. - P. 316-321.
- Haijamae H. // Int. J. Intensive Care. — 1999- — Vol. 6, N 1.- P. 20-30.
- Harke H., Pieper C, Meredig J. et al. // Anaesthesist. — 1980.- Bd. 29. - S. 71.
- Jamnicki M., Zolimger A., Seifert B. et al. // Anesth. Analg. — 1998. - V o l . 8 7, N 5. - P. 98 9 - 9 9 3 .
- Karoutsos S., Nathan N., Lahrimi A. et al. // Br. J. Anaesth. — 1999. - V o l . 8 2, N 2. - P. 17 5 - 1 7 7 .
- Katsuda K., Maeno H. // Thromb. Res. - 1980. - Vol. 19. -P. 655-662.
- Langeron O., Doeiberg M., Ang E.-T. et al. // Anesth. Analg. — 2001. - Vol. 92. - P. 855-862.
- Macintyre E., Mackie I. J., Ho D. et al. // Intensive Care Med. - 1985. - Vol. 11. - P. 300-303.
- Mantel S. N., Sounders F, M., Allen H. et at. // Br. J. Anaesth. - 1998. - Vol. 80. - P. 204-207.
- Micluels J. /., Budde U., van der Planken M. et al. // Best Pract. Res. Clin. Haematol. — 2001. — Vol. 14, N 2. — P. 401-436.
- Strauss R. G. // Transfusion. - 1981. - Vol. 21. - P. 299— 302.
- Strauss R. G., Stump D. C, Henriben R. A. et al. // Transfu sion. - 19S5. - Vol. 25. - P. 230-234.
- Strauss R. G. // J. Cardiothorac. Anesth. - 1988. - Vol. 2. -P. 24-32.
- Strauss R. G., Stansfield C, Henriben R. A. et al. // Transfu sion. - 1988. - Vol. 28. - P. 257-260.
- Stump D. C, Strauss R. G., Henriksen R. A. et al. // Transfu sion. - 1985. - Vol. 25. - P. 349-354.
- Tabuchi N., Haan J., Gailandat Huet R. С G. et al. // Tromb. Haemost. - 1995. - Vol. 74. - P. 1447-1451.
- Thurner F, // Intensive Care Med. — 1990. — Vol. 16. — P. 148.
- Treib J., Baron J.-F., Grauer M. Т., Strauss R. G. Ц Intensive Care Med. - 1999. - Vol. 25. - P. 258-268.

