Профилактика преэклампсии и внутриутробной задержки роста плода с помощью аспирина, который назначался на ранних сроках беременности
Мета - анализ
Emmanuel Bujold, MD, MSc, Stephanie Roberge, MSc, Yves Lacasse, MD, MSc, Marc Bureau, MD, Franc`ois Audibert, MD, MSc, Sylvie Marcoux, MD, PhD, Jean-Claude Forest, MD, PhD, and Yves Gigue`re, MD, PhD
Статья опубликована в журнале Obstet Gynecol 2010;116:402–14
ЦЕЛЬ РАБОТЫ: Оценить влияние низких доз аспирина, назначенного на ранних сроках беременности, на частоту преэклампсии и внутриутробной задержки развития плода (ВЗРП).
ИСТОЧНИКИ ДАННЫХ: Систематический обзор и мета-анализы были выполнены с применением электронных поисковых систем (PubMed, Cochrane, Embase).
МЕТОДИКА ОТБОРА ИССЛЕДОВАНИЙ: Рандомизированные контролируемые исследования, проведенные у беременных женщин с риском развития преэклампсии, которые получали либо аспирин, либо плацебо (или полное отсутствие лечения). Вторичные исходы – внутриутробная задержка роста плода, тяжелая преэклампсия и преждевременные роды.
Эффект аспирина анализировали с учетом срока беременности на момент начала лечения (16 недель беременности и менее, 16 недель беременности и более).
РАСЧЕТЫ, СВЕДЕНИЕ ДАННЫХ И РЕЗУЛЬТАТЫ: Тридцать четыре рандомизированных контролируемых исследования соответствовали критериям включения, в том числе 27 работ (всего включены 11,348 женщин), в которых проводилось наблюдение за исходом преэклампсия. Если применение аспирина в низких дозах начинали на 16 неделе беременности или ранее, это сопровождалось значительным снижением числа случаев преэклампсии (относительный риск – ОР – 0.47, 95% доверительный интервал (ДИ) 0.34–0.65, распространенность 9.3% у получавших лечение по сравнению с 21.3% в контрольной группе) И ВЗРП (ОР 0.44, 95% ДИ 0.30–0.65, распространенность в 7% у получавших лечение по сравнению с 16.3% в контрольной группе), тогда как при начале лечения после 16 недель беременности предупреждения преэклампсии достигнуть не удалось (преэклампсия: ОР 0.81, 95% ДИ 0.63–1.03, распространенность 7.3% в группе, получавшей лечение, по сравнению с 8.1% в контрольной группе; внутриутробная задержка роста плода: ОР 0.98, 95% ДИ 0.87–1.10, распространенность 10.3% в группе, получавшей лечение и 10.5% в контрольной группе). Лечение низкими дозами аспирина, начатое при сроке беременности 16 недель и ранее, также сопровождалось значительным уменьшением числа случаев тяжелой преэклампсии (ОР 0.09, 95% ДИ 0.02– 0.37, 0.7% в группе получавших лечение и 15.0% в контрольной группе), гестационной артериальной гипертензии (ОР 0.62, 95% ДИ 0.45– 0.84, 16.7% в группе получавших лечение и 29.7% в контрольной группе), а также преждевременных родов (ОР 0.22, 95% ДИ 0.10–0.49, 3.5% в группе получавших лечение и 16.9% в контрольной группе). Следует отметить, что во все исследования, в которых аспирин начинали применять при сроке беременности 16 недель и меньше, были включены женщины, у которых был средний и высокий риск развития преэклампсии.
ВЫВОДЫ: Лечение низкими дозами аспирина, начатое на ранних сроках беременности, является эффективным методом профилактики преэклампсии и внутриутробной задержки роста плода.
Преэклампсия и внутриутробная задержка роста плода (ВЗРП) являются важной причиной осложнений и летальности как у матерей, так и у детей (1,2). Преэклампсия осложняет течение примерно 2–5% беременностей и является причиной гибели примерно 100,000 женщин во всем мире (2). В развитых странах, она остается основной причиной таких тяжелых осложнений у матери, как коагулопатия, почечная и печеночная недостаточность, инсульт и наконец, материнской смертности (3). Преэклампсия также сопровождается увеличением риска возникновения внутриутробной задержки роста плода в четыре раза, а это имеет как ближайшее, так и отдаленное влияние на состояние здоровья новорожденного (4). Дети, страдавшие внутриутробной задержкой роста плода, имеют высокий риск ожирения, сердечно-сосудистых заболеваний, артериальной гипертензии и диабета во взрослом возрасте (5,6).
Хотя истинные причины преэклампсии м ВЗРП до сих пор остаются неясными, оба состояния совершенно явно связаны с дефектной плацентацией, что приводит к неадекватному маточно-плацентарному кровотоку и ишемии (7). При нормальной плацентации происходит инвазия клеток трофобласта в спиральные артерии, что приводит к обратимым изменениям в нормальной архитектонике стенки артерии (8).
Физиологическая инвазия трофобласта в спиральные артерии начинается с 18 недель беременности и считается, что она завершается к 16-20 неделям беременности (7,9,10). Недавно проведенные исследования показали, что изменения артериального кровотока при допплерометрии и сывороточные маркеры дефектной плацентации позволяют выделить группу женщин с высоким риском развития преэклампсии и внутриутробной задержки роста плода уже в первом триместре беременности (11,12).
Неадекватная перфузия плаценты и ее ишемия провоцирует дисфункцию эндотелия, с активацией тромбоцитов и системы свертывания крови (13,14). Поэтому гипотеза о том, что антитромбоцитарные средства способны предотвращать развитие преэклампсии и внутриутробной задержки роста плода, в последние 30 лет вызывает неподдельный интерес (15,16). Считается, что аспирин в низких дозах может ингибировать вазоконстрикцию, обусловленную тромбоксаном, и тем самым, предотвратить спазм сосудов и патологическое свертывание крови в плаценте (17,18). Предполагалось, что применение аспирина в низких дозах способно предупреждать нарушения физиологической трансформации спиральных артерий, и тем самым, развитие преэклампсии и внутриутробной задержки роста плода. Однако результаты рандомизированных исследований по данной проблеме оказались противоречивыми (16,19,20). Несколько крупных, проспективных, многоцентровых исследований не смогли доказать клиническую эффективность аспирина в низких дозах в плане профилактики преэклампсии (20–23). С другой стороны, позднее начало лечения (после 18-20 недели беременности) и включение в исследование пациенток из группы низкого риска могут быть логичным объяснением отрицательных или слабо-положительных результатов исследований. И на самом деле, недавно мы обнаружили, что профилактическое применение аспирина в низких дозах, начатое до 16 недель беременности у женщин с патологическими результатами допплерометрии, сопровождалось уменьшением числа случаев преэклампсии на 50% (24).
В данном обзоре мы посчитали необходимым оценить и сравнить влияние срока беременности на момент начала терапии аспирином на частоту развития преэклампсии и внутриутробной задержки роста плода посредством выполнения системиатического обзора и мета-анализов всех случаев, в которых женщин относили к группе риска развития преэклампсии.
ИСТОЧНИКИ
Стратегия поиска – источники выбирались из баз данных Embase, PubMed и Кохрейновского центрального регистра контролируемых исследований (CENTRAL), начиная с 1965 года и заканчивая июлем 2008. Ключевые слова – Беременность, Осложнения беременности, Аспирин, Преэклампсия, Гипертензия, Эклампсия, Артериальное давление. Ограничения по языку не устанавливались.
Все исследования, подходившие по критериям поиска, были тщательно проанализированы, классифицированы, а разночтения выносились на совместное обсуждение.
КРИТЕРИИ ОТБОРА ИССЛЕДОВАНИЙ
В работу были включены только проспективные, рандомизированные, контролируемые исследования. Квази-рандомизированные исследования из мета-анализа исключались.
Группу пациентов составили только беременные женщины с риском развития эклампсии. Ограничений по критериям риска развития преэклампсии не было, но учитывалась частота развития преэклампсии, зафиксированная в каждой работе. Женщины в группе, получающей лечение, принимали аспирин в низких дозах (от 50 до 150 мг ацетилсалициловой кислоты в день, самостоятельно или в сочетании с другим антитромбоцитарным препаратом, дипиридамолом, не более 300 мг в сутки). Контрольная группа получала либо плацебо, либо вообще ничего. Исследования исключали из мета-анализа, если 20% и более пациенток отрывались от последующего наблюдения, чтобы не допустить ошибок (26). Также исключали исследования с неясными критериями отбора, с применением нумерованных таблеток или заклеенных конвертов, чтобы избежать ошибок отбора (26).
Была подготовлена публикация о качестве проведенных исследований (27).
Первичным исходом была частота преэклампсии. Вторичные исходы – внутриутробная задержка роста плода (ВЗРП), тяжелая преэклампсия, гестационная артериальная гипертензия, отслойка плаценты, низкий вес при рождении и срок беременности на момент родов (Таблица 1). Во избежание ошибок отбор данных из исследований осуществляли два автора независимо друг от друга. Каждый исход был стратифицирован в зависимости от срока беременности на момент начала терапии аспирином – 16 полных недель беременности или меньше и срок более 16 недель беременности. Порог срока беременности был установлен на основании физиологических изменений – трансформации спиральных артерий, что обычно происходит при сроке беременности от 16 до 20 недель (7,9).
Таблица 1.
Определение исходов и характеристик включения
| Исходы и критерии включения |
Определения характеристик |
| Преэклампсия | Хроническая гипертензия у беременной в сочетании с протеинурии, диагностированная после 20-ой недели беременности |
| Гестационная гипертензия | Систолическое АД 140 mmHg и выше, или диастолическое АД 90 mmHg и выше, или то и другое, зарегистрированное после 20-ой недели беременности (9) |
| Протеинурия | 300 и более миллиграммов белка в суточной моче или положительная реакция на белок в средней порции мочи (10) |
| Тяжелая преэклампсия | Диагностируется по следующим критериям: тяжелая гипертензия (АД по крайней мере 160 mmHg систолическое или110 mmHg диастолическое или 105 mmHg диастолическое), выраженная протеинурия (по крайней мере 2, 3 или 5 г белка в суточной моче или 3+ при исследовании тест- полосками), снижение суточного диуреза (менее 400-500 мл мочи за сутки), неврологические нарушения, например, головная боль, изменения зрения, боль в верхних отделах живота, отек легких, изменения функциональных печеночных проб, повышение сывороточного креатинина, тромбоцитопения. |
| Внутриутробная задержка роста плода | Вес ниже 10-ой перцентили (ВЗРП, меньше 10 перцентили) или вес при рождении менее пятой или третьей перцентили, или дети, маловесные для гестационного возраста (то есть любое определение ВЗРП) |
| Преждевременные роды | Роды до срока беременности до 37 недель беременности, или, если точно срок беременности не известен, то роды до 36, 35 или 34 недель беременности |
| Отслойка плаценты | Отслойка плаценты или кровотечение у беременной |
| Вес при рождении | Вес новорожденного ребенка в граммах |
| Гестационный возраст | Срок беременности на момент рождения в неделях |
| Популяционный риск преэклампсии | Распространенность преэклампсии, зафиксированная в контрольной группе |
| Низкий | 7% и менее |
| Умеренный или высокий | Более 7% |
Анализ всех данных по женщинам, включенным в исследование, проводился до окончания беременности.
Относительный риск для подгрупп рассчитывался с поправкой на срок беременности на момент включения в исследование. Наконец, исследования были разделены на 2 группы: распространенность преэклампсии 7% и менее – группа низкого риска, распространенность преэклампсии более 7% - умеренный и высокий риск преэклампсии. Значение P менее 0.05 рассматривались, как статистически достоверные.
РЕЗУЛЬТАТЫ
При поиске источников в литературе были отобраны 773 статьи, как потенциально пригодные для включения в исследование. Из них были исключены 290, так как они не соответствовали критериям включения (Рис. 1). Для данного обзора были проанализированы 34 исследования, в том числе 27 – по первичному исходу (преэклампсия), всего выборка составила 11,348 женщин (20,21,23,35–66). Для второго включения в работу 337 публикаций осуществлялось в соответствии со взвешенным критерием каппа 0.88.
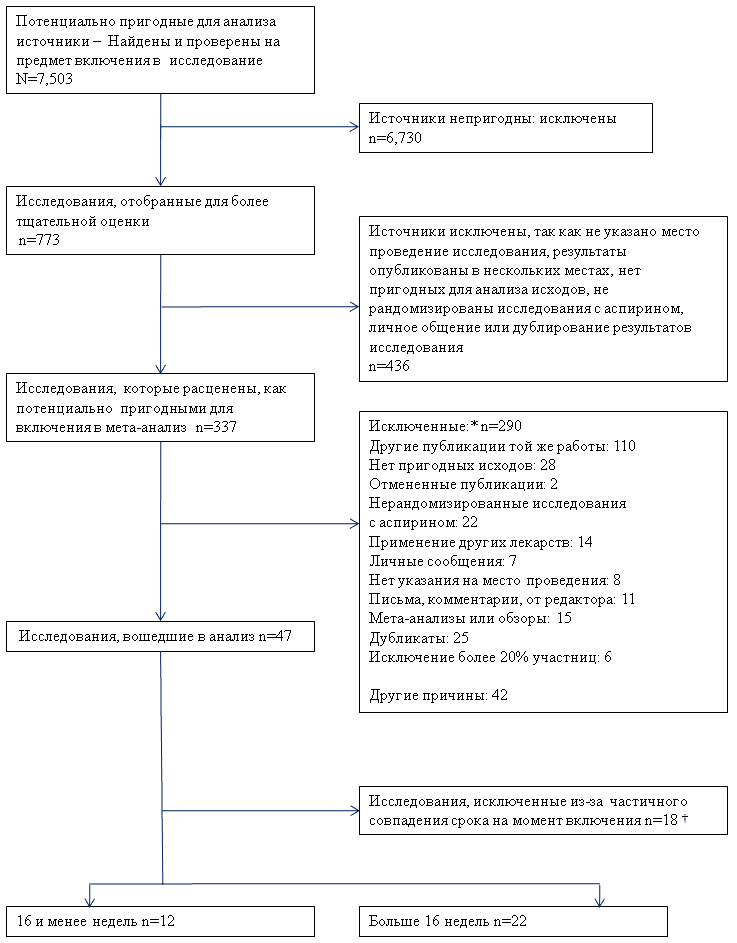 |
|
В дополнение к электронному поиску, другие недавно проведенные мета-анализы позволили нам подтвердить полноту проведенного нами поиска литературных источников (16,67–69). Все выбранные статьи были опубликованы в период с 1985 по 2005, исследования проводились более, чем в 20 странах. В двенадцати исследованиях представлены результаты исследований, проведенных у женщин, включенных до 16 недель беременности, а в 22 публикациях – результаты, полученные после 16 недель беременности. В таблице 2 представлены характеристики всех включенных в мета-анализ исследований, а в Таблице 3 – сводные показатели качества исследований (метод рандомизации, ослепление, эффективность вмешательства и процент женщин, которые были под наблюдением до окончания исследования) в каждой подгруппе.
Таблица 2.
Характеристики включенных исследований
| Первый автор, год |
Участницы | Критерии включения | Вмешательство | Исход |
| 16 недель беременности и менее | ||||
| August, 199435 | 54 женщины на сроке 13–15 недель | Хроническая АГ или тяжелая преэклампсия в анамнезе |
Аспирин 100 мг в сравнении с плацебо |
ПЭ, тяжелая ПЭ, ВЗРП, отслойка плаценты |
| Azar, 199037 | 91 женщин на сроке 16 недель |
В анамнезе – ранняя тяжелая преэклампсия, тяжелая ВЗРП, или гибель плода вследствие плацентарной недостаточности | Аспирин 100 мг или дипиридамол 300 мг в сравнении с плацебо | ПЭ, гестационная гипертензия, низкий вес при рождении, гестационный возраст |
| Beaufils, 198538 | 102 женщины, срок беременности от 14 недель | В анамнезе несколько осложненных беременностей, или сосудистые факторы риска – например, эссенциальная гипертензия (АД выше 160/95) или семейный анамнез гипертензии. | Аспирин 100 мг или дипиридамол 300 мг в сравнении с плацебо | ПЭ, тяжелая ПЭ, ВЗРП, отслойка плаценты, низкий вес при рождении, гестационный возраст |
| Benigni, 198939 | 33 женщины, срок беременности 12 недель | Эссенциальная гипертензия или отягощенный акушерский анамнез | Аспирин 60 мг в сравнении с плацебо | ПЭ, тяжелая ПЭ, ВЗРП, отслойка плаценты, низкий вес при рождении, гестационный возраст |
| Chiaffarino, 200441 | 40 женщин, срок беременности до 14 недель | Хроническая артериальная гипертензия с нефропатией или без нее, тяжелая ПЭ в анамнезе, эклампсия, ВЗРП, или метроворождение | Аспирин 100 мг в сравнении с отсутствием лечения | Ребенок, маловесный для гестационного возраста, вес при рождении, гестационный возраст на момент рождения, гипертензия |
| Dasari, 199836 | 50 женщин, срок беременности 12 недель | Первородящие женщины | Аспирин 100 мг в сравнении с плацебо | Ребенок, маловесный для гестационного возраста, вес при рождении, гестационный возраст на момент рождения |
| Ebrashy, 200543 |
139 женщин, срок беременности 14-16 недель | Нарушения маточного кровотока по данным Допплеровского исследования, наличие факторов риска ПЭ и ВЗРП | Аспирин 75 мг в сравнении с отсутствием лечения | ПЭ, тяжелая ПЭ, преждевременные роды, ВЗРП, вес при рождении, отслойка плаценты |
| Hermida, 199750 | 107 женщин, срок беременности 12-16 недель | Семейный или личный анамнез гестационной артериальной гипертензии, преэклампсии, хронической артериальной гипертензии, болезни сердечно-сосудистой или эндокринной системы, самопроизвольные выкидыши, многоплодная беременности, или ожирение у первородящей (моложе 18 лет или старше 35). |
Аспирин 100 мг в сравнении с плацебо | ПЭ, тяжелая ПЭ, преждевременные роды, ВЗРП, вес при рождении, отслойка плаценты |
| Michael, 199252 |
110 женщин, срок беременности 16 недель | Артериальная гипертензия на ранних сроках беременности, диастолическое АД выше DBP 90 mmHg или систолическое АД 140 mmHg и выше, или тяжелая преэклампсия в анамнезе |
Аспирин 100 мг в сравнении с плацебо | ПЭ, гестационная гипертензия |
| Tulppala, 199759 |
66 женщин, срок беременности примерно 7 недель | Ранее – неоднократные самопроизвольные выкидыши | Аспирин 50 мг в сравнении с плацебо | ПЭ, преждевременные роды, вес при рождении |
| Vainio, 200260 |
90 женщин, срок беременности 12 – 14 недель | Наличие в анамнезе факторов риска в сочетании с нарушениями маточного кровотока при Допплеровском исследовании | Аспирин 0.5 мг/кг/сут в сравнении с плацебо | ПЭ, тяжелая ПЭ, преждевременные роды, ВЗРП, вес при рождении, отслойка плаценты |
| Срок беременности более 16 недель | ||||
| Byaruhanga, 199866 |
250 женщин, срок беременности 20-28 недели | ПЭ или хроническая артериальная гипертензия в анамнезе | Аспирин 75 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, вес при рождении, отслойка плаценты |
| Caritis, 199821* | 2,539 женщин, срок беременности 13-26 недели | Инсулинозависимый сахарный диабет, хроническая артериальная гипертензия, многоплодная беременность или ПЭ в анамнезе | Аспирин 60 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, вес при рождении, отслойка плаценты |
| CLASP, 199420* |
9,364 женщины, срок беременности 12- 32 недели |
Риск развития ПЭ на основании хронической артериальной гипертензии в анамнезе, заболеваний почек, большой возраст матери, семейный анамнез сердечно-сосудистых заболеваний, многоплодная беременность, уже диагностированная ПЭ или ВЗРП | Аспирин 60 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП |
| Davies, 199542 |
122 женщины, срок беременности 18 недель | Первородящие, гемоглобин выше 132 г/л на 12-19 неделе беременности, диастолическое артериальное давление ниже 90 mmHg, не выявлена протеинурия |
Аспирин 75 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении, маловесные для гестационного возраста дети |
| ECPPA, 199644* |
1,009 женщин, срок беременности 12- 32 недели |
Хроническая артериальная гипертензия, первобеременные, сахарный диабет, патология почек, ПЭ или ВЗРП в анамнезе | Аспирин 60 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении, маловесные для гестационного возраста дети |
| Ferrier, 199645 |
43 женщины, срок беременности 22- 24 недели | Первородящие с индексами резистентности кровотока в маточных артериях со стороны плаценты выше 90-го центиля, или с диастолическим «провалом» | Аспирин 60 мг в сравнении с плацебо | ПЭ, гестационная гипертензия |
| Gallery, 199746 |
120 женщин, срок беременности 17- 19 недель | Фоновая хроническая артериальная гипертензия, патология почек или рано возникшая преэклампсия в анамнезе | Аспирин 100 мг в сравнении с плацебо | Преждевременные роды, маловесный для гестационного возраста ребенок, отслойка плаценты |
| Grab, 200047 |
43 женщины, срок беременности 20 недель | Одноплодная беременности с рано развившейся ВЗРП, ухудшение маточно-плацентарного кровотока, хроническая артериальная гипертензия, ПЭ, ВЗРП или мертворождение в анамнезе | Аспирин 100 мг в сравнении с плацебо | ПЭ |
| Golding, 199823* |
6,275 женщин, срок беременности 12-32 недели | Первородящие женщины | Аспирин 60 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении, маловесные для гестационного возраста дети |
| Hauth, 199348 |
606 женщин, срок беременности 24 недели | Первородящие женщины, здоровые, с одноплодной беременностью | Аспирин 60 мг в сравнении с плацебо | ПЭ, тяжелая ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении |
| McParland, 199051 |
106 женщин, срок беременности 24 недели | Первородящие женщины со стойкими изменениями маточно-плацентарного кровотока при допплеровском исследовании |
Аспирин 75 мг в сравнении с плацебо | ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении, маловесные для гестационного возраста дети |
| Morris, 199653 | 104 женщины, срок беременности 17- 19 недель | Первородящие женщины со стойкими изменениями маточно-плацентарного кровотока при допплеровском исследовании на 18 неделе беременности (S/D отношение выше 3.3 или выше 3 с ранним диастолическим «провалом») |
Аспирин 100 мг в сравнении с плацебо | роды, ВЗРП, гестационный возраст на момент родов, вес при рождении |
| Newnham, 199554 |
51 женщина, срок беременности 28-36 недель | ВЗРП, нарушения кровотока в маточной артерии: S/D отношение при допплеровском исследовании выше 95-ой перцентили |
Аспирин 100 мг в сравнении с плацебо | преждевременные роды, ВЗРП, гестационный возраст на момент родов, вес при рождении |
| Rogers, 199955 |
215 женщины, срок беременности 22 недели | Первобеременные женщины с нормальным артериальным давлением, среднее артериальное давление от 80 до 106 mmHg в начале второго триместра и САД выше 60 |
Аспирин 80 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП, вес при рождении |
| Rotchell, 199856* |
3,697 женщин, срок беременности 12-32 недели | Все беременные женщины без противопоказаний | Аспирин 75 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов |
| Schiff, 198957 |
65 женщин, срок беременности 28-29 недель | Беременность близнецами, ПЭ в анамнезе, первородящие, положительный постуральный тест на 28–29 неделе беременности | Аспирин 100 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов |
| Schrocksnadel, 199258 |
41 женщина, срок беременности 28-32 недели | Первородящие, положительный постуральный тест |
Аспирин 80 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП, гестационный возраст на момент родов |
| Wallenburg, 198661 |
46 женщин, срок беременности 28 недель | Чувствительные к ангиотензину II–первобеременные, без хронической артериальной гипертензии, сердечно-сосудистой и почечной патологии в анамнезе, диастолическое артериальное давление ниже 80 mmHg |
Аспирин 60 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП |
| Wang, 199662 |
84 женщины, срок беременности 28-34 недели | В основном первобеременные с одноплодной беременностью с высоким риском ВЗРП | Аспирин 75 мг в сравнении с плацебо | ПЭ, гипертензия, тяжелая ПЭ, преждевременные роды, ВЗРП |
| Wu, 199663 |
104 женщины, срок беременности 30-32 недели |
Женщины старшего возраста – первобеременные, повторнобеременные с тяжелой артериальной гипертензией, обусловленной беременностью, ожирением, средним артериальным давлением выше 12 kPa, гемоглобин менее 80 г/л, PCV больше 0.37, семейный анамнез хронической артериальной гипертензии или гипертензии, обусловленной беременностью. | Аспирин 50 мг в сравнении с плацебо | Гипертензия, вес при рождении |
| Yu, 200364 | 560 женщин, срок беременности 22-24 недели | Одноплодная беременность и индексы пульсации при допплеровском исследовании более 1.6 (95- я перцентиль) |
Аспирин 150 мг в сравнении с плацебо | ПЭ, тяжелая ПЭ, ВЗРП, преждевременные роды, отслойка плаценты |
| Zimmermann, 199765 |
26 женщин, срок беременности 22-24 недели | Двусторонние «провалы» в кровотоке при допплеровском исследовании | Аспирин 50 мг в сравнении с отсутствием лечения | ПЭ, гипертензия, вес при рождении, гестационный возраст, преждевременные роды, ВЗРП, отслойка плаценты |
ПЭ – преэклампсия, ВЗРП – внутриутробная задержка роста плода, АД – артериальное давление, S/D – систоло-диастолическое отношение.
* В данных исследованиях нет результатов обследований, полученных при сроке беременности более 20 недель.
Таблица 3.
Обобщенные результаты по качеству 34 исследований, включенных в мета-анализ
| Исход | 16 недель и менее (n=12) | Более 16 недель (n=22) |
| Метод рандомизации | ||
| Сгенерировано компьютером |
3 (25) | 11 (50) |
| Запечатанные конверты |
— | 2 (9) |
| Другие |
3 (25) | 4 (18) |
| Не сообщается | 6 (50) | 5 (23) |
| Намерение лечить | ||
| Да |
4 (33) | 10 (46) |
| Не сообщается | 8 (67) | 12 (55) |
| Ослепление | ||
| Двойное |
4 (33) | 16 (73) |
| Одинарное | 1 (8) | 2 (9) |
| Не было | 3 (25) | 2 (9) |
| Не сообщается | 4 (33) | 2 (9) |
Все данные представлены в %.
Женщин относили к группе риска преэклампсии по гетерогенным критериям, в том числе – это были первородящие, пациентки с преэклампсией в анамнезе, имеющие нарушения при Допплеровском исследовании маточно-плацентарного кровотока, и другие факторы риска.
Отмечено значительное снижение частоты преэклампсии среди подгруппы женщин, которые начали принимать аспирин на сроке беременности 16 недель и меньше (ОР 0.47, 95% ДИ 0.34–0.65), тогда как в подгруппе, где применение аспирина было начато позже 16 недель беременности, такой эффект зарегистрирован не был (ОР 0.81, 95% ДИ 0.63–1.03) (Рис. 2). Разница в воздействии лечения на риск преэклампсии между двумя группами была существенной (анализ смешанной регрессии для сравнения двух подгрупп дал значение P<.01). Существенное различие частоты тяжелой преэклампсии, гестационной артериальной гипертензии и преждевременных родов также наблюдались в подгруппе, где аспирин начинали принимать на сроке 16 недель беременности и меньше (Таблица 4). Более того, средний срок беременности на момент родов (взвешенная средняя разница 1.4 недели, 95% ДИ 0.4 –2.3 недель) был больше, когда аспирин начинали принимать на сроке беременности 16 недель и меньше, в отличие от той подгруппы, где аспирин принимали на сроке беременности больше 16 недель (взвешенная средняя разница 0.0 недель; 95% ДИ -0.7 - 0.7 недель). На распространенность отслойки плаценты аспирин не влиял.
Снижение частоты ВЗРП (это вес при рождении менее 10-ой перцентили), было существенным только в группе женщин, которые начинали принимать аспирин на сроке беременности 16 недель и меньше (Рис. 3) (анализ смешанной регрессии для сравнения исходов в субгруппах показал значение P< 0.001). Среднее увеличение веса при рождении составило 196 г (95% ДИ 107–285 г), если аспирин начинали принимать на сроке беременности в 16 недель и менее, если же прием начинали после 16 недель беременности, то вес увеличивался в среднем на 70 г (95% ДИ 15–124 г).
Авторы также обнаружили, что гетерогенность в каждой из подгрупп была меньше, чем при анализе гетерогенности во всей выборке, и она практически отсутствовала в подгруппе, где аспирин начали принимать при сроке беременности 16 недель и менее (I2 для преэклампсии: в группе, где аспирин начинали принимать на сроке беременности 16 недель и меньше - 0%, более 16 недель - 48%, всего 52%; I2 для ВЗРП: в первой группе 0%, во второй группе 1%, всего 28%). Эта находка поддерживает гипотезу о том, что аспирин по-разному действует в разные сроки беременности. Анализ диаграммы показал, что тут может быть проблема из-за того, что упущены мелкие исследования, которые не показали преимуществ аспирина (Рис. 4) (33).
Эти результаты были подтверждены тестом Эггера, который показал, что асимметрия и сдвиг публикации были значительны в группе женщин, которые получали аспирин на сроке 16 недель беременности и менее. Эти результаты позволяют предположить объемную переоценку. Поскольку между исследованиями могут существовать и другие различия, авторы выполнили анализ чувствительности, чтобы оценить приблизительность результатов (Рис. 5). При проведении данного анализа было обнаружено, что вариабельность в группе, которая получала аспирин на сроке беременности 16 недель и менее, была минимальной: не было выявлено статистически достоверной разницы в статистических моделях, использованных для анализа, методах ослепления, выборке исследования, дозе аспирина, и добавлении дипиридамола в схему лечения.
Следует отметить, что в этой подгруппе оказалось только одно крупное исследование, в котором были только пациентки с риском преэклампсии от среднего до высокого (распространенность преэклампсии в контрольной группе 7% и более).
ВЫВОДЫ
Авторы подтвердили, что ежедневный прием низких доз аспирина, начатый до 16 недели беременности, достоверно снижает частоту преэклампсии, тяжелой преэклампсии, ВЗРП и преждевременных родов у женщин, которые находятся в группе риска развития преэклампсии. Выводы авторов полностью подтвердили результаты ранее проведенных мета-анализов, которые показали, что прием аспирина в низких дозах снижает вероятность развития преэклампсии, причем без учета срока беременности, на котором начинали прием (16,68). Также результаты совпадают с результатами недавно опубликованного ретроспективного исследования Baschat с соавт., которые сообщили, что прием аспирина в низких дозах, начатый в первом триместре беременности снижает сопротивление плацентарному кровотоку и наиболее вероятно, предотвращает развитие преэклампсии (70). Более того, результаты работы также совпали с итогами недавно проведенного рандомизированного исследования, которое показало более низкую частоты гипертензии, обусловленной беременностью, в группе, принимавшей аспирин в низких дозах в первом триместре беременности, наступившей после экстракорпорального оплодотворения (71). Новизна проведенного авторами исследования заключается в проведении анализа по подгруппам, выделенным по сроку беременности на момент начала приема аспирина. В ранее опубликованном мета-анализе Duley с соавт. сообщили об отсутствии статистически достоверной разницы в частоте преэклампсии при приеме аспирина в низких дозах до 20 недель беременности и после этого срока (68). В большинстве случаев в том мета-анализе «срок до 20 недель» означал 16-18 недель.
Таким образом, все эти результаты позволяют предположить следующее:
- У женщин с риском преэклампсии от среднего до высокого аспирин может предотвратить развитие преэклампсии и ВЗРП,
- Чем раньше начата профилактика низкими дозами аспирина, тем более эффективна профилактика преэклампсии и ВЗРП.
Остается неясным, существует ли пороговый срок беременности, при котором профилактика аспирином становится уже неэффективной, и необходимость продолжения профилактического лечения вплоть до окончания беременности.
Ограничения нашего мета-анализа – снижение силы результатов из-за стратификации выборки на подгруппы. Такие результаты могут привести к ложно-отрицательными результатами. Мы обнаружили, что исследования, проведенные в подгруппах на сроке беременности 16 недель и меньше, включали только женщин со средним и высоким риском развития преэклампсии, и в них использовались более высокие дозы аспирина. Однако, тот факт, что в подгруппах (до 16 недель беременности и после 16 недель) была отмечена выраженная гомогенность, позволяет предположить существенную роль срока беременности, в который начинается профилактический прием аспирина. Выраженная гомогенность результатов различных исследований в подгруппе, где профилактику аспирином начинали на сроке беременности 16 недель и менее, говорит о реальном эффекте аспирина в этой подгруппе. С другой стороны, на диаграмме и при анализе чувствительности становятся видны возможные сдвиги публикаций.
Результаты проведенного мета-анализа имеют важное клиническое значение.
В настоящее время появляется все больше и больше подтверждений тому, что у большого количества женщин, имеющих средний и высокий риск преэклампсии, главным образом рано начавшейся преэклампсии, тяжелой преэклампсии и ВЗРП, можно выявить такой высокий риск на ранних сроках беременности по сочетанию нескольких факторов, а именного среднего артериального давления, индекса массы тела, этнического происхождения, сывороточных маркеров и данных Допплеровского исследования маточно-плацентарного кровотока (72). Более того, недавно опубликованные результаты исследований позволяют предположить, что трехмерное исследование плаценты в первом триместре беременности может также рано прогнозировать развитие плацентарной недостаточности (73,74).
Поэтому мы предположили, что возможно выявлять женщин с риском преэклампсии или ВЗРП от среднего до высокого для профилактики этих осложнений течения беременности аспирином в низких дозах, который начинают принимать с ранних сроков беременности. В будущих рандомизированных исследованиях следует уточнить оптимальную дозу аспирина, или проведение тестов на агрегацию тромбоцитов, чтобы отрегулировать дозу (75,76). Более того, с учетом недавно опубликованных результатов рандомизированных исследований, которые показали, что низкомолекулярные гепарины также могут снизить вероятность развития тяжелой преэклампсии, требуются дальнейшие сравнительные исследования для сравнения гепаринов и низких доз аспирина в популяциях высокого риска (77).
Основываясь на результатах настоящего обзора, можно утверждать, что существуют доказательства, что профилактика низкими дозами аспирина, начатая на ранних сроках беременности, может снижать частоту преэклампсии, ВЗРП и преждевременных родов у женщин с риском развития преэклампсии от среднего до высокого. Следует отметить, что большинство исследований, проведенных в подгруппе на сроке беременности 16 недель и меньше, имели небольшие группы, и поскольку были сдвиги публикаций, мы считаем, что необходимы крупные рандомизированные контролируемые исследования, которые подтвердят наши результаты. С развитием метода прогнозирования высокого риска преэклампсии будет возможно выполнение рандомизированных исследований с отслеживанием групп высокого риска преэклампсии с ранних сроков беременности и профилактики преэклампсии и ВЗРП низкими дозами аспирина с ранних сроков.
СПИСОК ЛИТЕРАТУРЫ
- Geographic variation in the incidence of hypertension in pregnancy. World Health Organization International Collaborative Study of Hypertensive Disorders of Pregnancy. Am J
Obstet Gynecol 1988;158:80–3. - Khan KS, Wojdyla D, Say L, Gulmezoglu AM, Van Look PF. WHO analysis of causes of maternal death: a systematic review. Lancet 2006;367:1066–74.
- Sibai B, Dekker G, Kupferminc M. Pre-eclampsia. Lancet 2005;365:785–99.
- Odegard RA, Vatten LJ, Nilsen ST, Salvesen KA, Austgulen R. Preeclampsia and fetal growth. Obstet Gynecol 2000;96: 950–5.
- Barker DJ. The fetal and infant origins of adult disease. BMJ 1990;301:1111.
- Barker DJ. The developmental origins of chronic adult disease. Acta Paediatr Suppl 2004;93:26 –33.
- Khong TY, De Wolf F, Robertson WB, Brosens I. Inadequate maternal vascular response to placentation in pregnancies complicated by pre-eclampsia and by small-for-gestational age infants. Br J Obstet Gynaecol 1986;93:1049–59.
- Brosens I, Robertson WB, Dixon HG. The physiological response of the vessels of the placental bed to normal pregnancy. J Pathol Bacteriol 1967;93:569–79.
- Pijnenborg R, Dixon G, Robertson WB, Brosens I. Trophoblastic invasion of human decidua from 8 to 18 weeks of pregnancy. Placenta 1980;1:3–19.
- De Wolf F, DeWolf-Peeters C, Brosens I, Robertson W. The human placental bed: electron microscopic study of trophoplastic invasion of spiral arteries. Am J Obstet Gynecol 1980; 137:58–70.
- Cnossen JS, Morris RK, ter Riet G, Mol BW, van der Post JA, Coomarasamy A, et al. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: a systematic review and bivariable meta-analysis. CMAJ 2008;178:701–11.
- Salomon L, Benattar C, Audibert F, Fernandez H, Duyme M, Taieb J, et al. Severe preeclampsia is associated with high inhibin A levels and normal leptin levels at 7 and 13 weeks into pregnancy. Am J Obstet Gynecol 2003;189:1517–22.
- Redman CW, Bonnar J, Beilin L. Early platelet consumption in pre-eclampsia. Br Med J 1978;1:467–9.
- Janes SL, Kyle PM, Redman C, Goodall AH. Flow cytometric detection of activated platelets in pregnant women prior to the development of pre-eclampsia. Thromb Haemost 1995;74: 1059–63.
- Masotti G, Galanti G, Poggesi L, Abbate R, Neri Serneri GG. Differential inhibition of prostacyclin production and platelet aggregation by aspirin. Lancet 1979;2:1213–7.
- Askie LM, Duley L, Henderson-Smart DJ, Stewart LA. Antiplatelet agents for prevention of pre-eclampsia: a meta-analysis of individual patient data. Lancet 2007;369:1791–8.
- Thorp JA, Walsh SW, Brath PC. Low-dose aspirin inhibits thromboxane, but not prostacyclin, production by human placental arteries. Am J Obstet Gynecol 1988;159:1381–4.
- Aspirin and pre-eclampsia. Lancet 1986;1:328 –9.
- Sibai BM, Caritis SN, Thom E, Klebanoff M, McNellis D, Rocco L, et al. Prevention of preeclampsia with low-dose aspirin in healthy, nulliparous pregnant women. The National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. N Engl J Med 1993;329: 1213–8.
- CLASP CL-dASiPCG. CLASP: a randomised trial of low-dose aspirin for the prevention and treatment of pre-eclampsia among 9364 pregnant women. Lancet 1994;343:619–29.
- Caritis S, Sibai B, Hauth J, Lindheimer MD, Klebanoff M, Thom E, et al. Low-dose aspirin to prevent preeclampsia in women at high risk. National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. N Engl J Med 1998;338:701–5.
- Subtil D, Goeusse P, Puech F, Lequien P, Biausque S, Breart G, et al. Aspirin (100 mg) used for prevention of pre-eclampsia in nulliparous women: the Essai Regional Aspirine Mere-Enfantstudy (Part 1). BJOG 2003;110:475–84.
- Golding J. A randomised trial of low dose aspirin for primiparae in pregnancy. The Jamaica Low Dose Aspirin Study Group. Br J Obstet Gynaecol 1998;105:293–9.
- Bujold E, Morency AM, Roberge S, Lacasse Y, Forest JC, Giguere Y. Acetylsalicylic acid for the prevention of preeclampsia and intra-uterine growth restriction in women with abnormal uterine artery Doppler: a systematic review and meta-analysis. J Obstet Gynaecol Can 2009;31:818–26.
- Moher D, Liberati A, Tetzlaff J, Altman DG. Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. PLoS Med 2009;6:e1000097.
- Juni P, Altman DG, Egger M. Systematic reviews in health care: assessing the quality of controlled clinical trials. BMJ 2001;323:42–6.
- Schulz KF, Chalmers I, Hayes RJ, Altman DG. Empirical evidence of bias. Dimensions of methodological quality associated with estimates of treatment effects in controlled trials. JAMA 1995;273:408–12.
- Landis J, Koch G. The measurement of observer agreement for categorical data. Biometrics 1977;33:159–74.
- DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177–88.
- Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ 2003;327:557–60.
- Egger MSG, Phillips AN. Meta-analysis: principles and procedures. BMJ 1997;315:1533–7.
- Egger M, Davey Smith G, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997; 315:629–34.
- Sterne JA, Egger M, Smith GD. Systematic reviews in health care: investigating and dealing with publication and other biases in meta-analysis. BMJ 2001;323:101–5.
- Borenstein M, Hedges LV, Higgins JP, Rothstein HR, editors. Introduction to meta-analysis. West Sussex (UK): Wiley; 2009.
- August P, Helseth G, Edersheim T, Hutson J, Druzin M. Sustained relase, low-dose aspirin ameliorates but does not prevent preeclampsia (PE) in a high risk population. Proceedings of the 9th International Congress, International Society for the Study of Hypertension March 15–18, 1994, Sydney, Australia. Hypertension in Pregnancy. p. 72.
- Dasari R, Narang A, Vasishta K, Garewal G. Effect of maternal low dose aspirin on neonatal platelet function. Indian Pediatr 1998;35:507–11.
- Azar R TD. Effect of antiplatelet therapy in women at high risk for pregnancy-induced hypertension. Proceedings of 7th World Congress of Hypertension in Pregnancy. October 1990, Perugia, Italy. p. 257.
- Beaufils M, Uzan S, Donsimoni R, Colau JC. Prevention of pre-eclampsia by early antiplatelet therapy. Lancet 1985;1: 840–2.
- Benigni A, Gregorini G, Frusca T, Chiabrando C, Ballerini S, Valcamonico A, et al. Effect of low-dose aspirin on fetal and maternal generation of thromboxane by platelets in women at risk for pregnancy-induced hypertension. N Engl J Med 1989; 321:357–62.
- Caritis S, Sibai B, Hauth J, Lindheimer MD, Klebanoff M, Thom E, et al. Low-dose aspirin to prevent preeclampsia in women at high risk. National Institute of Child Health and Human Development Network of Maternal-Fetal Medicine Units. N Engl J Med 1998;338:701–5.
- Chiaffarino F, Parazzini F, Paladini D, Acaia B, Ossola W, Marozio L, et al. A small randomised trial of low-dose aspirin in women at high risk of pre-eclampsia. Eur J Obstet Gynecol Reprod Biol 2004;112:142–4.
- Davies NJ GM, Farquharson RG,Walkinshaw SA. Low-dose aspirin in the prevention of hypertensive disorders of pregnancy in relatively low-risk nulliparous women. Hypertension in Pregnancy 1995;14:49 –55.
- Ebrashy A, Ibrahim M, Marzook A, Yousef D. Usefulness of aspirin therapy in high-risk pregnant women with abnormal uterine artery Doppler ultrasound at 14–16 weeks pregnancy:
randomized controlled clinical trial. Croat Med J 2005;46: 826–31. - ECPPA. ECPPA: randomised trial of low dose aspirin for the prevention of maternal and fetal complications in high risk pregnant women. ECPPA (Estudo Colaborativo para Prevencao da Pre-eclampsia com Aspirina) Collaborative Group. Br J Obstet Gynaecol 1996;103:39–47.
- Ferrier C NR, Kincaid-Smith P. Low dose aspirin delays the onset of pre-eclampsia in pregnancies with abnormal uteroplacental circulation. Proceedings of the 10th World Congress of the International Society for the Study of Hypertension in Pregnancy, August 4–8, 1996, Seattle, WA. p. 151.
- Gallery EDM, Ross MR, Hawkins M, Leslie G, Gyo? ry AZ. Low-dose aspirin in high-risk pregnancy. Hypertens Pregnancy 1997;16:229–38.
- Grab D, Paulus WE, Erdmann M, Terinde R, Oberhoffer R, Lang D, et al. Effects of low-dose aspirin on uterine and fetal blood flow during pregnancy: results of a randomized, placebo-controlled, double-blind trial. Ultrasound Obstet Gynecol 2000;15:19 –27.
- Hauth JC, Goldenberg RL, Parker CR Jr, Philips JB, 3rd, Copper RL, DuBard MB, et al. Low-dose aspirin therapy to prevent preeclampsia. Am J Obstet Gynecol 1993;168: 1083–91.
- Hermida RC, Ayala DE, Fernandez JR, Mojon A, Alonso I, Silva I, et al. Administration time-dependent effects of aspirin in women at differing risk for preeclampsia. Hypertension 1999;34:1016–23.
- Hermida RC, Ayala DE, Iglesias M, Mojon A, Silva I, Ucieda R, et al. Time-dependent effects of low-dose aspirin administration on blood pressure in pregnant women. Hypertension 1997;30:589–95.
- McParland P, Pearce JM, Chamberlain GV. Doppler ultrasound and aspirin in recognition and prevention of pregnancyinduced hypertension. Lancet 1990;335:1552–5.
- Michael CA, Walters BNJ. Low-dose aspirin in the prevention of pre-eclampsia: current evaluation. In: Teoh ES, Ratnam SS, Macnaughton MC, editors. Maternal physiology and pathology. The current status of gynaecology and obstetrics series. Carnforth (UK): Parthenon Publishing Group Limited; 1992. p. 183–9.
- Morris JM FR, Ellwood DA, Cook C, Devonald KJ. A randomized controlled trial of aspirin in patients with abnormal uterine artery blood flow. Obstet Gynecol 1996;87:74–8.
- Newnham JP GM, Walters BJN, Philips J, Evans SF. Low dose aspirin for the treatment of fetal growth restriction: a randomized controlled trial. Aust NZ J Obstet Gynaecol 1995;35: 370–4.
- Rogers MS, Fung HY, Hung CY. Calcium and low-dose aspirin prophylaxis in women at high risk of pregnancyinduced hypertension. Hypert Pregn 1999;18:165–72.
- Rotchell YE, Cruickshank JK, Gay MP, Griffiths J, Stewart A, Farrell B, et al. Barbados Low Dose Aspirin Study in Pregnancy (BLASP): a randomised trial for the prevention of pre-eclampsia and its complications. Br J Obstet Gynaecol 1998;105:286–92.
- Schiff E, Peleg E, Goldenberg M, Rosenthal T, Ruppin E, Tamarkin M, et al. The use of aspirin to prevent pregnancyinduced hypertension and lower the ratio of thromboxane A2 to prostacyclin in relatively high risk pregnancies. N Engl J Med 1989;321:351–6.
- Schrocksnadel HSB, Alge A, Stechel-Berger G, Schwegel P, Pastner E, et al. Low-dose aspirin in primigravidae with positive rollover test. Gynecol Obstet Invest 1992;34:146–50.
- Tulppala M, Marttunen M, Soderstrom-Anttila V, Foudila T, Ailus K, Palosuo T, et al. Low-dose aspirin in prevention of miscarriage in women with unexplained or autoimmune related recurrent miscarriage: effect on prostacyclin and thromboxane A2 production. Hum Reprod 1997;12:1567–72.
- Vainio M, Kujansuu E, Iso-Mustajarvi M, Maenpaa J. Low dose acetylsalicylic acid in prevention of pregnancy-induced hypertension and intrauterine growth retardation in women with bilateral uterine artery notches. Br J Obstet Gynecol 2002;109:161–7.
- Wallenburg HC, Dekker GA, Makovitz JW, Rotmans P. Low-dose aspirin prevents pregnancy-induced hypertension and pre-eclampsia in angiotensin-sensitive primigravidae. Lancet 1986;8476:1–3.
- Wang Z, Li W. A prospective randomized placebo-controlled trial of low-dose aspirin for prevention of intra-uterine growth retardation. Chin Med J (Engl) 1996;109:238–42.
- Wu J, Yang W, Shen W, He Y. Small dosage aspirin in the prevention of hypertension of pregnancy. Acta AcademiaeMedicinae Suzhou 1996;16:551–3.
- Yu CK, Papageorghiou AT, Parra M, Palma Dias R, Nicolaides KH. Randomized controlled trial using low-dose aspirin in the prevention of pre-eclampsia in women with abnormal uterine artery Doppler at 23 weeks’ gestation. Ultrasound Obstet Gynecol 2003;22:233–9.
- Zimmermann P, Eirio V, Koskinen J, Niemi K, Nyman R, Kujansuu E, et al. Effect of low dose aspirin treatment on vascular resistance in the uterine, uteroplacental, renal and umbilical arteries - a prospective longitudinal study on a high risk population with persistent notch in the uterine arteries. Euro J Ultrasound 1997;5:17–30.
- Byaruhanga RN, Chipato T, Rusakaniko S. A randomized controlled trial of low-dose aspirin in women at risk from pre-eclampsia. Int J Gynaecol Obstet 1998;60:129–35.
- Coomarasamy A, Honest H, Papaioannou S, Gee H, Khan KS. Aspirin for prevention of preeclampsia in women with historical risk factors: a systematic review. Obstet Gynecol 2003;101: 1319–32.
- Duley L, Henderson-Smart DJ, Meher S, King JF. Antiplatelet agents for preventing pre-eclampsia and its complications. The Cochrane Database of Systematic Reviews 2007, Issue 2. Art. No.: CD004659. DOI: 10.1002/14651858.CD004659.pub2.
- Ruano R, Fontes RS, Zugaib M. Prevention of preeclampsia with low-dose aspirin – a systematic review and meta-analysis of the main randomized controlled trials. Clinics (Sao Paulo) 2005;60:407–14.
- Baschat AA, Poon LY, Blitzer M, Nicolaides KH, Harman C. Impact of 1st trimester aspirin on population pervalence of preeclampsia. Ultrasound Obstet Gynecol 2009;34:14.
- Lambers MJ, Groeneveld E, Hoozemans DA, Schats R, Homburg R, Lambalk CB, et al. Lower incidence of hypertensive complications during pregnancy in patients treated with lowdose
aspirin during in vitro fertilization and early pregnancy. Hum Reprod 2009;24:2447–50. - Poon LC, Stratieva V, Piras S, Piri S, Nicolaides KH. Hypertensive disorders in pregnancy: combined screening by uterine artery Doppler, blood pressure and serum PAPP-A at 11–13 weeks. Prenat Diagn 2010;30:216–23.
- Bujold E, Effendi M, Girard M, Gouin K, Forest JC, Couturier B, et al. reproducibility of first trimester threedimensional placental measurements in the evaluation of early placental insufficiency. J Obstet Gynaecol Can 2009; 31:1144 – 8.
- Rizzo G, Capponi A, Pietrolucci ME, Capece A, Arduini D. First-trimester placental volume and vascularization measured by 3-dimensional power Doppler sonography in pregnancies with low serum pregnancy-associated plasma protein a levels. J Ultrasound Med 2009;28:1615–22.
- Dumont A, Flahault A, Beaufils M, Verdy E, Uzan S. Effect of aspirin in pregnant women is dependent on increase in bleeding time. Am J Obstet Gynecol 1999;180:135–40.
- Caron N, Rivard GE, Michon N, Morin F, Pilon D, Moutquin JM, et al. Low-dose ASA response using the PFA-100 in women with high-risk pregnancy. J Obstet Gynaecol Can 2009;31:1022–7.
- Rey E, Garneau P, David M, Gauthier R, Leduc L, Michon N, et al. Dalteparin for the prevention of recurrence of placentalmediated complications of pregnancy in women without thrombophilia: a pilot randomized controlled trial. J Thromb Haemost 2009;7:58–64.

