Findings on the Portable Chest Radiograph
Correlate With Fluid Balance in Critically Ill Patients
Оценка водного баланса у больных в критическом состоянии
по данным рентгенологического исследования
Greg .S. Martin, MD, FCCP; E. Wesley Ely, MD, MPH, FCCP;
Frank E. Carroll, MD; Gordon R. Bernard, MD, FCCP.
Статья опубликована в журнале CHEST 2002; 122:2087–2095
Цель: Определять водный баланс за сутки рекомендуется в ситуациях, когда невозможно оценить объем циркулирующей крови. По рентгенограммам грудной клетки можно косвенно определить количество жидкости в интерстициальной ткани легких при их остром травматическом повреждении и общий объем крови у здоровых людей. На основании этого было высказано предположение о том, что рентгенограммы грудной клетки смогут отразить изменения водного баланса у пациентов в критическом состоянии.
План исследования: Проводилась стандартная оценка 133 рентгенограмм грудной клетки, выполненных на портативном аппарате в прямой проекции в положении больного на спине. Выводы были сделаны на основе как объективной, так и субъективной оценки количества жидкости в сосудах и интерстициальной ткани легкого.
Условия: Медицинский академический центр университета города Нэшвиль и филиал Госпиталя для вертеранов.
Пациенты: В исследование были включены 37 пациентов с «шоковыми» легкими, которые в течение 5 дней находились на искусственной вентиляции легких. Двойным слепым методом было назначено лечение либо диуретиками и коллоидными растворами, либо плацебо.
Оценка результатов: Пациенты, получавшие лечение, в течение 5 дней выделили с мочой в среднем 3,3 л жидкости, а средняя потеря веса составила 10 кг. У всех пациентов прослеживалась взаимосвязь ширины сосудистого пучка, соотношения полученной/выделенной жидкости (r =0,50, p = 0,01) и массы тела (r =0,51, p = 0,01). Эта связь была наиболее выражена у группы больных, получавших лечение (r =0,71, p = 0,005). Изменения ширины сосудистого пучка также зависели от давления заклинивания легочной артерии (r =0,70, p <0,01). Рентгенологически к концу первого дня наблюдения ширина сосудистого пучка в двух группах значительно варьировала, а легочно-сердечный индекс и субъективная оценка интерстициального отека не изменились. Количество больных с шириной сосудистого пучка <70 мм в обеих группах оставалось на начальном уровне, но в последующие дни в группе, получавшей лечение, этот показатель варьировал меньше (p <0,05).
На основании проведенного исследования был сделан вывод, что по рентгенограммам, полученным с помощью передвижного рентгеновского аппарата, можно изучать динамику водного обмена. Объективная оценка объема внутрисосудистой жидкости путем измерения ширины сосудистого пучка является более надежной и чувствительной, чем субъективная. При систематической оценке результатов этот метод может стать существенным дополнением к другим клиническим данным по ведению инфузионной терапии у пациентов в критическом состоянии.
Потребность в проведении инфузионной терапии у пациентов палат интенсивной терапии возникает ежедневно. Однако оценка объема жидкости в сосудистом русле у пациентов при критических состояниях может представлять значительную трудность (1-3). Осмотическое давление в таких случаях часто снижено, что приводит к общему обезвоживанию организма и усложняет ведение таких больных (4). Инвазивные методы определения гемодинамики зачастую влекут за собой неправильное толкование полученных данных, и таким образом только наносят вред пациенту (5-8). Именно поэтому для врачей-интенсивистов столь важна оценка обмена жидкости без инвазивного вмешательства.
Ретгенография грудной клетки – это испытанный и широко применяемый неинвазивный метод выявления и оценки застойных явлений (9,10). Milne с соавторами (11) разработали рентгенологические критерии для кардиогенного, нефрогенного и травматического застоя в легких. По данным нескольких схожих исследований, ширина сосудистого пучка на рентгенограммах, выполненных в вертикальном положении, отображает объем циркулирующей крови ( r = 0,80) и его изменения ( r = 0,93) у кардиологических пациентов (12). Но этот показатель, хорошо отображающий резкие изменения объема циркулирующей крови, не отображает изменений артериального давления (13). Колебания объема циркулирующей крови у больных, находящихся на гемодиализе, довольно точно можно определить по ширине сосудистого пучка (ШСП) и легочно-сердечному индексу (ЛСИ) (14). Для дифференциальной диагностики застойных явлений разработаны дополнительные критерии. По данным Thomason и его коллег (15) сочетание ЛСИ >0,52 и ШСП >63 мм увеличивает точность диагностики гидростатических изменений в легких до 73%. Принимая во внимание волемический статус, Ely с соавторами (16) разработали критерии рентгенологической диагностики, кореллирующие с показателями инвазивного мониторинга гемодинамики. При сопоставлении данных рентгенографии и давления заклинивания легочной артерии выяснилось, что ШСП >70мм и ЛСИ >0,55 соответствуют давлению > 18 мм в легочной артерии. Возможности рентгенографии в прогнозировании динамики водного обмена крайне ограничены, поскольку внутрисосудистое давление недостаточно хорошо отражает объем циркулирующей крови, а зависимость рентгенологической картины от количества внесосудистой жидкости в легких изучена слабо (9, 17). Более точная оценка объема жидкости в сосудистом русле и интерстиции могла бы положительно сказаться на результатах лечения (18).
Данных по рентгенологическим проявлениям динамики водного баланса при критических состояниях в доступной литературе найти не удалось. Было высказано предположение о том, что эти изменения могут отражаться на рентгенограммах грудной клетки. Кроме того, в задачу исследования вошло сопоставление результатов рентгеновского исследования и данных инвазивных методов определения параметров гемодинамики. Для подтверждения этой гипотезы были оценены 133 рентгенограммы, выполненные у 36 больных, находившихся в палате интенсивной терапии с «шоковыми» легкими и респираторным дисстресс-синдромом взрослых. Рентгенография выполнялась в прямой проекции в положении больного на спине.
Материалы и методы.
Исследование проводилось после рассмотрения советами Медицинского центра Вандербильта и филиала Гспиталя для ветеранов, г. Нэшвиль. Было получено письменное информированное согласие законных представителей всех пациентов.
Как было сказано выше, все пациенты с 1996 по 1999 годы в двойном слепом исследовании получали терапию либо лазиксом и растворами альбуминов, либо плацебо (19, 20). Оценивались демографические данные, тяжесть заболевания по шкале APACHE III и тяжесть «шоковых» легких/респираторного дисстресс-синдрома по шкале LIS (таблица 1) (21-23).
Таблица 1. Демографические данные
и начальные показатели состояния больных*
| Показатель, (среднеквадратичное отклонение) | Плацебо (n=18) | Лечение (n=19) |
| Демографические данные | ||
| Средний возраст (годы) | 42,5 (18,0) | 42,3 (15,9) |
| Процент мужчин в группе, % | 74 | 53 |
| Этиология «шоковых» легких, n (%) | ||
| Травма | 15 (54) | 13 (46) |
| Пневмония | 1 (17) | 5 (83) |
| Сепсис | 1 (50) | 1 (50) |
| Аспирация | 1 (100) | 0 (0) |
| Объективные показатели, ( среднее значение) | ||
| Оценка по шкале LIS † | 2,6 (0,4) | 2,6 (0,6) |
| Оценка по шкале APACHE III | 55,8 (20,8) | 61,1 (22,2) |
| Белок сыворотки крови, г/дЛ | 4,0 (0,5) | 3,9 (0,6) |
| Альбумин крови | 1,7 (0,3) | 1,8 (0,3) |
| Вентиляция, л/мин | 11,0 (3,4) | 11,3 (2,7) |
| FiO2 | 0,45 (0,09) | 0,46 (0,09) |
| Отношение PaO 2/ FiO 2, мм.рт.столба | 197 (54) | 179 (59) |
| ПДКВ , см H2O | 10,0 (4,1) | 9,0 (3,9) |
| Paw , см H2O | 16,3 (1,2) | 14,3 (1,1) |
| Уровень оксигенации, см H 2 O /мм.рт.столба | 8,4 (0,6) | 9,7 (1,1) |
| Наивысшее давление на вдохе, см H 2 O | 35,4 (8,1) | 32,8 (7,4) |
| Среднее давление на вдохе, см H 2 O | 28,0 (4,8) | 27, 2 (4,0) |
| H2O | ||
| Cstat H2O, мл/ см H2O | 31 (11) | 31 (14) |
| Vd/Vt | 0,42 (0,10) | 0, 43 (0,18) |
| Средний объем вдоха, мл | 576 (180) | 530 (165) |
| Ширина сосудистого пучка, мм | 65,1 (16,0) | 61,0 (9,1) |
| Легочно-сердеченый индекс | 0,53 (0,06) | 0,54 (0,06) |
| Оценка по шкале отечности | 2,1 (0,8) | 1,9 (0,8) |
| Линии Керли | 0,1 (0,3) | 0,1 (0,2) |
| Баротравма | 0,5 (0,5) | 0,6 (0,5) |
| Количество вовлеченных легочных полей | 3,6 (0,6) | 3,8 (0,4) |
| ЦВД, см.вод .столба | 11,1 (6,8) | 10,8 (4,8) |
| Давление заклинивания ЛА, мм.рт.столба | 17,4 (6,4) | 15,3 (3,4) |
| Сердечный выброс | 8,2 (2,7) | 10,3 (3,6) |
| *Данные представлены как N (%), кроме тех случаев, где это оговаривается. FiO 2 = фракция кислорода во вдыхаемом воздухе; ПДКВ = положительное давление в конце выдоха; Paw = среднее давление в дыхательных путях; Cstat = ригидностьь дыхательной системы в покое; Vd / Vt = остаточный объем легких † По данным Murray и соавторов (22). |
Рентгенограммы выполнялись на момент начала лечения (исходные), на 1, 3 и 5 (последний) дни лечения. Если в течение дня выполнялось несколько рентгенограмм органов грудной клетки, то в оценку включался только первый снимок. Оценка проводилась по стандартной схеме (см. приложение) (15, 24, 25). Ширина сосудистого пучка определялась по перпендикуляру от точки отхода левой подключичной артерии от дуги аорты через точку пересечения верхней полой вены с правым главным бронхом. Легочно-сердеченый индекс определялся по соотношению наиболее широкого поперечного размера сердца и наибольшего поперечного размера грудной клетки над диафрагмой. Оценку проводил один рентгенолог, специализирующийся на рентгенограммах органов грудной клетки, не знавший никаких деталей ведения данных больных. Каждой рентгенограмме был присвоен случайный номер, а данные о пациенте и назначенном лечении не раскрывались. Затем проводилась оценка качества и экспозиции снимка для того, чтобы дать ему правильное описание.
Рентгенологические методы.
До октября 1997 года, всем пациентам выполнялись конвенциональные рентгенограммы в прямой проекции, в положении больного на спине, размером 35,5 х 43 см, с использованием стандартной пленки и кассет (корпорация Kodak , Rochester , NY ). Снимки выполнялись с фокусным расстоянием 1 м, при 75-85 киловольтах, а стандартная экспозиция 1 мАс регулировалась по телосложению больного. Все рентгенограммы проявлялись на стандартной проявочной машине в течение 45 секунд. Начиная с октября 1997 года, все рентгенограммы выполнялись в цифровом формате при помощи светочувствительной многоразовой пластины (корпорация AGFA , Ridgefield Park , NJ ). Снимки выполнялись с использованием стандартных кассет размером 35,5 х 43 см, с таким же фокусным расстоянием, при 75 киловольтах, и с различной выдержкой в зависимости от телосложения больного. Обработка производилась на лазерном сканере (модель ADC 70, корпорация AGFA ), соединенном с архивной и коммуникационной системой. Каждая рентгенограмма рассматривалась в полный размер 35,5 х 43 см, с разрешением 2000 – 2500, и с электронной измерительной шкалой для объективных исследований (ШСП, ЛСИ).
Статистический анализ.
Первичной переменной была ширина сосудистого пучка.
Вторичными переменными были:
- Легочно-сердечный индекс
- Оценка степени отека по шкале от 0 до 4 (25, 26)
- Наличие и выраженность линий Керли (короткие линии, перпендикулярные к костальной плевре и соприкасающиеся с ней, от 1 до 2 см в длину)
- Баротравма.
Усредненные данные с учетом среднеквадратичного отклонения подвергались статистической компьютерной обработке ( NCSS , версия 6.0; NCSS Statistical Software , Kayville , UT ) (27). После сравнения двух групп пациентов была проведена оценка результатов лечения. Сопоставление переменных во времени проводили по анализу вариаций с использованием t-теста или U-теста Манна-Уитни для нормально и аномально распределенных значений, по порядку, с поправкой Бонферрони для множественных сравнений. Тест точности Фишера использовался для двоичных переменных, а для оценки пропорций был использован статистический анализ c2 с поправкой Ятса. Для сопоставления непрерывных переменных применялась одномерная линейная регрессия. Как статистически значимое было выбрано значение a, равное 0,05.
Результаты:
В исследовании были включены 37 пациентов. Рентгенограммы одного из пациентов были не доступны для исследования, таким образом анализу были подвергнуты 36 пациентов (получавшие лечение, n = 18; контрольная группа, n = 18). Из последовательных рентгенограмм, выполненных у этих пациентов, 11 были недоступны для анализа (получавшие лечение, n = 6; контрольная группа, n=5), таким образом, в исследование вошли 133 рентгенограммы грудной клетки, сделанные на портативном аппарате в прямой проекции в положении больного на спине. При оценке снимков на пленке и в цифровом виде существенной разницы не было. Сопоставляемые группы были схожи по демографическим показателям и по тяжести заболевания (оценка по шкалам LIS и APACHE III ). В обеих группах основными причинами в развитии «шоковых» легких и острого респираторного дисстресс-синдрома взрослых были пневмония, травма и сепсис.
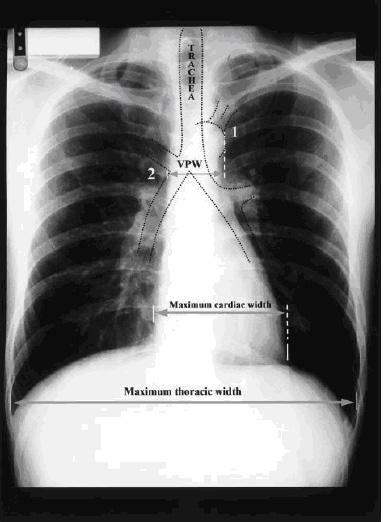 |
| Рисунок 1. Рентгенограмма органов грудной клетки с разметкой – как измерять ширину сосудистого пучка, и отношение размеров сердца и грудной клетки (кардиоторакальный индекс). Точка 1- это место отхождения левой подключичной артерии от дуги аорты. Точка 2. – это пересечение верхней полой вены с правым главным бронхом. Ширину сосудистого пучка определяют по перпендикулярным линиям, которые разделяют эти две точки. Кардио-торакальный индекс рассчитывается путем деления максимальной ширины тени сердца на максимальную ширину грудной клетки. |
Все пациенты из группы, получавшей лечение, имели обезвоживание. Средний диурез в этой группе составил 3,3 л, что значительно превышало средний диурез в контрольной группе (0,5 л за 5 дней, р = 0,14). Помимо этого потеря массы тела за 5 дней в первой группе составила в среднем 10 кг, в то время как в контрольной группе – всего 4,7 кг ( р = 0,14). Разница в потере массы тела была значительной уже в первый день (-2,8 и -0,8 соответственно, р = 0,05), в то время как разница в соотношении введенной и выделенной жидкости стала значимой лишь в последующие дни наблюдения (см. таблицу 2).
Таблица 2. Динамика переменных в период наблюдения
| Варианта | Контрольная группа (n = 18) | Наблюдаемая группа (n = 18) | ||||
| День 1 | День 3 | День 5 | День 1 | День 3 | День 5 | |
| Масса тела, кг | -0,8 (1,6) | -2,3 (6,3) | -4,7(8,8) | -2,8 (3,1) | -6,7(5,2) | -10 (5,6) |
| Водный обмен, л | 0,6 (2,5) | 0,9 (5,4) | 0,5 (1,0) | -0,1 (2,9) | -2,1(5,0) | -3,3 (1,1) |
| Общий белок крови, г/дл | 0,0 (0,2) | 0,2 (0,4) | 0,7 (0,6) | 0,6 (0,3) | 1,6 (0,4) | 1,9 (0,5) |
| Ширина сосудистого пучка, мм | 0,2 (5,4) | -0,7 (5,2) | 1,9 (6,8) | -2,3 (6,1) | -5,1(6,2) | -5,3(7,6) |
| Легочно-сердечный индекс | -0,01 (0,04) | -0,01 (0,06) | -0,01 (0,04) | 0,00 (0,08) | -0,01 (0,08) | 0,00 (0,06) |
| Оценка по шкале отека | 0,1 (0,4) | -0,1 (0,3) | -0,6 (0,6) | -0,1 (0,4) | 0,0 (0,5) | -0,5 (0,5) |
| Линии Керли | 0,0 (0,1) | -0,1 (0,2) | -0,1 (0,1) | 0,0 (0,1) | -0,1(0.1) | -0,1 (0,1) |
| Баротравма | 0, (0,2) | -0,1 (0,3) | -0,2 (0,4) | 0,0 (0,2) | -0,2(0,4) | -0,3 (0,3) |
| Вовлеченные легочные поля | 0,3 (0,3) | 0,1 (0,6) | 0,0 (0,8) | -0,3 (0,1) | -0,2(0,9) | -0,6 (1,0) |
| Объем Вдоха, мл | -15 (48) | 36 (46) | 11 (49) | 25 (61) | 55 (73) | 57 (70) |
| РаО2/FiО2, мм.рт.столба | 5 (25) | 43 (84) | 52 (112) | 64 (73) | 47 (82) | 45 (88) |
| ПДКВ, см.вод.столба | 0,3 (1,5) | -0,7 (1,4) | -1,2 (2,3) | -1,0 (1,1) | -1,8(0,9) | -1,6 (1,5) |
| Давление на пике вдохе, см.в.столба | 1,3 (7,4) | 3,3 (8,1) | -2,2 (11,3) | -1,3 (5,8) | 0,2 (6,1) | 0,8 (6,6) |
| Среднее давление на вдохе, см.вод.ст. | -0,6 (1,6) | -2,4 (0,6) | -0,1 (2,8) | -1,0 (1,3) | -1,1(1,5) | -2,0 (1,1) |
| Сstat, мл/ см.водного столба | -0,2 (9,2) | 2,6 (9,1) | -0,6 (10,6) | 1,9 (6,5) | 6,7(16,5) | 1,0(11,3) |
| Vd/Vt | 0,00 (0,26) | -0,04 (0,09) | 0,01 (0,12) | -0,11 (0,14) | -0,01 (0,16) | -0,3 (0,5) |
| Шкала LIS | 0,1 (0,2) | -0,3 (0,3) | -0,3(0,4) | -0,3 (0,3) | -0,3(0,4) | -0,3 (0,5) |
В группе, получавшей лечение, показатель общего белка крови увеличился в среднем на 1,9 г/дл за 5 дней, в то время как в контрольной группе лишь на 0,7 г/дл (р < 0,001). Значимой разницы в режиме вентиляции и в смертности между группами не наблюдалось.
На момент начала лечения значительной разницы показателей, включая ШСП и ЛСИ, между группами не было. За период наблюдения ширина сосудистого пучка у пролеченных пациентов значительно уменьшалась (-5,2 мм к 5 дню, р = 0,01). Ширина сосудистого пучка на 3й (р = 0,04) и 5й (р = 0,01) дни наблюдения в этой группе была значительно меньше, чем в контрольной группе. Значительных изменений ЛСИ за 5 дней наблюдения не обнаружено. Все остальные переменные не различались ни внутри групп, ни между ними. Динамика показателей ШСП и ЛСИ в течение 5 дней наглядно показана на рисунке 2.
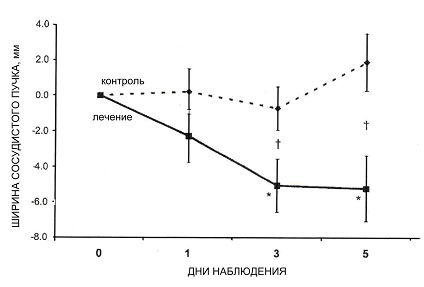 |
| Рисунок 2. Графическое отображение изменений ширины сосудистого пучка во времени. Все точки даны по среднему значению с учетом погрешности в расчетах. |
У больных с катетеризированной легочной артерией прослеживалась зависимость ширины сосудистого пучка и внутрисосудистого давления (n = 10, r = 0,70, р < 0,001). На протяжении всего периода исследования (r = 0,56, р < 0,001) между шириной сосудистого пучка и центральным венозным давлением (ЦВД)) прослеживалась существенная зависимость. В то же время не было каких-либо значимых изменений в величине ЛСИ, оценке отечности или значении внутрисосудистого давления. Что же касается объективных рентгенологических показателей, количество больных с застойными явлениями (ШСП > 63 или 70 мм) значительно уменьшалось с каждым днем наблюдения ( р < 0,05 для каждого дня). В то же время, количество пациентов со значением ЛСИ свыше 0,52 или 0,55 было примерно равным и внутри групп, и между ними в течение всего периода.
У всех пациентов прослеживалась взаимосвязь ширины сосудистого пучка, соотношения полученной/выделенной жидкости (r =0,50, p = 0,01) и массы тела (r =0,51, p = 0,01). Эта связь была наиболее выражена у группы больных, получавших лечение (r=0,71, p = 0,005).
По субъективной рентгенологической оценке кардиомегалии, интенсивности затенения, наличия или отсутствия линий Керли, перибронхиальной инфильтрации, а также при оценке по шкале отечности, оценке плеврального выпота, баротравмы и при оценке воздушных бронхограмм значительной разницы не наблюдалось (см. таблицу 2). У таких пациентов с «шоковыми» легкими редко встречаются классические проявления застоя в легких. В таких случаях более характерна картина симметричной диссеминации (>90%). Значимой связи между оценкой по шкале отечности и изменением ширины сосудистого пучка не было. Кроме того, не прослеживалась связь рентгенологических изменений ни с этиологией легочной патологии, ни с результатом лечения, включая смертность, количество дней на искусственной вентиляции, длительность пребывания в палате интенсивной терапии и больнице.
Обсуждение:
Водный баланс – это клинический параметр, который наиболее часто затрагивается при лечении в палате интенсивной терапии. Инвазивные методики оценки гемодинамики связаны с большим риском для жизни пациента. Поэтому так необходим поиск альтернативных методов определения водного баланса. Это систематизированное двойное слепое исследование при помощи рентгенографии показало, что изменения водного баланса у пациентов при критических состояниях могут отражаться на рентгенограммах грудной клетки, сделанных с помощью передвижного аппарата в условиях палаты интенсивной терапии. Что еще более важно, рентгенологические изменения ширины сосудистого пучка по достоверности сопоставимы с определением внутрисосудистого объема жидкости путем катетеризации легочной артерии. Учитывая данные этого и предыдущих исследований (15, 16) по рентгенограммам грудной клетки, выполненным на портативном рентгеновском аппарате в положении больного на спине, можно заключить, что измерение ширины сосудистого пучка может существенно помочь клиницистам в оценке внутрисосудистого объема.
Внутрисосудистый объем и баланс жидкости – это два важных фактора в ведении больного в условиях палаты интенсивной терапии, каждый из которых существенно влияет на результат лечения (4,28). Крайне важно прогнозировать изменения водного баланса у пациентов с избытком жидкости в малом круге и «нормальными» показателями гидростатического давления, как это бывает при «шоковых» легких и респираторном дисстресс-синдроме взрослых. Этот клинический синдром связан с высокой летальностью и часто встречается у пациентов палат интенсивной терапии (29). Несмотря на то, что хорошо изучена взаимосвязь высокой смертности со способностью удерживать жидкость и массу тела с при респираторном дисстресс-синдроме взрослых (4,28, 30-32), о физиологических эффектах уменьшения объема жидкости у таких больных известно мало. Ретроспективный анализ показал, что снижение гидростатического давления увеличивает выживаемость пациентов (33), а отрицательный водный баланс является благоприятным диагностическим признаком у большинства больных в критических состояниях (31). Дальнейшее исследование этой тактики ведения больных с застоем в легких показало, что это сокращает сроки пребывания на механической вентиляции и в палате интенсивной терапии (34). Учитывая, что гидростатическое давление повышается у 82% пациентов с «шоковыми» легкими, измерение ширины сосудистого пучка может послужить индикатором динамических изменений водного баланса (35). На основании полученных данных можно сделать вывод, что рентгенографическая оценка является широко доступным и наглядным показателем внутрисосудистого объема жидкости у пациентов в критическом состоянии. Более того, объективная рентгенологическая оценка ширины сосудистого пучка является более наглядной, чем более широко распространенная субъективная оценка с использованием шкалы отечности или подсчетом квадрантов, так как данные показатели в течение периода наблюдения не изменялись, несмотря на существенные сдвиги в водном обмене.
При эффективном диурезе и потере массы тела у больных с «шоковыми» легкими на рентгенограммах наблюдается сужение сосудистого пучка. Это говорит о том, что при лечении таких больных коллоидными растворами и диуретиками, как минимум в половине случаев по показателю ШСП можно оценить водный обмен. Нужно заметить, что отношение полученной и выделенной жидкости, а также масса тела могут значительно варьировать без каких-либо видимых причин. При проведении этого исследования было приложено много усилий для учета всех возможных параметров водного баланса, чтобы можно было с наименьшей погрешностью сопоставить изменения массы тела, водный баланс и ширину сосудистого пучка (36). Но, несмотря на тщательность оценки данных, есть существенные разногласия в изменениях массы тела и водного баланса. Наиболее логичным объяснением этому может быть сложность в подсчете незначительных потерь жидкости в организме больных, находящихся в критическом состоянии. Таким образом, наиболее простой и чувствительной переменной при расчете водного баланса является потеря массы тела. В обычных клинических условиях, когда параметры водного обмена отслеживаются не так строго, наиболее результативным способом определения колебаний внутрисосудистого объема жидкости является оценка ширины сосудистого пучка на последовательно сделанных рентгенограммах, что подтверждается высоким коэффициентом корреляции (15, 16).
Актуальность данного исследования состоит в том в том, что использование в условиях палаты интенсивной терапии такого доступного метода, как рентгенография, позволяет приблизительно определить внутрисосудистый объем жидкости у пациентов в критическом состоянии (1-3), что в принципе сделать достаточно сложно. У пациентов палат интенсивной терапии, находящихся на искусственной вентиляции легких, большинство рентгенограмм выполняется в связи с изменением терапии (66%), а наиболее частым методом лечения является назначение диуретиков (37). Это говорит о том, что клиницисты зачастую включают рентгенографию грудной клетки в диагностический минимум при расчете водного обмена, хотя и не всегда до конца понимают и используют возможности этого метода. Например, точность рентгенологической дифференциальной диагностики интерстициального отека легких, связанного с застоем и связанного с повышенной проницаемостью составляет от 41 до 70%, включая измерение легочно-сердечного индекса и ширины сосудистого пучка (15, 16). Может возникнуть необходимость в комплексной оценке с учетом других показателей внутрисосудистого объема жидкости. Большинство методик определения внутрисосудистого объема либо недостаточно точны, либо очень дороги (18, 38). До сих пор эти алгоритмы не включали в себя определение ширины сосудистого пучка по рентгенограммам грудной клетки.
Рентгенограммы грудной клетки по чувствительности идентичны инвазивным методам определения внутрисосудистого объема (которые на 49% определяют давление заклинивания легочной артерии). В меньшей степени эта зависимость изучена для центрального венозного давления, которое является недостаточно точным признаком для определения сердечной преднагрузки или внутрисосудистого объема. Как и в случае с разногласиями в колебаниях массы тела и водного баланса, внутрисосудистый объем зависит от воздействия многих переменных, таких, например, как осмотическое давление коллоидов плазмы или проницаемость капилляров. Определить внутрисосудистый объем жидкости можно инвазивным путем, измерив давление при катетеризации легочной артерии (например, давление заклинивания легочной артерии как показатель конечного диастолического объема в левом желудочке). Однако, эти результаты во многом зависят от растяжимости и сократимости сердца, от внутригрудного давления, а значит, не полностью отражают изменения внутрисосудистого объема. Это исследование подтвердило тот факт, что при последовательной оценке рентгенограмм грудной клетки в динамике существует определенная зависимость внутрисосудистого объема и ширины сосудистого пучка. Это говорит о том, что уже изученная связь ширины сосудистого пучка и внутрисосудистого давления на рентгенограммах, выполненных в вертикальной позиции больного, распространяется и на рентгенограммы, сделанные в условиях палаты интенсивной терапии (12, 14, 18). Таким образом, серия снимков в динамике является готовым инструментом для определения внутрисосудистого объема, который, в отличие от катетеризации легочной артерии, не зависит от воздействия внешних факторов. Исходя из этого, учет колебаний массы тела в сочетании с измерением ширины сосудистого пучка, может дополнить стандартную схему расчета внутрисосудистого объема, которая включает в себя определение водного баланса, физикальные и лабораторные данные.
Недостатками данного исследования стали однородность популяции пациентов (только с «шоковыми» легкими и респираторным дисстресс-синдром взрослых) и привлечение лишь одного рентгенолога для оценки рентгенограмм. Спектральная кривая - расширенная чувствительность для изучения популяции пациентов, в которой проводилась исследование, подтвердит, что схожие результаты могут получиться при изучении больных с другой патологией (39). Возможность оценки ширины сосудистого пучка даже при наличии затемнений в легочной ткани (как в случае с «шоковыми» легкими), делает этот метод еще более ценным (40). Измерение ширины сосудистого пучка является наиболее чувствительным из неинвазивных методов определения внутрисосудистого объема, так как включает в себя и венозную (правая часть), и артериальную (левая часть) составляющие (41). В своем исследовании Pistolesi с соавторами (12) сообщают о том, что увеличение внутрисосудистого объема на 1 литр по данным рентгенограмм, выполненных в положении больного стоя, повлекло за собой расширение сосудистого пучка на 5 мм. В данном исследовании такая зависимость по рентгенограммам, выполненным на портативном аппарате в положении больного на спине, прослеживалась, но в меньшей степени. Так, например, сужение сосудистого пучка на 5 мм было связано с потерей 3,2 л жидкости. Это можно объяснить различием в техническом обеспечении или наложением затенений легочной паренхимы, которые зачастую сопутствуют «шоковым» легким. Используя цифровую технику, изменения в ширине сосудистого пучка можно определять с большей точностью. Это могло бы сделать исследование более чувствительным. Снимок, сделанный с наклоном влево на 15° , уменьшает ширину сосудистого пучка на 6% (24). Значит, для наиболее точной оценки рентгенограмм необходимо выполнять обследование по стандартной методике и тщательно обучать персонал оценивать результаты рентгенографии (42, 43). Правильная техника выполнения исследования, т.е. с одинаковым углом ротации влево на обеих рентгенограммах, представлена на Рисунке 3.
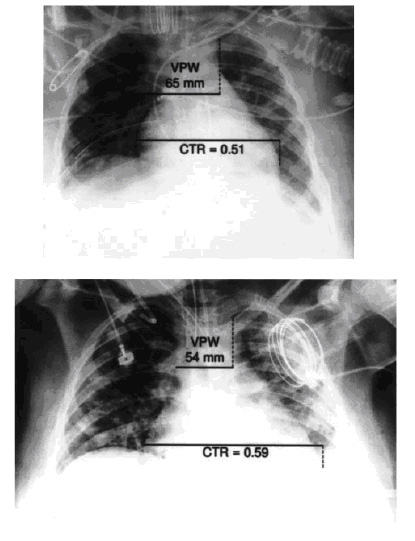 |
| Рисунок 3. Вверху: рентгенограмма органов грудной клетки, выполненная в положении лежа на передвижном аппарате у больного с травмой и респираторным дистресс-синдромом. Отметки – измерения ширины сосудистого пучка и кардиоторакального индекса исходно. Внизу : тот же больной после 5 дней лечения - рентгенограмма органов грудной клетки, выполненная в положении лежа на передвижном аппарате, диурез за 5 дней составил 6.5 литров и потеря массы тела – 8 кг, концентрация альбумина в сыворотке крови возросла на 68%. Отметки – измерения ширины сосудистого пучка и кардиоторакального индекса после лечения. |
В данном исследовании для оценки внутрисосудистого объема была выбрана катетеризация легочной артерии как признанный «золотой» стандарт. Несмотря на широкое применение этого метода, необходимо помнить о его ограничениях при мониторинге гемодинамики, в частности, при определении преднагрузки. Метод часто используется для определения этого параметра, но необходимо помнить о погрешностях в определении объема по показателям давления, как было описано выше. Нужно также учитывать, что барометрические показатели (доступные при катетеризации легочной артерии) не соотносятся с изменениями объема, которые свойственны для осмотического давления коллоидов. Внутрисосудистый объем повышается вместе с осмотическим давлением и зачастую не затрагивает гидростатическое давление. Таким образом, катетеризация легочной артерии не всегда отражает изменения осмотического давления. Поэтому, учитывая колебания белков плазмы крови, значение истинного внутрисосудистого объема жидкости может быть выше или ниже прогнозируемого по давлению заклинивания легочной артерии.
В данном исследовании изучалась неизвестная последовательная динамика рентгенологических изменений при воздействии на водный обмен. Объективная оценка ширины сосудистого пучка по рентгенограммам, выполненным на портативном аппарате в положении больного на спине, сопоставима по точности с непосредственным измерением и инвазивными методами определения внутрисосудистого объема. Учитывая риск осложнений при инвазивных методиках мониторинга и сложность новых алгоритмов диагностики, у больных в критических состояниях предложенный метод расчета водного обмена является предпочтительным. При дальнейшем исследовании, в которое будут включены пациенты палат интенсивной терапии с различной патологией, эти данные могут послужить отправной точкой и для рентгенологов, и для интенсивистов, которые пока мало что знают о таких объективных показателях оценки, как ширина сосудистого пучка. Использование рентгенографии может сократить количество побочных эффектов при использовании инвазивных методик, и таким образом может улучшить прогноз без каких-либо дополнительных затрат. В дальнейшем необходимо подробное клиническое изучение метода.
ПРИЛОЖЕНИЕ.
БЛАНК ДЛЯ СБОРА ДАННЫХ ПО РЕНТГЕНОГРАММАМ ГРУДНОЙ КЛЕТКИ
Список литературы
- McGee S, Abernethy WB III, Simel DL. Is this patient hypovolemic? JAMA 1999; 281:1022–1029
- Eisenberg PR, Jaffe AS, Schuster DP. Clinical evaluation compared to pulmonary artery catheterization in the hemodynamic assessment of critically ill patients. Crit Care Med 1984; 12:549–553
- Connors AF, Dawson NV, McCaffree DR, et al. Assessing hemodynamic status in critically ill patients: do physicians use clinical information optimally? J Crit Care 1987; 2:174–180
- Mangialardi RJ, Martin GS, Bernard GR, et al. Hypoproteinemia predicts ARDS development, weight gain, and death in patients with sepsis. Crit Care Med 2000; 28:3137–3145
- Bernard GR, Sopko G, Cerra F, et al. Pulmonary artery catheterization and clinical outcomes: National Heart, Lung, and Blood Institute and Food and Drug Administration Workshop Report. JAMA 2000; 283:2568–2572
- Al-Kharrat T, Zarich S, Amoateng-Adjepong Y, et al. Analysis of observer variability in measurement of pulmonary artery occlusion pressures. Am J Respir Crit Care Med 1999; 160:415–420
- Connors AF Jr, Speroff T, Dawson NV, et al. The effectiveness of right heart catheterization in the initial care of critically ill patients. JAMA 1996; 276:889–897
- Dalen JE, Bone RC. Is it time to pull the pulmonary artery catheter? JAMA 1996; 276:916–918
- Staub NC. Clinical use of lung water measurements: report of a workshop. Chest 1986; 90:588–594
- Pistolesi M, Miniati M, Milne ENC, et al. The chest roentgenogram in pulmonary edema. Clin Chest Med 1985; 6:315–344
- Milne EN, Pistolesi M, Miniati M, et al. The radiologic distinction of cardiogenic and noncardiogenic edema. AJR Am J Roentgenol 1985; 144:879–894
- Pistolesi M, Milne EN, Miniati M, et al. The vascular pedicle and the vena azygous: II. In cardiac failure. Radiology 1984; 152:9–17
- Milne ENC. Correlation of physiologic findings with chest roentgenology. Radiol Clin North Am 1973; 11:17–47
- 14 Don C, Burns KD, Levine DZ. Body fluid status in hemodialysis patients: the value of the chest radiograph. Can Assoc Radiol J 1990; 41:123–126
- Thomason JWW, Ely EW, Chiles C, et al. Appraising pulmonary edema using supine roentgenograms in ventilated patients. Am J Respir Crit Care Med 1998; 157:1600–1608
- Ely EW, Smith AC, Chiles C, et al. The radiologic determination of volume status using portable, digital, chest radiography: a prospective investigation in 100 patients. Crit Care Med 2001; 29:1502–1512
- Van der Water JM, Sheh JM, O'Connor NE, et al. Pulmonary extravascular water volume: measurement and significance in critically ill patients. J Trauma 1970; 10:440–449
- Ely EW, Haponik EF. Using the chest radiograph to determine intravascular volume status: the role of vascular pedicle width. Chest 2002; 121:942–950
- Martin GS, Mangialardi RJ, Wheeler AP, et al. Albumin and diuretics in ARDS [abstract]. Am J Respir Crit Care Med 1999; 159:A376
- Martin GS, Mangialardi RJ, Wheeler AP, et al. Albumin and furosemide therapy in hypoproteinemic patients with acute lung injury. Crit Care Med 2002; 30:2175–2182
- Bernard GR, Artigas A, Brigham KL, et al. The American- European consensus conference on ARDS: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149:818–824
- Murray JF, Matthay MA, Luce JM, et al. An expanded definition of the adult respiratory distress syndrome. Am Rev Respir Dis 1988; 138:720–723
- Knaus WA, Wagner DP, Draper EA, et al. The APACHE III prognostic system: risk prediction of hospital mortality for critically ill hospitalized adults. Chest 1991; 100:1619–1636
- Milne E, Pistolesi M, Miniati M, et al. The vascular pedicle of the heart and the venous azygous: I. The normal subject. Radiology 1984; 152:1–8
- Wheeler AP, Carroll FE, Bernard GR. Radiographic issues in adult respiratory distress syndrome. New Horiz 1993; 1:471– 477
- Bernard GR, Wheeler AP, Russell JA, et al. The effects of ibuprofen on the physiology and survival of patients with sepsis: The Ibuprofen in Sepsis Study Group. N Engl J Med 1997; 336:912–918
- Hintze JL. Number Cruncher Statistical Software (NCSS) 6.0 user's manual. Kaysville, UT: NCSS, 1995
- Simmons RS, Berdine GG, Seidenfeld JJ, et al. Fluid balance and the adult respiratory distress syndrome. Am Rev Respir Dis 1987; 135:924–929
- Milberg JA, Davis DR, Steinberg KP, et al. Improved survival of patients with acute respiratory distress syndrome (ARDS), 1983–1993. JAMA 1995; 273:306–309
- Schuster DP. The case for and against fluid restriction and occlusion pressure reduction in adult respiratory distress syndrome. New Horiz 1993; 1:478–488
- Humphrey H, Hall J, Sznajder I, et al. Improved survival in ARDS patients associated with a reduction in pulmonary capillary wedge pressure. Chest 1990; 97:1176–1180
- Neff MJ, Rubenfeld GD, Caldwell ES, et al. Exclusion of patients with elevated pulmonary capillary wedge pressure from ARDS [abstract]. Am J Respir Crit Care Med 1999; 159:A716
- Alsous F, Khamiees M, DeGirolamo A, et al. Negative fluid balance predicts survival in patients with septic shock: a retrospective pilot study. Chest 2000; 117:1749–1754
- Mitchell JP, Schuller D, Calandrino FS, et al. Improved outcome based on fluid management in critically ill patients requiring pulmonary artery catheterization. Am Rev Respir Dis 1992; 145:990–998
- Ferguson ND, Meade MO, Tomlinson G, et al. Values of the pulmonary artery occlusion pressure (PAOP) in ARDS and ALI [abstract]. Am J Respir Crit Care Med 1999; 159:A716
- Roos AN, Westendorp RG, Frolich M, et al. Weight changes in critically ill patients evaluated by fluid balances and impedance measurements. Crit Care Med 1993; 21:871–877
- Marik PE, Janower ML. The impact of routine chest radiography on ICU management decisions: an observational study. Am J Crit Care 1997; 6:95–98
- Duane PG, Colice GL. Impact of noninvasive studies to distinguish volume overload from ARDS in acutely ill patients with pulmonary edema. Chest 2000; 118:1709–1717
- Ransohoff DF, Feinstein AR. Problems of spectrum and bias in evaluating the efficacy of diagnostic tests. N Engl J Med 1978; 299:926–930
- Henschke CI, Yankelevitz DF, Wand A, et al. Accuracy and efficacy of chest radiography in the intensive care unit. Radiol Clin North Am 1996; 34:21–31
- Milne ENC, Imray TJ, Pistolesi M, et al. The vascular pedicle and the vena azygos: III. In trauma—the “vanishing azygos.” Radiology 1984; 153:25–31
- Rubenfeld GD, Caldwell E, Granton J, et al. Interobserver variability in applying a radiographic definition for ARDS. Chest 1999; 116:1347–1353
- Meade MO, Cook RJ, Guyatt GH, et al. Interobserver variation in interpreting chest radiographs for the diagnosis of acute respiratory distress syndrome. Am J Respir Crit Care Med 2000; 161:85–90

