|
|||
Периоперационное ведение больных с сопутствующей ишемической болезнью сердца.
Проект клинических рекомендаций
Заболотских И.Б. 1, Лебединский К.М. 2, Григорьев Е.В. 3, Григорьев С.В. 1, Грицан А.И. 4, Данилюк П.И. 1,
Киров М.Ю. 5, Козлов И.А. 6, Курапеев И.С. 2, Лихванцев В.В. 6, Мизиков В.М. 7, Потиевская В.И. 8, Субботин В.В. 9
- ГБОУ ВПО Кубанский государственный медицинский университет Минздрава России, 350063, г. Краснодар,
- ГБОУ ВПО Северо-Западный государственный медицинский университет имени И. И. Мечникова Минздрава России, 191015, Санкт-Петербург
- ГБОУ ВПО Кемеровская государственная медицинская академия Минздрава России, 650029, Кемерово
- ГБОУ ВПО КрасГМУ им. проф. В.Ф.Войно-Ясенецкого Минздрава России, 660022, Красноярск
- ГБОУ ВПО Северный государственный медицинский университет Минздрава России, 163000, Архангельск
- ФГБУ НИИ общей реаниматологии им. В.А. Неговского РАМН, 107031, Москва
- ФГБУ «Российский научный центр хирургии имени академика Б.В. Петровского РАМН», 119991, Москва
- ГБОУ ДПО Российская медицинская академия последипломного образования Минздрава России, 123995, Москва
- ФГБУ «Институт хирургии им.А.В.Вишневского Росмедтехнологий» 117997, Москва
Резюме
Встречаемость сердечно-сосудистой патологии, особенно у пожилых пациентов, увеличивается. В то же время, у пациентов с сопутствующей ишемической болезнью сердца проводится все больше несердечных хирургических вмеш ательств. В данных клинических рекомендациях отражены особенности предоперационной оценки, периоперационного мониторинга и выбора тактики анестезии больных с сопутствующей ишемической болезнью сердца. Настоящие рекомендации распространяются на осуществление медицинской помощи всем пациентам с ишемической болезнью сердца в периоперационный период в условиях стационара.
Ключевые слова: анестезия; ишемическая болезнь сердца; периоперационное ведение.
Список сокращений
АД – артериальное давление
АПФ – ангиотензинпревращающий фермент
БАБ – ?-адреноблокаторы
ИАПФ – ингибиторы ангиотензинпревращающего фермента
ИБС – ишемическая болезнь сердца
ИМ – инфаркт миокарда
КШ – коронарное шунтирование
МЕТ – метаболический эквивалент
СВ – сердечный выброс
ССС – сердечно-сосудистая система
ТИА – транзиторная ишемическая атака
ЧСС – частота сердечных сокращений
ЭКГ – электрокардиография
NYHA – Нью-Йоркская ассоциация сердца
ХСН – хроническая сердечная недостаточность
ХПН – хроническая почечная недостаточность
ЧКВ – чрескожное коронарное вмешательство
1. ОБЩИЕ ПОНЯТИЯ
В современной медицине наблюдается явная тенденция постарения контингента больных, что сочетается с большей частотой сопутствующих заболеваний, чаще всего – кардиологических. Сердечно-сосудистые заболевания продолжают лидировать, как причина смерти, во всем мире. Ежегодно около 100 млн. взрослого населения подвергаются хирургическим операциям некардиологического профиля, при этом у 500-900 тыс. человек в периоперационном периоде развиваются сердечно-сосудистые осложнения [32]. Установлено, что необходимость в хирургическом лечении у пожилых возникает в четыре раза чаще, чем в среднем по популяции [34]. Хотя летальность от заболеваний сердца в целом снижается, частота ишемической болезни сердца (ИБС), сердечной недостаточности, и других факторов риска осложнений, особенно сахарного диабета, возрастает [38]. Частота развития периоперационных сердечно-сосудистых осложнений при внесердечных хирургических вмешательствах у больных без ИБС составляет менее 1%, в то время как у 20-40% пациентов с ИБС развивается периоперационная ишемия миокарда [2]. Свыше 50% случаев развития инфаркта миокарда (ИМ) может быть не распознано, если ориентироваться только на клинические признаки и симптомы. С периоперационным ИМ связано 30-50% периоперационной летальности и снижение выживаемости пациентов в отдаленной перспективе [12, 45].
Уменьшение кардиологических осложнений в периоперационном периоде может потенциально уменьшить заболеваемость, смертность и продолжительность госпитализации, а также стоимость лечения. Снижение периоперационных кардиологических осложнений у пациентов с ИБС основано на трёх принципах:
- Дооперационная идентификация пациентов высокого риска.
- Диагностика периоперационной ишемии миокарда для последующего проведения неотложных мероприятий.
- Профилактическое использование анестезиологических и антиишемических мероприятий по уменьшению распространённости и тяжести периоперационной ишемии миокарда и улучшению ближайших и отдаленных исходов лечения.
Рекомендации являются результатом согласованного мнения экспертов, выработанного на основании анализа опубликованных исследований в этой области [4, 7, 8]. Данные рекомендации не могут описать всего многообразия клинических форм основного и сопутствующих заболеваний и клинических ситуаций, и призваны помочь выбрать врачу наиболее оптимальную стратегию и тактику периоперационного ведения больных с ишемической болезнью сердца. В тех случаях, когда данные рекомендации являются неприменимыми, врач может и должен обоснованно применить альтернативный подход к лечению конкретного пациента, в соответствии с клинической ситуацией. Критическая оценка диагностических и лечебных процедур в последнее время включает определение соотношения риск–польза. Уровень доказательности и сила рекомендаций по определенным видам лечения приведены согласно шкалам, описанным в таблицах 1 и 2.
Таблица 1. |
Классы рекомендаций
Классы рекомендаций |
Определение |
Класс I |
Доказательно и/или имеется общее мнение, что проводимое лечение или процедура выгодны, удобны и эффективны |
Класс II |
Разночтения в доказательности и/или расхождение мнений о полезности/эффективности лечения или процедуры |
Класс IIa |
Сила доказательств и/или мнений указывают на полезность/эффективность |
Класс IIb |
Полезность/эффективность в меньшей степени установлены доказательствами/мнениями |
Класс III |
Доказательно и/или имеется общее мнение, что проводимое лечение или процедура не выгодны/эффективны, и в некоторых случаях могут принести вред |
Таблица 2. |
Уровень доказательности
Уровень доказательности А |
Данные получены на основе многоцентровых рандомизированных исследований или мета-анализов |
Уровень доказательности B |
Данные получены на основе одиночных рандомизированных исследований или больших нерандомизированных исследований |
Уровень доказательности C |
Консенсус мнений экспертов и/или небольших исследований, ретроспективных исследований, регистров |
Область применения
Настоящие рекомендации распространяются на осуществление медицинской помощи всем пациентам с ишемической болезнью сердца в периоперационный период в условиях стационара.
Цель разработки и внедрения
Улучшение качества оказания медицинской помощи больным с ишемической болезнью сердца в периоперационный период.
Задачи разработки и внедрения
- Совершенствование методов периоперационного ведения больных с ишемической болезнью сердца.
- Обеспечение доступности оказания медицинской помощи населению в рамках Программы государственных гарантий оказания гражданам.
Определение
Ишемическая болезнь сердца – это патологический процесс, складывающийся из:
- Атеросклеротического поражения коронарных артерий и /или
- Нарушения баланса между потребностью миокарда в кислороде и его доставкой.
Эти два механизма особенно важны при возникновении и оценке периоперационной ишемии миокарда [38].
Ишемическая болезнь сердца наблюдается у 30% плановых больных. Риск развития ИБС увеличивается с возрастом, но при сочетании неблагоприятных факторов риск повышается даже в молодом возрасте.
Факторы риска развития ИБС [11]:
- Мужской пол;
- Старение – процесс, который сложно охарактеризовать точно;
- Гиперхолестеринемия;
- Артериальная гипертензия;
- Курение;
- Сахарный диабет;
- Ожирение;
- Малоподвижный образ жизни (гиподинамия, гипокинезия);
- Генетические факторы/семейный анамнез.
Любое хирургическое вмешательство обусловливает стресс-реакцию. Повреждение тканей высвобождает нейроэндокринные факторы, происходят изменения жидкостных секторов организма, гемостатического потенциала. В результате возникают тахикардия, гипертензия, повышение потребления миокарда кислородом, повышается риск тромбообразования.
Классификация ишемической болезни сердца по международной классификации болезней (МКБ, 10-й пересмотр)
- Внезапная коронарная смерть (МКБ-Х — 146.1).
- Стенокардия (МКБ-Х — 120.0): стабильная стенокардия напряжения (I, II, III, IV функциональный класс — ФК); к III, IV ФК относят и стенокардию покоя (малых напряжений); вазоспастическая стенокардия (спонтанная, Принцметала); нестабильная стенокардия (выявленная впервые до 28 суток; прогрессирующая; ранняя постинфарктная).
- Острый инфаркт миокарда (ОИМ; МКБ-Х — 121.0) с указанием даты возникновения, локализации, осложнений: при наличии зубца Q (трансмуральный); без зубца Q (мелкоочаговый), субэндокардиальный; неопределенный', рецидивирующий (от 3 до 28 сут.); повторный (после 28 сут.); острая коронарная недостаточность.
- Кардиосклероз (с указанием стадии СН и вида аритмии): очаговый (МКБ-Х — 125.2) (постинфарктный; не обусловленный ИМ); диффузный (МКБ-Х — 125.0).
- Безболевая форма ИБС (МКБ-Х — 125.6)
2. ПРЕДОПЕРАЦИОННАЯ ОЦЕНКА ПАЦИЕНТА
Предоперационное обследование
В задачи предоперационного обследования входит определение текущего состояния функции сердечно-сосудистой системы, степень компенсации расстройств, оценка функциональных резервов. В последние десятилетия для объективизации риска кардиальных осложнений при внесердечных операциях активно используют разные прогностические индексы: Goldman, Detsky, Lee, RCRI и другие. Объем и длительность планируемого оперативного вмешательства также играют роль в повышении риска кардиальных осложнений. Инструментальное обследование должно включать нагрузочные пробы, так как стандартное обследование может не выявить функциональной дисфункции, особенно у пожилых [16]. Латентная ишемия миокарда, как правило, протекает без клиники стенокардии. Около 75% эпизодов ишемии у пациентов с симптоматической ИБС не связаны со стенокардией. До 10-15% острых эпизодов инфаркта миокарда протекают латентно.
Электрокардиография
Таблица 3. |
Показания для регистрации ЭКГ покоя в рамках предоперационного обследования [42]
Рекомендации |
Класс |
Уровень |
ЭКГ показана пациентам, имеющим факторы риска ССЗ, при планируемом хирургическом вмешательстве высокого или промежуточного риска. |
I |
B |
ЭКГ показана всем пациентам с нестабильным течением сердечно-сосудистого заболевания. |
I |
C |
ЭКГ показана пациентам, имеющим факторы риска ССЗ, при планируемом хирургическом вмешательстве низкого риска. |
Ia |
B |
Эхокардиография
Таблица 4. |
Показания для предоперационной неинвазивной оценки функции левого желудочка
Рекомендации |
Класс |
Уровень |
Пациентам с одышкой неизвестной этиологии целесообразно определять функцию ЛЖ. |
IIa |
C |
У пациентов с существующей или предшествующей ХСН с усилением одышки или другими изменениями в клиническом статусе целесообразно определение функции ЛЖ, если оно не проводилось в течение последних 12 месяцев. |
IIa |
C |
Целесообразность повторного исследования функции ЛЖ у клинически стабильных пациентов с диагностированной кардиомиопатией хорошо не изучена |
IIB |
C |
Рутинное периоперационное исследование функции ЛЖ не рекомендуется. |
III |
B |
Методы обследования для больных с ИБС [31]
А) Пробы с физической нагрузкой (тредмил-тест, велоэргометрия).
Б) Эхокардиография при использовании добутаминовой нагрузки.
В) Дооперационный Холтеровский мониторинг.
Г) Коронарная ангиография.
Индексы риска кардиальных осложнений
Факторы риска развития кардиальных осложнений при выполнении операций среднего/высокого кардиального риска:
- Gеренесенный ИМ давностью более 30 суток;
- Rомпенсированная ХСН;
- Cахарный диабет, требующий инсулинотерапии;
- ХПН (креатинин плазмы крови более 177 мкмоль/л и/или клиренс креатинина менее 60 мл/мин);
- Перенесенный ишемический инсульт или ТИА.
Стратегия стратификации риска (для стабильных пациентов)
Для определения сердечно-сосудистого риска в периоперационном периоде широко используют два типа индексов, основанных на клинической оценке состояния пациентов. Первый тип клинических индексов (генерические) определяют риск на основании подсчёта общего количества факторов риска (индексы Lee, Goldman, Larsen и Gilbert). Второй тип индексов основан на теореме Байеса и определяет риск в зависимости от априорной вероятности (частота развития сердечно-сосудистых осложнений в данном лечебном учреждении при данном виде хирургического лечения) и индивидуальных факторов риска пациента (индексы Kumar и Detsky).
Для объективизации сердечно-сосудистого риска следует оценить пациента по одному из индексов, наиболее соответствующему состоянию пациента и диагностическим возможностям на момент оценки (например, Detsky, Goldman, Lee) [8]. Индексы определения риска приведены ниже (таблицы 4-9).
Таблица 5. |
Шкала и индекс Goldman (L. Goldman, D. Caldera, 1978)
Критерий |
Баллы |
Анамнез а. Возраст > 70 лет б. Инфаркт миокарда в последние 6 мес. |
5 10 |
Объективный статус: а. S2 галоп или набухание яремных вен б. Значимый клапанный аортальный стеноз |
11 3 |
ЭКГ: а. Любой ритм, за исключением синусового или раннее сокращение предсердий на последней предоперационной ЭКГ б. > 5 преждевременных желудочковых сокращений в мин, зарегистрированных в любое время до операции |
7 |
Общий статус: РO2 < 60 или РСО2 > 50 мм рт.ст.; К+ < 3,0 или НСО3– < 20 ммоль/л; |
3 |
Оперативное вмешательство: а. Операции на брюшной полости, грудной клетке или аорте б. Экстренные операции |
3 4 |
Количество возможных баллов |
53 |
Таблица 6. |
Интерпретация индекса Goldman
Класс |
Количество баллов |
Риск развития осложнений (%) |
I класс |
До 5 |
1-7 |
II класс |
6-12 |
7-11 |
III класс |
13-25 |
14-38 |
IV класс |
Более 26 |
30-100 |
Таблица 7. |
Индекс Detsky [37]
Критерии |
Баллы |
Возраст старше 70 лет |
5 |
ИМ в течение предшествующих 6 мес. |
10 |
ИМ более 6 мес. |
5 |
Стенокардия III ФК в соответствии с классификацией Канадского кардиологического общества (ССS) |
10 |
Стенокардия IV ФК в соответствии с CCS |
20 |
Отек легких в течение предшествующей недели |
10 |
Отек легких в анамнезе в любое время |
5 |
Любая аритмия |
5 |
Желудочковые экстрасистолы более 5 в 1 мин |
5 |
Выраженный стеноз аортального клапана |
20 |
Общее состояние, любое из перечисленных: PO2 < 60 мм рт. ст.; рСO2 > 50 мм рт. ст.; K+ крови < 3 ммоль/л; азот мочевины крови > 50 ммоль/л; креатинин крови > 260 мкмоль/л; постельный режим вследствие некардиальных причин |
5 |
Экстренная операция |
10 |
Таблица 8. |
Интерпретация индекса Detsky [37]
Класс |
Количество баллов |
Риск развития осложнений (%) |
I класс |
До 15 |
5 |
II класс |
20-30 |
27 |
III класс |
Более 30 |
60 |
Применение индекса Lee [29], включающего оценку шести параметров (таблица 9), рекомендуется для предоперационной оценки сердечно-сосудистого риска (класс I, уровень А) [38].
Таблица 9. |
Пересмотренный индекс сердечно-сосудистого риска Lee
Параметры |
Баллы |
Хирургическое вмешательство высокого риска
|
1 |
Ишемическая болезнь сердца
|
1 |
Застойная сердечная недостаточность
|
1 |
Церебрально-васкулярные заболевания
|
1 |
Инсулин-зависимый сахарный диабет |
1 |
Креатинин сыворотки >2,0 мг/дл |
1 |
Интерпретация результатов при оценке пациента по индексу Lee
Категория риска |
Сумма баллов |
Риск развития осложнений, % |
I. Очень низкий |
0 |
0,4 |
II. Низкий |
1 |
0,9 |
III. Промежуточный |
2 |
6,6 |
IV. Высокий |
3 и более |
11,0 |
Наибольшее признание в мировой практике получила шкала Lee et al. Однако следует отметить, что индекс Lee был разработан и апробирован на контингенте исключительно плановых хирургических больных, причем большинство операций составляли малотравматичные вмешательства. По этой причине шкала Lee малоэффективна в подгруппах с заведомо высоким риском кардиальных осложнений, таких как пожилые больные, которым выполняют обширные абдоминальные операции [6]. Мы рекомендуем использование шкалы Lee для скриниговой оценки кардиального риска в общехирургической практике. При необходимости уточнения вероятности кардиальных осложнений у больных из группы риска представляется обоснованным использовать более детальные индексы Goldman и Detsky. Последняя шкала особенно эффективна в количественной, в процентах, оценке кардиального риска.
Существенным ограничением индексов Lee, Goldman, Detsky и других шкал является обобщенность прогноза: они позволяют оценить вероятность кардиальных осложнений, но не позволяют предсказать их вид и выявить возможные механизмы. В то же время, очевидно, что для профилактики декомпенсации коронарной и сердечной недостаточности могут потребоваться совершенно различные меры. С целью раздельной оценки риска этих осложнений возможно рекомендовать следующий подход.
- При оценке риска коронарогенных осложнений, возникающих на фоне коронарной недостаточности (вследствие наличия исходных стенозов коронарных артерий), учитывают функциональный класс стенокардии напряжения, наличие инфаркта миокарда в анамнезе, а также данные стресс-эхокардиографии.
- Затруднительным является прогнозирование периоперационных инфарктов миокарда вследствие разрыва атеросклеротической бляшки, поскольку такого рода осложнения могут возникать у больных без исходных признаков ишемической болезни сердца. При оценке риска кардиальных осложнений в данной группе рекомендуется учитывать наличие факторов риска и маркеров системного атеросклероза (табл. 10). Наличие 5 и более из них свидетельствует о высоком кардиальном риске.
- Существенное значение в оценке риска декомпенсации сердечной недостаточности имеет предоперационный уровень NT-proBNP в сыворотке крови. Повышение этого маркера даже при отсутствии клинических признаков субкомпенсации сердечной недостаточности является маркером высокого кардиального риска [6].
Таблица 10. |
Факторы риска/маркеры атеросклероза
Транзиторная ишемическая атака, инфаркт головного мозга, стеноз сонной артерии более 50% (по данным ультразвуковой допплерографии) и/или реконструктивные вмешательства на сонных артериях в анамнезе |
Аневризма брюшного или грудного отдела аорты |
Атеросклероз сосудов нижних конечностей: наличие гемодинамически значимых стенозов в сочетании с клиническими признаками недостаточности кровообращения или реконструктивные вмешательства на артериях нижних конечностей в анамнезе |
Сахарный диабет или нарушение толерантности к глюкозе |
Курение |
Дислипидемия: индекс атерогенности (отношение содержания холестерина липопротеидов низкой плотности к содержанию холестерина липопротеидов высокой плотности) более 3 |
Индекс массы тела более 25 кг/м2 |
Артериальная гипертензия: АД >140/80 мм рт. ст. или применение гипотензивных препаратов |
Интерпретация результатов при оценке сердечно-сосудистого риска по индексу Lee предполагает стратификацию пациентов на категории очень низкого, низкого, промежуточного и высокого риска; с повышением числа факторов риска частота развития периоперационных кардиальных осложнений возрастает при разных типах операций. Следует отметить, что при оценке риска по шкале Lee исключают пациентов с нестабильной стенокардией, недавно перенесённым инфарктом миокарда и стенокардией выше III функционального класса (CCS). Для повышения качества прогноза лучше использовать несколько индексов одновременно [8].
Если у пациента в анамнезе – перенесенный инфаркт миокарда, то перед проведением планового внесердечного оперативного вмешательства определяют риск развития кардиальных осложнений [11]. Критические состояния, требующие повышенного внимания, приведены в таблице 11. Чем меньше времени прошло от перенесенного ИМ, тем выше риск периоперационного реинфаркта [33, 37, 40]; рекомендуется отсрочить вмешательство на срок не менее 6 недель [11].
Таблица 11. |
Клинические состояния, требующие временной отмены плановой внесердечной
операции, немедленного обследования и лечения (класс I, уровень
доказательности В)
Патология |
Пример |
|
Острый коронарный синдром |
| ИМ давностью менее 30 суток | |
| Нестабильная стенокардия | |
| Стабильная стенокардия III-IV ФК по Канадской классификации | |
Тяжелая ХСН |
Декомпенсированная ХСН (III-IV ФК по Нью-Йоркской классификации) |
Выраженные нарушения ритма сердца и проводимости
|
АВ-блокада 2 степени типа Мобитц 2 |
| АВ-блокада 3 степени | |
| Симптоматическая желудочковая аритмия | |
| Впервые выявленная устойчивая желудочковая тахикардия, | |
Суправентрикулярная аритмия с неконтролируемой частотой желудочкового ритма (ЧСС более 100 в минуту в покое) |
|
| Симптоматическая синусовая брадикардия, эпизоды асистолии > 3 секунд, фибрилляция предсердий (брадисистолия) |
Оценка функциональных резервов пациента
Одной из важных составляющих с точки зрения оценки тяжести ишемической болезни сердца является определение функциональных резервов пациента.
Риск повышается у пациентов, которые при нагрузке не способны достичь мощности четырех метаболических эквивалентов (МЕТ). 1 МЕТ = потребление кислорода в покое у 40-летнего мужчины весом 70 кг ? 3,5 мл/кг
Функциональные резервы клинически можно определить, используя таблицу 12 (учитывается максимальное значение активности пациента).
Функциональные резервы можно оценить как
- Прекрасные – более 10 МЕТ
- Хорошие – 7-10 МЕТ
- Удовлетворительные – 4-7 МЕТ
- Плохие – менее 4 МЕТ
Таблица 12. |
Оценка функциональных резервов пациента в МЕТ при различной деятельности
МЕТ |
Уровни функциональной нагрузки |
Можете ли вы: |
|
1 |
Есть, работать на компьютере, одеваться? |
2 |
Спуститься на 1 этаж, передвигаться по дому, готовить? |
3 |
Пройти 1-2 квартала? |
4 |
Сгребать листья, заниматься садоводством? |
5 |
Пройти пролет лестницы, танцевать, ездить на велосипеде? |
6 |
Играть в гольф, наносить удар? |
7 |
Играть в одиночный теннис? |
8 |
Быстро подняться на 1 пролет, медленно бежать? |
9 |
Медленно прыгать на скакалке? |
10 |
Быстро плавать, бегать? |
11 |
Кататься на лыжах, играть в баскетбол? |
12 |
Быстро бежать на средние/длинные дистанции? |
Пациенты классифицируются как пациенты высокого риска вследствие возраста или наличия кардиологического заболевания. Пациенты без клинических проявлений, которые способны пробегать ежедневно по 30 минут, могут не нуждаться в дальнейшем обследовании. Напротив, малоподвижным пациентам без кардиологического заболевания в анамнезе, но с клиническими факторами, подтверждающими увеличение периоперационного риска, может быть полезно более интенсивное дооперационное обследование. Показания к неинвазивному нагрузочному тестированию приведены в таблице 13.
Таблица 13. |
Показания для неинвазивного нагрузочного тестирования
Рекомендации |
Класс |
Уровень |
Пациенты с нестабильными коронарными состояниями (см. таблицу 8), которым планируется выполнения некардиальной хирургической операции, должны пройти обследование (включая нагрузочное тестирование) и получить соответствующее лечение перед операцией в соответствии с существующими клиническими рекомендациями. |
I |
B |
Неинвазивный стресс-тест целесообразно проводить пациентам с тремя или более клиническими факторами риска (таблица 6) и низким функциональным статусом (менее 4 МЕТ), которым запланированы сосудистые хирургические вмешательства, если это может изменить стратегию лечения. |
IIa |
B |
Проведение неинвазивного стресс-теста обосновано у пациентов с 1-2 факторами риска и хорошими функциональными возможностями (более 4 МЕТ), которым запланирована сосудистая операция, если это может изменить стратегию лечения |
IIb |
B |
Проведение неинвазивного стресс-теста обосновано у пациентов с 1-2 факторами риска и хорошими функциональными возможностями (более 4 МЕТ), которым запланированы внесердечные хирургические вмешательства промежуточного риска, если это может изменить стратегию лечения |
IIb |
B |
Проведение неинвазивного стресс-теста не показано пациентам без клинических факторов риска, которым запланированы внесердечные хирургические вмешательства промежуточного риска. |
III |
С |
Проведение неинвазивного стресс-теста не показано пациентам, которым запланированы внесердечные хирургические вмешательства низкого риска. |
III |
С |
После проведения нагрузочных тестов необходимо оценить результаты по критериям высокого риска развития осложнений. Эти критерии представлены в таблице 14.
Таблица 14. |
Критерии высокого риска по данными неинвазивного нагрузочного тестирования
Критерий высокого риска |
Описание |
Интенсивность нагрузки |
Ишемия индуцирована низкой нагрузкой (менее 4 МЕТ |
Низкая пороговая ЧСС при появлении симптомов |
Ишемия индуцирована при ЧСС менее 100 в минуту или менее 70% от максимальной для данного возраста при отмене бета-адреноблокаторов |
Депрессия сегмента ST |
Горизонтальная или косонисходящая депрессия сегмента ST более 0,1 мВ |
Элевация ST |
Подъем сегмента ST более 0,1 мВ в неинфарктном отведении |
Объем вовлеченного миокарда |
Патологические изменения появляются в 5 и более отведениях ЭКГ или в 5 и более сегментах ЛЖ |
Клиника |
Индуцирован типичный ангинозный приступ |
Реакция АД |
Снижение систолического АД более чем на 10 мм рт. ст. в связи с нагрузкой |
В случае их отсутствия обследование можно завершить и начать периоперационное лечение. При выявлении критериев высокого риска значительно повышается вероятность периоперационного инфаркта миокарда. В связи с этим решение о проведении хирургического вмешательства должно приниматься индивидуально с учетом соотношения потенциальной пользы и риска оперативного лечения. В этой ситуации необходимо рассмотреть вопрос о целесообразности выполнения коронарографии и реваскуляризации миокарда перед операцией. В то же время, согласно результатам ряда последних исследований, предварительная реваскуляризация миокарда перед внесердечным оперативным вмешательством не снижает риск неблагоприятных сердечно-сосудистых событий, в связи с чем ее проведение рекомендуется только тем пациентам, которым она показана независимо от предполагаемой операции. При этом, риск периоперационных осложнений реваскуляризации миокарда, рассчитанный по шкале EuroSCORE (таблица 15) не должен превышать риск кардиальных осложнений предполагаемого внесердечного хирургического вмешательства.
Таблица 15. |
Факторы риска оценочной шкалы EuroSCORE
Фактор риска |
Определение фактора риска |
Баллы |
Факторы риска, связанные с характеристикой пациента |
||
Возраст |
Каждые 5 лет после 60 |
1 |
Пол |
Женский пол |
1 |
Хронические заболевания легких |
Длительное применение бронхолитиков и стероидов по поводу хронических заболеваний легких |
1 |
Экстракардиальная артериопатия |
Окклюзия сонной артерии или стеноз >50%. Перенесенное или планируемое вмешательство на сонной артерии или брюшной аорте |
2 |
Неврологические отклонения |
Неврологические отклонения, затрудняющие передвижение и повседневную деятельность |
2 |
Предшествовавшие кардиохирургические вмешательства |
Ранее перенесенные операции, потребовавшие вскрытия перикарда |
3 |
Уровень креатинина сыворотки крови |
>200 ммоль/л до операции |
3 |
Активный эндокардит |
Антибиотикотерапия активного эндокардита на момент выполнения операции |
3 |
Критический дооперационный статус |
Критическое состояние: ЖТ, фибрилляция, перенесенная внезапная смерть, массаж сердца или ИВЛ до поступления в операционную, дооперационная поддержка, внутриаортальная баллонная контрпульсация, предоперационная почечная недостаточность (анурия, олигурия <10 мл/ч) |
3 |
Факторы риска, связанные с состоянием сердца |
||
Стенокардия покоя |
Стенокардия покоя, требующая внутривенного введения нитратов до поступления в операционную |
2 |
Дисфункция левого желудочка |
Умеренная – ФВ ЛЖ 30-50% |
1 |
|
Выраженная – ФВ ЛЖ < 30% |
3 |
Перенесенный («свежий») инфаркт миокарда |
<90 дней |
2 |
Легочная гипертензия |
Систолическое АД в легочной артерии >60 мм рт. ст. |
2 |
Факторы риска, связанные с операцией |
||
Экстренность |
Экстренная операция (выполняется в течение 1 суток после поступления в стационар) |
2 |
Все операции, за исключением изолированного аорто-коронарного шунтирования |
Сложные кардиохирургические вмешательства |
2 |
Хирургия грудной аорты |
Операции на дуге аорты, восходящей или нисходящей аорте |
3 |
Постинфарктный дефект межжелудочковой перегородки |
|
4 |
Рекомендации по проведению коронарографии в предоперационном периоде представлены в таблице 16.
Таблица 16. |
Рекомендации по проведению коронарографии в периоперационном периоде внесердечных хирургических вмешательств
Рекомендации |
Класс |
Уровень |
Предоперационное выполнение коронарографии рекомендовано у пациентов с острым коронарным синдромом с подъемом сегмента ST. |
I |
А |
Предоперационное выполнение коронарографии рекомендовано у пациентов с острым коронарным синдромом без подъема сегмента ST. |
I |
А |
Предоперационное выполнение коронарографии рекомендовано у пациентов с тяжелой стабильной стенокардией, клиника которой сохраняется на фоне оптимальной медикаментозной терапии. |
I |
А |
Проведение коронарографии может рассматриваться у пациентов со стабильным течением ИБС, которым планируется выполнение операции высокого кардиального риска. |
IIb |
В |
Проведение коронарографии может рассматриваться у пациентов со стабильным течением ИБС, которым планируется выполнение операции среднего кардиального риска. |
IIb |
С |
Проведение коронарографии не рекомендовано пациентам перед внесердечным хирургическим вмешательством низкого коронарного риска |
III |
С |
Выбор метода реваскуляризации (чрескожное коронарное вмешательство (ЧКВ) или коронарное шунтирование) осуществляется согласно существующим рекомендациям по коронарной реваскуляризации. В случае выбора ЧКВ необходимо принимать во внимание, что пациент будет должен длительное время получать антитромбоцитарную терапию. Если некардиальную операцию нельзя отложить более, чем на 12 месяцев, предпочтительна имплантация голометаллических стентов, так как в этом случае продолжительность двойной антитромбоцитарной терапии составляет минимально 1 месяц.
Оценка оперативного вмешательства
Оценка хирургического риска при проведении некардиологического оперативного вмешательства связана с двумя важными факторами. Во-первых, тип вмешательства (таблица 17) может указать пациентов с повышенным риском развития периоперативной кардиологической патологии (вплоть до летального исхода). Так, при сосудистой операции наличие кардиологического заболевания является важным фактором для пациента. Если пациенту проводится сосудистая операция, необходимо тщательно выполнить необходимые обследования, если это может повлиять на тактику лечения. Другие типы вмешательств могут быть связаны с меньшим риском, чем сосудистые операции. При неинвазивной хирургии, где периоперативная заболеваемость связана с операцией в 1-5% случаев (оперативное вмешательство среднего риска), сокращение количества исследований определило наилучшую стратегию (выполнение запланированного оперативного вмешательства под контролем ЧСС с помощью ?-блокаторов и дальнейшим обследованием сердечно-сосудистой системы, если это изменит лечение). Тем не менее, при подготовке к лапароскопическим манипуляциям рекомендуется (класс I, уровень А) такой же объем скрининга, как и для полостных операций [35].Таблица 17 |
Классификация кардиологического риска при выполнении не кардиологических
операций (риск развития кардиологических осложнений и летального исхода) [19]
Риск операции |
Пример процедур |
Низкий (кардиологический риск менее 1%) |
Эндоскопические вмешательства |
Средний (кардиологический риск от 1 до 5%) |
Абдоминальные и торакальные оперативные вмешательства |
Сосудистые/высокий (кардиологический риск часто более 5%) |
Операции на аорте и других больших сосудах. |
Пошаговая оценка пациента с ишемической болезнью сердца при необходимости некардиальной операции
В ургентных ситуациях у анестезиолога может не оказаться времени на полномасштабное дообследование пациента, в таких случаях необходимо проводить максимально достаточный мониторинг состояния пациента и корректировать лечение по клинической ситуации. В плановой же хирургии следует предпринять ряд шагов по уменьшению риска развития кардиальных осложнений.
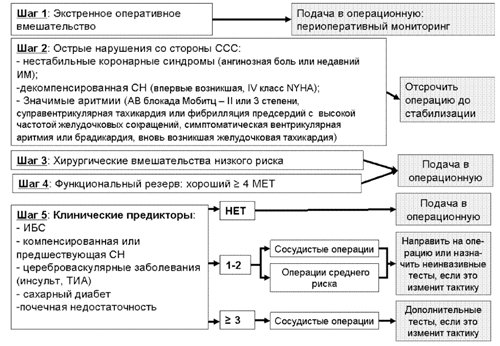
Ниже представлены 2 алгоритма оценки ССС при внесердечных операциях – упрощенный (рис. 1) и расширенный (рис. 2).
Рисунок 1. Упрощенная оценка сердечно-сосудистой системы при некардиальных операциях
Расширенный алгоритм пошаговой оценки состоит из 8 шагов (рис. 2).
- Определение экстренности операции и нестабильности состояния ССС
- При плановой операции: коронарная реваскуляризация в последние 5 лет
- Недавняя оценка функции коронарных сосудов
- Стратификация коронарного риска и решение дальнейшей лечебной тактики
- Высокий риск – отмена операции и дообследование
- Средний и низкий риск – дифференциальная оценка:
- Учет функциональных резервов при среднем риске
- Учет функциональных резервов при низком риске
Неинвазивная и инвазивная оценка и решение вопроса об операции
Рисунок 2. Алгоритм предоперационной оценки пациентов с ишемической болезнью
сердца с учетом клинических и хирургических факторов риск
3. Предоперационная подготовка
После определения факторов риска пациента основными путями подготовки к некардиальному оперативному вмешательству являются:
- Реваскуляризация хирургическим путем / установка стента
- Оптимизация медикаментозной терапии (табл. 18)
Оптимизация медикаментозной терапии
Исследования последних лет, в том числе ряд мета-анализов, показали, что наиболее эффективными препаратами, позволяющими улучшить послеоперационные исходы, являются ?-адреноблокаторы (табл. 19) и статины [15, 38].
Таблица 18 |
Оптимизация медикаментозной терапии
Задачи оптимизации |
Препараты |
|
|
Таблица 19. |
Рекомендации по назначению ?–адреноблокаторов в периоперационный период
Рекомендации |
Класс |
Уровень |
Прием БАБ, применявшихся ранее для лечения состояний, являющихся показаниями класса I по рекомендациям ВНОК, должен быть продолжен у пациентов, подвергающихся хирургическим вмешательствам. |
I |
С |
Прием БАБ, вероятно, целесообразно рекомендовать пациентам, подвергающимся сосудистым хирургическим вмешательствам, которые относятся к высокому кардиальному риску в связи с наличием ИБС или ишемии миокарда, индуцированной в ходе предоперационного нагрузочного тестирования. |
IIa |
B |
Обосновано назначение БАБ пациентам, которые подвергаются выполнению хирургического вмешательства промежуточного кардиального риска и у которых выявлена ИБС и/или наличие более одного клинического фактора риска (таблица 13). |
IIa |
B |
Обосновано назначение БАБ пациентам, которые имеют более одного клинического фактора риска (таблица 13) и подвергаются выполнению сосудистого хирургического вмешательства. |
IIa |
C |
Целесообразность использования БАБ неясна у пациентов, подвергающихся сосудистым вмешательствам без клинических факторов риска и доказанной ИБС, которые в настоящее время не принимают БАБ. |
IIb |
B |
Рутинное назначение высоких доз БАБ без индивидуального подбора дозы нецелесообразно и может быть опасным для пациентов, которые подвергаются внесердечным хирургическим вмешательствам и не принимают в настоящее время БАБ. |
III |
B |
БАБ не должны назначаться пациентам, подвергающимся хирургическим вмешательствам и имеющим абсолютные противопоказания для приема БАБ. |
III |
С |
Эффективность дозы определяется поддержанием ЧСС в покое на уровне 50-60 ударов в минуту; при нагрузке ожидаемое увеличение ЧСС – на 10-20%. Терапия должна быть продолжена в течение периоперативного периода. Атропин (гликопирролат – не зарегистрирован в РФ) предотвращает чрезмерный отрицательный хронотропный эффект ?-блокаторов в течение периоперативного периода.
Статины
По данным мета-анализа 12 ретроспективных и 3 проспективных исследований было доказано, что статины снижают смертность при проведении внесердечных вмешательств на 29% и сосудистых – на 59%, причем это, в первую очередь, касается операций высокого риска [46]. Внезапная отмена статинов может привести к неблагоприятным сосудистым событиям, в том числе к инфаркту миокарда. Рекомендованы препараты длительного действия – розувастатин, аторвастатин, флувастатин. Терапию статинами (если она не была назначена раньше) необходимо начинать в сроки от 30 до 7 суток до операции и продолжать в послеоперационном периоде [17]. Клинические рекомендации по применению статинов представлены в таблице 20.Таблица 20. |
Рекомендации по назначению статинов в периоперационном периоде
Рекомендации |
Класс |
Уровень |
Прием статинов у пациентов, получающих их в настоящее время и подвергающихся внесердечным хирургическим вмешательствам, должен быть продолжен. |
I |
B |
У пациентов, подвергающихся сосудистым хирургическим вмешательствам с наличием или отсутствием клинических факторов риска, применение статинов обосновано. |
IIa |
B |
Статины могут быть назначены пациентам, имеющим, по крайней мере, один клинический фактор риска, с предстоящим хирургическим вмешательствам промежуточного риска. |
IIb |
C |
Ингибиторы АПФ
Рекомендуется (класс I, уровень С) продолжить прием ингибиторов АПФ при внесердечных операциях у стабильных пациентов с дисфункцией левого желудочка [38]. Необходимо отказаться от приема ингибиторов АПФ в течение 24 часов перед операцией с существенным волемическим расстройством или кровопотерей (рекомендации класс IIa, уровень С).
Ивабрадин
Рекомендуется использовать у пациентов высокого кардиального риска, имеющих противопоказания к применению ?-блокаторов или совместно с ?-блокаторами при невозможности титрования их дозы. Доказано, что препарат снижает риск ишемии и периоперационного инфаркта миокарда.
Антиагреганты
При проведении первичной профилактики ацетилсалициловая кислота, а также другие антиагреганты (клопидогрель, тикагрелор) должны быть отменены за 5–7 дней до оперативного внесердечного вмешательства, так как их применение сопряжено с повышенным риском кровотечений. В то же время при проведении вторичной профилактики у больных ИБС прием антиагрегантов следует продолжить до начала оперативного вмешательства за исключением оперативных вмешательств в замкнутых пространствах (интракраниальные, внутри спинномозгового канала, на заднем сегменте глаза и др.), когда также требуется отмена препаратов за 5-7 дней до вмешательства. Прием ацетилсалициловой кислоты рекомендуется возобновить через 24 ч.
Нитраты
Инфузия нитратов показана в случае выявленной ишемии миокарда при интраоперационном мониторинге ЭКГ.
Антагонисты кальция
Недигидропиридиновые антагонисты кальция могут быть использованы при наличии противопоказаний к применению ?-блокаторов (класс I, C).
Диуретики
При артериальной гипертонии прием диуретиков рекомендуется отменять в день операции. Пациентам с ХСН может потребоваться введение диуретиков во время операции. Возобновить прием препаратов рекомендуется на следующий день. Необходим также контроль электролитов крови.
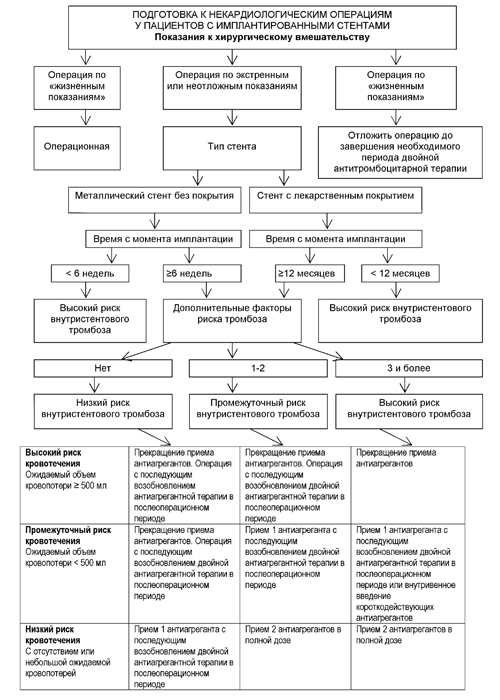
Особенности периоперационного ведения пациентов с ангиопластикой и стентированием коронарных артерий в анамнезе.
В современном мире анестезиологам все чаще приходится встречаться с пациентами, перенесшими чрескожные коронарные вмешательства (ЧКВ). Согласно литературным данным, в течение первого года после ЧКВ около 5% пациентов оперируются по показаниям, не связанным с заболеваниями сердца [45].
ACC/AHA, ряд других обществ и ВНОК рекомендуют:
- Избегать имплантации стентов с лекарственным покрытием, если пациент не сможет принимать сочетание ацетилсалициловой кислоты с клопидогрелем (или другим блокатором P2Y12 рецепторов тромбоцитов) в течение 12 месяцев;
- Проводить хирургическую реваскуляризацию, ангиопластику или использовать голометаллические стенты, если в течение 12 месяцев после ЧКВ планируется оперативное лечение;
- После проведенной баллонной ангиопластики без стентирования коронарных артерий внесердечное хирургическое вмешательство следует выполнять не ранее, чем через 2–4 недели, учитывая незавершенный процесс репарации сосуда;
- Подробно информировать пациента о важности двойной антитромбоцитарной терапии ацетилсалициловой кислотой и блокатором рецептора P2Y12 тромбоцитов;
- Перед принятием решения отменить антитромбоцитарные препараты обсудить этот вопрос с кардиологом;
- Минимальная длительность терапии сочетанием ацетилсалициловой кислоты с клопидогрелем (или другим блокатором P2Y12 рецепторов тромбоцитов) после имплантации олометаллического стента составляет 1 месяц или 6-12 месяцев после имплантации стента с лекарственным покрытием;
- После отмены клопидогреля (или другого блокатора P2Y12 рецепторов тромбоцитов) до момента вмешательства пациент должен принимать ацетилсалициловую кислоту;
- После выполнения хирургического вмешательства терапия клопидогрелем (или другим блокатором P2Y12 рецепторов тромбоцитов) должна быть возобновлена как можно раньше;
- В обязательном порядке следует указывать тип стента в выписке из стационара, где было проведено ЧКВ;
- Стоимость лекарственной терапии не должна оказывать влияние на ее длительность.
Необходимо отметить, что, с одной стороны, само по себе хирургическое вмешательства повышает риск развития тромбоза стента и инфаркта миокарда, так как неизбежно связано с периоперационным стрессом, активацией симпатоадреналовой системы и гиперкоагуляцией в ответ на повреждение тканей. Однако самой важной причиной тромбоза стента является преждевременное прекращение двойной антитромбоцитарной терапии. В фазу эндотелизации коронарного стента средний риск периоперационного инфаркта, связанного с тромбозом стента, составляет 35%, смерти – 30 – 40% [43], т.е. периоперационная смертность возрастает в 5-10 раз.
Таким образом, рекомендовано отложить плановое оперативное вмешательство до отмены двойной антитромбоцитарной терапии. Если на фоне двойной антитромбоцитарной терапии необходимо выполнить вмешательство закрытого типа (интракраниальные, внутри спинномозгового канала, на заднем сегменте глаза и другие) или операцию с высоким риском кровотечения, рекомендуется прекратить прием клопидогреля (или другого блокатора P2Y12 рецепторов тромбоцитов) за 5-7 дней до вмешательства при сохранении терапии ацетилсалициловой кислотой. Экстренные вмешательства должны проводиться на фоне полноценной антитромбоцитарной терапии, несмотря на повышенный риск развития кровотечений.
При принятии решения об отмене или продолжении антитромбоцитарной терапии необходимо также учитывать дополнительные факторы риска тромбоза стента:
- бифуркационный стент;
- стент в устье коронарной артерии (остиальный);
- стент малого диаметра (менее 3 мм);
- множественные стенты;
- накладывающиеся стенты;
- субоптимальный результат стентирования (кровоток TIMI III; остаточные стенозы);
- имплантация стента в экстренном порядке;
- сахарный диабет;
- почечная недостаточность;
- пожилой возраст (старше 70 лет);
- низкая фракция выброса левого желудочка (менее 35%).
актика ведения больных с имплантированными стентами представлена на рисунке 3 [10].
Рисунок 3. Тактика периоперационного ведения пациентов с имплантированными коронарными стентами
Особенности периоперационного ведения пациентов с операцией коронарного шунтирования в анамнезе
Пациенты, перенесшие операцию коронарного шунтирования (КШ) в сроки менее 6 недель назад, относятся к группе высокого риска. Плановые хирургические вмешательства должны быть отложены.
Если с момента выполнения КШ прошло от 6 недель до 3 месяцев, пациенты относятся к группе среднего риска и тактика их ведения не отличается от тактики ведения больных с ИБС.
Если после операции КШ прошло более 3 месяцев, но менее 6 лет и у пациента нет клинических проявлений стенокардии и необходимости приема антиангинальных препаратов, то периоперационный риск развития кардиальных осложнений при выполнении внесердечных хирургических вмешательств не отличается от риска осложнений у больных без ИБС [10].
Премедикация
Важной задачей премедикации у пациентов с ИБС является профилактика симпатической активации и устранение коронарной вазоконстрикции [35]. Для подготовки пациента перед подачей в операционную можно применять бензодиазепины и опиоиды:
- Мидазолам 2,5–5 мг в/м за 0,5 часа до подачи в операционную (с осторожностью использовать у пожилых пациентов, т.к. препарат, как и все бензодиазепины, способен провоцировать возникновение послеоперационного делирия. Препараты диазепама применять не рекомендуется.
- Морфин 0,1 мг/кг в/м за 0,5 ч до подачи в операционную или фентанил – 0,5-1 мкг/кг, в/в вводимый анестезиологом по требованию после установки в/в катетера.
При наличии язвенной болезни и рефлюкса следует назначить антациды и антисекреторные препараты. При закрытоугольной глаукоме применяют м-холиномиметики; использование системных антихолинергических препаратов не является противопоказанием при глаукоме, если продолжено основное лечение заболевания. При сахарном диабете обязательны контроль и поддержание уровня глюкозы крови в пределах 5,6-14,0 ммоль/л.
4. Интраоперационный период
Ключевая задача анестезиолога в периоперационном периоде – поддержание в миокарде баланса между потребностью в кислороде и его доставкой. Этого можно добиться двумя путями: во-первых, избегать увеличения ЧСС, значительного повышения конечно-диастолического давления в левом желудочке, во-вторых, поддерживать оптимальное АД, гемоглобин выше 90 г/л, Ht ? 0,32, PаО2 выше 60 мм рт. ст., нормотермию. Ряд интраоперационных событий могут ухудшить этот баланс (таблица 21).Таблица 21 |
Интраоперационные события, которые влияют на баланс между доставкой
и потреблением миокардом кислорода [7, 18]
Задачи оптимизации |
Препараты |
Снижение доставки кислорода (в частности, снижение коронарного кровотока)
|
Увеличение потребности в кислороде
|
Интраоперационный инфаркт миокарда, в соответствие с третьим универсальным определением [43], выявляется при повышении концентрации кардиомаркера [предпочтительно кардиального тропонина (cTn)], по крайней мере, на одно значение выше верхнего референсного значения. В дополнение к значению кардиального тропонина, должен быть, по крайней мере, один из пяти признаков, подтверждающих диагноз ИМ:
- симптомы ишемии;
- новое (или предположительно новое) значительное изменение сегмента ST и зубца T, или блокада левой ножки пучка Гиса;
- появление патологического зубца Q;
- дополнительная утрата жизнеспособного миокарда или региональное нарушение подвижности миокарда, доказанные путем визуализации (ЭХО-КГ, сцинтиграфия);
- обнаружение внутрикоронарного тромба при ангиографии или при аутопсии.
Перечисленные показатели следует оценивать при диагностике интраоперационного ИМ у пациентов с некардиальными операциями, тем не менее, четких критериев его диагностики пока не предложено [15].
Интраоперационный мониторинг
Выбор объема мониторинга должен определяться анестезиологической бригадой для обеспечения гладкого течения периоперационного периода [20]. Кроме того, рекомендуется начать мониторинг до индукции анестезии, чтобы иметь представление о пре-, интра- и постоперационной функции сердечно-сосудистой системы [24].
Перечень рекомендуемого интраоперационного мониторинга у пациентов с ИБС [35, 38]
- ЭКГ (рекомендации класс I, уровень С)
- Пульсоксиметрия
- Измерение температуры тела
- Измерение диуреза
- Лабораторные исследования
- Определение артериального давления: неинвазивное или инвазивное
- Чрезспищеводная (при наличии) или трансторакальная эхокардиография
- Измерение центрального венозного давления
- Капнография
- Использование катетера Свана-Ганца (при наличии и клинической необходимости)
Электрокардиограмма является важнейшим способом контроля состояния миокарда у пациентов с ИБС [25]. Желателен мониторинг сегмента ST. Изменения на ЭКГ должны всегда фиксироваться на распечатанной бумажной копии. При высоком риске оперативного вмешательства у больных с риском ИБС целесообразнее применять инвазивные методы измерения АД, хотя при малых операциях можно пользоваться неинвазивными методами измерения АД.
Индукция и поддержание анестезии
Необходимо учитывать, что рутинная практика предоперационного голодания и ограничения приема жидкости могут привести к относительной гиповолемии и способствовать развитию выраженной гипотензии на этапе индукции анестезии. У больных с сопутствующей кардиальной патологией особенно важно не допускать развития интраоперационной гипотермии, так как на этапе выхода из анестезии возможно развитие мышечной дрожи, повышения потребления кислорода и развития ишемии миокарда.
Ингаляционные анестетики
Преимущества современных летучих ингаляционных анестетиков – быстрое выключение сознания, мышечная релаксация, быстрое восстановление дыхательной функции, дозозависимое уменьшение работы желудочков и потребления кислорода [37]. Недостатки – ограниченная способность подавления рефлексов на хирургическую стимуляцию (при моноанестезии), чрезмерная сердечно-сосудистая депрессия (в дозах более 1,5-2,0 МАК для некоторых анестетиков), неадекватная аналгезия при выходе из анестезии, увеличение потребления кислорода вследствие тепловых потерь, увеличенная периферическая вазодилятация.
Влияние ингаляционных анестетиков на сократимость миокарда – отрицательное, усиливается при гипокальциемии, использовании антагонистов кальциевых каналов, ?-блокаторов. Отрицательное инотропное действие уменьшается в эволюционном ряду [галотан = энфлюран > изофлюран > десфлюран = севофлюран].
Выбор ингаляционных анестетиков [18]: изофлюран – постепенно уступает свои позиции сево- и десфлурану; при ИБС предпочтителен выбор севофлюрана. Есть данные об успешном использовании ксенона в составе комбинированного эндотрахеального наркоза. К преимуществам ксеноновой анестезии относится отсутствие отрицательного инотропного влияния на миокард, а также наличие антигипоксических и кардиопротекторных свойств данного анестетика [3, 36].
Внутривенные анестетики
Гипнотики и транквилизаторы широко применяются у больных с ИБС с учетом особенностей их действия [35]. Мидазолам обладает минимальным депрессивным эффектом на сократимость миокарда. Пропофол обусловливает вазодилятацию и умеренное отрицательное инотропное действие, в то же время отличаясь быстрым восстановлением сознания. Тиопентал похож на пропофол, но имеет более длительное время восстановления. Этомидат обладает наименьшими гемодинамическими изменениями среди седативных препаратов. Кетамин не рекомендуется в кардиоанестезиологии и в общей хирургии у пациентов с низкой фракцией изгнания левого желудочка (менее 0,35) [9]. Основное показание для введения кетамина – острая выраженная кровопотеря, гиповолемия, тампонада сердца [10].
Опиоиды
Применение высоких доз наркотических аналгетиков не продемонстрировало различий в летальности и выживаемости по сравнению с использованием ингаляционной анестезии, но при высоких дозах опиоидов требуется длительная послеоперационная вентиляция вследствие депрессии дыхания [19].
Интубация
При проведении прямой ларингоскопии и интубации существует высокая опасность изменений гемодинамики в виде рефлекторных тахикардии и гипертензии. Поэтому предпочтительна короткая продолжительность прямой ларингоскопии (<15 с). При трудной интубации или гипертензии – минимизация прессорного ответа (лидокаин – спрей или в/в, эсмолол или фентанил).
Миорелаксанты
Рокуроний, векуроний, пипекуроний, цис-атракурий – средства выбора для гемодинамически нестабильного пациента с ограниченными сердечно-сосудистыми резервами.
Регионарная анестезия
Регионарная анестезия является методом выбора [18] для различных типов некардиальных операций у больных с кардиологическими заболеваниями, особенно при операциях на грудной или брюшной полости (класс рекомендации IIa, уровень A). Однако высокая торакальная анестезия с десимпатизацией сердца не рекомендуется из-за высокого риска системной гипоперфузии и неизбежного применения катехоламинов. Сочетание регионарной и общей анестезии обычно обеспечивает лучший послеоперационный исход лечения, уменьшение общего количества анестетиков, хорошее послеоперационное обезболивание, уменьшение кардиологических осложнений. Уменьшается частота гиперкоагуляционных состояний. При регионарной анестезии предпочтительно поддержание ЧСС не менее 80 мин–1.
Интраоперационное лечение ишемии миокарда должно быть начато при изменении сегмента ST на 1 мм на ЭКГ. Более чувствительными, однако менее доступными мониторными критериями ишемии миокарда являются рост давления заклинивания легочной артерии и снижение смешанной венозной сатурации по данным катетеризации легочной артерии и появление локальных аномалий движения стенки сердца по данным чреспищеводной эхокардиографии. Медикаментозная терапия направлена на коррекцию изменений ЧСС или АД. Увеличение ЧСС можно предотвратить ?-блокаторами (эсмолол). Нитроглицерин – препарат выбора при ишемии на фоне нормального или умеренно повышенного АД. При гипотонии применяются вазопрессоры и инфузионная терапия
Электрические взаимодействия с имплантированными водителями ритма
При выполнении хирургических вмешательств, особенно торакальных и абдоминальных, возможно интенсивное применение электрокоагуляции. Хирургической бригаде следует рекомендовать применять биполярную коагуляцию, поскольку высокочастотные импульсы монополярного коагулятора могут быть расценены кардиостимулятором как исходящие из предсердий, что приведет к неконтролируемой желудочковой тахикардии. В случае, если подобная ситуация возникнет во время операции, следует с помощью постоянного магнита (например, репродуктора) принудительно перевести стимулятор в асинхронный режим. Пациенты, зависимые от имплантированного пейсмекера, должны проверить состояние устройства не более чем за 3–6 месяцев до операции, а также после нее. При планируемом применении монополярной электрокоагуляции перед операцией пейсмекер должен быть перепрограммирован в асинхронный режим. В имплантированном кардиовертере/дефибрилляторе должен быть отключен до операции и включен сразу после нее алгоритм лечения тахиаритмии (для исключения ложного срабатывания). Кроме того, необходимо отключить функцию частотной адаптации, повысить чувствительность, амплитуду (до заводских установок), увеличить длительность импульса (до 1,0 мс). Восстановление режима работы устройства производится перед переводом пациента в отделение реанимации. В случаях экстренной наружной кардиоверсии необходимо расположить электроды как можно дальше от пейсмекера и перпендикулярно оси его электродов, т.е. лучше использовать передне-заднее расположение электродов дефибриллятора [20]. Радиотерапия, чрескожная электрическая стимуляция нервов, спинного мозга, проведение пластических процедур также могут вызвать нарушение работы искусственных водителей ритма. Все эти процедуры должны выполняться с прерывистом режиме, с минимальной мощностью, в биполярном режиме и при постоянном мониторировании ЭКГ. Трансуретральная резекция предстательной железы, гастро- и колоноскопия, бронхоскопия, электромиелография, литотрипсия, ионофорез, фотодинамическая терапия, дентальные процедуры, как правило, не влияют на работу перечисленных устройств. Однако при проведении литотрипсии расстояние от фокуса направленного луча аппарата до корпуса устройства должно быть не менее 15 см.5. Ранний послеоперационный период у пациентов с сопутствующей ИБС
Ранний послеоперационный период, как правило, сопровождается болью, тахикардией, артериальной гипертензией, изменениями внутри- и внесосудистых объемов, гиперкоагуляцией. Бессимптомное течение послеоперационной ишемии миокарда возможно за счёт маскировки хирургической болью или на фоне адекватного использования опиоидов [35].
Послеоперационная ишемия миокарда [18, 19] является частой проблемой. Послеоперационная депрессия сегмента ST длительностью более 2 часов – лучший индикатор ишемии миокарда. Существует зависимость между непрерывными эпизодами изменений сегмента ST в течение 30 минут и послеоперационными кардиологическими осложнениями. Всем пациентам с повышенным риском осложнений рекомендовано проводить мониторирование ЭКГ в течение 72 ч после операции.
Тахикардия увеличивает потребность миокарда в кислороде (увеличивает работу миокарда) и уменьшает доставку кислорода к миокарду (сокращение диастолы). Гиперволемия увеличивает растяжение желудочков (увеличивает потребность в кислороде) и приводит к уменьшению кровотока в растянутом желудочке (увеличено конечно-диастолическое давление левого желудочка). Анемия уменьшает доставку кислорода, а также увеличивает ЧСС и СВ, что повышает потребление кислорода.
Принципы ведения диагностированного интраоперационного инфаркта миокарда
В большинстве случаев инфаркт миокарда в периоперационном периоде развивается в течение нескольких первых суток после операции, характеризуется смазанной клинической картиной и чаще всего представлен инфарктом миокарда без зубца Q, которому обычно предшествует депрессия сегмента ST. Диагностика инфаркта миокарда в периоперационном периоде сопряжена с определёнными трудностями и основана на формализованных диагностических критериях (перечислены в разделе IV пункт 1).
В случае развитии итраоперационного ИМ, осложненного кардиогенным шоком, при невозможности адекватной его коррекции инфузионной терапией и медикаментозными средствами, следует использовать механическую поддержку кровообращения, в частности внутриаортальную баллонную контрпульсацию (ВАБК), как наиболее широко применяемый метод вспомогательного кровообращения. Эффекты ВАБК заключаются в:
- Уменьшении частоты сердечных сокращений;
- Увеличении сердечного выброса;
- Снижении давления заклинивания легочной артерии;
- Снижении общего периферического сосудистого сопротивления;
- Улучшении тканевой перфузию.
При проведении общехирургических операций у пациентов с исходной дисфункцией левого желудочка может быть рекомендовано превентивное использование ВАБК [27, 30, 42]. Также следует решить вопрос о необходимости экстренной коронарографии и реваскуляризации миокарда.
Рекомендации по ведению раннего послеоперационного периода
Большинство неблагоприятных событий происходят в первые 48 часов после операции, но могут быть отдаленные эпизоды в течение первых 30 дней.
Основные подходы к профилактике ишемии миокарда:
- Ингаляция О2;
- Обезболивание;
- Продолжение инвазивного мониторинга;
- Регистрация ЭКГ в течение 72 часов;
- ?-адреноблокаторы уменьшают послеоперационные осложнения и увеличивают выживаемость пациентов (в настоящее время не доказано, однако, снижение частоты послеоперационного ИМ на фоне приема ?-блокаторов);
КЛЮЧЕВЫЕ РЕКОМЕНДАЦИИ
- Наличие ишемической болезни сердца у пациентов, подвергающихся некардиальным хирургическим вмешательствам, увеличивает риск развития периоперационных сердечно-сосудистых осложнений. Основные клинические факторы риска наличия ранее недиагностированной ИБС – мужской пол, пожилой возраст, гипертензия, ожирение, дислипидемия, сахарный диабет.
- Для количественной предоперационной оценки сердечно-сосудистого риска рекомендуется совместное применение различных индексов (Lee, Goldman, Eagle, Detsky и др.). Необходима оценка клинических критериев риска периоперационных кардиальных осложнений, в том числе оценка функциональных резервов пациента в метаболических единицах (МЕТ). Также на исходы влияет объем операции, которые можно оценить по хирургическому риску (низкий, средний и высокий, в т.ч. все сосудистые операции), либо по категории риска
- Выполнение 12-канальной ЭКГ в покое и ЭХО-КГ показано всем пациентам, имеющим факторы риска сердечно-сосудистых заболеваний, при планируемом хирургическом вмешательстве высокого или промежуточного риска, при нестабильном течении сердечно-сосудистого заболевания, а также пациентам, имеющим факторы риска сердечно-сосудистых заболеваний при планируемом хирургическом вмешательстве низкого риска.
- Недавно перенесенный пациентом инфаркт миокарда требует более тщательной оценки состояния и, возможно, отсрочки планового хирургического вмешательства на срок не менее 6 недель.
- При экстренных хирургических вмешательствах, как правило, оценка и коррекция скомпрометированной сердечно-сосудистой функции проводится безотлагательно, в операционной. При плановых операциях решение о дополнительном обследовании, терапии и возможном переносе вмешательства для улучшения состояния пациента принимается согласно описанным алгоритмам пошаговой оценки.
- Наиболее эффективными препаратами, позволяющими улучшить послеоперационные исходы, являются ?-блокаторы и статины. Также периоперационная медикаментозная терапия у пациентов с ИБС может включать центральные ?2-агонисты, блокаторы кальциевых каналов, ингибиторы АПФ, антиагреганты, антикоагулянты.
- Периоперационное применение ?-блокаторов снижает летальность у пациентов с высоким кардиальным риском.
- Применение антиагрегантов и непрямых антикоагулянтов должно быть прекращено заблаговременно перед плановой операцией с одновременным переходом на терапию прямыми антикоагулянтами по схеме.
- Основными задачами интраоперационного периода у пациентов с ИБС является поддержание в миокарде баланса между доставкой и потреблением кислорода за счет предупреждения тахикардии, поддержания оптимального АД (в пределах ±20% от исходного), гемоглобина (выше 90 г/л), гематокрита (? 0,32), SvO2 >65–70%, нормотермии. Интраоперационный контроль ЭКГ обязателен, желателен мониторинг сегмента ST в двух отведениях. Наличие искусственного водителя ритма сердца требует заблаговременного планирования тактики действий при необходимости применения хирургической электрокоагуляции или электроимпульсной терапии.
- Интубация трахеи для минимизации прессорного ответа должна производиться быстро, возможно, на фоне местной анестезии, системного введения опиоидов, при необходимости ?-блокаторов короткого действия (эсмолол). Применение современных ингаляционных анестетиков при ишемии позволяет уменьшить размер гипоксического повреждения. Широко применяется изофлюран, более предпочтительным является севофлюран, который в меньшей степени обладает отрицательным инотропным эффектом. Ксенон не вызывает депрессию гемодинамики. Севофлюран и ксенон обладают кардиопротекторным эффектом. Сочетание регионарной и общей анестезии при длительных и травматичных вмешательствах обеспечивает при ишемической болезни сердца лучшие исходы лечения и уменьшение частоты кардиальных осложнений.
СПИСОК ЛИТЕРАТУРЫ
- Аронов Д.М., Лупанов В.П. Функциональные пробы в кардиологии. - Москва: МЕДпресс-информ, 2002. – 296 с.
- Бураковский В.И. и др. Сердечно-сосудистая хирургия: руководство / В.И. Бураковский, Л.А. Бокерия и др. – М.: Медицина, 2000. –752 с.
- Буров Н.Е. Представления о механизме анестезиологических и лечебных свойств ксенона. Анестезиология и реаниматология, 2011. - №2, с. 58 – 68
- Кровообращение и анестезия / Под ред. К.М. Лебединского. – СПб.: Человек, 2012. – 1076 с.
- Морган–мл. Дж.Э., Михаил М.С. Клиническая анестезиология: кн. 1–я. Пер. с англ. – М.; СПб.: Из–во БИНОМ, 2004. – 431 с.
- Мороз В.В., Добрушина О.Р., Стрельникова Е.П., Корниенко А.Н., Зинина Е.П. Предикторы кардиальных осложнений операций на органах брюшной полости и малого таза у больных пожилого и старческого возраста Общая реаниматология. — 2011. — Т. 7. — N. 5. — C. 26–31.
- Национальные рекомендации комитета экспертов Всероссийского научного общества кардиологов «Прогнозирование и профилактика кардиальных осложнений внесердечных хирургических вмешательств». – М., 2011 . – 28 с.
- Периоперационное ведение больных с сопутствующими заболеваниями / Под ред. И.Б. Заболотских – М.: Практическая медицина, 2011. – 240 с.
- Практическое руководство по анестезиологии (2-ое издание) / Под ред. Лихванцева В.В. – М., МИА, 2011. – 567 с.
- Хенсли Ф.А. Практическая кардиоанестезиология: [Пер. с англ.] / Хенсли Ф.А.-мл., Мартин Д.Э., Грэвли Г.П. – 3-е изд. – М.: ООО «Медицинское информационное агентство», 2008. – 1104 с.
- Akhtar S. Ischemic heart disease. Stoelting's Anesthesia and Co-Existing Disease / Eds.: Hines R.L., Marschall K.E. – Saunders, 2008. – 688 p.
- Berger P.B., Bell M.R., Hasdai D., Grill D.E., Melby S., Holmes D.R. Jr. Safety and efficacy of ticlopidine for only 2 weeks after successful intracoronary stent placement. Circulation. 1999; 99: 248–253.
- Davies S.J., Wilson R.J.T. Rationalizing the use of surgical critical care: the role of cardiopulmonary exercise testing. Ed.: J.-L. Vincent. Yearbook of intensive care and emergency medicine. – Springer, 2009. – PP. 445-460.
- De Caterina R, Husted S, Wallentin L, et al. Anticoagulants in heart disease: current status and perspectives. Eur Heart J 2007;28:880–913.
- De Hert S.G. Perioperative cardiovascular assessment in noncardiac surgery: an update. Eur J Anaesth. – 2009. – V. 26. – N. 6. – pp. 449-457.
- Del Guercio L.R., Cohn J.D. Monitoring operative risk in the elderly. JAMA. – 1980. – V. 243. – PP. 1350-1355.
- Dunkelgrun M, Boersma E, Schouten O et al. Bisoprolol and fluvastin for the reduction of perioperative cardiac mortality and myocardial infarction in intermediate-risk patients undergoing non-cardiovascular surgery; a randomized controlled trial (DECREASE-IV). Ann Surg 2009;249:921–926
- Fleisher L.A., Barash P. G. Cardiac Anesthesia, 2001.
- Fleisher L.A., Beckman J.A., Brown K.A., et al. ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for non cardiac surgery: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery). Circulation. 2007;116:1971–1996
- Fleisher L.A., Nelson A.H., Rosenbaum S.H. Postoperative myocardial ischemia: etiology of cardiac morbidity or manifestation of underlying disease? J Clin Anesth. 1995 Mar;7(2):97-102.
- Fowkes FG, Dunbar JT, Lee AJ. Risk factor profile of nonsmokers with peripheral arterial disease. Angiology. 1995 Aug;46(8):657-62.
- Fowkes FG, Lee AJ, Lowe GD, Riemersma RA, Housley E. Inter-relationships of plasma fibrinogen, low-density lipoprotein cholesterol, cigarette smoking and the prevalence of cardiovascular disease. J Cardiovasc Risk. 1996 Jun;3(3):307-11.
- Garraway W.M., Whisnant J.P. The changing pattern of hypertension and the declining incidence of stroke. JAMA. 1987 Jul 10;258(2):214-7.Links
- Green D.W. Advanced minimally invasive hemodynamic monitoring of the high-risk major surgery patients. Ed.: J.-L. Vincent. Yearbook of intensive care and emergency medicine. – Springer, 2009. – PP. 461-472.
- Hillel Z., Landesberg G. Electrocardiography. In: Miller’s Anesthesia. Ed.: Мiller R.D., 2009 – p.1357-1386
- Hindler K, Shaw AD, Samuels J, Fulton S, Collard CD, Riedel B. Improved postoperative outcomes associated with preoperative statin therapy. Anesthesiology 2006;105:1260–1272; quiz 1289–1290.
- Jafary F.H. Preoperative use of intra-aortic balloon counterpulsation in very high-risk patients prior to urgent noncardiac surgery Acta Cardiol. – 2005. – Vol. 60. – № 5. – P. 557-560.
- Kasper W, Konstantinides S, Geibel A, et al. Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry. / Am Coll Cardiol. 1997;30:1165-71.
- Lee TH, Marcantonio ER, Mangione CM, et al. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation. 1999;100:1043-9.
- Macas A., Bukauskas T., Suskeviciene I. et al. Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock Medicina (Kaunas).– 2011. – Vol. 47. – № 4. – P. 212-218.
- Mangano D.T. et al. Effect of atenolol on mortality and cardiovascular morbidity after noncardiac surgery. N. Engl. J. Med. – 1996. – Vol. 23., N 335. – PP. 1713-1720
- Mangano D.T. Perioperative cardiac morbidity. Anaesthesiology. – 1990. – V. 72. – pp. 153-184.
- Mauney FM Jr, Ebert PA, Sabiston DC Jr. Postoperative myocardial infarction: a study of predisposing factors, diagnosis and mortality in a high risk group of surgical patients. Ann Surg. 1970 Sep;172(3):497-503.
- Naughton C, Feneck RO. The impact of age on 6-month survival in patients with cardiovascular risk factors undergoing elective non-cardiac surgery. Int J Clin Pract 2007;61:768–776.
- Nussmtier N.A., Hauser M.C., Munnammad F.S. et al. Anesthesia for Cardiac Surgical Procedures In: Мiller’s Anaesthesia. Ed. Miller R.D., 2009. – p.1889-1976.
- Pagel P.S. Cardioprotection by noble gases. J Cardiothorac Vasc Anesth. 2010 Feb;24(1):143-63.
- Pagel P.S., Farber N.E., Wedel D.J. Cardiovascular Pharmacology In: Мiller’s Anaesthesia. Ed. Miller R.D., 2005
- Poldermans D. et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery. European Heart Journal (2009) 30, 2769–2812
- Poldermans D. et al. The effect of bisoprolol on perioperative mortality and myocardial infarction in high-risk patients undergoing vascular surgery. N. Engl. J. Med. – 1999. – Vol. 24., N 341. – PP. 1789-1794.
- Rao TL, Jacobs KH, El-Etr AA Reinfarction following anesthesia in patients with myocardial infarction Anesthesiology. 1983 Dec;59(6):499-505.
- Roizen M.F., Fleisher L.A. Anesthetic Implications of Concurrent Diseases In: Мiller’s Anaesthesia. Ed. Miller R.D., 2009. – p.1067-1150.
- Schmidt R., Kasper M., Gerula C. et al. Intra-aortic balloon pump prior to noncardiac surgery: a forgotten remedy? J. Invasive. Cardiol. – 2011. – Vol. 23. – № 2. – P. E26-30.
- Thygesen K., Alpert J.S., Jaffe A.S. et al. Third universal definition of myocardial infarction J. Am. Coll. Cardiol. – 2012. – Vol. 60. – № 16. – P. 1581-1598.
- Wetterslev J., Juul A.B. Benefits and harms of perioperative beta-blockade. Best practice & research clinical anesthesiology. – 2006. – Vol. 20, No 2. – PP. 285-302.
- Wilson SH, Rihal CS, Bell MR, Velianou JL, Holmes DR, Jr., Berger PB. Timing of coronary stent thrombosis in patients treated with ticlopidine and aspirin Am J Cardiol. 1999;83: 1006-11.
- Winkel TA, Schouten O, Vofite MT, et al. The effect of statins on perioperative events in patients undergoing vascular surgery Acta Chir Belg. 2010;110(1):28-31
|
|||