двухмесячный научно-образовательный журнал
"Тольяттинский медицинский консилиум" 2011г. № 3-4Аппаратная реинфузия крови в лечении острой кровопотериВ.Я. Вартанов1, И.В. Вартанова2, Н.Н. Хуторская1, Л.А Вольгов3, Дословные перевод понятия «реинфузия крови» означает обратное переливание крови (reinfusio sanguinis; ре- + инфузия ). Практически всё началось с британского акушера и хирурга Джеймса Бланделла (James Blundell, 1790–1878), вошедшего в историю медицины как врач, впервые выполнивший успешную трансфузию крови по схеме «от человека к человеку» [1,2]. Тягостные впечатления о погибшей от профузного маточного кровотечения пациентки он изложил так: «Рассуждая позже на эту мрачную тему, я отметил обстоятельства, которые придавали ей особый интерес. Я не мог противостоять нахлынувшим размышлениям о том, что эта больная, вероятно, могла быть спасена переливанием крови; и, несмотря на то, что здесь была небольшая благоприятная возможность для операции в обычном режиме, сосуды могли быть пополнены кровью посредством шприца с легкостью и быстротой» [3] . William Highmore (1874), предположительно был первым специалистом, использовавшим аутогемотрансфузию. Он предложил собирать и дефибринировать кровь, излившуюся после родов, согревать её до температуры тела и переливать родильнице при помощи шприца Хиггинсона. Успех превзошёл все ожидания. Литературный поиск показал, что шприц, или правильнее, насос Хиггинсона представляет собой один из варинтов клизмы, успешно применяющейся и в наши дни. В 1914-15 г.г. три исследователя из разных стран (A. Hustin, Belgium; R. Lewisohn, USA; L. Agote, Argentina), работающих независимо друг от друга [4], пришли к выводу, что цитрат натрия может быть использован при гемотрансфузиях в качестве антикоагулянта. Современный этап реинфузии крови связан с именем американского военного хирурга Gerald Klebanoff [5], который в 1968 г. использовал кардиотомный резервуар и роликовый насос DeBakey* для сбора, антикоагуляции, фильтрации и интраоператорной реинфузии. Упрощённая обработка крови (только фильтрация) сопровождалась лизисом эритроцитов, повышением уровня свободного Hb, расстройством гемокоагуляции, почечной недостаточностью, воздушной эмболией. Первые коммерческие образцы аппаратов под названием Cell Saver (этот термин с тех пор cтал расхожим), основанных на этом принципе, выпустила американская фирма Haemonetics в 1974 году. Аппараты этого типа ознаменовали качественно новый этап в развитии реинфузии, так как позволяли не только собирать кровь из операционной раны, стабилизировать и фильтровать, но и отмывать физиологическим раствором. * Майкл Эллис Дебейки (Michael Ellis DeBakey)-выдающийся американский кардиохирург. В возрасте 23 лет он изобрёл роликовый насос — основную часть большого количества медицинских приборов. Роликовый насос приводится в движение двигателем, скорость которого не зависит от нагрузки. После установки скорости потока насос будет нагнетать установленный поток даже при увеличении сопротивления из-за перегиба или пережатия магистрали. http://eternaltown.com.ua/content/view/9072/2/ Принципиальное отличие и преимущество данной методики состоит в возможности очистки крови от антикоагулянтов, свободного гемоглобина, лизированных эритроцитов, активированных факторов свёртывания, внеклеточного калия, частиц жира и детрита, миоглобина. Как и каждая бочка мёда эта методика имеет свою «ложку дёгтя», так в результате отмывки удаляется и плазмы крови. Pеинфузия кpови - пpостой и безопасный способ компенсации кpовопотеpи, имеющий, однако, существенные огpаничения. Согласно приказу Минздрава РФ от 25 ноября 2002 г. № 363, «реинфузия крови, теряемой во время операции, предполагает аспирацию такой крови из операционной раны или полостей тела стерильным отсосом в стерильную емкость с последующим отмыванием, а затем возврат реципиенту во время операции или в срок, не превышающий 6 часов после начала сбора. Применение интраоперационной реинфузии крови показано согласно приказу только при тех обстоятельствах, когда предполагаемая кровопотеря превышает 20% объема циркулирующей крови, что наблюдается в сердечнососудистой хирургии, при внематочной беременности, в ортопедической хирургии, в травматологии. Противопоказана интраоперационная реинфузия крови при ее бактериальном загрязнении, попадании амниотической жидкости, при отсутствии возможности отмывания излившейся во время операции крови. Излившаяся в полости тела кровь отличается по своему составу от циркулирующей крови. В ней снижено содержание тромбоцитов, фибриногена, Хотя вышецитируемый приказ ещё никто не отменял, современные показания для проведения аппаратной реинфузии расширены. Согласно последним литературным данным показаниями для проведения реинфузии крови являются[6]:
Относительные противопоказания к реинфузии крови:
Преимущества реинфузии крови очевидны [7]:
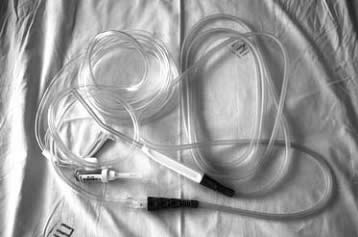
В своей практике для аппаратной реинфузии крови мы использовали C.A.T.S.® (Continuous AutoTransfusion System)* фирмы Fresenius (см. рис.1). * Continuous AutoTransfusion System – система продлённой (непрерывной) аутотрансфузии
Сбор крови из операционной раны производят с помощью специального двухканального шланга (см. рис.2), в один канал которого поступает физиологический раствор с добавлением антикоагулянта (раствор «глюгицира» из расчета 100 мл на 500 мл крови, 4 % раствор лимоннокислого натрия из расчета 10 мл на 100 мл крови) [8], а через второй - стабилизированная кровь. Последняя засасывается с помощью вакуум-аспиратора в кардиотомный резервуар (см. рис. 3), где с помощью фильтра ATR 120 с порами в 120 микрон отфильтровываются мелкие кусочки тканей, сгустки крови и другие макроструктуры (первичная очистка стабилизированной крови). Смешивание крови со стабилизатором происходит в наконечнике шланга и резервуаре.
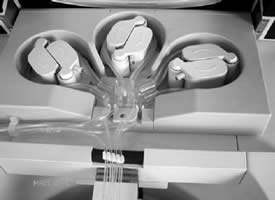
Принципиальное отличие C.A.T.S.® - наличие сепарационной камеры, выполненной в виде спирального канала, которая работает в непрерывном режиме и позволяет одновременно сепарировать и отмывать красные кровяные клетки. В C.A.T.S.® используются 3 роликовых насоса (см. рис.4), позволяющие производить одновременную, а, следовательно, непрерывную обработку крови. Один насос нагнетает в сепарационную камеру собранную кровь, другой моющий раствор, третий перекачивает полученную эритромассу в пакет для реинфузии. Эритроциты связываются в центрифуге (см. рис. 5) центробежными силами, в то время, как плазма выносится из колокола, вымывая свободный гемоглобин, антикоагулянт, активированный фактор свертывания (АСТ), активизированные тромбоциты. Как только гематокрит крови, содержащийся в сепарационной камере, достигает 80%, туда начинает поступать физиологический раствор, промывая эритроциты. Эффективность промывки составляет более 95%, количество эритроцитов более 98% от собранных. По окончании цикла промывки концентрированная суспензия эритроцитов в физиологическом растворе поступает в мешок для реинфузии (на рис.1 указан стрелкой).
Обычно используют следующие режимы работы [10]:
В результате интраоперационной обработки раневой крови получается ЭМ из отмытых эритроцитов. Недостатки такой ЭМ: нестабильность и, соответственно, резкое укорочение срока хранения, а также хрупкость эритроцитов и примесь частично разрушенных клеток. Специфические особенности эритроцитной массы, приготовленной аппаратами типа Cell Saver - возможное присутствие загрязняющих частиц и жидкостей из операционной раны. Типичные осложнения: 1. Коагулопатии. Возможны серьезные посттрансфузионные нарушения гемостаза, что объясняются присутствием конгломератов из лейкоцитов и тромбоцитов при неправильно выбранном режиме обработки крови. Удлинение АЧТВ или тромбинового времени должно насторожить врача и может быть сигналом для использования антагонистов. 2. Гемолиз. Механическая обработка крови, пропускание ее через роликовый насос и длинные магистрали всегда чреваты развитием гемолиза, а, следовательно, острой почечной недостаточностью. Профилактика гемолиза состоит в тщательном отмывании крови. Следует обратить особое внимание на ограничение степени разрежения в вакуум - аспираторе. При клинически значимом гемолизе используют осмодиуретики, ощелачивают плазму. К недостаткам аппаратной реинфузии крови следует отнести то обстоятельство, что вместе с промывными водами безвозвратно утрачивается плазма. Именно по этому восстановление коллоидно-онкотического давления и коагуляционного потенциала крови с помощью классического Cell Saver'a невозможно. По решению 25 съезда Международного трансфузиологического общества* интраоперационная реинфузия крови абсолютно противопоказана при ее загрязнении:
* 25th Congress of the International Society of Blood Transfusion: Plenary and State-of-the-art Lectures by T. Kristensen(Editor) Special Order. Karger Paperback Ограничена реинфузия у больных с различными заболеваниями крови. Имеет значение и сам объем pеинфузиpованной кpови. Так, pеинфузия 500 мл кpови, собpанной из бpюшной полости, не вызывает выpаженных изменений гемокоагуляции, однако после массивных pеинфузий (более 2000 мл) возможно pазвитие ДВС-синдpома. Широкому распространению аппаратной реинфузии крови мешает как высокая стоимость самой аппаратуры, так и расходных материалов к ней. Для иллюстрации вышесказанного мы решили привести в таблице № 1 стоимость одной процедуры аппаратной реинфузии крови. Таблица 1.
* 25th Congress of the International Society of Blood Transfusion: Plenary and State-of-the-art Lectures by Кроме высокой стоимости, подчеркнём наиболее распространённые недостатки аутоэрмассы
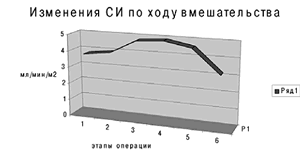
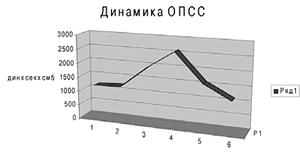
Кроме того, при аппаратной реинфузии невозможно сохранить плазму крови и тромбоциты, что приводит к потере факторов свёртываемости и нарушениям гемостаза. Это приводит к наиболее распространённым осложнениям процедуры, таким как тромбоцитопении, коагуляционные расстройства. К слову сказать, вместе с плазмой теряются и иммуноглобулины - Ig G, Ig A и Ig M, альбумин и другие белки крови [12]. Дискутабельным остаётся вопрос применения аппаратной реинфузии в онкохирургии. Некоторые исследователи считают, что из-за потенциальной опасности контаминации злокачественными клетками и метастазирования, кровь у данной категории больных не должна реинфузироваться [13]. Однако, по данным других авторов, опасность гематогенного метастазирования может быть устранена путём применения при аутогемотрансфузии лейкоцитарных фильтров, что повышает безопасность методики у онкологических больных [14]. И всё же, преимущества аппаратной реинфузии крови при методически правильном использовании перевешивают её недостатки. Для иллюстрации вышесказанного приводим наше клиническое наблюдение. Пациентка М., 32 лет, поступила в ОПБ 18.03.2011 г. Клинический диагноз: V беременность 39 недель. Поперечное положение плода. Множественная миома матки. Ожирение IV ст. Под общим обезболиванием по ЭТМ на фоне ИВЛ аппаратом Draeger Fabius GS (ДО 650 мл, МОД 9,1 л, FiO2 40%) и миоплегии ардуаном (6 мг) с применением препаратов для НЛА и ГОМК-а (6 г) произведены: лапаротомия, кесарево сечение. Тело матки деформировано миоматозным узлом больших размеров 12 см * 15 см, расположенным по передней стенке ниже разреза на матке с переходом на правую боковую стенку. Второй большой узел 8 см * 9 см расположен по левому ребру матки. Учитывая наличие множественной миомы матки больших размеров, внутримышечное расположение узлов, отсутствие технической возможности ушивания разреза на матке, произведена простая надвлагалищная ампутация матки без придатков. Объём кровопотери во время операции составил 2000 мл. Интраоператорно мониторировались (Nihon Kohden) следующие параметры: АД, ЧСС, МОС, СИ, ОПСС (см. рис.6), температура тела SaO2, EtCО2. Технически операция без особенностей, брюшная полость послойно ушита наглухо. Течение операции и анестезии без особенностей. Длительность операции - 1 час 30 мин.
Инфузия по ходу вмешательства: По ходу вмешательства проводилась коррекция гемокоагуляции (транесксам 500 мг). Биологический гемостаз адекватен (ВСК в пределах 4 мин 15 с - 4 мин 30 с, 5 мин 10 с - 5 мин 25 с). Показатели коагулограммы у нашей пациентки на момент перевода в отделение интенсивной терапии были следующими:
С целью профилактики тромбоэмболических осложнений через 8 часов после операции назначено 0,3 мл фраксипарина х 2раза/сутки (введение препарата продолжено еще в течение 5 суток). Антибактериальная терапия: цефтриаксон 2г/сутки (в течение 7 суток). Обезболивание в I-е сутки представлено трамадолом (50 мг х 3 раза/сутки) и промедолом (20 мг в/м х 3 раза /сутки), на II- III-е сутки трамадол (50 мг х 4 раза/сутки). На II-е сутки переведена в послеродовое отделение, на V-е сутки выписана домой. Литература
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||