двухмесячный научно-образовательный журнал
"Тольяттинский медицинский консилиум" 2011г. № 3-4Сердечно-легочная реанимация у детей: чем руководствоваться?Г.В. Карпов1, Т.А. Ермолаева1, И.С. Резник1, В.Н. Губа1, Т.А. Маликова1, Руководство по сердечно-легочной реанимации (СЛР) Европейского совета по реанимации (ERC) основывается на «Согласительном мнении по доказательной медицине в СЛР и лечебным рекомендациям» (CoSTR), выработанном «Международным комитетом по реанимации» (ILCOR). ILCOR был основан в 1992 году как международный комитет по сотрудничеству между Американской кардиологической ассоциацией, ERC, Фондом сердечно-сосудистых заболеваний Канады, Советом по реанимации Южной Африки, Австралийским и Новозеландским советом и Латиноамериканским советом по СЛР. Полный текст ERS руководства по СЛР за 2005 год, а также ILCOR СoSTR-документ свободно доступны на сайте ERC – www.erc.edu Доказательная база, лежащая в основе данных рекомендаций базируется на 2 исследованиях – ретроспективном и проспективном, которые показали повышение выживаемости при внегоспитальной остановке кровообращения, если перед дефибрилляцией выполнялись меры СЛР. Проспективное исследование продемонстрировало, что если от остановки кровообращения до оказания помощи прошло 5 минут и более, выживаемость при выписке из стационара выше у тех пациентов, которым перед дефибрилляцией выполнялась СЛР. Третье исследование не подтвердило положительное влияние на выживаемость тактики «первоначальной СЛР», но данные всех трех исследований свидетельствуют о преимуществах данного подхода. По многим вопросам доказательные данные не были получены или были очень скудными, поэтому руководство основывалось на согласованном мнении экспертов [2]. Реанимация у детей отличается от реанимации у взрослых. Причины этих отличий связаны прежде всего не с анатомическими или физиологическими различиями между взрослыми и детьми, которые хорошо известны анестезиологам-реаниматологам, а патофизиологией состояний, ведущих к остановке кровообращения. Остановка сердца у детей редко обусловленa первичными кардинальными причинами. Значительно чаще она возникает в результате гипоксемии и шока. К моменту развития циркуляторного шока во внутренних органах ребенка уже развились необратимые изменения, вызванные состояниями, предшествующими остановке кровообращения. В связи с этим выживаемость в целом невысока. Процент выживаемости с благоприятным неврологическим исходом при внебольничной остановке кровообращения у детей варьирует в пределах 0-12%, однако в условиях стационара наблюдается более высокая выживаемость (до 25%). Исключенями из этого утверждения являются случаи синдрома внезапной смерти (СВС) детей грудного возраста, обширные травмы или несомненная первичная остановка сердечной деятельности [1]. Реанимацию детей особенно раннего возраста часто не начинают из страха навредить, потому что врачи не помнят или не знают особенностей детского организма [3]. Различие техники реанимации у детей и взрослых часто мешают не только окружающим, но и медицинским работникам приступить к оказанию первой помощи – искусственному дыханию, непрямому массажу сердца. Новые рекомендации предлагают более простой унифицированный подход к реанимации детей и взрослых. Доказано, что исход будет лучше, если предпринято хотя бы искусственное дыхание, либо только непрямой массаж сердца, чем совсем ничего. Причины клинической смерти у детей Существует множество достаточно частых причин клинической смерти (КС) у детей, но большинство из них укладывается в следующую классификацию: болезни органов дыхания (пневмония, утопление, вдыхание дыма, аспирация и обструкция дыхательных путей, апноэ, удушение, бронхиолит, эпиглоттит); сердечно-сосудистые заболевания (врожденный порок сердца, застойная сердечная недостаточность, перикардит, миокардит, аритмии, септический шок); болезни ЦНС (судорожные приступы и их осложнения, гидроцефалия и дисфункция шунта, опухоли, менингит, внутричерепные кровоизлияния) и другие (травма, синдром внезапной смерти, анафилаксия, желудочно-кишечные кровотечения, отравления). Согласно опубликованным исследованиям, поражения дыхательной системы вместе с СВС постоянно служат причиной от одной до двух третей всех случаев КС у детей [9]. Клиническая смерть (КС) – состояние организма после остановки кровообращения в течение периода времени, после которого возможно восстановление самостоятельной сердечной деятельности. Диагностика КС ставится на основании наличия следующих признаков:
Диагностика клинической смерти не должна занимать более 10-15 секунд. Констатация факта апноэ (в сочетании с отсутствием сознания) делает необязательным оценку состояния пульса и требует немедленных реанимационных мероприятий [6]. Сердечно-легочная реанимация подразумевает комплекс действий, направленных на поддержание воздухообмена и кровообращения в организме путем обеспечения свободной проходимости дыхательных путей, проведения искусственной вентиляции легких и компрессий грудной клетки при КС. В настоящее время в большинстве стран термин «реанимация» заменен на «поддержание жизнедеятельности» (life support), условно разделяющий мероприятия на базовые (basic life support) и расширенные (advanced life support). При этом проведение базовых мероприятий должно быть начато немедленно после распознавания состояния КС и не предусматривает использование каких-либо специальных аппаратов и приспособлений, в то время как расширенные мероприятия обязательно проводятся с помощью специальной техники [4]. Комплект оборудования, материалов и медикаментов для оказания реанимационной помощи должен быть круглосуточно доступен в любом подразделении стационара, а не только в отделении интенсивной терапии. Персонал любого медицинского подразделения должен владеть навыками оказания реанимационного пособия, так как любая задержка в оказании помощи серьезно ухудшает прогноз. Соотношение частоты компрессий и вдувание в легкие При осуществлении реанимационных мероприятий Рекомендации предусматривают максимальную непрерывность компрессий грудной клетки. Поэтому непрофессиональным спасателям или оказывающим помощь в одиночку рекомендуется осуществлять реанимацию следующим образом: 30 компрессий на два вдувания (как и для взрослых). Однако, если помощь оказывают двое или профессионал, то следует осуществлять 15 компрессий на 2 вдувания (продолжительность вдоха 1 секунда). Хотя доказательств целесообразности использования определенной частоты в детской реанимации нет, прежде рекомендованное соотношение 5:1 более не считается приемлемым, т.к. не обеспечивает достаточной частоты компрессий [3]. Возрастные особенности С отменой различий соотношения частоты компрессий и вдуваний при оказании помощи детям и взрослым отпала необходимость делить пациентов на возрастные группы. Реанимационные мероприятия эффективны для детей так же, как и для взрослых. Разница заключается лишь в этиологическом факторе. Если все же необходимо определить, к какой возрастной группе относится пострадавший, то следует проводить границу по началу подросткового периода. Однако определение возраста в подобных условиях представляется излишним и нецелесообразным. В этом случае следует оказать помощь пострадавшему по педиатрическим рекомендациям. Ошибка в выборе техники оказания помощи в зависимости от возраста в данном случае не будет иметь пагубных последствий, так как основные реакции развиваются одинаково как у детей, так и подростков [3]. Техника компрессии грудной клетки Место, где следует осуществлять надавливания, определяется по мечевидному отростку (как и у взрослых), а не по линии, соединяющие соски, как раньше. У более старших детей эта точка просто находится посредине передней поверхности грудной клетки (как и у взрослых). Поэтому сложности, связанные с поиском места, где должна осуществляться компрессия, были устранены. Техника компрессии также была упрощена. Рекомендуется сжимать грудную клетку на половину или треть обычного объема. Компрессию можно осуществлять одним пальцем, одной рукой или двумя руками, чтобы обеспечить ее нужную степень. У маленьких детей, если помощь оказывают двое, рекомендуется использовать технику компрессии с окружностью, образованной двумя большими пальцами [8]. Механизм, который при наружном массаже сердца заставляет кровь двигаться, активно обсуждается. Были предложены две наиболее популярные теории: либо это эффект непосредственного сдавления сердца, либо выталкивание крови из легких и левых камер сердца вследствие повышения внутригрудного давления (торакальный насос). Базовое оказание реанимационной помощи (Basic Life Support – BLS)
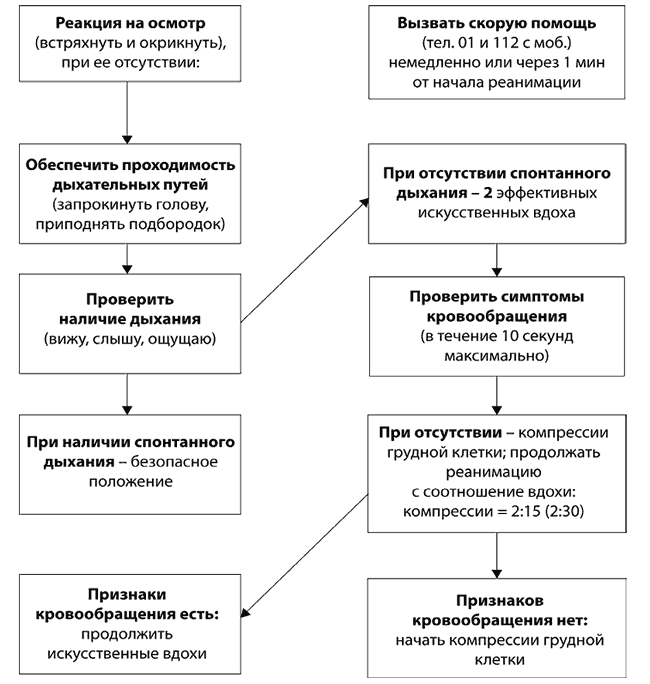
Принципиально важно обращать внимание на полное расправление грудной клетки при выполнении компрессий. Недостаточное расправление грудной клетки приводит к недостаточному диастолическому наполнению и, соответственно, недостаточному ударному объему. Алгоритм базовых мероприятий по поддержанию жизнедеятельности у детей приведен на рисунке 1.
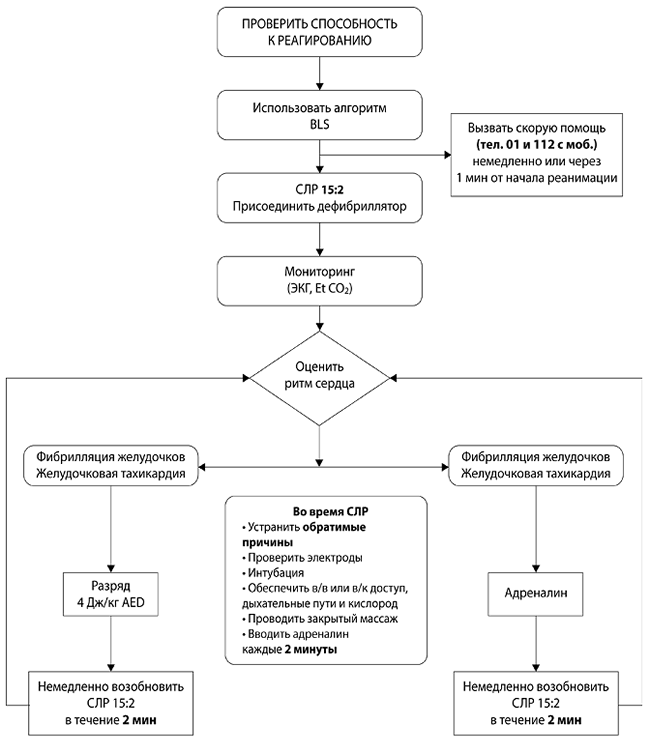
Расширенные мероприятия по поддержанию жизнедеятельности у детей (Advanced Life Support) Расширенные мероприятия предполагают использование различных видов инструментальных манипуляций и лекарственных средств в процессе проведения реанимации у пациентов, находящихся в терминальном состоянии или в состоянии клинической смерти (см. рис.2) [13].
В системе PALS (Pediatric Advance Life Support) представлены 6 состояний, начинающихся на букву «Н», и 4 – на букву «Т» [4]. Список устраняемых причин для мнемонического запоминания
Гиповолемия Гиповолемия является обратимой причиной остановки сердца. Она вполне может быть предотвращена при своевременной диагностике. На ранних стадиях введение коллоидных растворов не дают преимуществ, рекомендуются изотонические солевые растворы. Растворы декстроз не рекомендуются, так как могут вызвать гипонатриемию и гипергликемию, что ухудшает неврологический исход остановки сердца. Способы для поддержания проходимости дыхательных путей Первая попытка обеспечить проходимость дыхательных путей заключается в том, чтобы восстановить их правильное положение. Нередко одно это мероприятие дает эффект. Поскольку большинство случаев обструкции дыхательных путей обусловлено действием силы тяжести на массив мягких тканей нижней челюсти, она может быть устранена разгибанием головы и поднятием подбородка или с помощью приема выдвижения нижней челюсти. Рвотные массы или другие инородные тела также могут перекрывать дыхательные пути. Исследуйте их просвет на предмет наличия этого препятствия и пользуйтесь аспиратором как можно раньше и чаще. В некоторых случаях у больных с измененным уровнем сознания можно применять назо- или орофарингеальные воздуховоды. Дети с нарушениями сознания обычно лучше переносят более мягкие назофарингеаьные воздуховоды, чем жесткие и менее удобные орофарингеальные. Применение подобных устройств нередко приносит пользу детям в состоянии после судорожного приступа, у которых постоянно отмечаются спонтанные попытки вдоха, но имеется обструкция верхних дыхательных путей из-за низкого мышечного тонуса. В настоящее время у детей трахеостомия как рутинный способ обеспечения доступа к просвету дыхательных путей в экстренной ситуации не используется. Способы доставки ребенку дополнительного количества кислорода Дополнительный кислород ребенку можно доставить различными способами. Наиболее тяжелых больных следует обеспечить кислородом в наибольшей концентрации и максимально прямым методом из возможных. Детям, у которых сохранено спонтанное дыхание, требуются менее инвазивные методы обеспечения дополнительной оксигенации. Ниже приведено несколько различных способов доставки кислорода и соответствующие им потенциальные возможности содержания кислорода во вдыхаемом воздухе [10].
Детям, у которых спонтанные дыхательные усилия неадекватны, необходима аппаратная респираторная поддержка. Различные масочные способы вентиляции дыхательным мешком с клапаном характеризуются неодинаковыми возможностями доставки кислорода. Самораздувающиеся устройства типа «мешок-клапан» способны обеспечить 60-90% концентрацию кислорода во вдыхаемом воздухе, в то время как нераздувающиеся (наркозная дыхательная аппаратура) дают пациенту 100% кислород. Эндотрахеальная интубация представляет собой наиболее безопасный и непосредственный способ доставки пациенту 100% кислорода [9]. Показания для интубации трахеи Помимо наиболее очевидного показания для интубации трахеи – продолжающегося апноэ, существует ряд других, в том числе следующие:
Во многих случаях вентиляция больного с помощью мешка через маску и через эндотрахеальную Выбор размера эндотрахеальной трубки Для интубации готовят три трубки: расчетного диаметра, на размер больше, на размер меньше. Существует много способов, гарантирующих правильный выбор размера эндотрахеальной трубки (ЭТТ). Наиболее часто приводят формулы, в которых за основу взят возраст ребенка: меньше 6 лет – возраст в годах / 3 + 3,75;
Исследования показали, что при выборе интубационной трубки можно ориентироваться на ширину ногтевой пластинки V пальца руки (мизинца) ребенка, которая примерно соответствует наружному диаметру правильно выбранной ЭТТ. Используйте трубки без манжеты у всех детей до 10 лет; у этих пациентов анатомическое сужение на уровне перстневидного хряща является естественной «манжетой». Надлежащую глубину введения ЭТТ, если принять за точку отсчета передние резцы пациента, можно примерно рассчитать, умножая величину внутреннего диаметра трубки на 3. Удостовериться в правильности положения ЭТТ помогут измерение концентрации СО2 в выдыхаемом воздухе, наблюдение за симметричностью раздувания грудной клетки, аускультация дыхательных шумов с обеих сторон. Лучший способ достоверно определить положение трубки, вероятно, рентгенологический, с помощью рентгенограммы грудной клетки: проксимальный конец ЭТТ должен проецироваться на область II-III грудных позвонков. При назотрахеальной интубации глубина стояния трубки больше на 3 см. Сосудистый доступ В первую очередь испробовать тот метод, который Вам лично удается с наибольшим успехом. Один катетер малого диаметра лучше, чем ничего! На эти «золотые правила» должно быть затрачено не более 90 секунд. Помните: во время реанимационных мероприятий процедуры должны выполнять те, кто владеет ими лучше, и эти люди должны делать то, что они умеют лучше всего. Хорошо при реанимации иметь в распоряжении сосудистый доступ большого диаметра, хотя тонкого катетера вполне достаточно для введения лекарственных средств и медленной инфузии жидкостей. В настоящее время общепринятым является отказ от внутрисердечных введений лекарственных препаратов при проведении сердечно-легочной реанимации, так как велика вероятность тяжелых осложнений (гемоперикард, пневмоторакс и т.д.) Медикаментозное обеспечение Помните: при оказании помощи каждому ребенку, находящемуся в тяжелом состоянии, приоритет надо всегда отдавать оксигенации и вентиляции. Лекарственная терапия предназначена для тех, у кого базовые мероприятия не обеспечили достаточного эффекта. 1. Адреналин За последнее время рекомендации по дозированию адреналина стали предметом многочисленных дискуссий. В докладах упоминались наблюдения «возрастающей эффективности» высоких доз адреналина во время церебральной реанимации детей, которые перенесли документированную СЛР. По другим сообщениям, не было отмечено увеличения эффективности при повышении дозы адреналина. Пока ожидаются результаты соответственно организованных проспективных исследований, Американская ассоциация кардиологии (American Heart Association, AHA) и Американская академия педиатрии (American Academy of Pediatrics, AAP) разработали программу PALS, где опубликовывали рекомендации по применению адреналина в случаях асистолии. В целом, при асистолии у детей адреналин следует использовать не совсем так, как она назначается для устранения брадикардии. Тем не менее, в обеих ситуациях применяется метод титрования дозы адреналина по мере введения [10]. Рекомендации PALS для случаев асистолии:
Рекомендации PALS для случаев брадикардии:
Существуют четыре препарата, традиционно используемых при реанимации, которые сохраняют эффективность при введении в эндотрахеальную трубку. Это лидокаин, атропин, налоксон и адреналин. Легко запомнить их помогает аббревиатура LANE (lidocaine, atropine, naloxone, epinephrine). Препарат Versed (мидазолам) также применяется и эффективен при эндотрахеальном введении. При дополнении его к списку получается другая аббревиатура: NAVEL. За исключением адреналина, дозы препаратов для эндотрахеального введения такие же, как для интраваскулярного. В каждом случае использование эндотрахеального пути доза адреналина увеличивается (до 0,1 мг/кг), доза лидокаина – 2-3 мг/кг, доза атропина – 0,03 мг/кг, доза налоксона должна быть не ниже, чем 0,1 мг/кг у детей до 5 лет и 2 мг у детей старше 5 лет и взрослых. Препарат разводят в 5 мл физиологического раствора и быстро вводят в просвет эндотрахеальной трубки и затем совершают 5 искусственных вдохов. 2. Атропин Атропин (обычная доза 0,02 мг/кг) характеризуется минимальным порогом дозы для эффективного устранения брадикардии. Оказывается, в количестве менее 0,1 мг этот препарат обладает действием, которое может фактически усилить брадикардию. Таким образом, если рассматривать атропин в качестве средства для лечения брадикардии у ребенка, который весит менее 5 кг, минимальная доза для введения составляет 0,1 мг. 3. Препараты кальция Хотя от использования кальция во время реанимации во многих случаях отказались, остаются особые обстоятельства, в которых он представляет значительную ценность. Применяйте кальций для лечения следующих документированных состояний:
Когда кальций необходим, его нужно вводить в медленном темпе. Быстрая инфузия приводит к тяжелой брадикардии. Позаботьтесь о том, чтобы растворы, содержащие кальций и гидрокарбонат натрия, не были перелиты один вслед за другим. Если эти вещества смешиваются, они реагируют с образованием карбоната кальция (мел), которые оседает в системе для внутренней инфузии. Используют в виде 10% раствора кальция хлорида в дозе 20мг/кг (0,2 мл/кг), вводят внутривенно медленно. Можно повторить дозу через 15 минут, всего вводят двукратно. 4. Гидрокарбонат натрия Гидрокарбонат натрия – препарат, успешно применяемый для устранения документированного метаболического ацидоза. Однако эффективен он только при условии адекватной вентиляции. Когда бикарбонат связывается с водородом, образуется комплексное соединение, которое распадается на углекислый газ и воду. Углекислый газ может быть выведен только одним способом – посредством дыхания. При отсутствии эффективной вентиляции этот побочный продукт не элиминируется, и буферное действие гидрокарбоната ликвидируется [8]. При реанимации идеальным считается рН – 7,3-7,35. Осуществление лабораторного контроля (КОС) Стартовая доза бикарбоната натрия – 1ммоль/кг массы тела (1 мл 4% р-ра соды содержит 0,5 ммоль соды). Последующие дозы подбирают на основании параметров КОС (0,3 ? ВЕ ? МТ в кг) или из расчета 0,5 ммоль/кг каждые 10 мин. Общая доза на реанимацию составляет 4-5 ммоль/кг. Вводится медленно болюсно (не быстрее 2 мин) или капельно. 5. Глюкоза Единственным показанием к введению препаратов глюкозы при сердечно-легочной реанимации 6. Лидокаин Используют для купирования желудочковой тахикардии, рефрактерной фибрилляции. Дозы: внутривенно или внутрикостно 1 мг/кг, при титровании – 20-50 мкг/кг/мин. 7. Амиодарон Используют по тем же показаниям, что и лидокаин. Вводят в дозе 5 мг/кг внутривенно или внутрикостно, последующая инфузия осуществляется со скоростью 5-15 мкг/кг/мин. Максимальная доза в сутки 15мг/кг. Методы простого подсчета концентрации препаратов для постоянной инфузии Используется несколько простых способов: Для постоянной инфузии препарата (адреналин), начиная со скорости 0,1 мкг/кг/мин: если 0,6 умножить на массу тела больного в килограммах, это соответствует количеству миллиграмм препарата, которое нужно добавить к достаточному объему раствора, чтобы в сумме оказалось 100 мл. Получившийся в результате раствор затем вводят со скоростью 1 мл/ч, что эквивалентно дозе 0,1 мкг/кг/мин. Допамин 4% (рассчитанная суточная доза разводится физиологическим раствором до 48 мл). Выбранную дозу (мкг/кг/мин) 4% допамина последовательно умножить на массу тела (кг) на 60 (минут) на 24 (часа) и разделить на 40 000:
Например, ребенку 5 лет весом 20 кг рассчитанная доза 5 мкг/кг/мин:
К 3,6 мл 4% допамина нужно добавить (до 48 мл) 44,6 мл физиологического раствора и вводить перфузором со скоростью 2 мл/ч, что эквивалентно выбранной дозе 5 мкг/кг/мин. Добутамин 1% (250 мг разводится на 25 мл 5% глюкозы). Выбранную дозу (мкг/кг/мин) 1% добутамина последовательно умножить на массу тела (кг) на 60 (минут) на 24 (часа) и разделить на 10 000:
Например, ребенку 5 лет весом 20 кг рассчитанная доза 5 мкг/кг/мин:
К 14,4 мл 1% добутамина нужно добавить (до 48 мл) 33,6 мл 5% глюкозы и вводить перфузором со По силе инотропного действия добутамин не уступает адреналину и превышает допамин. Основным преимуществом добутамина является в меньшей степени увеличение потребления кислорода, в большей степени увеличение доставки кислорода к миокарду. Электрическая дефибрилляция при реанимации у детей – относительно редкое вмешательство в практике детского анестезиолога-реаниматолога. Асистолия представляет собой гораздо более распространенный вид нарушения ритма сердца при остановке кровообращения. Для сердца ребенка фибрилляция не характерна. Следовательно, нужно тщательно оценить сердечный ритм перед тем, как сделать попытку дефибрилляции. Проводить дефибрилляцию ребенку при отсутствии монитора не рекомендуется. Прекардиальный удар также не рекомендован для применения у детей [4]. Механизм действия дефибрилляции заключается в массовой поляризации клеток миокарда с целью стимулировать возврат к спонтанному синусовому ритму. Как только диагностирована фибрилляция желудочков, начинайте готовить больного к дефибрилляции, корригируйте ацидоз и гипоксемию. Введение адреналина может способствовать увеличению амплитуды волн фибрилляции. В этом случае необходимо немедленно провести электрическую дефибрилляцию разрядом (с двухфазной волной) в 4 Дж/кг, после чего в течение 2 мин проводить ИВЛ и компрессию грудной клетки, затем определить состояние сердечной деятельности с помощью кардиомонитора. Были пересмотрены рекомендации по величине разряда для дефибрилляции. Некоторые исследования показали, что первоначального монофазного или двухфазного разряда величиной 2 Дж/кг достаточно для прекращения фибрилляции желудочков. В то же время исследования, касающиеся реанимации детей, показали, что более сильные разряды (4 Дж/кг) также прекращали фибрилляцию при минимальных побочных эффектах. Поэтому для усиления воздействия первого разряда в педиатрической практике при ручной установке величины разряда рекомендуется использовать уровень 4 Дж/кг. До сих пор нет убедительных доказательств за или против использования дефибриллятора у детей младше года [3]. Для проведения электрической дефибрилляции у детей старше 1 года – электроды диаметром 8-12 см, усилие составляет у детей от 1 года до 8 лет – 5 кг, с 8 лет – 8 кг. Абсолютно необходимым является использование специального геля на водной основе, которым обильно смазываются поверхности электродов, которые затем плотное прижимаются к коже пациента. Недопустимо использовать для этих целей салфетки, смоченные различными растворами или гель, предназначенный для ультразвуковых аппаратов [4]. Один электрод помещают на переднюю стенку грудной клетки в правой подключичной области, а другой на боковую поверхность левой половины грудной клетки по подмышечной линии. При наличии электродов для взрослых один электрод располагают на спине, под левой лопаткой, другой – слева от грудины. В момент проведения разряда недопустимо, чтобы кто-либо касался больного или поверхности, на которой он лежит. Также недопустимо, чтобы в момент разряда электроды дефибриллятора касались друг друга. Даже относительно короткие перерывы в массаже сердца вне и внутри стационара сопровождаются уменьшением вероятности превращения фибрилляции в другое нарушение ритма и снижают шансы на выживание. Ранее при использовании протокола трехкратного разряда время, затрачиваемое на дефибрилляцию и анализ последующего ритма, приводили к задержке с продолжением СЛР. Этот факт в сочетании с увеличением эффективности первого разряда (для купирования фибрилляции и желудочковой тахикардии) за счет использования метода двухфазного разряда стал причиной перехода к стратегии однократного разряда при дефибрилляции. Некоторые обязательные действия после восстановления сердечного ритма
Проведение сердечно-легочной реанимации требует отражения в протоколе СЛР, который, помимо паспортных данных, должен содержать информацию о времени и вероятной причине остановки кровообращения, времени интубации трахеи, времени введения и дозировках препаратов, времени и энергии дефибрилляции, времени восстановления сердечного ритма и быть подписан всеми участниками реанимации. Противопоказания к реанимации Противопоказания к реанимации рассматриваются в соответствии с государственным законодательством:
Реанимационные мероприятия не проводятся в следующих случаях:
Помните, что из-за трудностей в разграничении обратимых и необратимых состояний реанимационное пособие следует начинать во всех случаях скоропостижной (внезапной) смерти и уже по ходу реанимации уточнять прогностически значимые особенности анамнеза. Решение «не реанимировать», отказ от реанимационных мероприятий ввиду их потенциальной неэффективности у пациентов с терминальными стадиями хронических заболеваний целесообразно оформлять в виде решения консилиума заблаговременно [6, 14]. Проведение реанимационных мероприятий должно продолжаться до восстановления самостоятельного кровообращения или появления признаком смерти. Смерть сердца становится очевидной в случае развития стойкой (по крайней мере, в течение 30 мин) электрической асистолии (прямая линия на ЭКГ). Механическая асистолия без электрической (пульс отсутствует, а на ЭКГ фиксируется кривая электрических потенциалов сердца) не является признаком необратимости. До тех пор пока сохраняется ЭКГ-активность, не следует терять надежды на восстановление самостоятельного кровообращения. Смерть мозга – полное и необратимое нарушение функций мозга при еще сохраняющемся кровообращении в остальном теле. Предпосылки для постановки диагноза смерти мозга:
Документировать смерть мозга возможно у пациента, соответствующего вышеперечисленным критериям при отсутствии гипотермии, артериальной гипотензии, в случае отказа от использования препаратов групп мышечных релаксантов, гипнотиков, опиоидов в течение не менее чем 24 ч до выполнения тестов. Дополнительные обследования: изоэлектрическая линия на ЭЭГ в течение 30 мин в сочетании с вышеизложенными симптомами – достаточно для диагностики смерти мозга без дальнейшего наблюдения. Без энцефалографии данные симптомы должны отмечаться:
Только через эти промежутки времени можно выставить диагноз «смерть мозга». У грудных и детей первых лет жизни следует все случаи первичного повреждения мозга наблюдать в течение 24 ч. Критерии смерти мозга незначительно различаются в разных государствах в зависимости от законодательства, касающегося трансплантации органов. Необходимо отметить, что степень повреждения головного мозга во время проведения реанимационных мероприятий определить невозможно. Поэтому только необратимая остановка сердца является предпосылкой для принятия решения о прекращении реанимации. Ответственность за это решение несет только врач! Никаких четких рекомендаций или правил, регламентирующих прекращение реанимации, нет. Успешный результат во многом зависит от исходного состояния больного. Чем дольше продолжается реанимация, тем меньше шансов на успех, но это положение не абсолютно! Если в течение 30-40 минут активной реанимации кровообращение не восстанавливается, реанимационные мероприятия можно прекратить и констатировать биологическую смерть головного мозга. Существует ряд исключений, когда реанимационные мероприятия нужно продолжать более 30 минут:
Типичные ошибки при СЛР. При реанимации велика цена любых тактических и технических ошибок, поэтому на типичных целесообразно остановиться особо [7]. Тактические ошибки:
Ошибки при компрессии сердца:
Ошибки при ИВЛ:
Ошибки при дефибрилляции:
Литература
|