"Тольяттинский медицинский консилиум" 2016г. № 1-2
Синдром эмбриоплацентарной дисфункции: профилактика эмбриональных потерь на догестационном этапе
И.С. Липатов1, Ю.В. Тезиков1, О.А. Кутузова2, Т.А. Тезикова2, Р.Я. Ильяшевская3, Е.В. Жернакова4
1Самарский государственный медицинский университет
2Самарская областная клиническая больница им. В.Д. Середавина
3Самарская городская клиническая больница им. Н.А. Семашко
4Самарская городская клиническая поликлиника №15
Embriofetalni dysfunction syndrome: Prevention of embryonic losses before gestation period
I.S. Lipatov, Yu.V. Tezikov, O.A. Kutuzova, T.A. Tezikova, R.J. Ilashevskay, E.V. Zhernakova
Резюме
В настоящем исследовании в качестве доклинического этапа патологического течения беременности ранних сроков выделен синдром эмбриоплацентарной дисфункции, разработаны патогенетически обоснованные высокоинформативные критерии прогнозирования и ранней диагностики самопроизвольного аборта и неразвивающейся беременности. У 122 беременных женщин с высоким риском эмбриональных потерь в динамике I триместра гестации (5-7 нед., 8-12 нед.) проведена клиническая оценка содержания в крови лимфоцитов CD95+, сывороточных уровней провоспалительных цитокинов (ФНОα, ИЛ1β, ИЛ6), гликоделина (АМГФ), плацентарного сосудисто-эндотелиального фактора роста (ФРП), общего IgE, плазменной концентрации фибронектина. Контрольную группу составили 30 здоровых беременных женщин. Ретроспективный клинико-лабораторный анализ позволил сделать заключение о важном практическом значении догестационной профилактики эмбриональных потерь, включающей персонифицированные восстановительное лечение после неблагоприятного исхода предыдущей беременности и прегравидарную подготовку
Ключевые слова: эмбриоплацентарная дисфункция - невынашивание беременности – догестационная профилактика
Введение
В настоящее время происходит рост частоты ранних потерь беременности. Риск развития самопроизвольного выкидыша (СВ) и неразвивающейся беременности (НБ) значительно повышается при активации инфекционного процесса у беременной женщины, наличии иммунодефицитных состояний, генетически детерминированных тромбофилиях, развитии ауто- и аллоиммунных процессов, нарушениях иммунобиологической гестационной толерантности, эндокринопатиях [1-4].
На современном этапе развития акушерской науки отсутствует возможность достоверного прогнозирования НБ, СВ вследствие сходности факторов риска развития данных патологических состояний и других осложнений гестации (угроза прерывания беременности, хроническая плацентарная недостаточность, гестоз) [5-8]. Диагноз НБ ставится только при наличии свершившегося факта гибели эмбриона, а самопроизвольного аборта – при нарушении связи между трофобластами децидуальной оболочкой [9-13].
Согласно Международной статистической классификации болезней X пересмотра (1995), под неразвивающейся беременностью понимают гибель эмбриона или раннего плода с длительной задержкой его в полости матки (шифр О 02.1). Следует отметить, что, согласно последним данным мировой литературы, НБ включена в понятие синдрома потери плода, помимо принятого ранее термина «привычное невынашивание» [14]. В структуре репродуктивных потерь доля НБ составляет 10-20%, а среди самопроизвольного прерывания беременности на ранних стадиях – 30-50% [15].
Некоторыми авторами СВ и НБ объединяются понятием эмбриоплацентарная недостаточность [16-19]. По-мнению других исследователей, общий термин «эмбриоплацентарная недостаточность» трактуется более широко и включает в себя, помимо CВ и НБ, патологические состояния связанные с пролонгированием беременности (плацентарная недостаточность, гестоз) [20-24]. Учитывая связь нарушений процессов имплантации с невынашиванием беременности, плацентарной недостаточностью и другими акушерскими осложнениями, уместным было бы выделить этап, предшествующий клинической реализации СВ, НБ, плацентарной недостаточности и других осложнений, и определить его как эмбриоплацентарная дисфункция (ЭПД).При этом эмбриоплацентарную недостаточность следует рассматривать как более тяжелую патологию, развивающуюся вследствие эмбриоплацентарной дисфункции. Различные клинические варианты эмбриоплацентарной недостаточности обусловлены генетическим кодом, характером повреждающих эндогенных и экзогенных факторов. В общем виде проявления нарушений процессов эмбриогенеза в виде ЭПД можно рассматривать как донозологический этап, предшествующий клинической реализации эмбриоплацентарной недостаточности, включающей CВ и НБ.
Ранние механизмы регуляции реакций, обусловленных действием повреждающего агента на эмбриоплацентарный комплекс, связаны с изменением функций иммунокомпетентных клеток, реализующихся через действия провоспалительных и противовоспалительных цитокинов. В последующем при нарастании альтеративно-экссудативных процессов происходят значительные изменения соотношения иммунных факторов с увеличением провоспалительного звена, дисбалансом противовоспалительных интерлейкинов и системы гемостаза [25-28]. Для снижения функциональной агрессии активированных лимфоцитов и предотвращения нежелательных иммунных реакций на границе раздела организмов матери и раннего плода индуцируется апоптоз иммунокомпетентных клеток [29-32].
Зная причины и патогенез ЭПД можно целенаправленно проводить патогенетическое лечение и реабилитацию пациенток группы высокого риска по эмбриоплацентарным потерям в догестационном периоде. Однако для осуществления контроля эффективности реабилитационных мероприятий и течения беременности ранних сроков в настоящее время отсутствуют универсальные критерии диагностики эмбриоплацентарной дисфункции.
Целью настоящего исследования явилась разработка критериев диагностики эмбриоплацентарной дисфункции у беременных с самопроизвольным выкидышем и неразвивающейся беременностью для оптимизации акушерской тактики по снижению эмбриональных потерь.
Пациент и методы.
Под наблюдением находились 122 беременные женщины с высоким риском невынашивания беременности [11], имеющие в анамнезе СВ или НБ.
Из них у 70 женщин (57,4%) в анамнезе имела место НБ, у 52 женщин (42,6%) – СВ. Средний возраст обследованных составил 30,2±2,5 лет. У всех женщин данная беременность вторая. В зависимости от характера реабилитационных мероприятий в догестационном периоде женщины были разделены на две клинические группы сравнения. I группу составили 55 женщин (30 - с НБ в анамнезе; 25 – с СВ в анамнезе), которым после прерывания беременности и обследования проводилось восстановительное лечение по персонифицированной программе реабилитационных мероприятий с учетом этиологического фактора, включающей антибактериальную терапию с учетом чувствительности микроорганизмов, противовоспалительные средства, иммуномодуляторы (неовир, даларгин, виферон), терапию, нормализующую реологические свойства и коагуляционный потенциал крови (энзимотерапия – вобэнзим, флогэнзим; гепариноидсулодексид), препараты, улучшающие метаболизм (комплекс витаминов и минералов, фолиевая кислота и др.), гормонотерапию (дюфастон, комбинированные эстроген-гестагенные препараты). У 67 женщин (40 - с НБ анамнезе; 27 – с СВ в анамнезе) II группы сравнения лечебные мероприятия ограничились применением витаминноминерального комплекса, вследствие отказа женщин от других видов лечения. Средний срок повторного наступления беременности в I группе составил 8,5±2,2 мес., во II группе – 5,2±0,8 мес. За 2 месяца до планируемой беременности прегравидарная подготовка с учетом индивидуальных особенностей репродуктивного статуса была проведена только у женщин I клинической группы.
Одним из условий включения женщин в настоящее исследование была ранняя постановка на учет в связи с беременностью. В динамике I триместра гестации в сроки 5-7 нед. и 8-12 нед. всем беременным женщинам групп сравнения проведено обследование, включающее определение в крови содержания лимфоцитов с фенотипом CD95+(Л CD95+; Fas/APO-1/CD95 – мембранный рецептор инициации апоптоза); сывороточных уровней провоспалительных цитокинов – фактора некроза опухоли альфа (ФНОα), интерлейкина 1 бетта (ИЛ 1β), интерлейкина 6 (ИЛ 6); маркера функциональной активности децидуальной оболочки – альфа-2-микроглобулина фертильности (АМГФ, гликоделин); маркеров сосудисто-эндотелиальной дисфункции – фактора роста плаценты (ФРП), общего иммуноглобулина Е (IgE); маркера состояния системы гемостаза – плазменной концентрация фибронектина (ФН) [1, 8, 9, 16, 22, 23].
Для диагностики состояния эмбриоплацентарного комплекса применялось ультразвуковое исследование по трансвагинальной методикена аппарате «AcusonSimens» (Германия) с цветным допплеровским картированием. Результаты лабораторного тестирования ретроспективно сопоставлялись в группах сравнения с учетом срока наблюдения и исхода беременности. Идентификацию фенотипа лимфоцитов (CD95+) осуществляли стандартным методом иммунофлюоресцентного анализа с использованием моноклональных антител к поверхностному антигену CD 95 лимфоцитов человека и меченных FITSFab–фрагментов антимышиных иммуноглобулинов производства НПФ «МедБиоСпектор» (Россия);определение в сыворотке крови концентрации ФНОα, ИЛ 1β, ИЛ 6, ФРП, общего IgE, АМГФ, плазменной концентрации ФН проводилось методом твердофазного иммуноферментного анализа с помощьюнабора реагентов ООО «Протеиновый контур» (Санкт-Петербург, Россия), «Диатех – Э» (г. Москва), «АМГФ – Фертитест» (НИИ Морфологии человека РАМН), стандартных тест-систем производства НИИ вакцин и сывороток им. И.И. Мечникова [16]. Для верификации диагноза проводилось гистологическое исследование абортивного материала и последа [10]. Степень тяжести гестоза оценивалась по шкале Goekи Г.М. Савельевой. Контрольную группу составили 30 здоровых беременных женщин аналогичной возрастной группы, родоразрешенных через естественные родовые пути при доношенной гестации.
Математическая обработка полученных данных проводилась на персональном компьютере AMDAthlonII в среде WindowsXP с использованием программы MicrosoftOfficeExcel 2003, статистического пакета Statistica 6.0 фирмы STATSOFT. Весь полученный числовой материал подвергался статистической обработке с заданной надежностью 95% или уровнем значимости (P) 0,05. Оценка значимости различий средних арифметических значений (M±δ, где δ – среднее квадратичное отклонение от среднего) проводилась с помощью критерия Стъюдента, возможность использования которого определялась критерием Фишера-Снедекора. Для оценки прогностической значимости предлагаемых критериев были рассчитаны чувствительность, специфичность, предсказательная ценность положительного и отрицательного результатов, диагностическая точность способов прогнозирования осложнений гестации. Чувствительность (Sn) – вероятность позитивного теста у лиц с наличием заболевания: Sn= TP/Д+ × 100, где TP – число истинноположительных ответов, Д+ - число истинноположительных и ложноотрицательных ответов. Специфичность (Pp) – вероятность отрицательного результата у лиц с отсутствием заболевания: Pp=TN/Д_ × 100, где TN – число истинноотрицательных ответов, Д_ – число ложноположительных и истинноотрицательных ответов. Точность (Ex) – пропорция правильных результатов среди всех обследованных лиц: Ex= (TP+TN)/N×100, где N – число всех обследованных лиц. Прогностичность результатов оценивалась исходя из преваленса частоты признака в исследуемой группе пациентов: PV+ =TP/T+ ×100; PV_ =TN/T_ ×100. Критерий PV+ напрямую показывает насколько велика вероятность болезни при положительных результатах исследования, а критерий PV_ - насколько велика вероятность отсутствия болезни при отрицательных результатах [4, 6].
Результаты исследования и их обсуждение.
Исходы беременности у женщин I и II клинических групп сравнения представлены в таблице 1.
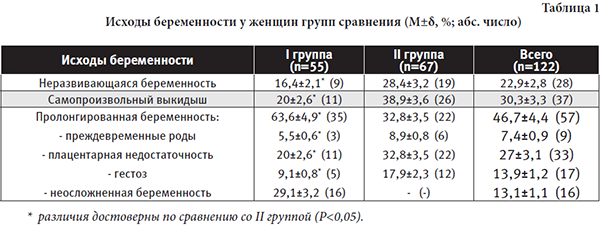
Реализация осложненного течения беременности в I группе женщин, которым проводились персонифицированные превентивные мероприятия в интергенетическом периоде, достоверно (P<0,05) отличалась от беременных женщин II клинической группы без восстановительного лечения и прегестационной подготовки. Согласно полученным данным, у женщин II группы беременность закончилась несостоявшимся и самопроизвольным абортами в конце I триместра гестации соответственно в 1,7 раза и в 1,9 раза чаще по сравнению с женщинами I группы сравнения. В целом невынашивание беременности (НБ и СВ) в группе высокого риска (122 женщины) отмечено более, чем в половине наблюдений (53,2%). Пролонгирование беременности у женщин с высоким риском невынашивания в I группе отмечалось практически в 2 раза чаще по сравнению со II группой наблюдения. При этом неосложненное течение гестации имело место в 29,1% наблюдений в I группе и отсутствовало во II группе сравнения. Осложненное течение беременности на поздних сроках диагностировано у 34,5% и 32,8% женщин соответственно I и II группам сравнения. Несколько большая частота поздних гестационных осложнений в I группе объясняется значительно меньшим переходом ЭПД в эмбриоплацентарную недостаточность (НБ и СВ) на ранних сроках гестации. Основными осложнениями беременности были преждевременные роды, плацентарная недостаточность различной степени тяжести, гестоз. Преждевременные роды имели место в 1,6 раза реже в группе женщин с проведенными профилактическими мероприятиями на догестационном этапе. Плацентарная недостаточность реализовалась в 1,6 раза реже в I группе по сравнению со II группой, при этом в структуре степени тяжести плацентарной недостаточности компенсированная плацентарная недостаточность составила 81,9% (9 наблюдений) и 63,6% (14 наблюдений), субкомпенсированная – 18,1% (2 наблюдения) и 22,7% (5 наблюдений), декомпенсированная – отсутствовала и 13,7% (3 наблюдения) – соответственно Iи II группам сравнения.В целом плацентарная недостаточность в I группе диагностирована в 34,5% наблюдений от всех женщин с пролонгированной беременностью, во II группе – в 100%, из всех беременных I и II групп – в 57,9%. Схожая тенденция отмечена в отношении реализации гестоза: в I группе гестоз имел место в 1,9 раза реже (9,1% - 5 наблюдений легкой степени тяжести), чем во II группе (17,9% - 8 наблюдений легкой степени тяжести, 4 наблюдения средней степени тяжести), в общей сложности гестоз реализовался в 28,1% наблюдений от всех женщин с пролонгированной беременностью.
Следовательно, анализ клинического течения беременности у женщин групп высокого риска по невынашиванию в зависимости от наличия проведенных превентивных мероприятий в отношении реализации эмбриоплацентарной дисфункции и недостаточности показал, что практически каждая третья беременная женщина имеет неосложненное течение гестации в случае их проведения и 100% женщин имеют те или иные осложнения на разных сроках беременности (НБ, СВ, преждевременные роды, плацентарная недостаточность, гестоз) при отсутствии профилактических мероприятий на догестационном этапе. При этом значительно реже отмечается переход ЭПД в эмбриоплацентарную недостаточность (НБ, СВ) в I триместре гестации – 36,4% в I группе против 67,3% во II группе сравнения.
Результаты лабораторного тестирования беременных женщин в динамике I триместра с учетом клинического течения гестации представлены в таблице 2.
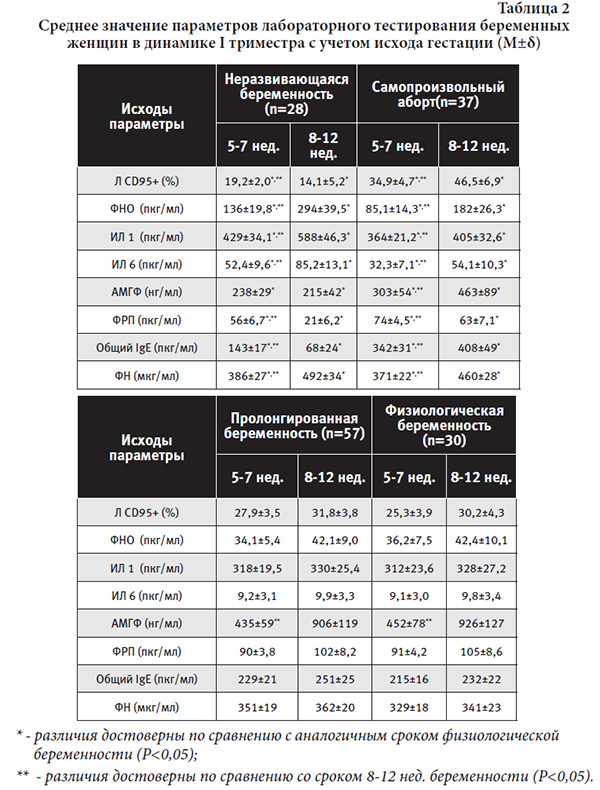
Согласно полученным данным в 5-7 нед. и 8-12 нед. гестации достоверные отличия изученных параметров от физиологического течения беременности имелись при НБ и CВ (P<0,05) и отсутствовали при пролонгированной беременности.
Несмотря на достоверные различия уровней маркера индуцированной трофобластом запрограммированной клеточной гибели иммунокомпетентных клеток при эмбриоплацентарной недостаточности и физиологической гестации, отмечена разнонаправленность динамики данного параметра при НБ и СВ. Так, при НБ в 5-7 нед. беременности (за 3-4 нед. до гибели эмбриона) уровень Л CD95+ достоверно снижается до 19,2±2,0% (при норме – 25,3±3,9%), в то время как при СВ (за 3-4 нед. до клинических проявлений СВ) – увеличивается до 34,9±4,7%. Данную разнонаправленность изменений содержания в крови Л CD95+ можно объяснить различной степенью повреждения трофобласта за 3-4 нед. до перехода ЭПД в эмбриоплацентарную недостаточность: при НБ трофобласт, по-видимому, вследствие более глубокого повреждения, теряет защитные механизмы, и в частности, способность индуцировать апоптоз активированных лимфоцитов с целью их селекции. В 8-12 нед. гестации данная закономерность усиливается: при НБ уровень Л CD95+ достоверно снижается до 14,1±5,2% (при норме – 30,2±4,3%), при CВ–увеличивается до 46,5±6,9%. При СВ защитные механизмы цито- и синцитиотрофобласта ранней плаценты от повреждения сохраняются значительно дольше (вплоть до состоявшегося аборта) по сравнению с НБ [15, 19, 23, 24].
Анализ динамики показателей, характеризующих сывороточные концентрации провоспалительных цитокинов (ФНОα, ИЛ 1β, ИЛ 6), свидетельствует о формировании синдрома системного воспалительного ответа на доклиническом этапе (ЭПД) как несостоявшегося аборта, так и самопроизвольного выкидыша [5, 9, 13]. Кроме того, количественная оценка изученных цитокинов показала достоверную разницу (P<0,05) в их содержании при НБ и СВ, несмотря на общую тенденцию к повышению: при НБ (за 3-4 нед. до гибели эмбриона) средние значения ФНОα, ИЛ 1β, ИЛ 6 увеличены по сравнению с CВв 1,6 раза, 1,2 раза, 1,6 раза соответственно. Объясняя выявленное повышение уровней провоспалительных цитокинов при ЭПД и эмбриоплацентарной недостаточности по сравнению с физиологической гестацией можно согласиться с мнением ряда авторов, считающих, что в норме цитокины, образующиеся при первичном иммунном ответе на эмбриональные антигены, не поступают в кровоток и не вызывают системных эффектов [5, 13, 20].
В настоящее время известно, что большая часть лимфоцитов децидуальной оболочки в I триместре беременности представлены большими гранулярными лимфоцитами, имеющими фенотип CD16+CD56/ CD3-, которые обеспечивают иммунотрофизм – усиление роста трофобластической ткани [3, 17, 20]. В результате воздействия антигенов трофобласта на ткани эндометрия происходит дифференцировка Т-хелперов на две субпопуляции:Th1 и Th2. Класс Th1 синтезирует провоспалительные цитокины, такие как ИЛ 1, ИЛ 6, гамма-интерферон, факторы некроза опухоли альфа и бетта(ФНОα,β), класс Th2 – регуляторные или противовоспалительные цитокины: ИЛ 3, ИЛ 4, ИЛ 10, ИЛ 13 [13, 22]. Это является результатом модифицирования иммунного ответа матери по отношению к плаценте, суть которого заключается в супрессии цитотоксического хелперного ответа первого типа и активации хелперного ответа второго типа. При преобладании в эндометрии Th2-лимофоцитов происходит выработка антител, блокирующих распознавание антителами матери антигенов трофобласта, что способствует нормальному процессу имплантации. Сдвиг баланса в сторону преобладания класса Th1 приводит к повышенной продукции провоспалительных цитокинов, избыточному воспалительному процессу, что является причиной неполноценной имплантации с недостаточной глубиной ее инвазии [3, 18, 21]. Отмечено, что провоспалительные цитокины, в первую очередь ФНОα, способны «направить» NK-лимфоциты в сторону апоптогенного воздействия на клетки трофобласта [18, 20, 22]. Персистенция условно-патогенных микроорганизмов и вирусов в эндометрии характеризуется привлечением в очаг хронического воспаления мононуклеарных фагоцитов, естественных киллеров Th, синтезирующих провоспалительные цитокины ФНОα, ИЛ 1β, ИЛ 6. Изменения состояния эндометрия препятствуют созданию локальнойиммуносупрессии в преимплантационный период, необходимый для формирования защитного барьера и предотвращения отторжения наполовину чужеродного тела. Повышение содержания провоспалительных цитокинов сопровождается активацией протромбиназы с образованием гематом, тромбозов в области плаценты, что и приводит к прерыванию беременности [5, 9, 13].
Исследование сывороточного уровня АМГФ (гликоделина), характеризующего состояние децидуальной оболочки на ранних сроках беременности, показало его достоверное снижение (P<0,05) при ЭПД с усилением процесса при эмбриоплацентарной недостаточности по сравнению с физиологическим течением гестации. При этом изменения концентрации гликоделина более выражены (P<0,05) при НБ по сравнению с СВ, что свидетельствует о более значительных изменениях децидуальной части ранней плаценты альтеративно-экссудативного характера при несостоявшемся аборте [22].
Количественная оценка маркеров сосудисто-эндотелиальной дисфункции (ФРП, общего IgE) в динамике I триместра беременности показала более значительное снижение (P<0,05) уровня ФРП в сыворотке крови беременных с НБ (56±6,7 пкг/мл и 21±6,2 пкг/мл соответственно 5-7 нед. и 8-12 нед.) по сравнению с СВ (74±4,5 пкг/мл и 63±7,1 пкг/мл соответственно указанным срокам) и разнонаправленность динамики содержания общего IgE при НБ и СВ по сравнению с группой контроля.
Снижение сывороточных уровней ФРПи общего IgE при несостоявшемся аборте в 5-7 нед. и 8-12 нед. гестации можно объяснить нарастанием патологических изменений эмбриона и параэмбриональных структур, сопровождающихся снижением выработки сосудисто-эндотелиального фактора регуляции васкуло- и ангиогенеза и повышенным образованием комплексов IgE–АГ с локализацией в сосудистой стенке эмбриоплацентарного комплекса.
Важным молекулярным фактором регуляции состояния системы гемостаза, в том числе в эмбриоплацентарном комплексе, является фибронектин (ФН). Научными работами последних лет доказано, что ФН при различной остроте тромботического процесса изменяет свою концентрацию. Выявлено, что содержание ФН в плазме крови значительно снижается при остром ДВС-синдроме и повышается при хроническом тромботическом процессе. Установлено, что ФН в больших концентрациях может значительно подавлять агрегационную способность и адгезию тромбоцитов на таких субстратах, как фибриноген и фактор Виллебранда. Связываясь с фибриновыми волокнами и тромбоцитами, ФН активно потребляется в формирующийся тромб и способствует его консолидации [1]. Учитывая, что основные методы лабораторной диагностики тромбофилических нарушений достаточно дорогостоящие, определение уровня ФН в разные сроки беременности, по-мнению ряда авторов [9, 12], является информативным и доступным методом исследования предтромботических и тромбоопасных состояний.
В проведенном исследовании содержание ФН в плазме крови беременных женщин с НБ и СВ имело общую закономерность: достоверное повышение на этапе ЭПД (386±27 мкг/мл и 371±22 мкг/мл – соответственно) по сравнению с физиологической гестацией (329±18 мкг/мл) с последующим нарастанием концентрациипри клинической реализации эмбриоплацентарной недостаточности (492±34 мкг/мл и 460±28 мкг/мл – соответственно НБ и СВ по сравнению с 341±23 мкг/мл при физиологической беременности).
С позиции доказательной медицины определены чувствительность, специфичность, прогностическая ценность положительного и отрицательного результатов, точность способа прогнозирования различных клинических вариантов эмбриоплацентарной недостаточности на ранних сроках беременности (НБ и СВ) путем комплексного лабораторно тестирования, которые соответственно равны 91%, 87%, 90%, 89%, 92%, что свидетельствует о высокой информативности и достоверности предлагаемого способа прогнозирования.
Обобщая данный раздел работы следует отметить, что динамическое лабораторное тестирование беременных женщин группы высокого риска по невынашиванию с исследованием в I триместре гестации маркеров апоптоза иммунокомпетентных клеток, синдрома системного воспалительного ответа (в частности, провоспалительных цитокинов), функциональной активности децидуальной оболочки ранней плаценты, сосудисто-эндотелиальной дисфункции эмбриоплацентарного комплекса, состояние системы гемостаза позволяет диагностировать доклинический этап осложнений беременности (НБ, СВ) – эмбриоплацентарную дисфункцию.
Отдельно проведен анализ количественных значений параметров, характеризующих состояние эмбриоплацентарного комплекса в динамике I триместра гестации у беременных женщин в зависимости от проведения профилактических мероприятий в отношении ЭПД на догестационном этапе. Средние значения параметров лабораторного тестирования беременных женщин в зависимости от наличия восстановительного лечения и прегестационной подготовки представлены в таблице 3.
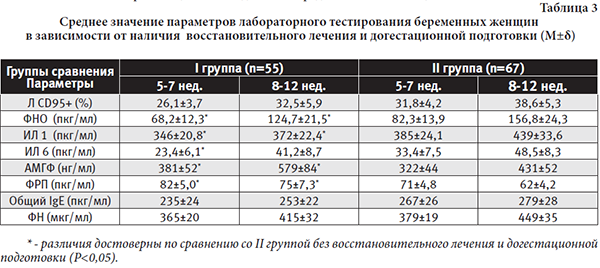
Все исследованные параметры у беременных I клинической группы, которым в интергенетическом периоде проводились превентивные мероприятия для снижения неблагоприятных последствий патологического исхода (НБ, СВ) предыдущей беременности, свидетельствуют о более благоприятном течении ранних сроков гестации по сравнению со II группой беременных: более низкие уровни провоспалительных медиаторов межклеточных взаимодействий (ФНОα, ИЛ 1β, ИЛ 6), интегрированного показателя состояния системы гемостаза (ФН), общего IgE, маркера запрограммированной клеточной гибели иммуноцитов (Л CD95+); более высокие концентрации плацентарного сосудисто-эндотелиального фактора роста (ФРП) и маркера функциональной активности децидуальной оболочки ранней плаценты (АМГФ).
Полученные данные лабораторного тестирования с учетом клинических исходов беременности подтвердили важное практическое значение применения восстановительного лечения и прегравидарной подготовки у беременных с высоким риском эмбриоплацентарных потерь.
Выводы
- Дифференцированный подход к прогнозированию и ранней диагностике неразвивающейся беременности и самопроизвольного аборта может осуществляться путем количественной объективизации высокоинформативных лабораторных критериев эмбриоплацентарной дисфункции.
- Догестационная профилактика эмбриональных потерь (НБ, СВ), включающая персонифицированные восстановительное лечение после неблагоприятного исхода предыдущей беременности и прегравидарную подготовку, позволяет снизить частоту реализации синдрома потери плода в 1,8 раза, увеличить частоту пролонгирования беременности в 2 раза, неосложненного течения беременности на 29,1%.
Литература
-
Липатов И.С., Санталова Г.В., Тезиков Ю.В. и др. Применение антигомотоксической терапии в акушерстве, гинекологии и неонатологии // Вестник новых медицинских технологий. – 2014. – Том.8, №1. VNMT: www/ medtsu.tula.ru / Bulletin/E2014-1/00.html.-п.л.9.
- Тезиков Ю.В., Липатов И.С., Мельников В.А. и др. Патоморфологические особенности состояния яичников при беременности // Российский вестник акушера-гинеколога. - 2010. - Т. 10, №4. - С. 50-57.
- Тезиков Ю.В., Мельников В.А., Липатов И.С. Новые подходы к ведению беременных женщин с плацентарной недостаточностью // Вестник Волгоградского государственного медицинского университета. - 2010.- №2. - С. 64-67.
- Липатов И.С., Тезиков Ю.В., Есартия М.А. Прогнозирование и коррекция нарушений лактационной функции с использованием видимого инфракрасного поляризованного света на этапе лактогенеза // Российский вестник акушера-гинеколога. - 2008. - Т.8, №2. - С. 30-36.
- Санталова Г.В., Валеева Г.Р., Липатов И.С., Тезиков Ю.В. Анализ соматической патологии детей, рожденных от герпес-инфицированных матерей // Вестник Российского университета дружбы народов. Серия: Медицина. – 2009. - №4. – С. 210-215.
- Тезиков Ю.В., Липатов И.С., Рябова С.А., и др. Перинатальная хрономедицина: биоритмостаз плода при неосложненной беременности и плацентарной недостаточности // Известия Самарского научного центра Российской академии наук. – 2014. – Т.16, №5-4. – С. 1467-1470.
- Овчинникова М.А., Санталова Г.В., Липатов И.С., Тезиков Ю.В. Состояние здоровья детей от герпесинфицированных матерей, получавших противорецидивную терапию // Известия Самарского научного центра Российской академии наук. – 2015. – Т.17, №2-2. – С. 351-356.
- Рябова С.А., Тезиков Ю.В., Липатов И.С. Результаты клинической апробации комплексной балльной шкалы оценки степени тяжести хронической плацентарной недостаточности // Известия Самарского научного центра Российской академии наук. – 2015. – Т.17, №2-2. – С. 371-375.
- Фролова Н.А., Тезиков Ю.В., Липатов И.С. Обоснование выбора ангиопротекторадиосмина в качестве профилактического агента преэклампсии // Известия Самарского научного центра Российской академии наук. – 2015. – Т.17, №2-2. – С. 398-403.
- Липатов И.С., Тезиков Ю.В., Зубковская Е.В. и др. Биомодулирующие механизмы действия видимого и инфракрасного поляризованного света // Вестник Самарского государственного университета. – 2006. - №9 (49). – С. 109-122.
- Кравченко Ю.Л., Липатов И.С., Данилова Н.Н. и др. Аспекты профилактики социальных и экологических факторов риска перинатальной смертности в условиях городской клинической больницы крупного промышленного города // Человек и Вселенная. - 2006. - Т.56, №3. - С. 119-132.
- Тезиков Ю.В., Липатов И.С. Предикторные индексы тяжелых форм хронической плацентарной недостаточности // Медицинский альманах. - 2011. - №6. - С. 60-63.
- Липатов И.С. Клиническая оценка иммунных проявлений повреждения сосудистой стенки при физиологической и осложненной гестозом беременности: Автореф. дис. … канд. мед.наук. Самара, 1993. - 24 с.
- Тезиков Ю.В., Липатов И.С., Фролова Н.А. и др. Сравнительная оценка эффективности методов превентивной монотерапиипреэклампсии у беременных группы высокого риска // Известия Самарского научного центра Российской академии наук. – 2014. – Т.16, №5-4. – С. 1471-1474.
- Табельская Т.В., Липатов И.С., Фролова Н.А., Тезиков Ю.В. Состояние сосудисто-тромбоцитарного, цитокинового, гемокоагуляционного гомеостаза у беременных на ранних сроках физиологической гестации // Известия Самарского научного центра Российской академии наук. – 2014. – Т.16, №5-4. – С. 1459-1462.
- Тезиков Ю.В., Липатов И.С. Результаты применения карбогенотерапии для профилактики плацентарной недостаточности // Российский вестник акушера-гинеколога. - 2011. - Т. 11, №5. - С. 71-77.
- Тезиков Ю.В., Липатов И.С., Санталова Г.В. и др. Прикладные аспекты иммунологической толерантности в системе «мать-плод» // Уральский медицинский журнал. - 2009. - №10 (64). - С. 121-128.
- Потапова И.А., Пурыгин П.П., Липатов И.С. и др. Синтез и биологическая активность алифатических и ароматических сульфокислот // Химико-фармацевтический журнал. - 2001. - Т.35, №11. - С. 5.
- Тезиков Ю.В., Липатов И.С., Дремлюга Н.М. и др. Биоритмологический подход к оценке состояния фетоплацентарного комплекса и новорожденных » // Уральский медицинский журнал. - 2008. - №12. - С. 154-160.
- Тезиков Ю.В., Липатов И.С., Есартия М.А. и др. Становление лактации у женщин с плацентарной недостаточностью и новые подходы к лечению гипогалактии // Уральский медицинский журнал. - 2010. - №3 (68). - С. 42-48.
- Мельников В.А., Купаев И.А., Липатов И.С. Противососудистые антитела у женщин с физиологической и осложненной гестозом беременностью // Акушерство и гинекология. - 1992. - №3-7. - С. 19.
- Агаркова И.А., Липатов И.С., Тезиков Ю.В. Профессия и репродукция // Терапевт. – 2013. - №5. – С. 57-62.
- Липатов И.С., Купаев И.А., Козупица Г.С. Исходы беременности у женщин с патологической прибавкой массы тела, сосудистой дисфункцией, преходящими отеками и транзиторной протеинурией // Акушерство и гинекология. – 1995. - №6. – С.6.
- Липатов И.С., Тезиков Ю.В., Санталова Г.В. и др. Профилактика рецидивов герпетической инфекции у беременных и внутриутробного инфицирования плода вирусом простого герпеса // Российский вестник акушера-гинеколога. - 2014. - Т.14, №4. - С. 63-68.
- Тезиков Ю.В. Клинико-иммунологические аспекты ранней диагностики повреждения эндотелия у беременных с гестозом: Автореф. дис. … канд. мед.наук. Самара, 2001. - 26 с.
- Липатов И.С., Тезиков Ю.В., Никаноров В.Н. Инфекция гриппа и беременность: проблема специфической профилактики // Вопросы гинекологии, акушерства и перинатологии. - 2015. - Т. 14, №1. - С. 57-63.
- Липатов И.С., Тезиков Ю.В., Рябова С.А. и др. Оценка церебральной гемодинамики плода при плацентарной недостаточности с учетом его суточного биоритмостаза // Российский вестник акушера-гинеколога. - 2015. - Т.15, №4. - С. 42-48.
- Стрижаков А.Н., Липатов И.С., Тезиков Ю.В. Плацентарная недостаточность. Монография. Самара: ООО «Офорт», 2014. - 239 с.
- Стрижаков А.Н., Тезиков Ю.В., Липатов И.С. и др. Стандартизация диагностики и клиническая классификация хронической плацентарной недостаточности // Вопросы гинекологии, акушерства и перинатологии. - 2014. - Т. 13, № 3. - С. 5-12.
- Тезиков Ю.В., Липатов И.С., Завалко А.Ф. и др. Особенности современного клинического течения гестоза у беременных // Актуальные вопросы акушерства и гинекологии. - 2001. - Т.1, №1.- С. 35.
- Тезиков Ю.В. Патогенетическое обоснование прогнозирования, ранней диагностики и профилактики тяжелых форм плацентарной недостаточности: Автореф. дис. … докт. мед. наук. Самара, 2013. - 51 с.
- Тезиков Ю.В., Липатов И.С., Мельников В.А. и др. Прогностическая значимость методов диагностики плацентарной недостаточности и состояния плода // Уральский медицинский журнал. - 2009. - №3 (57). - С. 33-40.
|



