"Тольяттинский медицинский консилиум" 2016г. № 3-4
Сравнительный анализ взаимосвязи клинико-лабораторных данных с исходом сепсиса в ОРИТ
Ю.Л. Кецко1,2, А.В. Лунина1,2, О.А. Гусякова 3,4
1ГБОУ ВО СамГМУ МЗ РОССИИ
Кафедра анестезиологии, реаниматологии и скорой медицинской помощи ИПО
2Отделение реанимации и интенсивной терапии Клиник СамГМУ, Клиники ГБОУ ВПО
3Центральная клинико-диагностическая лаборатория Клиник СамГМУ
4Кафедра фундаментальной и клинической биохимии с лабораторной диагностикой ГБОУ
Comparative analysis of relationship clinical and laboratory data with the outcome of sepsis in departments of intensive care
Iu.L. Ketsko, A.V. Luninа, O.A. Gusiakovа
Резюме
Цель исследования. Произвести анализ динамической взаимосвязи клинико-лабораторных данных пациентов с сепсисом и исходом в условиях ОРИТ.
Материалы и методы. Произведен ретроспективный анализ 108 историй болезни пациентов с сепсисом. Средний возраст пациентов - 50,5±15,5 (максимум -77, минимум -21год). Мужчины составили 58% от всех поступивших пациентов. В состоянии септического шока находилось 29 больных.
По входным воротам: у 69 больных причинным фактором была абдоминальная хирургическая патология, у 25 – тяжелые инфекции мягких тканей, 10 пациентов с нозокомиальной пневмонией, у 4 пациентов – ангиогенная катетерная инфекция. Относительная летальность в исследуемой группе составила 32,4%. В качестве исследуемых признаков выступали критерии, входящие в интегральные шкалы тяжести SOFA и SAPS II. Исходя из современных исследований, дополнительно изучалась значимость лабораторных показателей: процент лимфоцитов, уровень Pct и показатели тромбоэластографии.
Результаты. Проведенный множественный регрессионный анализ в общей группе и в группе выживших больных с сепсисом с зависимой переменной соответственно – исход заболевания в ОРИТ и койко/день в ОРИТ показал ранние значимые изменения в гемостазе, требующие своевременной коррекции. Для группы выживших пациентов: гиперкоагуляционный синдром, инициация тромбоцитопении, активация вторичного фибринолиза. Для общей группы больных: гиперфибринолиз с нормо-и гипокоагуляционным синдромом, прогрессивная тромбоцитопения.
Заключение. Неспецифичность клинических симптомов сепсиса диктует необходимость выбора ранних лабораторных маркеров сепсиса с целью своевременной целенаправленной терапии. Динамика показателей гемостаза, выявляемых методом тромбоэластографии являются ранними предикторами сепсиса. Они характеризуют нарастающую тромбинемию. Достоверными дополнительными критериями неблагоприятного исхода сепсиса по значимости были процент лимфоцитов. уровень лейкоцитоза и прокальцитонина.
Ключевые слова: Сепсис, летальность, клинические и лабораторные критерии, гемостаз, тромБоэластография
Введение
На сегодняшний день диагноз сепсиса определяют совокупностью ряда клинических и лабораторных данных [1, 2, 3]. Важность ранней диагностики сепсиса и своевременность начала лечения позволяет улучшить результаты лечения [4, 5, 6].
Тяжесть клинической картины, неспецифичность начальных клинических симптомов сепсиса диктует необходимость высокой степени настороженности тяжелой инфекции и всеобъемлющей клинической оценки в совокупности с лабораторными данными [7].
Если клиническо-лабораторные критерии синдрома системной воспалительной реакции чётко определены, то их сравнительная значимость имеет определённые трудности [8, 9]. Из имеющихся в электронной базе данных PubMed 178 различных биомаркеров сепсиса только 5 имеют достоверные данные по чувствительности и специфичности [2, 10]. Данные мета-анализа подтверждают, что прокальцитониновый тест (Pct) продолжает иметь высокую диагностическую ценность, особенно при бактеремиях [11, 12]. В качестве дополнительных критериев выступают: уровень лейкоцитоза, выраженность лимфопении, их соотношение, величина тромбоцитопении и уровень лактата крови [13, 14].
Для лабораторной диагностики ДВС-синдрома при тяжелом сепсисе используются критерии нескольких классификаций (ISTH, JAAM DIC) без четкого определения их значимости в диагностике и прогнозе сепсиса.
Цель - определение наиболее достоверных клинико-лабораторных критериев, влияющих на исход Сепсиса
Материалы и методы
Произведен ретроспективный анализ 108 историй болезни пациентов с сепсисом. Исследованы клинические данные и показатели гомеостаза, входящие в интегральные шкалы тяжести (SOFA и SAPS II), процент лимфоцитов, уровень Pct, данные ТЭГ. Клинический диагноз сепсис выставлен в соответствие с Guidelines for Management of Severe Sepsis and Septic Shock (2012). Средний возраст пациентов - 50,5±15,5 (максимум -77, минимум -21год). Возрастная гистограмма поступивших пациентов выглядит следующим образом (Рисунок 1)
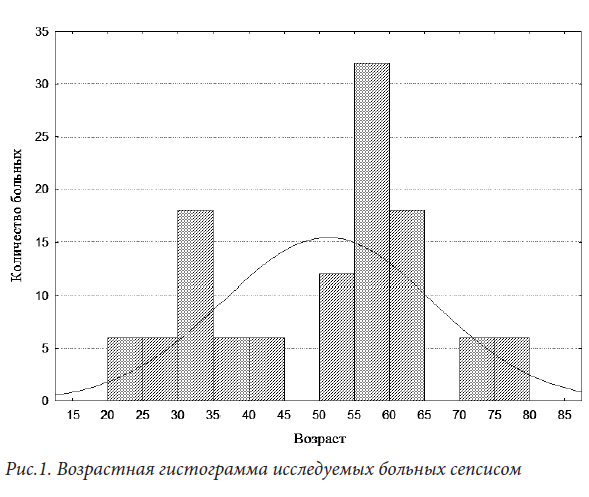
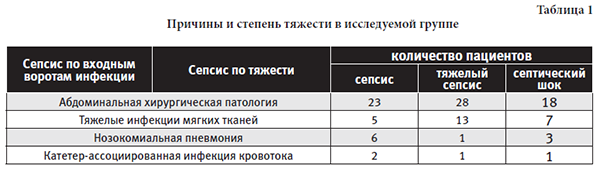
Мужчины составили 58% от всех поступивших пациентов. В состоянии септического шока находилось 29 пациентов (26,9%), тяжелого сепсиса 43 пациента (39,8%). Входными воротами сепсиса были: абдоминальная хирургическая патология, тяжелые инфекции мягких тканей, нозокомиальная пневмония, катетер-ассоциированная инфекция кровотока (таблица 1):
Больным проводился мониторинг гемодинамики, температуры тела, почасового диуреза. Лабораторные исследования включали: развернутый анализ крови (Sysmex КХ–21, Rochе), биохимический анализ крови (мочевина, креатинин, общий билирубин, Na+, K+, Cl-; Integra 400+, «Rochе»), показатели КЩС (paO2, cHCO3st; Cobas b 221, «Roche Diagnostics GmbH»), исследование уровня Pct (ECL, «Elecsys 2010») и тромбоэластографию (ТЭГ) (TEG® 5000, «Hemoscope»).
С помощью TEG исследованы показатели: R - время сначала пробы до момента образования первых нитей фибрина (9-27 мин.), характеризует энзиматическую часть коагуляционного каскада; К - время с момента начала образования сгустка до достижения фиксированного уровня прочности сгустка (2-9 мин.);. MA - определяет динамические свойства соединения фибрина и тромбоцитов посредством GPIIb/IIIa и отображает максимальную прочность сгустка. На 80% МА обусловлена количеством и свойствами (способностью к агрегации) тромбоцитов, на 20% - количеством образовавшегося фибрина; LY30 - изменение площади под кривой тромбоэластограммы в течение следующих за достижением МА 30 минут, по отношению к площади под кривой тромбоэластограммы без признаков лизиса (прямоугольник с высотой МА), выраженное в процентах . Представляет собой характеристику процесса растворения сгустка – лизиса. Коагуляционный индекс (CI) - является производным параметром от R, К, МА и угла (а), и характеризует коагуляционный потенциал крови пациента в целом.
Нормальные значения для коагуляционного индекса лежат в диапазоне между -3.0 и +3.0. Положительные значения вне этого диапазона (СI> +3.0) указывают, что образец находится в гиперкоагуляции, тогда как отрицательные значения вне этого диапазона (CI <-3.0) указывают, что образец в гипокоагуляции.
Данные мониторинга, результаты лабораторных данных фиксировали на момент поступления в ОРИТ, через 48 и 96 часов с момента поступления в ОРИТ.
Статистические исследования проводили для группы в целом и у выживших пациентов.
Последовательность исследований: получение данных описательной статистики, оценка распределения по критерию Колмогорова-Смирнова, определение достоверности разницы исследуемых признаков (критерий Wilcoxon, с уровнем достоверности p<0,05) в группах. С клинико-лабораторными признаками, имевшими достоверные различия в группах, проведен множественный регрессионный анализ, где зависимая переменная – исход заболевания в ОРИТ для всей исследуемой группы и койко/день в ОРИТ для группы выживших пациентов. Выявленные клинико-лабораторные признаки, оказывающие влияющие на исход в условиях ОРИТ, представлены в виде диаграмм Парето (режим quasi-Newton) [15]. Статистические исследования проведены с пакетом программ SPSS 13 (IBM SPSS, AMOS).
Результаты исследований
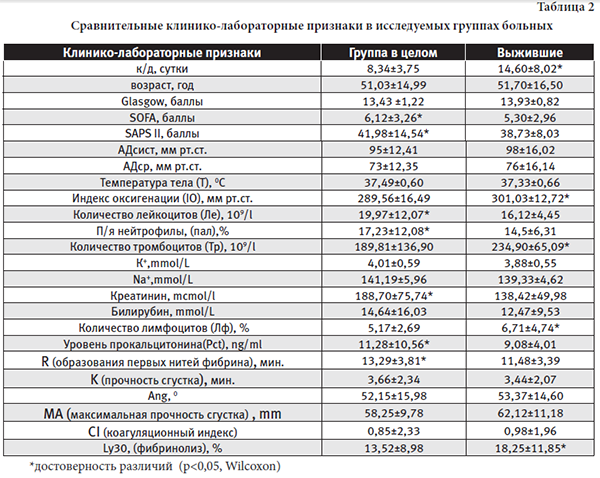
Сравнительные результаты клинико-лабораторные признаков в исследуемых группах представлены в таблице 2.
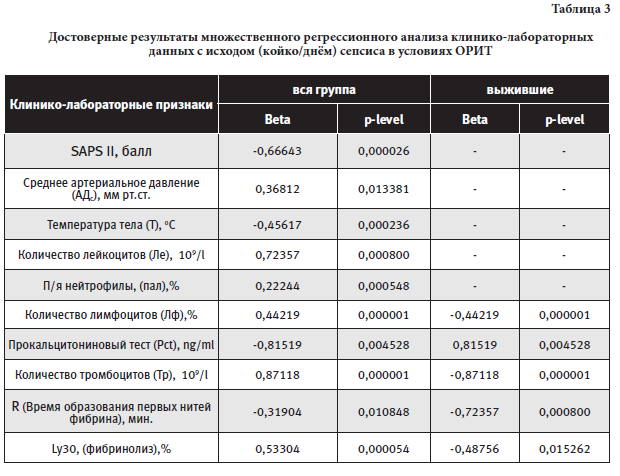
Относительная летальность в исследуемой группе составила 32,4%. Множественный регрессионный анализ позволил выделить достоверно связанные клинико-лабораторные признаки в группе выживших и всей группе пациентов (Таблица 3)
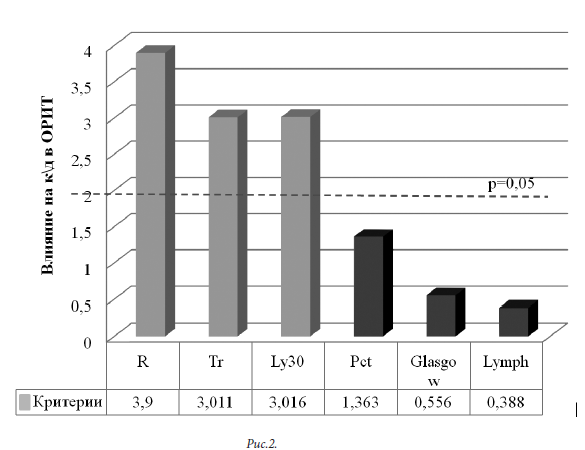
Значимость выявленных факторов в группе выживших пациентов представлена в регрессионной модели с построением диаграммы Парето «по причине» (рисунок 2).
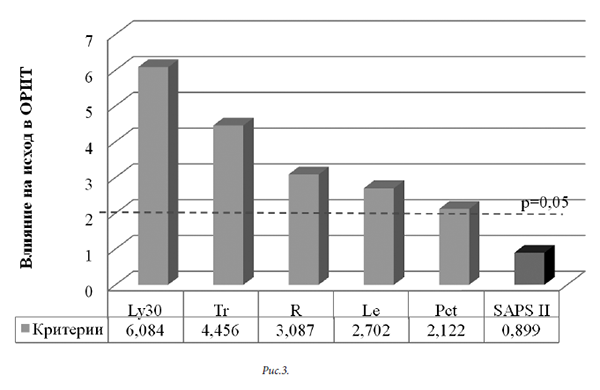
Аналогичный вариант исследования применен к общей группе пациентов (рисунок 3)
Обсуждение
Ранняя диагностика сепсиса имеет принципиально важное значения, позволяющее своевременно начать адекватное лечение, а, при необходимости, производить поиск источника инфекции. Для практикующего врача постоянно стоят вопросы:
- Какой клинический или лабораторный показатель при сепсисе следует считать ранним?
- В какой последовательности при сепсисе развиваются нарушения иммунитета, вегетативно-эндокринной регуляции и гемостаза?
- Есть ли прямая количественная зависимость между выраженностью системного воспалительного процесса и значениями лабораторных данных? Судя по критериям, входящим в оценочные шкалы тяжести, рост бальной оценки несет информацию о степени органной дисфункции и не определяется ранними признаками.
Качественные и количественные изменения в клеточном составе крови не всегда однозначны в связи с длительностью течения системного воспаления, сопутствующими альтернативными причинами иммунодефицита.
Наиболее распространенный биохимический маркер сепсиса – Pct может иметь ложно-отрицательные значения и не является абсолютно специфичным. Динамика уровня Pct в лечении и в совокупности с другими клинико-лабораторными критериями [16-17] имеет большую диагностическую ценность.
Особый интерес вызывает оценка показателей гемостаза на исход сепсиса (AT III, APTT, D-dimer, PT, TFPI, PAI-I, prot. C et S [18-26]). Ряд авторов отмечает, что использование показателей APTT (АПТВ) и PT (ПВ) не способно точно отразить баланс коагуляции и антикоагуляции, а определение АТ III, протеинов С и S, ингибиторов тканевого пути и фибринолиза (TFPI, PAI-1) практически недоступно для широкого клинического исследования [27].
Достаточно перспективным считают оценку гемостаза при сепсисе методом ТЭГ. Основные достоинства метода состоят в возможности оценить все звенья гемостаза за сравнительно короткий временной интервал. В зависимости от тяжести сепсиса методом ТЭГ выявляют гипер- и гипокоагуляционный профили [28, 29]. Последний является независимым фактором риска неблагоприятного исхода [30-33].
Выявление активации фибринолиза авторы определяют как специфический дифференциальный признак сепсиса, имеющий больший уровень чувствительности и специфичности (соответственно: 84%; 94%; [32, 34]), чем уровень Pct.
При собственном статистическом исследовании из общей группы больных (108 человека) выделена группа выживших пациентов (73 человека). Исходя из стандартного подхода к лечению пациентов, группа выживших пациентов соответствовала благоприятному течению сепсиса. Группа в целом имела различия с группой выживших больных в оценке первичного статуса по шкалам SOFA, SAPS II. Лабораторные различия касались величин IО, Pct, показателей общего анализа крови (Ле, П/я нейтрофилы, Лф, Тр), уровня креатинина и характера ТЭГ (R, Ly30).
Достоверно с величиной койко-дня у выживших пациентов были связаны: процент лимфоцитов (p=0,000001), уровень тромбоцитов (p=0,000001), Pct (p=0,004528) и показателей ТЭГ (R, Ly30; соответственно р=0,000800; 0,0152). Для исследуемой группы в целом факторов, влияющих на исход сепсиса в ОРИТ, значительно больше. Они определяют первичный статус пациента (SAPS II, p=0,000026), необходимость гемодинамической поддержки (p=0,013381), выраженность температурной реакции (p=0,000236), уровень лейкоцитоза и лимфоцитоза (соответственно p=0,000800; 0,000001). Показатели ТЭГ (R, Ly30; соответственно р=0,010848; 0,000054) также имеют достоверное влияние на летальность.
Построение регрессионной модели (логистическая регрессия) зависимых факторов на исход сепсиса позволило определить основную роль показателей гемостаза в обеих исследуемых группах.
В группе выживших – это гиперкоагуляционный профиль (R) с потреблением тромбоцитов (Tr) и активацией фибринолиза (Ly30; тромбинемия). Клинико-лабораторные показатели: оценка пациента по шкале Glasgow, уровень Pct и количество лимфоцитов – имеют важное вспомогательное значение.
Для исследуемой группы в целом активация фибринолиза (прогрессирующая тромбинемия) является ведущим предиктором. Она сопровождается потреблением тромбоцитов и переходом гиперкоагуляционного профиля в гипокоагуляционный. Дополнительными важными признаками прогрессирующего сепсиса являются уровень лейкоцитоза, Pct и оценка тяжести по шкале SAPS II.
Таким образом, уровень тромбинемии, включенный в оценочные шкалы по диагностике ДВСсиндрома (ISTH, [35-37]) следует рассматривать как важнейший достоверный предиктор сепсиса.
Выводы
- Показатели гемостаза являются достоверными предикторами сепсиса. Они характеризуют признаки нарастающей тромбинемии.
- Переход от гиперкоагуляционного профиля к гипокоагуляционному по ТЭГ определяет неблагоприятный прогноз сепсиса.
- Метод тромбоэластографии является оптимальным скрининг-методом для выявления особенностей нарушений гемостаза при сепсисе, позволяющий интегрально оценить коагуляционное, тромбоцитарное звенья гемостаза и активность фибринолиза.
- Дополнительными достоверными лабораторными признаками неблагоприятного течения сепсиса являются уровень лейкоцитоза, прокальцитонина, лимфоцитоза.
Литература
-
Rangel-Frausto MS., RP. Wenzel. The epidemiology and natural history of bacterial Sepsis // В книге: Sepsis and multiorgan failure. Ed 1997; 27-34.
- C Pierrakos, JL Vincent Sepsis biomarkers: a review The electronic version of this article is the complete one and can be found online at: http://ccforum.com/content/14/1/R15
- Society of Critical Care Medicine, European Society of Intensive Care Medicine 2013. www.survivingsepsis.org // Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock, 2012
- Lever A, Mackenzie I: Sepsis: definition, epidemiology, and diagnosis. BMJ 2007, 335:879-883.
- Kumar A, Roberts D, Wood KE, Light B, Parrillo JE, Sharma S, Suppes R, Feinstein D, Zanotti S, Taiberg L, Gurka D, Kumar A, Cheang M: Duration of hypotension before initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 2006, 34:1589-1596.
- Zambon M, Ceola M, Almeida-de-Castro R, Gullo A, Vincent JL: Implementation of the Surviving Sepsis Campaign guidelines for severe sepsis and septic shock: we could go faster. J Crit Care 2008, 23:455-460.
- PE Marik: Don’t miss the diagnosis of sepsis! Critical Care 2014 18:529.
- Biomarkers Definitions Working Group: Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther 2001, 69:89-95
- Marshall JC, Reinhart K: Biomarkers of sepsis. Crit Care Med 2009, 37:2290-2298.
- Tang BM, Eslick GD, Craig JC, McLean AS: Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis.
Lancet Infect Dis 2007, 7:210-217.
- Wacker C, Prkno A, Brunkhorst FM, Schlattmann P: Procalcitonin as adiagnostic marker for sepsis: a systematic review and meta-analysis. Lancet Infect Dis 2013, 13:426–435.
- Tromp M, Lansdorp B, Bleeker-Rovers CP, Gunnewiek JM, Kullberg BJ,Pickkers P: Serial and panel analyses of biomarkers do not improve the prediction of bacteremia compared to one procalcitonin measurement. J Infect 2012, 65:292–301
- Su CP, Chen TH, Chen SY, Ghiang WC, Wu GH, Sun HY, Lee CC, Wang JL, Chang SC, Chen YC, Yen AM, Chen WJ, Hsueh PR: Predictive model for bacteremia in adult patients with blood cultures performed at the emergency department: a preliminary report. J Microbiol Immunol Infect 2011, 44:449–455.
- Cavallazzi R, Bennin CL, Hirani A, Gilbert C, Marik PE: Is the band count useful in the diagnosis of infection? An accuracy study in critically ill patients.
J Intensive Care Med 2010, 25:353–357.
- В.А. Маренко Информационно-синергетический подход к анализу медицинских данных; Медицинская информатика; 2009. №2(20), с.33-38
- S Karlsson,M Heikkinen Predictive value of procalcitonin decrease in patients with severe sepsis: a prospective observational study Critical Care 2010, 14:R205 doi:10.1186/cc9327
- Nobre V, Harbarth S, Graf JD, Rohner P, Pugin J: Use of procalcitonin to shorten antibiotic treatment duration in septic patients: a randomized trial. Am J Respir Crit Care Med 2008, 177:498-505.
- Pettila V, Pentti J, Pettila M, Takkunen O, Jousela I: Predictive value of antithrombin III and serum C-reactive protein concentration in critically ill patients with suspected sepsis. Crit Care Med 2002, 30:271-275.
- Zakariah AN, Cozzi SM, Van Nuffelen M, Clausi CM, Pradier O, Vincent JL: Combination of biphasic transmittance waveform with blood procalcitonin levels for diagnosis of sepsis in acutely ill patients. Crit Care Med 2008, 36:1507-1512.
- Kinasewitz GT, Yan SB, Basson B, Comp P, Russell JA, Cariou A, Um SL, Utterback B, Laterre PF, Dhainaut JF: Universal changes in biomarkers of coagulation and inflammation occur in patients with severe sepsis, regardless of causative micro-organism [ISRCTN74215569]. Crit Care 2004, 8:R82-R90.
- Madoiwa S, Nunomiya S, Ono T, Shintani Y, Ohmori T, Mimuro J, Sakata Y: Plasminogen activator inhibitor 1 promotes a poor prognosis in sepsisinduced isseminated intravascular coagulation. Int J Hematol 2006, 84:398-405.
- Pralong G, Calandra T, Glauser MP, Schellekens J, Verhoef J, Bachmann F, Kruithof EK: Plasminogen activator inhibitor 1: a new prognostic marker in septic shock. Thromb Haemost 1989, 61:459-462.
- Fisher CJ Jr, Yan SB: Protein C levels as a prognostic indicator of outcome in sepsis and related diseases. Crit Care Med 2000, 28:S49-S56.
- Heuer JG, Sharma GR, Gerlitz B, Zhang T, Bailey DL, Ding C, Berg DT, Perkins D, Stephens EJ, Holmes KC, Grubbs RL, Fynboe KA, Chen YF, Grinnell B, Jakubowski JA: Evaluation of protein C and other biomarkers as predictors of mortality in a rat cecal ligation and puncture model of sepsis. Crit Care Med 2004, 32:1570-1578.
- Lin SM, Wang YM, Lin HC, Lee KY, Huang CD, Liu CY, Wang CH, Kuo HP: Serum thrombomodulin level relates to the clinical course of disseminated intravascular coagulation, multiorgan dysfunction syndrome, and mortality in patients with sepsis. Crit Care Med 2008, 36:683-689.
- Drake TA, Cheng J, Chang A, Taylor FB Jr: Expression of tissue factor, thrombomodulin, and E-selectin in baboons with lethal Escherichia coli sepsis. Am J Pathol 1993, 142:1458-1470.
- Levi M, Meijers JC: DIC: which laboratory tests are most useful. Blood Rev 2011, 25:33–37.
- Raineri SM, Cangemi L, Cortegiani A, Cascio ND, Mineo G, Evangelico G, Giarratano A: Fibrinolysis system, monitored by thromboelastography (TEG) and PAI-1 activity, in septic patients undergoing tight glycemic control [abstract]. Intensive Care Med 2009, Conference:S162.
- Collins PW, Macchiavello LI, Lewis SJ, Macartney NJ, Saayman AG, Luddington R, Baglin T, Findlay GP: Global tests of haemostasis in critically ill patients with severe sepsis syndrome compared to controls. Br J Haematol 2006, 135:220–227.
- Ostrowski SR, Windelov NA, Ibsen M, Haase N, Perner A, Johansson PI: Consecutive thrombelastography clot strength profiles in patients with severe sepsis and their association with 28-day mortality: a prospective study. J Crit Care 2013, 28:317.
- Chiairi F, Ickx B, Barvais L, Vincent J-L, Piagnerelli M: Does activated protein C influence the coagulation system assessed by the rotative thromboelastometry analysis [abstract]. Intensive Care Med 2009, Conference:S162.
- Adamzik M, Eggmann M, Frey UH, Gorlinger K, Brocker-Preuss M, Marggraf G, Saner F, Eggebrecht H, Peters J, Hartmann M: Comparison of thromboelastometry with procalcitonin, interleukin 6, and C-reactive protein as diagnostic tests for severe sepsis in critically ill adults. Crit Care 2010, 14:R178.
- Durila M, Bronsky J, Harustiak T, Pazdro A, Pechova M, Cvachovec K: Early
- diagnostic markers of sepsis after oesophagectomy (including thromboelastography). BMC Anesthesiol 2012, 12:12.
- Brenner T, Schmidt K, Delang M, Mehrabi A, Bruckner T, Lichtenstern C, Martin E, Weigand MA, Hofer S: Viscoelastic and aggregometric point-ofcare testing in patients with septic shock - cross-links between inflammation and haemostasis. Acta Anaesthesiol Scand 2012, 56:1277–1290.
- Massion PB, Peters P, Ledoux D, Zimermann V, Canivet JL, Massion PP, Damas P, Gothot A: Persistent hypocoagulability in patients with septic shock predicts greater hospital mortality: impact of impaired thrombin generation. Intensive Care Med 2012, 38:1326–1335.
- Umgelter A, Msmer G, Schmid RM, Kreymann B: Thromboelastography and platelet function assay in cirrhosis and sepsis [abstract]. Intensive Care Med 2009, Conference:S160.
- S Gando, D Saitoh A multicenter, prospective validation study of the Japanese Association for Acute Medicine disseminated intravascular coagulation scoring system in patients with severe sepsis Critical Care 2013, 17:R111 doi:10.1186/cc12783
|






