"Тольяттинский медицинский консилиум" 2017г. № 3-4
Клинико-лабораторные данные в прогнозе лечения больных с отёком мозга. что лечить: отёк мозга или ОЦН?
Ю.Л. Кецко1,2, О.А. Гусякова3,4, Д.П. Кубриков2, А.В. Лунина1,2, Ю.Г. Кутырева1
1 Кафедра анестезиологии, реаниматологии и скорой медицинской помощи ИПО, Самара
2 Отделение реанимации и интенсивной терапии Клиник СамГМУ, Клиники ФГБОУ ВО СамГМУ МЗ России, Самара
3 Центральная клинико-диагностическая лаборатория Клиник СамГМУ, Клиники ФГБОУ ВО СамГМУ МЗ России, Самара
4 Кафедра фундаментальной и клинической биохимии с лабораторной диагностикой ФГБОУВО СамГМУ МЗ России, Самара
Significance of clinical laboratory data forecast of treatment of patient with cerebral edema. what to treat: brain edema or aci?
J.L. Ketsko, O.A. Gusiakova, D.P. Kubrikov, A.V. Lunina, U.G. Kutyreva
Резюме
Цель. Изучить клинические и лабораторные признаки, имеющие прогностическую связь с исходом отека мозга разного генеза у больных в ОРИТи определить наиболее точную терминологию: лечение отёка мозга либо синдрома острой церебральной недостаточности.
Материалы и методы. Проведено динамическое пассивное проспективное исследование 270 пациентов, поступивших в ОРИТ с подтвержденным диагнозом «отек мозга». Стратификационная рандомизация пациентов проводилась по возрасту,причинным факторам,запланированному периоду исследования. Статистический анализ проведен по результатам клинико-лабораторных данных, полученныхна момент поступления и через 48 часов пребывания пациента в ОРИТ. Изучаемыми переменными были: пол, возраст пациентов, оценка по шкалам тяжести Glasgow, SOFA, показатели общего анализа крови, биохимические данные крови и ликвора, уровень белков острой фазы воспаления, показатели коагуляционнного гемостаза и ТЭГ. Логистический регрессионный анализ (ROC-анализ) проведен для каждой подгруппы с зависимой переменной – «исход в ОРИТ» с помощью пакета программ SPSS 13 (IBM SPSS AMOS).
Результат. Основным клиническим предиктором исхода в ОРИТ у пациентов с отёком мозга является степень тяжести пациента при поступлении. Достоверными лабораторными предикторами исхода в ОРИТу пациентов с разными механизмами отёка мозга являются: уровень мочевины ликвора, показатели осмотического градиента натрия и мочевины в крови и ликворе, уровень оксигенации и адекватность ИВЛ, выраженность расстройств гемостаза.
Выводы. Для разных причинных факторов формирования отёка мозга выявлены разные группы клинико-лабораторных предикторов, влияющих на исход заболевания. Лечение разных форм отёка мозга оптимально производить с позиций синдромальной терапии ОЦН.
Ключевые слова: отек мозга, формы отека мозга, отделение реанимации и интенсивной терапии, предикторы летальности клинические, лабораторные, синдром церебральной недостаточности
Сокращения
АТIII - антитромбин-3;
ВЧГ - внутричерепная гипертензия;
ВЧД - внутричерепное давление;
ЗПТ - заместительная почечная терапия;
ИВЛ - искусственная вентиляция легких;
КРС - кардио-ренальный синдром;
КТ - компьютерная томография;
КФК - креатинфосфокиназа, Ед/л;
ЛДГ - лактатдегидрогеназа, Ед/л;
ОНМ - отек и набухание мозга;
ОРДСВ - острый респираторный дистресс-синдром;
ОРИТ - отделение реанимации и интенсивной терапии;
ПЗПТ - продленная заместительная почечная терапия;
ХБП - хроническая болезнь почек;
ОПП - острое повреждение почек;
ОЦН - острая церебральная недостаточность;
ПТИ - протромбиновый индекс, %;
СВО - системный воспалительный ответ;
ЦНС - центральная нервная система;
ЦСЖ - цереброспинальная жидкость;
КЩС - кислотно-щелочное состояние;
Beecf - избыток (дефицит) оснований во внеклеточной жидкости, ммоль/л;
Cl- - хлор, ммоль/л;
Creat - уровень креатинина плазмы крови, мкмоль/л;
Creat_L - уровень креатинина в ликворе;
CRP - С-реактивный белок, мг/л;
Glasgow - количественная шкала оценки комы Глазго (TheGlasgowComaScale, GCS);
K+ - калий плазмы крови, ммоль/л;
Lac_L - уровень лактата в ликворе, ммоль/л;
LY30 - показатель ТЭГ, представляет собой характеристику процесса растворения сгустка в течение 30 мин., %;
MA - показатель ТЭГ, определяет динамические свойства соединения фибрина и тромбоцитов,%;
Na+ - уровень Na+ в плазме крови, ммоль/л;
Na_L - уровень Na+в ликворе, ммоль/л;
PO2/FiO2 - отношение парциального давления кислорода в артериальной крови к концентрации вдыхаемого кислорода, мм рт.ст.;
pаO2 - парциальное давление кислорода в артериальной крови, мм рт.ст.;
pаCO2 - парциальное давление углекислого газа в артериальной крови, мм рт.ст.;
PLT - содержание тромбоцитов в крови, ×109/л;
SOFA - шкала оценки тяжести пациента (Sepsis-related Organ Failure);
Urea - уровень мочевины в плазме крови, ммоль/л;
Urea_L - уровень мочевины в ликворе, ммоль/л РСТ прокальцитониновый тест, нг/мл ;
Введение
Острая церебральная недостаточность – один из наиболее распространенных реанимационных синдромов [1-2]. В основе его лежат механизмы развития ОНМ. Среди них важная роль принадлежит гемодинамическим, нейроэндокринным, циркуляторным факторам, тканевым изменениям, состоянию гемостаза, а также повышению проницаемости сосудистых стенок.
Будучи неспецифической и, в принципе, обратимой реакцией на разнообразные воздействия, выраженность ОНМ зависит не только от этиологического фактора, но и от индивидуальной реактивности ЦНС, степени запущенности (тяжести) патологического процесса [3]. С учётом однотипности клинической картины ОНМ и, в зависимости от нозологий, особый интерес представляет выявление клинико-лабораторных данных, имеющих тесную взаимосвязь с исходом пациента в условиях ОРИТ.
Цель. Изучить клинические и лабораторные признаки, имеющие корреляционную взаимосвязь с исходом ОНМ разного генеза у больных ОРИТ. Определить правильность выбора терминологии: лечение ОНМ или лечение острой церебральной недостаточности.
Материалы и методы. Проводилось лечение и динамический мониторинг 270 пациентов с подтвержденными клинико-лабораторными признаками ОНМ (неврологический статус, осмотр глазного дна, КТ головного мозга, люмбальная пункция). Стратификация пациентов проводилась по возрасту (от 25 до 75 лет) и по запланированному сроку исследования (с октября 2014 по октябрь 2016 года).
Исследование клинико-лабораторных показателей проведенона момент поступления и через 48 часов пребывания в ОРИТ (средний временной период развития ОНМ). Исследуемые показатели разделены на следующие группы (таблица 1):
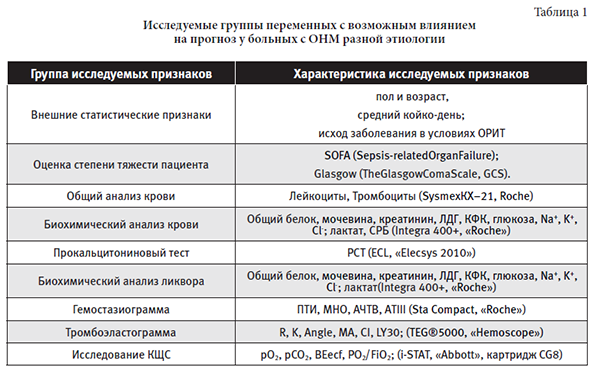
Дизайн исследования:
Проведен анализ показателей описательной статистики для всей группы. Для дальнейшего статистического исследования пациенты разделены на 4 подгруппы в соответствие с причиной развития ОНМ:
Первичные мозговые причины:
1 подгруппа. Цереброваскулярные причины: ишемический (48 пациентов), геморрагический инсульт (7 пациентов);
2 подгруппа. Инфекционные причины: гнойный менингит (98 пациентов), менингоэнцефалит (22 пациента);
Вторичные мозговые причины:
3 подгруппа. Сепсис: внегоспитальная пневмония (8 пациентов), абдоминальная хирургическая патология (41 пациент), тяжелые инфекции мягких тканей (3 пациента);
4 подгруппа. Уремия: терминальная ХБП (14 пациентов), сочетание ОПП и ХБП (26 пациентов), КРС (II, IV, V типы, (3 пациента)).
Методом множественного регрессионного анализа для каждой подгруппы пациентов определены переменные, имеющие достоверную корреляционную связь с исходом в условиях ОРИТ. Последующий логистический анализ (ROC-анализ) с найденными переменными определил качество модели, их взаимосвязи по определению площади под ROC-кривой (AUC)[4]. Статистические исследования проведены с пакетом программ SPSS 13 (IBM SPSS AMOS).
Результаты исследования
Для группы в целомсредний возраст пациентов был 58,97 ± 13,48 лет, мужчин -67,04%, оценка пациентов составила по шкалам: SOFA - 10,018 ±3,015 баллов, Glasgow- 8,018 ±1,87 баллов. Средний койко-день в ОРИТ составил 13,08 ± 6,38 суток, относительная летальность – 39,26%.
Общая характеристика пациентов исследуемой группы представлена в таблице 2.
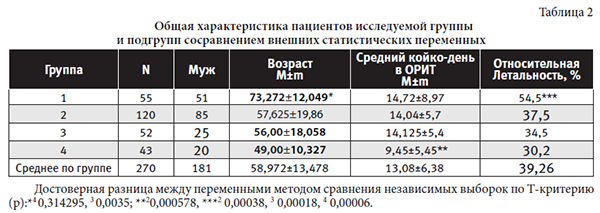
Отмечена четкая возрастная разница у пациентов 1-ой подгруппы в сравнении с 3-ей и 4-ой группами. Летальность у пациентов 1-ой подгруппы достоверно выше. Минимальный койко-день в ОРИТ у пациентов 4 подгруппы. Степень тяжести у пациентов исследуемой группы и подгрупп по шкалам тяжести SOFA, Glasgow представлена в таблице 3.
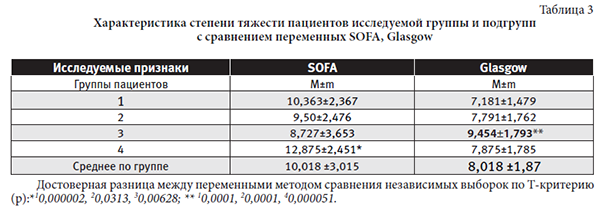
Наиболее тяжелыми в соответствие со шкалами SOFA, Glasgow были пациенты 4 и 3 подгрупп. Результаты логистического анализа (ROC-анализа), имеющие высокое качество взаимосвязи для каждой из подгрупп представлены в табличном варианте (таблицы4-7).
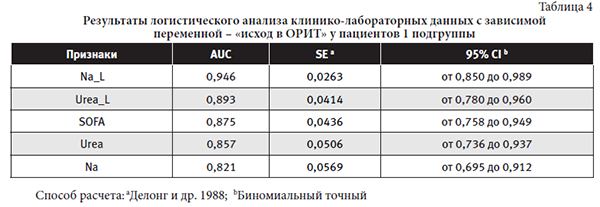
Средние показатели признаковс тесной взаимосвязью с переменной «исход в ОРИТ» у пациентов 1 подгруппы: Na_L 151,63±15,73 ммоль/л (139,0-192,4), Urea-L 11,96±6,214 ммоль/л (4,30-27,70), SOFA 10,36±2,37 балла (5,00-13,00), Urea 13,29 ±7,197 ммоль/л (4,80-28,00), Na 151,082±15,826 ммоль/л (134,00-194,60).
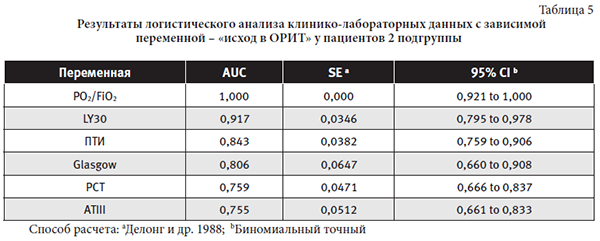
Средние показатели признаков с тесной взаимосвязью с переменной «исход в ОРИТ» у пациентов 2 подгруппы: PO2/FiO2 25,33±93,42 мм рт.ст. (117,00-466,00), LY 30 3,056±5,68% (0,00-17,60), ПТИ 63,257±26,94% (13,80-98,00), Glasgow 7,79±1,76 баллов (4,00-11,00), РСТ 6,24±10,74 нг/мл (0,018-36,40), АТIII 78,62±24,14% (52,00-136,00).
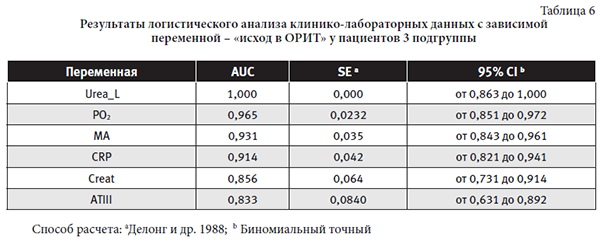
Средние показатели признаков с тесной взаимосвязью с переменной «исход в ОРИТ» у пациентов 3 подгруппы: Urea_L 18,21±13,29 ммоль/л (3,80-49,80), PO2 89,27±11,81 мм рт.ст. (73,00-114,00), MA 65,22±11,48% (48,90-77,50), CRP 94,08±68,8 мг/л (6,56-207,85), Creat 118,14±93,03 ммоль/л (33,80-355,60), ATIII 70,6±30,19% (26,00-124,00).
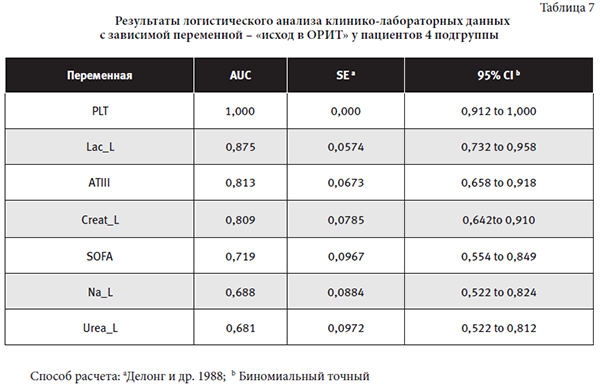
Средние показатели признаков с тесной взаимосвязью с переменной «исход в ОРИТ» у пациентов 4 подгруппы: PLT 122,63±55,65×109/л (50,0-219,00), Lac_L 2,43±0,58 ммоль/л (1,44-3,65), АТIII 84,87±24,27% (48,00-122,00), SOFA 12,87±2,45 баллов (7,00-15,00), Na_L138,36±46,35 ммоль/л (133,80-147,70), Urea_L 28,66±13,76 ммоль/л (8,55-56,9).
Обсуждение
В историческом плане попытки определить лабораторные данные с целью выявления универсальных алгоритмов лечения отёка мозга, не имели результатов. Тем не менее стало ясно, что механизмы возникновения ОНМ отличны от механизмов возникновения отека в других тканях, а также нет прямой зависимости между клинической картиной повышения ВЧД и морфологическими данными состояния мозговой ткани [5-7]. В дальнейшем, по механизму формирования ОНМ выделены: вазогенный, цитотоксический, осмотический и интерстициальный ОНМ, изучены патофизиологические механизмы их развития [8-18].
По результатам нашего исследования пациенты с цереброваскулярными причинами ОНМ (1 подгруппа) представляют достоверно высоковозрастную группу с относительно высокой летальностью. Состояние больных данной группы, как правило, отягощено сопутствующими заболеваниями сердца, почек, сахарным диабетом. Наиболее «молодая» 4 подгруппа пациентов имеет наиболее благоприятный исход в связи с особенностью основного патогенеза: гидростатический механизм с абсолютной гиперволемией, электролитными расстройствами с возможностью проведения заместительной почечной терапии.
Проведенный анализ факторов, связанных с исходом в условиях ОРИТ по группам пациентов позволил сделать следующие выводы:
Для пациентов 1 подгруппы с цереброваскулярными причинами ОНМ наиболее значимыми предикторами исхода являются: показатели осмотического градиента Na, Urea между ликвором и плазмой, исходная степень тяжести пациента. Пациенты этой подгруппы требуют тщательного отношения к выбору инфузионной терапии в связи с высоким риском усугубления ОНМ.
Значимыми предикторами исхода у пациентов 2 подгруппы являются: стадия ОРДСВ (PO2/FiO2), выраженность расстройств гемостаза (LY30, ПТИ,АТIII) и СВО (PCT), степень угнетения сознания при поступлении в ОРИТ (оценка пациента по шкале Glasgow).
Своевременность перевода пациента на ИВЛ, подбор протективного режима вентиляции, коррекции ДВС-синдрома, ранняя целенаправленная антибактериальная терапия – являются наиболее значимыми направлениями лечения.
Неожиданным в степени значимости предикторов «исхода в ОРИТ» для пациентов 3 подгруппы является уровень азотистых шлаков. Причем, значимость мочевины ликвора выше креатинина плазмы крови (Urea_L, Creat). Это должно настораживать врача в отношении своевременности начала заместительной почечной терапии. Степень выраженности оксигенации (PO2), ДВС-синдрома (МА, АТIII) имеют так же высокую прогностическую ценность. По результатам исследования наибольшее значение в оценке системного воспалительного ответа имеет уровень CRP.
Уровень азотистых шлаков для пациентов 4 подгруппы является наиболее важным предиктором исхода. Обыденность этого вывода имеет необычное лабораторное проявление: уровень лактата, креатинина, натрия и мочевины (Lac_L, Creat_L, Na_L, Urea_L) наиболее значимо в ликворе. Это требует лабораторного скрининга перед ЗПТ. Метод ПЗПТ, тщательно спланированный по скорости кровотока, объему эффлюента, профилированию Nа+, антикоагуляции- является методом выбора. Нарушение коагуляционного и тромбоцитарно-сосудистого гемостаза (PLT, АТIII) подтверждают гепарин- индуцированную тромбоцитопению и истощение антикоагуляционного резерва с риском геморрагических и тромботических осложнений. Как и в предыдущих подгруппах на исход влияет исходная степень тяжести пациента (SOFA).
Современные стандарты лечения ОНМ разной этиологии предусматривают базовую и экстренную терапию ВЧГ. Базовая (профилактическая) терапия направлена на устранение факторов, повышающих ВЧД. Это - коррекция положения головного конца пациента [19, 20], достаточная медикаментозная седация и предупреждение судорожного синдрома [19, 21], адекватная легочная вентиляция (оксигенация, нормокапния, с использованием минимального и достаточного PEEP, [22, 23 24]), предупреждение синдрома абдоминального компартмента [25, 26], коррекция гипертермии [27, 28], поддержание церебрального перфузионного давления [21, 29]. При неэффективности профилактических мер для коррекции ВЧД, превышающее 20 мм рт.ст. используют «пошаговый» алгоритм его снижение [27]. Он включает: КТ головного мозга для исключения причин ВЧГ, требующих хирургической коррекции, обеспечение контролируемого сброса ЦСЖ, обеспечение временной гипервентиляции, использование гиперосмолярных растворов, медикаментозной комы, искусственной гипотермии [27, 19, 30, 26, 31, 32 , 33].
Таким образом, исход ОНМ определяет раннее своевременное начало лечения в соответствие со стандартами по предполагаемой нозологии. Специализированный этап выполнения стандарта имеет диагностическую и лечебную цель, с коррекцией лечения по уточненному диагнозу, в соответствие с его тяжестью.
Разные клинико-лабораторные предикторы исхода ОНМ, смена или сочетание патофизиологических механизмов в динамике первичной нозологии предполагает комплексную направленность лечения ВЧГ и ОНМ. В связи с чем, мы лишь подтверждаем необходимость синдромального подхода в лечении ОЦН, где важнейшим патогенетическим звеном является ВЧГ[34, 35]. Он имеет специфический комплекс нейропатологических процессов, единый протокол ведения пациентов, включая скорую помощь, диагностические службы, нейрохирургические, анестезиологические и реанимационные отделения.
Выводы
- Основным клиническим предиктором исхода ОНМ у пациентов в ОРИТ является тяжесть пациента при поступлении.
- Лабораторные предикторы исхода ОНМ зависят от причин его развития.
- С точки зрения терминологии лечение синдрома ОЦНу больных с ВЧГ и ОНМ с позиций этапности, многонаправленности лечения и специфики работы ОРИТ является наиболее правильным.
Литература
-
Левит А.Л. Оптимизация работы реанимационно-анестезиологической службы Свердловской области в XXI веке. Проблемы решенные и нерешенные (часть 2); Журнал Интенсивная терапия 2005, №3, С.14-18.
- Левит А.Л., Руднов В.А., Белкин А.А. и др. Применение стандартов в практике интенсивной терапии. Сибирский Консилиум. 2004;
№5.- С. 63-65.
- Венгеров Ю.Я., Нагибина М.В., Волкова О.Е. и др. Отек и набухание головного мозга при нейроинфекциях. - Эпидемиология и инфекционные болезни. 2015. Т. 20. № 3. С. 17-22.
- BaseGroup Labs [http://www.basegroup.ru/library/analysis/regression/logistic]
- Местечкина А.Я. Биохимическая характеристика отека-набухания головного мозга / Автореферат диссертации на соискание ученой степени доктора биологических наук; КИЕВ — 1964, с 27
- Квитницкий-Рыжов Ю. Н., Литвиненко Л. Т., Местечкина, А. Я. И др. Взаимоотношение местных и общих патологических реакций при медленно нарастающем повышении внутричерепного давления// О закономерностях соотношений общемозговых и очаговых симптомов при опухолях головного мозга. (Тез. доп.). Киев, 1957.
КЛИНИЧЕСКАЯ И ТЕОРЕТИЧЕСКАЯ МЕДИЦИНА 37
- Зозуля Ю.А., Духин А.Л., Сергиенко Т.М. [и др.]. Методические рекомендации по коррекции внутричерепного давления — Киев:
МЗ УССР, 1984. — 32 с.
- Marmarou A. A review of progress in understanding the pathophysiology and treatment of brain edema // Neurosurg. Focus. – 2007. – Vol. 22,N 5. – E 1.
- Marmarou A. The pathophysiology of brain edema and elevate dintracranial pressure. Cleve Clin J Med.-2004, Vol.71 Suppl 1: S6-8.
- Maset A.L. Pressure-volume index in head injury // J. Neurosurg. –1987. – Vol. 67. – P. 832–840.
- Mc Manus ML, Churchwell KB,Strange K, Regulation of Cell Volume in Health and Disease N Engl J Med 1995 No19; V 333: 1260-1266
- Powner DJ, Boccalandro C, Alp MS, Vollmer DG. Endocrine failure aftertraumatic brain injury in adults. Neurocrit Care. 2006;5(1):61-70.
- Kiphuth IC, Schellinger PD, Kohrmann M, Bardutzky J, Lucking H, Kloska S,Schwab S, Huttner HB: Predictors for good functional outcome afterneurocritical care. Crit Care 2010, 14:R136.
- Earle SA, Proctor KG, Patel MB, Majetschak M: Ubiquitin reduces fluid shiftsafter traumatic brain injury. Surgery 2005, 138:431-438.
- Donkin J, Vink R Mechanisms of cerebral edema in traumatic brain injury: therapeutic developments. Current opinion in neurology.
(2010) 23:293-299.
- Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A. Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review. JAMA. 2007 Sep 26;298(12):рр 28-39.
- Timbonnier M: Antidiuretic hormone: regulation, disorders, and clinicalevaluation. In neuroendocrinology, Barrow DL and Selman W, (eds.) Concepts inneurosurgery. Williams and Wilkins, Baltimore, 1992, Vol.5:pp 19-30.
- Zygun DA. Sodium and brain injury: do we know what we are doing? Crit Care.2009; 13(5): 184. doi: 10.1186/cc8014. Epub 2009 Sep 3.
- Rangel-Castillo L., Gopinath S., Robertson C. Management of Intracranial Hypertension // Neurologic Clinics. – Vol. 26, N 2. – Р. 521–541.
- Feldman Z. Kanter M.J., Robertson C.S., et al. Effect of head elevation onintracranial pressure, cerebral perfusion pressure, and cerebral bloodflow in head-injured patients // J. Neurosurg. – 1992. – Vol. 76. – Р. 207–211
- Bratton S.L., Bullock R., Carney N., et. al. Guidelines for the managementof severe traumatic brain injury // J. Neurotrauma. – 2007. – Vol. 24. –Suppl. 1. – P. 1–106.
- Miller J.D., Becker D.P. Secondary insults to the injured brain // J. R. Coll.Surg. Edinb. – 1982. – Vol. 27. – Р. 292–298.
- Pinsky M.R. Cerebral Blood Flow: Mechanisms of Ischemia, Diagnosisand Therapy // Berlin: Springer-Verlag. – 2002. – 308 p.
- Oliveira-AbreulМ.,Lajana de Almeida М. Management of mechanicalventilation in brain injury: hyperventilation and positive endexpiratorypressure // Rev. Bras. Ter. Intensiva. – 2009. – Vol. 21, N 1. – Р. 72–79.
- Deeren D. H., Dits H., Malbrain M. Correlation between intra-abdominaland intracranial pressure in nontraumatic brain injury // Intensive CareMed. – 2005. – Vol. 31. – Р. 1577–1581.
- Гельфанд Б.Р., Проценко Д.Н., Подачин П.В. и соавт. Синдром абдоминальной гипертензии: состояние проблемы // Медицинскийалфавит. Неотложная медицина. – 2010. – № 3. – С. 34–42.
- Mayer S.A., Chong J.Y. Critical care management of increased intracranial pressure // Intensive Care Med. – 2002. – Vol. 17. – Р. 55–67.
- Rangel-Castillo L., Gopinath S., Robertson C. Management of Intracranial Hypertension // Neurologic Clinics. – Vol. 26, N 2. – Р. 521–541.
- Lee К., LukovitsТ, Friedman J. “Triple-H” Therapy for Cerebral Vasospasm Following Subarachnoid Hemorrhage // Neurocrit. Care. –2006.
N 4. – Р. 68–76.
- Башкиров М.В., Шахнович А.Р., Лубнин А.Ю. Внутричерепное давление и внутричерепная гипертензия // Рос.журн. анестезиол.
иинтенсив. тер. – 1999. – № 1. – С. 4–11.
- PoldermanК. Application of therapeutic hypothermia in the intensivecare unit // Intensive Care Med. – 2004. – Vol. 30. – P. 757–769.
- Лебедев В.В. Неотложная нейрохирургия: Руководство для врачей / В.В. Лебедев, В.В. Крылов. – М.: Медицина, 2000. – 567 с.
- Hutchinson P., Timofeev I., Kirkpatrick P. Surgery for brain edema //Neurosurg. Focus. – 2007. – Vol. 22, N 5. – Р. 14.
- Marshall J., Aarts M. From Celsus to Galen to Bone: the illnesses, syndromes, and diseases of acute inflammation. Yearbook of Intensive Care and Emergency Medicine, 2001: 3-12.
- Белкин А.А. Патогенетическое понимание системы церебральной защиты при внутричерепной гипертензии и пути ее клинической реализации у больных с острой церебральной недостаточностью // Журн. интенсивная терапия. — 2005. — № 1. — С. 9–13.
|







