Опиоид-индуцированная гипералгезия – патофизиология и клиническая значимость
Содержание
2.1. Модуляция мембранного потенциала
2.2. Деактивация аденилатциклазы
2.3. Направленная миграция рецептора
3.1. Рецептор-десенсибилизация
3.2. Активация аденилат циклазы
3.3. Активация NMDA -рецептора
3.4. Высвобождение пептидов со свойствами антагониста к опиоидам (анти-опиоиды)
4. Экспериментальное исследование опиоид-индуцированной гипералгезии
5.1. Антагонисты NMDA -рецептора
5.3. Ингибиторы ЦОГ и парацетамол
Тканевое повреждение во время операции вызывает активацию ноцицептивных систем . Высокопороговые механо-, термо- и хемо-рецепторы, а также ноцицепторы ( латынь: nocere - повреждать) быстро передают информацию о месте и степени повреждения в центральную нервную систему. В зависимости от типа и распространенности повреждения процессы сенсибилизации, приводящие к повышенной болевой чувствительности, т.е., к гипералгезии, могут наблюдаться в периферической и центральной нервной системе (рисунок 1A ). В частности периферическая сенсибилизация может наблюдаться во время воспаления и при других патологических тканевых процессах. Эти патологические изменения могут сенсибилизировать ноцицепторы локально путем снижения порога их активации или сенсибилизируя вновь первично нечувствительные, так называемые «немые» ноцицепторы [1-6]. Центральная сенсибилизация характеризуется повышенной спонтанной активностью и распространением рецепторных полей нейронов дорсального рога [7-10]. Одним из ключевых моментов этого процесса является активация N -метил- D -аспартат ( NMDA -) рецепторов спинного мозга глутаматом [11-13]. Процессы центральной сенсибилизации, таким образом, могут не только инициировать, но также и поддерживать болевые состояния, которые продолжаются дольше пускового события. Кроме того, процессы сенсибилизации происходят, не зависимо от восприятия боли во время анестезии и часто являются основой для развития послеоперационной боли.
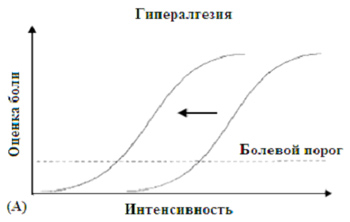 |
Рисунок 1. (A) Гипералгезия характеризуется смещением влево кривой раздражитель-боль, т.е., в норме неболевой раздражитель становится впоследствии вредным (=Аллодиния), в то время как обычно вызывающие боль раздражители повышают интенсивность боли. |
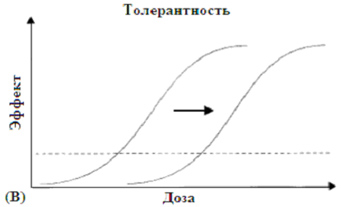 |
(B) Смещение вправо кривой доза-эффект может наблюдаться при развитии толерантности, т.е., препарат теряет свою эффективность. |
Несколько публикаций показывают, что периоперационная антиноцицептивная терапия опиоидами может снижать послеоперационную боль [14-20]. Кроме того, опиоиды – это препараты выбора в терапии боли при раке, при лечении выраженной травматической боли и при сопутствующем лечении у больных с длительной искусственной вентиляцией легких. Таким образом, удивительно, что пациенты с подобными состояниями часто требуют опиоидов в различных дозах. Факторы, которые влияют на эту вариабельность, включают тип боли (ноцицептивная, воспалительная или нейропатическая боль), психосоциальное состояние и генетическую предрасположенность (половая или этническая принадлежность) [21,22]. Привыкание к опиоидам или одновременное применение препаратов может также вызывать вариации в потребности в опиоидах.
Концепция «привыкания» основана на множестве адаптивных реакций организма в ответ на экзогенные опиоиды. При обсуждении, мы сделали вывод, что эти адаптивные реакции имеют отношение к развитию толерантности [23]. (Анальгетическая) толерантность характеризуется сниженным анальгетическим эффектом во время длительного применения опиоидов, требуя повышения доз (рис. 1В). Развитие толерантности основано на «усиленном» восприятии боли, но может наблюдаться даже без явного переживания боли [24]. Однако не только снижение анальгетического действия наблюдается в клинической практике после назначения опиоидов, но может отмечаться и выраженная боль сильнее предшествующего уровня или может возникать гипералгезия [25-29]. Это предполагает, что сниженный анальгетический эффект основан не только на снижении антиноцицептивной силы опиоидов, но помимо этого и на активации противодействующей, т.е., проноцицептивной системы [30-33]. Основная идея таких компенсаторных реакций при применении препарата описана по «Теории конкурирующего процесса» [34]. Согласно этой теории обсуждается взаимодействие между препарат-индуцированным центральным эффектом и индуцированной противодействующей эндогенной реакции. Препарат-индуцированные эффекты (например, опиоид-индуцированная аналгезия) имеют быстрое начало и сохраняются при повторном введении, в то время как противодействующий процесс (например, опиоид-индуцированная гипералгезия) имеет позднее развитие, которое усиливается при повторении (рис. 2). Согласно этой теории наблюдаемый эффект опиоидов будет определяться по взаимодействию двух противостоящих анти- и проноцицептивного процессов [33].
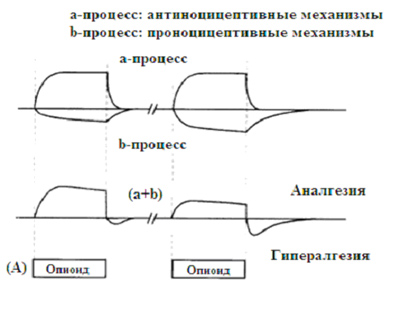 |
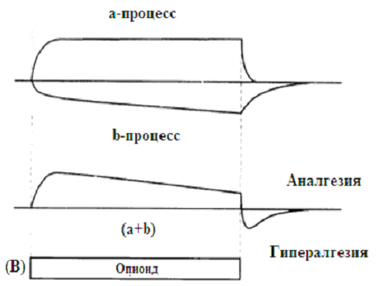 |
| Рисунок 2. «Теория конкурирующего процесса» показывает функцию активированного, позитивного процесса (a -процесс) одновременно с компенсаторной (противодействующей) реакцией, т.е., негативным процессом (b -процесс). Опиоид-индуцированная анал m гезия и гипералгезия являются следствием взаимодействия двух противодействующих процессов (a + b). Повторное воздействие опиоидами приводит к снижению анальгетического действия посредством повышенной активации проноцицептивных систем (A), в то время как четко длительная опиоидная терапия снижает анальгетический эффект (B). По данным источников [33, 34]. |
Молекулярные механизмы, лежащие в основе анти- и проноцицептивных процессов, обсуждаются ниже. Кроме того, будет описана значимость этих механизмов для человека и для экспериментальных исследований на животных; будут представлены подходы к терапевтической модуляции опиоид-индуцированной гипералгезии.
Опиоиды активируют периферические, спинальные и супраспинальные опиоидные рецепторы. На сегодняшний день уже выявлены четыре группы опиоидных рецепторов (m, d, k, ORL-1). Кроме того, фармакологически охарактеризованы восемь изоформ (m1-3, d1-2, k1-3) и многочисленные подтипы. Опиоидные рецепторы оказывают эффект посредством активации гуанин-нуклеотид-связывающего протеина (G -протеин), особенно – но не исключительно – коклюш токсин-чувствительного Gi/o-протеина [35].
2.1. Модуляция мембранного потенциала
b/g -субъединица G -протеинов приводит к утечке K+(KIR) и к закрытию потенциало-зависимых Ca2+-каналов [36], вызывая гиперполяризацию и снижая нейронную возбудимость. Возможные механизмы антиноцицептивных опиоидных эффектов суммированы на рисунке 3.
 |
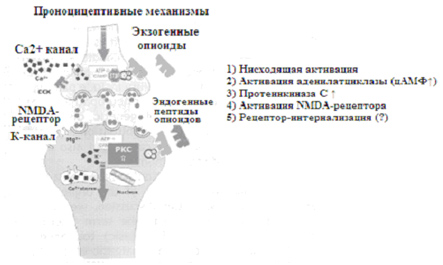 |
| Рисунок 3. Схематическая диаграмма антиноцицептивных и проноцицептивных механизмов, опосредованных m-агонистами. Для получения дальнейших объяснений смотрите описание в тексте. |
2.2. Деактивация аденилатциклазы
Gi/o -протеин опосредованная активация опиоидных рецепторов подавляет аденилатциклазу и, следовательно, вызывает снижение внутриклеточного циклического аденозинмонофосфата (цАМФ), что в свою очередь также может приводить к гиперполяризации и подавлению высвобождения нейромедиаторов, например, глутамата и вещества P (SP), на периферическом, спинальном и супраспинальном уровнях [37-39].
2.3. Направленная миграция рецептора
После активации опиоидный рецептор фосфорилируется G -протеин-регулируемыми рецепторными киназами (GRK) и, таким образом, отделяется от G -протеина. В результате, у рецептора повышается сродство к клеточному протеину аррестину, впоследствии активированный комплекс рецептор-аррестин может инициировать эндоцитоз [40]. После интернализации, рецептор также «используется повторно» и будет снова присутствовать на поверхности клетки, или будет разрушаться. Посредством интернализации и ре-экспрессии рецепторов связь опиоид-рецептор периодически распадается, начинаются другие адаптационные внутриклеточные процессы, приводящие к развитию толерантности [41, 42]. Эта теория объясняет наблюдения, что µ-агонист морфин не обладает значительной способностью интернализации рецептора, но проявляет высокий потенциал при развития толерантности [43, 44].
Нисходящее подавление создается в околоводопроводном сером веществе среднего мозга (ОВС) и ростральном вентромедиальном продолговатом мозге (РВМ). В РВМ могут быть выделены три класса нейронов: Off -нейроны - подавляются болевыми стимулами, On-нейроны - повышают работоспособность с помощью болевой стимуляции и нейтральные клетки, которые не реагируют на болевые стимулы [45-47]. Off- и On-клетки проецируются на нейроны дорсального рога и, соответственно, подавляют или усиливают синаптическую передачу ноцицептивного входа [46, 48]. Центральный анальгетический эффект m-агонистов характеризуется подавлением On-клеток и активацией Off -клеток [49, 50].
Помимо прямых эффектов на опиоидные рецепторы, сродство с или взаимодействие с другими антиноцицептивными системами, например, с ГАМК-эргической и глицинергической, нейроны [51-53] являются важными факторами для определения антиноцицептивной эффективности опиоидов.
Задолго до того как Pert и Snyder (1974) впервые описали опиоидные рецепторы, было известно, что длительная терапия опиоидами может быть причиной возобновляемого усиления ранее купированной боли, что первоначально приписывалась к потере антиноцицептивной способности опиоидов. В настоящее время предложена новая гипотеза, которая рассматривает активацию проноцицептивных систем опиоидами [30, 31, 33]. Возможные механизмы проноцицептивных опиоидных эффектов представлены на рисунке 3.
3.1. Рецептор - десенсибилизация
Опиоидные рецепторы демонстрируют быстро развивающуюся десенсибилизацию, несмотря на длительное наличие лигандов. Этот процесс первично может быть связан с фосфорилированием, опосредованным протеинкиназой C (PKC), и интернализацией опиоидных рецепторов. В настоящее время, по крайней мере, уже описано множество PKC -изоформ, из которых PKCg имеет наибольшее влияние на регуляцию спинальных ноцицептивных процессов [54, 55]. Активация PKC вызывает фосфорилирование во многих рецепторах и ионных каналах, включая µ-опиоидные рецепторы и NMDA - r рецепторы [56, 57], но фосфорилирование опиоидного рецептора может также быть опосредовано ? -адренергической рецепторной киназой 2 и ?-аррестином 2 [58, 59]. Десенсибилизация представляет гомологичный процесс, т.е., µ-опиоидные рецепторы могут быть десенсибилизированы только при применении m-селективных агонистов [43]. В настоящее время десенсибилизация может быть показана для практически всех опиоидов в клинической практике [44, 60, 61]. В этом контексте важен тот факт, что опиоидные рецепторы часто существуют как димеры или олигомеры. Таким образом, также могут наблюдаться гомодимеры (m/m, d/d , k/k ) и гетеродимеры (m/d, d/ k , d/b2 , ...) [62, 63]. Димеры и олигомеры, до сих пор, являются единственным объяснением для существования многочисленных, фармакологически определенных подтипов опиоидных рецепторов без значимого гена. Кроме того, тот факт, что применение низких концентраций d -селективных агонистов предотвращает десенсибилизацию против m-агониста морфина, укрепляет доказательства ди- и олигомеризации m- и d-опиоидных рецепторов, соответственно [41].
3.2. Активация аденилатциклазы
Как обсуждалось выше, опиоидный рецептор, связанный с Gi/oактивацией, снижает уровни цАМФ. Однако, длительное применение m-агонистов может вызывать GS -протеин опосредованное повышение регуляции работы аденилатциклазы, приводя к повышению уровня цАМФ [64-66]. Повышенный уровень цАМФ может посредством пресинаптической активации увеличивать высвобождение возбуждающих нейромедиаторов на спинальном уровне [67, 68], а также приводить к ГАМК-опосредованной повышенной передаче в ОВС и в других областях среднего мозга [51, 69, 70]. Эти данные поддерживаются наблюдениями, что бензодиазепин, в зависимости от спинального или супраспинального применения, может усиливать или ослаблять анальгетический эффект опиоидов [71-75].
3.3. Активация NMDA- рецептора
Активация PKC вызывает фосфорилирование NMDA -рецепторов с нейтрализацией Mg2+-блоков и повышением Ca2+-притока. Спинальная система NMDA -рецептора – это функционально важная проноцицептивная система, которая может активироваться через опиоиды. Особую значимость имеет тот факт, что опиоиды могут развивать синергичное действие с возбуждающими аминокислотами, то есть, нейромедиаторами, которые играют решающую роль в инициации и поддержании центральной сенсибилизации [76]. Активация NMDA -рецепторов вызывает приток Ca2+ , способствуя, через дальнейшее повышение активности PKC , фосфорилированию и инактивации опиоидных рецепторов. В дополнение, активация нейронной NO -синтетазы стимулирует образование NO (окиси азота). Это может доказывать, что индукция синтеза супраспинальной изоформы NO (nNOS1) снижает антиноцицептивную эффективность m-агонистов и, что неселективные ингибиторы NOS препятствуют развитию толерантности [77-80].
3.4. Высвобождение пептидов со свойствами антагониста к опиоидам (анти-опиоиды)
Длительное применение опиоидов может стимулировать пептиды с проноцицептивными свойствами. В настоящее время наиболее важными пептидами считаются холецистокинин (CCK), нейропептид FF (NPFF) и ноцицептин (орфанин FQ). Динорфин A может играть важную роль в этом процессе. Первично вследствие его ? -агонистических свойств, он классифицируется как эндогенный опиоид [81]. Современные исследования уже показали, что Динорфин A обладает значимыми проноцицептивными свойствами, которые, частично, приводят к активации NMDA -рецепторной системы [82-84]. Все упомянутые выше пептиды проявляют повышенную спинальную экспрессию при применении опиоидов [85-93]. Кроме того, было показано, что блокада их специфических рецепторов усиливает действие опиоидов [94-98].
В противоположность нисходящего подавления, усиление синаптической передачи в нейронах дорсальных рогов можно наблюдать при длительном применении m-агонистов [96, 99, 100]. Предполагается, что длительное применение опиоидов через проноцицептивные внутриклеточные системы также вызывает реверсию типов активации On -клеток в РВМ и, таким образом, приводит к развитию гипералгезии [96]. CCK и ноцицептин также усиливают эти проноцицептивные эффекты, хотя они подавляют, индуцированную m-агонистами активацию Off -клеток [101,102]. И наоборот, k-агонисты могут ослаблять активацию, вызванную m-агонистом, хотя действуют пресинаптически с активированными глютаматергическими синапсами [103]. Dourish с соавторами исследовали анальгезию морфином, а также опиатную толерантность и зависимость у крыс после применения селективного CCK - B антагониста L-365,260 и нашли усиленную аналгезию, индуцированную морфином [104]. Соответственно, интратекальное применение CCK -8 или CCK -рецепторных агонистов, что было также показано, влияет на толерантность морфина [105], хотя CCK -рецепторные антагонисты усиливают анальгетические эффекты морфина и эндорфина и предотвращают развитие толерантности к морфину [91, 97, 98, 106]. Эти данные предполагают, что сам CCK может ослаблять морфининдуцированную анальгезию у грызунов посредством CCK-B рецепторов.
Другие проноцицептивные свойства зависят от фармакокинетических характеристик отдельных опиоидов. Клиническую значимость имеют метаболиты морфина Морфин-3-Глюкуронид (M-3-G ) и Морфин6-Глюкуронид (M-6-G ). M-6-G обладает сильным анальгетическим действием [107], в то время как M-3-G проявляет частичные µ-антагонистические и возбуждающие свойства [108-110]. При длительном применении морфина M-3-G может аккумулироваться, проникать через гематоэнцефалический барьер и подавлять морфин и M-6-G .
4. Экспериментальное исследование опиоид-индуцированной гипералгезии
Опиоид-индуцированная гипералгезия уже исследована на примере болевого поведения на моделях животных и с помощью психофизики у человека. Ниже, мы сфокусировались на эффектах 4-анилинопиперидиновых опиоидов, используемых сегодня в периоперационных условиях (фентанил, алфентанил и ремифентанил); кроме того, опиоиды, используемые при лечении боли и при заместительной терапии (морфин, метадон и героин), будут охарактеризованы на основе экспериментальных исследований на животных и у человека.
В экспериментах на животных после повторного применения фентанила доза-зависимое снижение болевого порога могло наблюдаться после исчезновения анальгетического действия [111]. При применении дозы 80 мкг/кг этот эффект продолжался только в течение 1 дня, в то время как при применении дозы 400 мкг/кг вырабатывалась повышенная болевая чувствительность, которая наблюдалась в течение 5 дней. Подобным образом, болезненность при экспериментально полученном воспалении в дальнейшем усиливалась после прекращения терапии фентанилом [112]. Так как эта гипералгезия может быть уменьшена во всех случаях с помощью антагониста NMDA -рецептора кетамина, предполагается, что фентанил вызывает значительную активацию NMDA -рецепторных систем после краткосрочного применения [111, 112]. Это могло также объяснять частичную потерю анальгетического эффекта морфина при применении непосредственно после прекращения анальгезии фентанилом [113, 114]. Этот факт также показывает, что сочетание фентанила с кетамином или N 2 O восстанавливает анальгетическую способность после применения морфина [113-115]. В соответствии с этими результатами, пациенты, получающие высокие дозы фентанила во время операции (15 мкг/кг), при сравнении с низкими дозами фентанила (1 мкг/кг), имеют значительно более высокое потребление морфина после операции [116].
В эксперименте на животных снижение анальгетического эффекта может наблюдаться уже в течение первого часа после применения алфентанила [117, 118]. Помимо PKC -опосредованного соединения G -протеинов, в основе этого эффекта может лежать активация системы NMDA -рецептора [117, 119]. Однако, клиническая значимость этих данных сомнительна. При терапии послеоперационной боли не было найдено значительного повышения дозы после 6-часовой инфузии [120], что свидетельствует об отсутствии развития значимой толерантности.
Подобные наблюдения уже были сделаны в отношении быстродействующего опиоида - ремифентанила. Одно исследование сообщает, что длительная инфузия ремифентанила у здоровых волонтеров приводит к быстрому снижению его анальгетического эффекта на четверть от максимально возможного [121]. Однако, отсутствие контрольной группы, а также исключение некоторых волонтеров повлияло на результаты исследования. В других исследованиях, чистый доза-зависимый эффект был показан для ремифентанила; также, при 3-часовой инфузии потери эффекта опиоидов не наблюдалось [122, 123]. Эти данные были подтверждены клиническими наблюдениями при лечении боли в послеоперационном периоде [120, 124, 125]. Тем не менее, есть доказательства, что ремифентанил, даже после короткого периода применения, вызывает клинически значимую активацию проноцицептивных систем, приводя к повышенной болевой реактивности после прекращения введения опиоидов. Пациенты, которым проводились абдоминальные операции, и которые получали высокие дозы ремифентанила интраоперационно (0,3 мкг/кг/мин), имели значительно более высокую потребность в морфине после операции, чем группа больных, получавшая низкие дозы (0,1 мкг/кг/мин) ремифентанила интраоперационно [28]. Однако, если ремифентанил назначался в течение более короткого периода времени и в меньшей дозе, клинически значимые различия не могли наблюдаться при послеоперационном лечении боли [126]. Эти результаты предполагают, что активация проноцицептивных систем является время- и доза-зависимой. Экспериментальные исследования поддерживают эти представления . В нескольких исследованиях у здоровых волонтеров доза-зависимое повышение восприятия боли и изменение порога в ответ на механические раздражители уже наблюдалось после отмены опиоидов [127-129] . Сочетание ремифентанила с кетамином также вызывает подавление процессов центральной сенсибилизации [127, 130]. Эти результаты соответствуют клиническим наблюдениям, согласно которым интраоперационное применение кетамина (болюс 0,15 мг/кг, с последующей длительной инфузией 2 мкг/кг/мин) в сочетании с ремифентанилом, вызывало значительное снижение послеоперационной потребности морфина [131]. На модели волонтеров человека с помощью электрически-спровоцированной боли ремифентанил усиливал электрически-спровоцированное болевое восприятие при отмене. Это усиление боли связывают с интернализацией опиоидного рецептора, индуцированной ремифентанилом, и в результате снижения анальгезии эндогенными опиоидами, подобно быстрой отмены [129]. Дополнительное применение a2-агониста клонидина подавляет развитие быстрой отмены [130], в то время как при применении кетамина этого не происходит [130, 132]. Таким образом, оказалось, что ремифентанил-индуцированная гипералгезия вовлекает различные кетамин-чувствительные и a2-нечувствительные проноцицептивные системы.
В противоположность наблюдениям в периоперационных условиях, состояния гипералгезической боли уже возникали во время длительного (дни-недели) применения этого опиоида [25, 26, 133, 134]. Можно показать в эксперименте, что как системное, так и интратекальное применение морфина активирует NMDA -рецепторную систему. Специфические ( MK -801) и неспецифические антагонисты NMDA -рецептора (кетамин, декстрометорфан) вызывают значительное снижение гипералгезии [30, 57, 133, 135-139]. Эти данные поддерживаются клиническими наблюдениями, которые показали, что сочетание морфина с кетамином или декстрометорфаном снижает потребность в анальгетиках и предотвращает эпизод парадоксальной боли, особенно при длительном назначении [140-142].
Кроме того, доза-зависимые возбуждающие эффекты могут наблюдаться при терапии морфином и обычно приписываются к накоплению M-3-G в плазме [143-145]. Помимо усиления боли и появления новой боли, миоклония и судороги могут свидетельствовать о накоплении M-3-G [143, 145]. Замена на другой опиоид приводит к немедленному улучшению физиологического состояния [146].
В отличие от морфина, метадон функционирует антагонистично с NMDA -рецептором [147,148]. Можно показать, что это антиноцицептивное взаимодействие способствует улучшению аналгезии [149]. Хотя предполагается наличие перекрестной толерантности с морфином [150,151], развитие толерантности и результирующая гипералгезия при применении морфина может быть предотвращена метадоном [150, 152]. Помимо блокады NMDA -рецепторов, более высокая рецепторная специфичность метадона также является решающей для появления этих эффектов [53, 153]. Однако снижение болевых порогов может также наблюдаться при терапии метадоном [27, 154]. Эти данные могут быть прослежены, частично, с момента плана исследования и фармакокинетических свойств опиоида: метадон обладает очень большим периодом полувыведения и, следовательно, назначается только один раз в день. Таким образом, данные могут показать краткосрочную отмену с клинически значимой активацией проноцицептивных систем [155].
При сравнении оказалось, что героин проявляется гораздо более сильные и явные гипералгезические свойства. В экспериментальном исследовании, доза-зависимое снижение механических (болевых) порогов, длящееся несколько дней, уже можно было наблюдать после однократного применения [156, 157]. При применении в течение нескольких дней, значимая активация проноцицептивных систем все еще выявлялась спустя 4 недели [158, 159]. Во всех случаях этот процесс сенсибилизации может быть ослаблен или подавлен с помощью предварительного лечения NMDA -антагонистами.
Суммарно, можно сделать вывод, что в текущей клинической практике должно рассматриваться развитие опиоид-индуцированной гипералгезии, если возникает состояние гипералгезической боли во время длительной терапии опиоидами. Ясно, что процессы сенсибилизации индуцируются уже после краткосрочного применения и, таким образом, могут маскировать часть анальгетических эффектов даже спустя несколько дней после отмены.
Во многих случаях, повышенная потребность в опиоидах может быть объяснена растущим входом ноцицептивных афферентных стимулов или, в частности при лечении хронической и раковой боли, ситуативной вариацией переживания боли (боязнь, печаль и изоляция) [23], но не опиоид-индуцированной гипералгезией. Однако в этих клинических условиях усиление боли может быть опосредовано активацией таких же проноцицептивных систем (NMDA -рецепторной системы, нисходящей активации) и таким образом, терапевтически могут иметься одинаковые выводы.
5.1. Антагонист NMDA -рецептора
Сочетание опиоидов с антагонистами NMDA -рецептора кетамином или декстрометорфаном хорошо изучено в периоперационных условиях. Анти- гипералгезические эффекты кетамина при развитии послеоперационной боли также наблюдались в режиме низкой дозы [160], включавшей первоначально внутривенное применение препарата в дозе 0,5-1 мг/кг с последующей длительной инфузией 10-20 мкг/кг/мин. При применении S-кетамина эту дозировку необходимо снизить на 50%. Декстрометорфан, D-изомер производного леворфанола аналога кодеина, имеет подобную эффективность. Предоперационное применение декстрометорфана в дозе 1-5 мг/кг значительно снижает послеоперационную потребность в морфине [161-163]. Также, при хронической боли повышение дозы морфина можно предотвратить сочетанием морфина с декстрометорфаном в соотношении 1:1 [141].
Периоперационное применение клонидина в дозе 1-2 мкг/кг значительно повышает анальгетические опиоидные эффекты при лечении боли в послеоперационном периоде [164-167]. Показано, что клонидин не только усиливает опиоидный эффект, но также препятствует развитию толерантности [167, 168]. Кроме того, развитие симптомов отмены после отмены опиоида эффективно подавляется клонидином [130, 169]. Современные результаты предполагают, что a1 -агонисты могут также быть эффективными в этом случае [170].
5.3. Ингибиторы ЦОГ и парацетамол
Ингибиторы циклооксигеназы (ЦОГ) и парацетамол также проявляют защитные эффекты при развитии послеоперационной боли и повышают потребность в опиоидах [171-174]. Ингибиторы ЦОГ снижают спинальное высвобождение нейромедиаторов и действуют синергично с антагонистами NMDA -рецептора [175, 176]. Кроме метамизола, в настоящее время два новых препарата - парацетамол и парекоксиб - доступны в Европе для «разрешенного внутривенного применения». Оба препарата характеризуются отсутствием влияния на свертывание крови и на желудочно-кишечный тракт и, таким образом, оба препарата подходят для применения в периоперационных условиях. В настоящее время уже было показано, что профилактическое назначение парекоксиба приводит к увеличению ремифентанил-индуцированных антиноцицептивных эффектов во время инфузии и к значительному уменьшению гипералгезической реакции после отмены [177]. И наоборот, одновременное назначение парекоксиба не показало никакого модулирующего действия на ремифентанил-индуцированную гипералгезию.
Эти новые результаты подтверждают клинически значимое взаимодействие m-опиоидов и простагландинов у людей, и крайнюю важность адекватного расчета времени для антигипералгезического эффекта ингибиторв ЦОГ-2 в этих условиях. Однако, пока неясно – обладают ли другие ингибиторы ЦОГ и парацетамол подобными свойствами.
Большинство опиоидов, применяемых в клинической практике, характеризуются значительной активностью в отношении m-рецепторов. Однако, при сравнении с k -агонистами, m-агонисты проявляют явные, выраженные проноцицептивные свойства [44, 103]. Было показано, что как синтетический ? -агонист U-50,488H , так и сочетание k-агониста/m-антагониста налбуфина может замедлять или подавлять развитие толерантности к морфину [178-180]. Интересно, что ранние исследования чрескожного применения бупренорфина, частичного m-агониста/k-антагониста, показывают подобные результаты. После замены бупренорфина, у многих больных может наблюдаться длительное снижение потребности в опиоидах [181]. Кроме того, было найдено, что бупренорфин влияет на длительные антигипералгезические эффекты в экспериментальной модели боли [182]. Эти антигипералгезические эффекты показывают значительно больший период действия при сравнении с анальгетическими эффектами и отличаются замедленным повышением гипералгезии, наблюдаемой после назначения чистых агонистов m-рецептора. Пока неясно – оказывают ли влияние эти эффекты бупренорфина на улучшение лечения болевых состояний с доминирующей центральной сенсибилизацией.
Однако, опиоиды только со свойствами m-агониста рекомендуются для замены опиоидов. Разумное объяснение этого опиоидного чередования основано на неполном и часто очень трудном прогнозировании перекрестной толеранстности µ-агонистов в клинических условиях. Морфин, следовательно, часто чередуют с чрескожным фентанилом, гидроморфоном, оксикодоном или метадоном [183-185]. Улучшение качества анальгезии и снижения нежелательных побочных эффектов может быть достигнуто у двух из трех больных. Метадон в частности, как оказалось, несет преимущества вследствие его большего сродства с m-рецептором, а также благодаря антагонистическому эффекту на NMDA -рецепторы [183, 186, 187]. Рекомендуемая дозировка после замены опиоидов составляет 50% от рассчитанной эквивалентной дозы и, если необходимо, проводится быстрое титрование высокими дозами, так как индивидуальная сила эквивалентных доз может варьировать вследствие активации проноцицептивных систем [23]. Однако еще нет клинических доказательств в пользу того, что один опиоид более эффективен при опиоидном чередовании, чем другой.
Опиоидная анальгезия вызывает снижение и даже реверсию болевой сенсибилизации, таким образом, играя значительную роль для организма человека. Однако опиоиды также могут вызывать состояние гипералгезической боли как у животных, так и у человека [29], а терапия опиоидами может быть осложнена развитием толерантности. Было показано, что даже после краткосрочного применения опиоиды инициируют процессы сенсибилизации, которые могут выявляться несколько дней спустя [111, 112]. Как гипералгезические эффекты, так и развитие толерантности можно объяснить опиоид-активируемыми проноцицептивными системами. Активация этих проноцицептивных механизмов может также лежать в основе недостатка упреждающих свойств опиоидов, используемых сегодня в клинической практике [188-190], и должна рассматриваться клинически при недолгом применении опиодов, а также при более длительной опиоидной терапии. Сочетание опиоидов с другими классами анальгетиков и чередование опиоидов может помочь снизить сенсибилизацию и оптимизировать терапию боли, так как опиоиды будут сохранять их центральную роль при терапии послеоперационной, травматической или раковой боли.
- Beck P.W., Handwerker H.O. Bradykinin and serotonin effects on various types of cutaneous nerve fibers. Pflug Arch 1974; 347: 209-22.
- Bessou P., Perl E.R. Responses of cutaneous sensory units with unmyelinated fibers to noxious stimuli. J Neurophysiol 1969; 32: 1025-43.
- Meyer R.A., Campbell J.N. Myelinated nociceptive afferents account for the hyperalgesia that follows a burn to the hand. Science 1981; 213: 1527-9.
- Reeh P.W., Bayer J., Kocher L., Handwerker H.O. Sensitization of nociceptive cutaneous nerve fibers from the rat's tail by noxious mechanical stimulation. Exp Brain Res 1987; 65: 505-12.
- Schmelz M., Schmidt R., Ringkamp M., Forster C., Handwerker H.O., Torebjork H.E. Limitation of sensitization to injured parts of receptive fields in human skin C nociceptors. Exp Brain Res 1996; 109: 141-7.
- Schmidt R., Schmelz M., Forster C., Ringkamp M., Torebjork H.E., Handwerker H.O. Novel classes of responsive and unresponsive C nociceptors in human skin. J Neurosci 1995; 15: 333-41.
- Ali Z., Meyer R.A., Campbell J.N. Secondary hyperalgesia to mechanical but not heat stimuli following a capsaicin injection in hairy skin. Pain 1996; 68: 401-11.
- LaMotte R.H., Shain C.N., Simone D.A., Tsai E.F.P. Neurogenic hyperalgesia psychophysical studies of underlying mechanisms. J Neurophysiol 1991; 66: 190-211.
- Raja S.N., Campbell J.N., Meyer R.A. Evidence for different mechanisms of primary and secondary hyperalgesia following heat injury to the glabrous skin. Brain 1984; 107: 1179-88.
- Simone D.A., Baumann T.K., LaMotte R.H. Dose-dependent pain and mechanical hyperalgesia in humans after intradermal injection of capsaicin. Pain 1989; 38: 99-107.
- Dickenson A.H. Spinal cord pharmacology of pain. Brit J Anaesth 1995; 75: 193-200.
- Schaible H.G., Grubb B., Neugebauer V., Oppmann M. The effects of NMDA antagonists on neuronal activity in cats spinal cord evoked by acute inflammation in the knee joint. Eur J Neurosci 1991; 3: 981-91.
- Woolf C.J., Thompson S.W. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain 1991; 44: 293-9.
- Abram S.E., Yaksh T. Morphine, but not inhalation anesthesia, blocks post-injury facilitation. Anesthesiology 1993; 78: 713-21.
- Dahl J.B., Kehlet H. The value of pre-emptive analgesia in the treatment of postoperative pain. Brit J Anaesth 1993; 70: 434.
- Dahl J.B., Rosenberg J., Dirkes W.E., Morgensen T., Kehlet H. Prevention of postoperative pain by balanced analgesia. Brit J Anaesth 1990; 64: 518-20.
- Kehlet H. Surgical stress: the role of pain and analgesia. Brit J Anaesth 1989; 63: 189-95.
- Kehlet H. Multimodal approach to control postoperative pathophysiology and rehabilitation. Brit J Anaesth 1997; 708: 606-17.
- Kehlet H., Dahl J.B. The value of multimodal or balanced analgesia in postoperative pain treatment. Anesth Analg 1993; 77: 1048-56.
- Woolf C.J., Chong M.S. Preemptive analgesia-treating postoperative pain by preventing the establishment of central sensitization. Anesth Anatg 1993; 77: 362-79.
- Kest B., Sarton E., Dahan A. Gender-differences in opioid-mediated analgesia: animal and human studies. Anesthesiology 2000; 93: 539-47.
- Pleym H., Spigset O., Kharasch E.D., Dale O. Gender differences in drug effects: implications for anesthesiologists. Acta Anaesthesiol Scand 2003; 47: 241-59.
- Freye E., Latasch L. Toleranzentwicklung unter opioid-gabe-molekulare mechanismen and klinische bedeu-tung. Anasthesiol Intensivmed Notfallmed Schmerzther 2003; 38: 14-26.
- Kissin I., Bright C.A., Bradley Jr. E.L. Can inflammatory pain prevent the development of acute tolerance to alfentanil? Anesth Analg 2001; 92: 1296-300.
- Ali N.M. Hyperalgesic response is a patient receiving high concentrations of spinal morphine. Anesthesiology 1986; 65: 449-50.
- Arner S., Rawal N., Gustafsson L.L. Clinical experience of long-term treatment with epidural and intrathecal opioids-a nationwide survey. Acta Anaesthesiol Scand 1988; 32: 253-9.
- Doverty M., White J.M., Somogyi A.A., Bochner F., Ali R., Ling W. Hyperalgesic responses in methadone maintenance patients. Pain 2001; 90: 91-6.
- Guignard B., Bossard A.E., Coste C., Sessler D.I., Lebrault C., Alfonsi P., et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology 2000; 93: 409-17.
- Angst M.S., Clark J.D. Opioid-induced hyperalgesia. Anesthesiology 2006; 104: 570-87.
- Celerier E., Laulin J., Larcher A., Le Moat M., Simonnet G. Evidence for opiate-activated NMDA processes masking opiate analgesia in rats. Brain Res 1999; 847: 18-25.
- Colpaert F.C. System theory of pain and of opiate analgesia: no tolerance to opiates. Pharmacol Rev 1996; 48: 402.
- Ossipov M.H., Lai J., Vanderah T.W., Porreca F. Induction of pain facilitation by sustained opioid exposure: relationship to opioid antinociceptive tolerance. Life Sci 2003; 73: 783-800.
- Simonnet G., Rivat C. Opioid-induced hyperalgesia: abnormal or normal pain. Neuroreport 2003; 14: 1-7.
- Solomon R.L., Corbit J.D. An opponent-process theory of motivation. Psychol Rev 1974; 81: 119-45.
- Connor M., Christie M.J. Opiod receptor signalling mechanisms. Clin Exp Pharmacol Physiol 1999; 26: 493-9.
- Claphan D.E., Neer D.J. G protein ?? subunits. Annu Rev Pharmacol Toxicol 1997; 37: 167-203.
- Aimone L.D., Yaksh T.L. Opioid modulation of capsaicinevoked release of substance P from rat spinal cord in vivo. Peptides 1989; 10: 1127-31.
- Chang H.M., Berde C.B., Holz G.G., Steward G.F., Kream R.M. Sufentanil, morphine, met-enkephalin, and kappa-agonist (U-50,488H) inhibit substance P release from primary sensory neurons: a model for presynaptic spinal opioid actions. Anesthesiology 1989; 70: 672-7.
- Trafton J.A., Abbadie C., Marchand S., Mantyh P.W., Basbaum A.I. Spinal opioid analgesia: how critical is the regulation of substance P signaling. J Neurosci 1999; 19: 9642-53.
- Borgland S.L. Acute opioid receptor desensitization and tolerance: is there a link? Clin Exp Pharmacol Physiol 2001; 28: 147-54.
- He L., Fong J., von Zastrow M. Regulation of opioid receptor trafficking and morphine tolerance by receptor oligomerization. Cell 2002; 108: 271-82.
- Kieffer B.L., Evans C.J. Opioid tolerance-in search of the holy grail. Cell 2002; 108: 587-90.
- Keith D.E., Murray S.R., Zaki P.A., Chu P.C., Lissin D.V., Kag L., et al. Morphine activates opioid receptors without causing their rapid internalization. J Biol Chem 1996; 271: 19021-4.
- Whistler J., Chuang H.H., Chu P., Jan L.Y., von Zastrow M. Functional dissociation of m opioid receptor signalling and endocytosis: implications for the biology of opiate tolerance and addiction. Neuron 1999; 23: 737-46.
- Fields H.L., Bry J., Hentall I., Zorman G. The activity of neurons in the rostral medulla of the rat during withdrawal from noxious heat. J Neurosci 1983; 3: 2545-52.
- Fields H.L., Heinricher M.M. Anatomy and physiology of a nociceptive modulatory system. Philos Trans R Soc Lond B: Biol Sci 1985; 308: 361-74.
- Morgan M.M., Fields H.L. Pronounced changes in the activity of nociceptive modulatory neurons in the rostral ventromedial medulla in response to prolonged thermal noxious stimuli. J Neurophysiol 1994; 72: 1161-70.
- Fields HL, Heinricher MM, Mason P Neurotransmitters in nociceptive modulatory circuits. Annu Rev Neurosci 1991; 14: 219-45.
- Heinricher M.M., Morgan M.M., Fields H.L. Direct and indirect actions of morphine on medullary neurons that modulate nociception. Neuroscience 1992; 48: 533-43.
- Heinricher M.M., Morgan M.M., Tortorici V., Fields H.L. Disinhibition of Off-cells and antinociception produced by an opioid action within the rostral ventromedial medulla. Neuroscience 1994; 63: 279-88.
- Chieng B., Williams J.T. Increased opioid inhibition of GABA release in nucleus accumbens during morphine withdrawal. J Neurosci 1998; 18: 7033-9.
- Dickenson A.H., Chapman V., Green G.M. The pharmacology of excitatory and inhibitory amino acid-mediated events in the transmission and modulation of pain in the spinal cord. Gen Pharmacol 1997; 28: 633-8.
- Duttaroy A., Yoburn B.C. The effects of intrinsic efficacy on opioid tolerance. Anesthesiology 1995; 82: 1226-36.
- Basbaum A.I. Distinct neurochemical features of acute and persistent pain. Proc Natl Acad Sci USA 1999; 96: 7739-43.
- Martin W.J., Liu H., Wang H., Malmberg A.B, Basbaum A.I. Inflammation-induced up-regulation of protein kinase Cgamma immunoreactivity in rat spinal cord correlates with enhanced nociceptive processing. Neuroscience 1999; 88: 1267-74.
- Mayer D.J., Mao J., Holt J., Price D.D. Cellular mechanisms of neuropathic pain, morphine tolerance, and their interactions. Proc Natl Acad Sci USA 1999; 96: 7731-6.
- Mayer D.J., Mao J., Price D.D. The development of morphine tolerance and dependence is associated with translocation of protein kinase C. Pain 1995; 61: 365-74.
- Appleyard S.M., Celver J.P., Pineda V., Kovoor A., Wayman G.A., Chavkin C. Agonist-dependent desensitization of the kappa opioid receptor by G protein receptor kinase and beta-arrestin. J Biol Chem 2003; 27: 23802-7.
- Kovoor A., Celver J.P., Wu A., Chavkin C. Agonist induced homologous desensitization of mu-opioid receptors mediated by G protein-coupled receptor kinases is dependent on agonist efficacy. Mot Pharmacol 1998; 54: 704-11.
- Bot G., Blake A.D., Li S., Reisine T. Fentanyl and its analogs desensitize the cloned mu opioid receptor. J Pharmacol Exp Ther 1998; 285: 1207-18.
- Keith D.E., Anton B., Murray S.R., Zaki P.A., Chu P.C., Lissin D.V., et at. mu-Opioid receptor internalization: opiate drugs have differential effects on a conserved endocytic mechansim in vitro and in the mammalian brain. Mot Pharmacol 1998; 53: 377-84.
- Angers S., Salahpour A., Bouvier M. Dimerization: an emerging concept for G protein-coupled receptor ontogeny and function. Annu Rev Pharmacol Toxicol 2002; 42: 409-35.
- Jordan B.A., Devi L.A. G-protein coupled receptor heterodimerization modulates receptor function. Nature 1999; 399: 700.
- Avidor-Reiss T., Nevo I., Levy R., Pfuffer T., Vogel Z. Chronic opioid treatment induces adenyl cyclase V superactivation. J Biol Chem 1996; 271: 21309-15.
- Crain S.M., Shen K.F. Modulation of opioid analgesia, tolerance and dependence by Gs-coupled, GM1gangliosideregulated opioid receptor functions. Trends Pharmacol Sci 1998; 19: 358-65.
- Sharma S.J., Klee W.A., Nirenberg M. Morphine receptors as regulators of adenylate cyclase activity. Proc Natl Acad Sci USA 1975; 72: 590-4.
- Fairbanks C.A., Wilcox G.L. Spinal plasticity of acute opioid tolerance. J Biomed Sci 2000; 7: 200-12.
- Li X., Clark J.D. Hyperalgesia during opioid abstinence: mediation by glutamate and substance P. Anesth Analg 2002; 95: 979-84.
- Ingram S.L., Vaughan C.W., Bagley E.E., Connor M., Christie M.J. Enhanced opioid efficacy in opioid dependence is due to an additional signal transduction pathway. J Neurosci 1998; 18: 10269-76.
- Vaughan C.W., Ingram S.L., Connor M.A., Christie M.J. How opioids inhibit GABA-mediated neurotransmission. Nature 1997; 360: 611-4.
- Kissin I., Brown P.T., Bradley Jr. E.L. Does midazolam inhibit the development of acute tolerance to the analgesic effect of alfentanil? Life Sci 1992; 52: 55-60.
- Kissin I., Lee S.S., Arthur G.R., Bradley Jr. E.L. Effect of midazolam on development on acute tolerance to alfentanil the role of pharmacokinetic interactions. Anesth Analg 1997; 85: 182-7.
- Luger T.J., Hayashi T., Lorenz I.H., Hill H.E. Mechanisms of the influence of midazolame on morphine antinociception at spinal and supraspinal levels in rats. Eur J Pharmacol 1994; 271: 421-31.
- Luger T.J., Hayashi T., Weiss C.G., Hill H.E. The spinal potentiating effect and the supraspinat inhibitory effect of midazolam on opioid-induced analgesia. Eur J Pharmacol 1995; 275: 53-62.
- Tejwani G.A., Rattan A.K., Sribanditmongkol P., Sheu M.J., Zuniga J., McDonald J.S. Inhibition of morphine-induced tolerance and dependence by a benzodiazepine receptor agonist midazolam in the rat. Anesth Analg 1993; 76: 1052-60.
- Hahnenkamp K., Nollet J., van Aken H., Buerkle H., Halene T., Schauerte S., et al. Remifentanil directly activates human N-methyl-D-aspartate receptors expressed in xenopus laevis oocytes. Anesthesiology 2004; 100: 1531-7.
- Elliott K., Minami N., Kolesnikov Y.A., Pasternak G.W., Inturrisi C.E. The NMDA receptor antagonists, LY274614 and MK-801, and the nitric oxide synthase inhibitor, NG-nitro-L-arginine, attenuate analgesic tolerance to the mu-opioid morphine but not to kappa opioids. Pain 1994; 56: 69-75.
- KolesnikovY.A., Pick C.G., Ciszewska G., Pasternak G.W. Blockade of tolerance to morphine but not to k opioids by a nitric oxide synthese inhibitor. Proc Natl Acad Sci USA 1993; 90: 5162-6.
- Majeed N.H., Przewtocka B., Machelska H., Przewlocki R. Inhibition of nitric oxide synthetase attenuates the development of morphine tolerance and dependence in mice. Neuropharmacology 1994; 32: 189-92.
- Przewlocki R., Machelska H., Przewlocka B. Inhibition of nitric oxide synthase enhances morphine antinociception in the rat spinal cord. Life Sci 1993; 53: 1-5.
- Goldstein A., Tachibana S., Lowney L.I., Hunkapiller M., Hood L. Dynorphin-(1-13), an extraordinarily potent opioid peptide. Proc Natl Acad Sci USA 1979; 76: 6666-70.
- Faden A.I. Dynorphin increases extracellular levels of excitatory amino acids in the brain trough a non-opioid mechanism. J Neurosci 1992; 12: 425-9.
- Garden L.R., Wang R., Burgess S.E., Ossipov M.H., Vanderah T.W., Malan Jr. T.P, et al. Sustained morphine exposure induces a spinal dynorphin-dependent enhancement of excitatory transmitter release from primary afferent fibers. J Neurosci 2002; 22: 6747-55.
- Skilling S.R., Sun X., Kurtz H.J., Larson A.A. Selective potentiation on NMDA-induced activity and release of excitatory amino acids by dynorphin: possible roles in paralysis and neurotoxicity. Brain Res 1992; 575: 272-8.
- Benoliel J.J., Bourgoin S., Mauborgne A., Legrand J.C., Hamon M., Cesselin F. Differential inhibitory/stimulatory modulation of spinal CCK release by mu and delta opioid agonists, and selective blockade of mu-dependent inhibition by kappa receptor stimulation. Neurosci Lett 1991; 124: 204-7.
- Bourgoin S., Benoliel J.J., Collin E., Mauborgne A., Pohl M., Hamon M., et al. Opioidergic control of the spinal release of neuropetides. Possible significance for the analgesic effects of opioids. Fundam Clin Pharmacol 1994; 8: 307-21.
- Devillers J.P., Labrouche S.A., Castes E., Simonnet G. Release of neuropeptide FF, an anti-opioid peptide, in rat spinal cord slices is voltage- and Ca(2+)-sensitive: possible involvement of P-type Ca2+ channels. J Neurochem 1995; 64: 1567-75.
- Devillers J.P., Boisserie F., Laulin J.P., Larcher A., Simonnet G. Simultaneous activation of spinal antiopioid system (neuropeptide FF) and pain facilitatory circuitry by stimulation of opioid receptors in rats. Brain Res 1995; 700: 173-81.
- Gouarderes C., Tafani J.A., Meunier J.C., Jhamandas K., Zajac J.I.M. Nociceptin receptors in the rat spinal cord during morphine tolerance. Brain Res 1999; 838: 85-94.
- Rattan A.K., Tejwani G.A. Effect of chronic treatment with morphine, midazolame and both together on dynorphin(1-3) levels in the rat. Brain Res 1997; 754: 239-44.
- Xu X.J., Puke M.J.C., Verge V.M.K., Wiesenfeld-Hallin Z., Hughes J., Hokfelt T. Up-regulation of cholecystokinin in primary sensory neurons is associated with morphine insensitivity in experimental neuropathic pain in the rat. Neurosci Lett 1993; 152: 129-32.
- Yang H.Y., Fratta W., Majane E.A., Costa E. Isolation, sequencing, synthesis, and pharmacological characterization of two brain neuropeptides that modulate the action of morphine. Proc Natl Acad Sci USA 1985; 82: 7757-61.
- Yuan L., Han Z., Chang J.K., Han J.S. Accelerated release and production of orphanin FQin the brain of chronic morphine tolerant rats. Brain Res 1999; 826: 330-4.
- Rizzi A., Bigoni R., Marzola G., Guerrini R., Salvadori S., Regoli D., et al. The nociceptin/orphanin FQ receptor antagonist, [Nphe1]NC(1-13)NH2, potentiates morphine analgesia. Neuroreport 2000; 11: 2369-72.
- Vanderah T.W., Garden L.R., Burgess S.E., Ibrahim M., Dogrul A., Zhong C.M., et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance. J Neurosci 2000; 20: 7074-9.
- Vanderah T.W., Ossipov M.H., Lai J., Malan T.P., Porreca F. Mechanisms of opioid-induced pain and antinociceptive tolerance: descending facilitation and spinal dynorphin. Pain 2001; 92: 5-9.
- Watkins L.R., Kinscheck I.B., Mayer D.J. Potentiation of opiate analgesia and apparent reversal of morphine tolerance by proglumide. Science 1984; 224: 395-6.
- Watkins L.R., Kinscheck I.B., Mayer D.J. Potentiation of morphine analgesia by the cholecystokinin antagonists proglumide. Brain Res 1985; 327: 169-80.
- Kaplan H., Fields H.L. Hyperalgesia during acute opioid abstinence: evidence for a nociceptive facilitating function of the rostral ventromedial medulla. J Neurosci 1991; 11: 1433-9.
- Vanderah T.W., Suenaga N.M.H., Ossipov M.H., Malan T.P., Lai J., Porreca F. Tonic descending facilitation from the rostral ventromedial medulla mediates opioid-induced abnormal pain and antinociceptive tolerance. J Neurosci 2001; 21: 279-86.
- Heinricher M.M., McGaraughty S., Grandy D.K. Circuitry underlying antiopioid action of orphanin FQ in the rostral ventromedial medulla. J Neurophysiol 1997; 78: 3351-8.
- Heinricher M.M., McGaraughty S., Tortorici V. Circuitry underlying antiopioid actions of cholecystokinin within the rostral ventromedial medulla. J Neurophysiol 2001; 85: 280-6.
- Bie B., Pan Z.Z. Presynaptic mechanism for anti-analgesic and anti-hyperalgesic actions of k-opioid receptors. J Neurosci 2003; 23: 7262-8.
- Dourish C.T., O'Neill M.F., Coughlan J., Kitchener S.J., Hawley D., Iversen S.D. The selective CCK-B receptor antagonist L-365,260 enhances morphine analgesia and prevents morphine tolerance in the rat. Eur J Pharmacol 1990; 176: 35-44.
- Zarrindast M.R., Nikfar S., Rezayat M. Cholecystokinin receptor mechanism(s) and morphine tolerance in mice. Pharmacol Toxicol 1999; 84: 46-50.
- Price D.D., von der Gruen A., Miller J., Raft A., Price D. Potentiation of systemic morphine analgesia in humans by proglumide, a cholecystokinin antagonist. Anesth Analg 1985; 64: 801-6.
- Pasternak G.W., Bodnar R.J., Clark J.A., Inturrisi C.E. Morphine-6-glucuronide, a potent mu agonist. Life Sci 1987; 41: 2845-9.
- Shimomura K., Kamata O., Ueki S., Ida S., Oguri K. Analgesic effects of morphine glucuronides. Tohoku J Exp Med 1971; 105: 45-52.
- Smith M.T., Watt J.A., Crammond T. Morphine-3-glucuronide-a potent antagonist of morphine analgesia. Life Sci 1990; 47: 579-85.
- Yaksh T.L., Harty G.J. Pharmakology of the allodynia in rats evoked by high dose intrathecal morphine. J Pharmacol Exp Ther 1998; 244: 501-7.
- Celerier E., Rivat C., Jun Y., Laulin J.P., Larcher A., Reynier P., et at. Long-lasting hyperalgesia induced by fentanyl in rats: preventive effect of ketamine. Anesthesiology 2000; 92: 465-72.
- Rivat C., Laulin J.P., Corcuff J.B., Celerier E., Pain L., Simonnet G. Fentanyl enhancement of carrageenan-induced long-lasting hyperalgesia in rats: prevention by the N-methyl-D-aspartate receptor antagonist ketamine. Anesthesiology 2002; 96: 381-91.
- Laulin J.P., Maurette P., Corcuff J.B., Rivat C., Chauvin M., Simonnet G. The role of ketamine in preventing fentanyl-induced hyperalgesia and subsequent acute morphine tolerance. Anesth Analg 2002; 94: 1263-9 [table].
- Richebe P., Rivat C., Laulin J.P., Maurette P., Simonnet G. Acute morphine tolerance in rats operated under fentanyl. Preventive effect of ketamine. Anesthesiology 2003; 99: A941.
- Richebe P., Rivat C., Creton C., Maurette P., Simonnet G. Nitrous oxide revisited: preventive effects on fentanyl induced hyperalgesia and morphine acute tolerance. Anesthesiology 2003; 99: A940.
- Chia Y.Y., Liu K., Wang J.J., Kuo M.C., Ho S.T. Intraoperative high dose fentanyl induces postoperative fentanyl tolerance. Can J Anaesth 1999; 46: 872-7.
- Kissin I., Bright C.A., Bradley Jr. E.L. Acute tolerance to continuously infused alfentanil: the role of cholecystokinin and N-methyl-D-aspartate-nitric oxide systems. Anesth Analg 2000; 91: 110-6.
- Kissin I., Lee S.S., Arthur G.R., Bradley Jr. E.L. Time course characteristics of acute tolerance development to continuously infused alfentanil in rats. Anesth Analg 1996; 83: 600-5.
- Kissin I., Bright C.A., Bradley Jr. E.L. The effect of ketamine on opioid-induced acute tolerance: can it explain reduction of opioid consumption with ketamine-opioid analgesic combinations? Anesth Analg 2000; 91: 1483-8.
- Schraag S., Checketts M.R., Kenny G.N. Lack of rapid development of opioid tolerance during alfentanil and remifentanil infusions for postoperative pain. Anesth Analg 1999; 89: 753-7.
- Vinik H.R., Kissin I. Rapid development of tolerance to analgesia during remifentanil infusion in human. Anesth Analg 1998; 86: 1307-11.
- Gustorff B., Felleiter P., Nahlik G., Brannath W., Hoerauf K.H., Spacek A., et al. The effect of remifentanil on the heat pain threshold in volunteers. Anesth Analg 2001; 92: 369-74.
- Gustorff B., Nahlik G., Hoerauf K.H., Kress H.G. The absence of acute tolerance during remifentanil infusion in volunteers. Anesth Analg 2002; 94: 1223-8.
- Soltesz S., Biedler A., Silomon M., Schopflin I., Molter G.P. Recovery after remifentanil and sufentanil for analgesia and sedation of mechanically ventilated patients after trauma or major surgery. Brit J Anaesth 2001; 86: 763-8.
- Wilhelm W., Dorscheid E., Schlaich N., Niederprum P., Deller D. Remifentanil zur analgosedierung von intensivpatienten. Anaesthesist 1999; 48: 625-9.
- Cortinez L.I., Brandes V., Munoz H.R., Guerrero M.E., Mur M. No clinical evidence of acute opioid tolerance after remifentanil-based anaesthesia. Brit J Anaesth 2001; 87: 866-9.
- Angst M.S., Koppert W., Pahl I., Clark J.D., Schmelz M. Short-term infusion of the mu-opioid agonist remifentanil in humans causes hyperalgesia during withdrawal. Pain 2003; 106: 49-57.
- Hood D.D., Curry R., Eisenach J.C. Intravenous remifentanil produces withdrawal hyperalgesia in volunteers with capsaicin-induced hyperalgesia. Anesth Analg 2003; 97: 810-5.
- Koppert W., Angst M.S., Alsheimer M., Sittl R., Albrecht S., Schuttler J., et al. Naloxone provokes similar pain facilitation as observed after short-term infusion of remifentanil in humans. Pain 2003; 106: 91-9.
- Koppert W., Sittl R., Scheuber K., Alsheimer M., Schmelz M., Schuttler J. Differential modulation of remifentanil-induced analgesia and postinfusion hyperalgesia by S-ketamine and clonidine in humans. Anesthesiology 2003; 99: 152-9.
- Guignard B., Coste C., Costes H., Sessler D.I., Lebrault C., Morris W., et al. Supplementing desflurane-remifentanil anesthesia with small-dose ketamine reduces perioperative opioid analgesic requirements. Anesth Analg 2002; 95: 103-8 [table].
- Luginbuhl M., Gerber A., Schnider T.W., Petersen-Felix S., Arendt-Nielsen L. Modulation of remifentanil-induced analgesia, hyperalgesia and tolerance by small-dose ketamine in humans. Anesth Analg 2003; 96: 726-32.
- Mao J., Price D.D., Mayer D.J. Thermal hyperalgesia in association with the development of morphine tolerance in rats: roles of excitatory amino acid receptors and protein kinase C. J Neurosci 1994; 14: 2301-12.
- Stillman M.J., Moulin D.E., Foley K.M. Paradoxical pain following high-dose spinal morphine. Pain 1987; 4.
- Li X., Angst M.S., Clark J.D. Opioid-induced hyperalgesia and incisional pain. Anesth Analg 2001; 93: 204-9.
- Li X., Angst M.S., Clark J.D. A murine model of opioid-induced hyperalgesia. Brain Res Mot Brain Res 2001; 86: 56-62.
- Manning B., Mao J., Frenk H., Price D.D., Mayer D.J. Continuous co-administration of dextromethorphan or MK-801 with morphine: attenuation of morphine dependence and naloxone-reversible attenuation of morphine tolerance. Pain 1996; 67: 79-88.
- Mao J., Price D.D., Caruso F., Mayer D.J. Oral administration of dextromethorphan prevents the development of morphine tolerance and dependence in rats. Pain 1996; 67: 361-8.
- Mao J., Price D.D., Mayer D.J. Mechanisms of hyperalgesia and morphine tolerance: a current view of their possible interactions. Pain 1995; 62: 259-74.
- Adriaenssens G., Vermeyen K.M., Hoffmann V.L., Mertens E., Adriaensen H.E. Postoperative analgesia with i.v. patient-controlled morphine: effect of adding ketamine. Brit J Anaesth 1999; 83: 393-6.
- Katz N.P. Morphidex (MS:DM) double-blind, multiple-dose studies in chronic pain patients. J Pain Symptom Manage 2000; 19: S37-41.
- Weinbroum A.A. A single small dose of postoperative ketamine provides rapid and sustained improvement in morphine analgesia in the presence of morphine-resistant pain. Anesth Analg 2003; 96: 789-95.
- Sjogren P., Dragsted L., Christensen C.B. Myoclonic spasms during treatment with high doses of intravenous morphine in renal failure. Acta Anaesthesiol Scand 1993; 37: 780-2.
- Smith G.D., Smith M.T. Morphin-3-glucuronide: evidence to support its role in the development of tolerance to the antinozizeptive effects of morphine in the rat. Pain 1995; 62: 51-60.
- Smith M.T. Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clin Exp Pharmacol Physiol 2000; 27: 524-8.
- Sjogren P., Jensen N.H., Jensen T.S. Disappearence of morphine-induced hyperalgesia after discontinuing or substituting with other opioid agonists. Pain 1994; 59: 313-6.
- Ebert B., Andersen S., Krogsgaard-Larsen P. Ketobemidone, methadone and pethidine are non-competitive N-methylD-aspartate (NMDA) antagonists in the rat cortex and spinal cord. Neurosci Lett 1995; 187: 165-8.
- Gorman A.L., Elliott K.J., Inturrisi C.E. The D- and L-isomers of methadone bind to the non-competitive site on the N-methyl-D-aspartate (NMDA) receptor in rat forebrain and spinal cord. Neurosci Lett 1997; 223: 1-4.
- Carpenter K.J., Chapman V., Dickenson A.H. Neuronal inhibitory effects of methadone are predominantly opioid receptor mediated in the rat spinal cord in vivo. Eur J Pain 2000; 4: 19-26.
- Bulka A., Plesan A., Xu X.J., Wiesenfeld-Hallin Z. Reduced tolerance to the anti -hyperalgesic effect of methadone in comparison to morphine in a rat model of mononeuropathy. Pain 2002; 95: 103-9.
- Doverty M., Somogyi A.A., White J.M., Bochner F., Beare C.H., Menelaou A., et al. Methadone maintenance patients are cross-tolerant to the antinociceptive effects of morphine. Pain 2001; 93: 155-63.
- Davis A.M., Inturrisi C.E. d-methadone blocks morphine tolerance and N-methyl-D-aspartate-induced hyperalgesia. J Pharmacol Exp Ther 1999; 289: 1048-53.
- Stevens C.W., Yaksh T.L. Potency of infused spinal antinociceptive agents is inversely related to magnitude of tolerance after continuous infusion. J Pharmacol Exp Ther 1989; 250: 1-8.
- Compton P., Charuvastra V.C., Ling W. Pain intolerance in opioid-maintained former opiate addicts: effect of long-acting maintenance agent. Drug Alcohol Depend 2001; 63: 139-46.
- Clark J.D. Comment on: Doverty et al., hyperalgesic responses in methadone maintenance patients. Pain 2002; 99: 608-9.
- Larcher A., Laulin J.P., Celerier E., Le Moat M., Simonnet G. Acute tolerance associated with a single opiate administration: involvement of N-methyl-D-aspartate-dependent pain facilitatory systems. Neuroscience 1998; 84: 583-9.
- Laulin J.P., Larcher A., Celerier E., Le Moat M., Simonnet G. Long-lasting increased pain sensitivity in rat following exposure to heroin for the first time. Eur J Neurosci 1998; 10: 782-5.
- Celerier E., Laulin J.P., Corcuff J.B., Le Moat M., Simonnet G. Progressive enhancement of delayed hyperalgesia induced by repeated heroin administration: a sensitization process. J Neurosci 2001; 21: 4074-80.
- Laulin J.P., Celerier E., Larcher A., Le Moat M., Simonnet G. Opiate tolerance to daily heroin administration: an apparent phenomenon associated with enhanced pain sensitivity. Neuroscience 1999; 89: 631-6.
- Schmid R.L., Sandier A.N., Katz J. Use and efficacy of low-dose ketamine in the management of acute postoperative pain: a review of current techniques and outcomes. Pain 1999; 82: 111-25.
- Chia Y.Y., Liu K., Chow L.H., Lee T.Y. The preoperative administration of intravenous dextromethorphan reduces postoperative morphine consumption. Anesth Analg 1999; 89: 752.
- Weinbroum A.A., Bender B., Bickels J., Nirkin A., Marouani N., Chazam S., et al. Preoperative and postoperative dextromethorphan provides sustained reduction in postoperative pain and patient-controlled epidural analgesia requirement: a randomized, placebo-controlled, doubleblind study in lower-body bone malignancy-operated patients. Cancer 2003; 97: 2334-40.
- Weinbroum A.A., Gorodetzky A., Nirkin A., Kollender Y., Bickels J., Marouani N., et al. Dextromethorphan for the reduction of immediate and late postoperative pain and morphine consumption in orthopedic oncology patients: a randomized, placebo-controlled, double-blind study. Cancer 2002; 95: 1164-70.
- Bernard J.M., Hommeril J.L., Passuti N., Pinaud M. Postoperative analgesia by intravenous clonidine. Anesthesiology 1991; 75: 577-82.
- De Kock M.F., Crochet B., Morimont C., Scholtes J.L. Intravenous or epidural clonidine for intra and postoperative analgesia. Anesthesiology 1993; 79: 525-31.
- De Kock M.F., Pichon G., Scholtes J.L. Intraoperative clonidine enhances postoperative morphine patient-controlled analgesia. Can J Anaesth 1992; 39: 537-44.
- Spaulding T.C., Fielding S., Venafro J.J., Lal H. Antinociceptive activity of clonidine and its potentiation of morphine analgesia. Eur J Pharmacol 1979; 58: 19-25.
- Fairbanks C.A., Wilcox G.L. Spinal antinociceptive synergism between morphine and clonidine persists in mice made acutely or chronically tolerant to morphine. J Pharmacol Exp Ther 1999; 288: 1107-16.
- Gowing L.R., Farrell M., Ali R.L., White J.M. alpha2-Adrenergic agonists in opioid withdrawal. Addiction 2002; 97: 49-58.
- Bie B., Fields H.L., Williams J.T., Pan Z.Z. Roles of a1- and a2-adrenoreceptors in the nucleus raphe magnus in opioid analgesia and opioid abstinence-induced hyperalgesia. J Neurosci 2003; 23: 7950-7.
- Joshi W., Connelly N.R., Reuben S.S., Wolckenhaar M., Thakkar N. An evaluation of the safety and efficacy of administering rofecoxib for postoperative pain management. Anesth Analg 2003; 97: 35-8.
- Reuben S.S., Bhopatkar M., Maciolek H., Joshi W., Sklar J. Preemptive analgesic effect of refecoxib after ambulatory arthroscopic knee surgery. Anesth Analg 2002; 94: 55-9.
- Moore A., Collins S., Collins D., McQuay H., Edwards J. Single dose paracetamol (acetaminophen), with and without codeine, for postoperative pain. Cochrane Syst Rev 1998: 1-9.
- Hyllested M., Jones S., Pedersen J.L., Kehlet H. Comparative effect of paracetamol. NSAIDs or their combination in postoperative pain management: a qualitative review. Brit J Anaesth 2002; 88: 199-214.
- Malmberg A.B., Yaksh T.L. Hyperalgesia mediated by spinal glutamate or substance P receptor blocked by spinal cyclooxygenase inhibition. Science 1992; 257: 1276-9.
- Malmberg A.B., Yaksh T.L. Cyclooxygenase inhibition and the spinal release of prostaglandin E2 and amino acids evoked by paw formalin injection: a microdialysis study in unanesthetized rats. J Neurosci 1995; 15: 2768-76.
- Troster A., Sittl R., Singler B., Schmelz M., Schuttler J., Koppert W. Modulation of remifentanil-induced analgesia and post-infusion hyperalgesia by parecoxib in humans. Anesthesiology 2006; 105: 1016-23.
- Lee S.C., Wang J.J., Ho S.T., Tao P.L. Nalbuphine coadministered with morphine prevents tolerance and dependence. Anesth Analg 1997; 84: 810-5.
- Tao P.L., Hwang C.L., Chen C.Y. U-50,488 blocks the development of morphine tolerance and dependence at very low dose in mice. Eur J Pharmacol 1994; 256: 281-6.
- Yamamoto T., Ohno M., Ueki S. A selective k-agonist, U-50,488H, blocks the development of tolerance to morphine analgesia in rats. Eur J Pharmacol 1988; 156: 173-6.
- Likar R., Griessinger N., Sadjak A., Sittl R. Transdermales buprenorphin fur die behandlung chronischer tumor- and nicht-tumorschmerzen. Wien Med Wochenschr 2003; 153: 317-22.
- Koppert W., Ihmsen H., Koerber N., Wehrfritz A., Sittl R., Schmelz M., et al. Different profiles of buprenorphine-induced analgesia and anti hyperalgesia in a human pain model. Pain 2005; 118: 15-22.
- Bruera E., Peirera J., Watanabe C., Belzile M., Kuehn N., Hanson J. Opioid rotation in patients with cancer pain. A retrospective comparison of dose ratios between methadone, hydromorphone, and morphine. Cancer 1996; 78: 852-7.
- Mercadante S. Opioid rotation for cancer pain: rationale and clinical aspects. Cancer 1999; 86: 1856-66.
- Thomsen A.B., Becker N., Eriksen J. Opioid rotation in chronic non-malignant pain patients. Acta Anaesthesiol Scand 1999; 43: 918-23.
- Morley J.S., Watt J.W., Wells J.C., Miles J.B., Finnegan M.J., Leng G. Methadone in pain uncontrolled by morphine. Lancet 1993; 342: 1243.
- Williams P.I., Sarginson R.E., Ratcliffe J.M. Use of methadone in the morphine-tolerant burned paediatric patient. Brit J Anaesth 1998; 80: 92-5.
- Kelly D.J., Ahmad M., Brull S.J. Preemptive analgesia. I: Physiological pathways and pharmacolocigal modalities. Can J Anaesth 2001; 48: 1000-10.
- Kelly D.J., Ahmad M., Brull S.J. Preemptive analgesia. II: Recent advances and current trends. Can J Anaesth 2001; 48: 1091-101.
- Moiniche S., Kehlet H., Dahl J.B. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief. Anesthesiology 2002; 96: 725-41.
- Wolfgang Koppert. Opioid-induced hyperalgesia - Pathophysiology and clinical relevance //Acute Pain (2007) 9, 21-34