Фармакогенетика: значение для акушерской анестезиологии
Руфь Ландау
Служба анестезиологии, университетский госпиталь,
Женева, Швейцария
ВВЕДЕНИЕ
Фармакогенетика внедрилась в сферу анестезиологии в середине 1950-х годов с появлением первых наблюдений свидетельствующих, что генетические факторы могут формировать реакцию на различные фармакологические препараты. Первая статья, опубликованная в этой области, сообщила о случаях пролонгированной послеоперационной мышечной релаксации вследствие унаследованной вариации метаболизма препарата, вовлекающего фермент бутирилхолинэстеразу после применения сукцинилхолина [1]. В последующие десять лет, был отмечен бурный рост научных публикаций в области фармакогенетики, исследований изменчивости реакции препаратов вследствие генетической изменчивости. Как фармакогенетика, так и фармакогеномика используются как синонимы, но концепция фармакогеномики включает модернизированные геномные тесты, а также исследования для определения унаследованной от природы реакции на препарат.
Несомненно, знание и технология, приобретенные от «Проекта генома человека», помогут предотвратить генетически детерминированные заболевания, и будут более целенаправленно, способствовать индивидуализации медицины. Основной целью научных исследований фармакогенетики является «помощь врачам скорректировать дозы препаратов к уникальной генетической структуре человека» (сеть научных исследований в области фармакогенетики, http://www.PharmGKb.org ). Этот новый принцип должен сделать препараты более безопасными и более эффективными для каждого конкретного больного. На ежегодном съезде Американского Общества Анестезиологов (АОА) состоявшемся в Лас-Вегасе в октябре 2004 года, несколько специальных научных сессий были адресованы этим многообещающим разработкам и исследованиям по применению фармакогенетики в анестезиологии вообще и в акушерской анестезиологии в частности. Выполненный нами обзор преследует цель - осветить некоторые аспекты процесса перевода знаний человеческого генома в киническую терапию.
ПОЛИМОРФИЗМ
Геном человека содержит более трех миллионов нуклеотид (A , C, T и G). Ген состоящий в среднем из 3000 нуклеотид, имеющих много вариаций в своих размерах. Общее число генов оценивается как равное 25000-30000. До сих пор, несмотря на огромные усилия, функция более 50% их все еще неизвестна. Почти все (99,9%) нуклеотиды точно идентичны у всех индивидуумов, но геном человека, содержит, по крайней мере, 1,42 миллиона отдельных нуклеотидных полиморфизмов (SNPs) [2]. SNPs – это естественно возникающие варианты в структуре генов, которые могут оказывать значимое влияние на метаболизм, клиническую эффективность и профиль побочных эффектов препаратов, в зависимости от нуклеотидных изменений последовательности аминокислот кодированного протеина. Существует заметное этническое различие в частоте многочисленных генетических вариантов, которые могут отчасти объяснять межэтнические различия в реакции на препарат, преобладание и тяжесть заболевания [3].
Каждый индивидуум наследует один ген с материнской стороны и один ген со стороны отца. Таким образом, по каждому полиморфному локусу, индивидуум может быть или монозиготным для широкого типа вариантов, либо аллельным или гомозиготным для мутантной аллели. Аллель, которая была первой найдена, когда ген был упорядочен, называется аллелью дикого типа, независимо от того, действительно ли это более частый вариант в популяции или нет, гетерозиготным (одна аллель дикого типа и одна мутантная аллель). Если несколько SNPs происходят в одном и том же гене, то результирующий генотип называется гаплотип (сочетание нескольких SNPs). Определенные мутации всегда происходят вместе в одном и том же гене, вызывая то, что называется отсутствие связи, т.е. аллели в различных локусах не зависят друг от друга (см. ниже: β2 -адренергические рецепторы).
Фармакология и полиморфизм
Действие большинства препаратов определено взаимодействием нескольких полиморфизмов, которые влияют на фармакокинетику и фармакодинамику препаратов, включая унаследованные различия в препаратах мишенях (например, рецепторы) и расположение препаратов (например, препарат метаболизирующий ферменты и транспортный препарат). Это взаимодействие может привести к полигенным детерминантам, которые вовлекают многочисленные возможные комбинации метаболизма препаратов, переносчики препаратов и генотипы препаратов-рецепторов с соответствующими фенотипами препарат-реакция, принимая широкий предел терапевтических индексов (соотношение эффективность/токсичность) для данного препарата [4].
Препарат, метаболизирующий энзимы
Полиморфизмы семьи цитохрома P 450 являются типичными образцами SNPs отражающими реакцию на многие препараты, метаболизирующиеся либо в активную структуру, либо инактивированные этим метаболическим направлением [5].
Препарат, транспортирующий протеины
P -гликопротеин - один из большинства препаратов, транспортирующих протеины. Он является полиморфным и может способствовать созданию устойчивости к определенным препаратам, такие как сниженная CD 4 реакция у ВИЧ-инфицированных пациентов, лечившихся ингибиторами ВИЧ-протеаз, или сниженному бионакоплению дигоксина [6].
Препарат мишень
Гены, кодирующие рецепторы, присутствующие на клеточной поверхности, могут быть полиморфными и модифицируют эффект эндогенных или экзогенных молекул, которые связывают и активируют рецептор. Это происходит в случае с многими рецепторами семьи G -протеина, такими как адренергические рецепторы или ?-опиоидные рецепторы (μ-ОР). Кроме того, многочисленные SNPs -риодиновые рецепторы (РиР1) связаны с повышенным риском развития злокачественной гипертермии [7].
КЛИНИЧЕСКИ ЗНАЧИМЫЙ ПОЛИМОРФИЗМ
Многочисленные препараты, используемые в ежедневной анестезиологической практике, могут отражать важную межиндивидуумную изменчивость в их эффектах (сниженный эффект, непредсказуемая продолжительность действия, побочные эффекты и токсичность) вследствие полиморфизма. Всесторонняя программа всех изменений в профиле эффективности и токсичности распространяется далее границ этого обзора, но последующая информация может служить в качестве иллюстрации некоторых последствий фармакогенетики на клиническую анестезию и терапию боли.
Адренергические рецепторы
Адренергические рецепторы участвуют в регуляции многочисленных признаков, которые являются основными для анестезиолога, такие как частота сердечных сокращений, артериальное давление и сосудистая реактивность, релаксация гладких мышц (тонус бронхов, тонус матки) и метаболизм глюкозы, среди других.
Адренергические рецепторы являются частью семьи G -протеинов спаренных рецепторов ( GPSRs ). GPSRs - это трансмембранные протеины, которые регулируют многочисленные физиологические и метаболические процессы, и являются мишенями для терапевтических препаратов.
После воздействия агонистов, агонисты быстро активируют большинство GPSRs, и реакции, вызванная агонистами, являются субъектом для десенсибилизации, которая может произойти быстро (секунды-минуты) или более медленно (минуты-часы). Несколько механизмов вовлекаются в десенсибилизацию, например, рецепторное фосфорилирование, депонирование рецепторов, отсоединение от G-протеина или потеря рецепторного числа (понижающая регуляция). Все эти процессы приводят к тахифилаксии, потере эффекта препарата за период времени. Генетические варианты адренергических рецепторов, влияют на экспрессию рецепторов, посттрансляционный процесс, физиологическую и фармакологическую активацию и десенсибилизацию.
α1 -адренергические рецепторы (α1 -АР)
SNPs α1 -АР, α1А -АР Arg 492 Cys и SNPs α1В-АР рецепторы (рис.1) не связаны с клинически значимыми изменениями функции автономной нервной системы. Тем не менее, их исследования продолжаются, и связи с другими клиническими свойствами или другими SNPs вполне вероятно в будущем могут быть открыты [8].
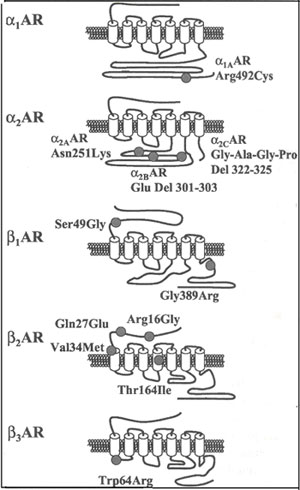 |
| Рисунок 1. Схематическое изображение структуры α- и β-адренергических рецепторов и расположение не-синонимичного кодируемого полиморфизма (отмечено серыми кружочками). Цилиндры отражают трансмембранные зоны; петли соответствуют внеклеточным и внутриклеточным зонам, ориентированным на отражение верхушки или низа, соответственно. Напечатано с разрешения авторов и издателя, Kirstein и Insel [8]. |
α2 -адренергические рецепторы
Исследования генной инженерии, проведенные на мышах, позволили определить роль каждого подтипа α2-АР. α2 -АР провоцируют эффекты, такие как антиноцицепция [9] и седация, а также сердечно-сосудистые эффекты [10]. α2В-АР играют доминантную роль в вазоконстрикторной реакции на α2 -адренергические агонисты [11]. α2С-АР имеют широкое распространение, но характерно распределение в головном мозге [12]. Помимо эффектов на центральную нервную систему, α2С -АР регулируют высвобождение катехоламинов из окончаний симпатических нервов [13]. In vitro полиморфизм α2С -АР (α2С Del 322-325) рецепторы, имеют сниженную функцию [14]. α2С Del 322-325 и Arg 389 вариант β1 -АР (смотри ниже), как показано, действует синергично, повышая риск сердечной недостаточности у афроамериканцев [15]. Генотипирование этих двух SNPs (рис. 1) может быть полезным методом для идентификации индивидуумов с риском сердечной недостаточности.
Активация >α2В -АР повышает сосудистый тонус, и обычный полиморфизм α2В -АР ( Del 310-303), как предсказывают, показывает большие реакции вызванные α2В -АР. Делеция генотипа, как, оказалось, вызывает артериальную гипертензию per se, но в настоящее время идентифицирована как фактор риска по развитию острой коронарной недостаточности. Она связана с измененной регуляцией сосудистого тонуса [16, 17] и повышенным риском нетромботических инфарктов миокарда и внезапной смерти [18]. Полиморфизм является более обычным у белокожего населения (31%), чем у афроамериканцев (12%) [19].
В итоге, исследование, изучающее полиморфизм α2А -АР, будет интересно для определения предполагаемой роли этого гена в условиях боли.
β1 -адренергические рецепторы
β1 -АР вызывают хронотропную и инотропную реакции на катехоламины, которые представляют особенный интерес для анестезиологов. Вариант Arg 389 обычного полиморфизма, Arg 389 Gly (рис.1) in vitro, проявляет большую реакцию против стимуляции [20]. Здесь нет специфических, имеющихся β1 -агонистов, следовательно, определение фармакологической значимости генетической вариации β1 -АР является проблематичным. Однако в настоящий момент селективные β1 -антагонисты имеются в арсенале врача, и поэтому они широко используются для лечения артериальной гипертензии, стенокардии и сердечной недостаточности. Генетические различия в реакции на эти препараты могут иметь большие клинические перспективы. В настоящее время показано, что индивидуумы с аллелью Gly 389 имеют сниженную чувствительность к блокаторам [21]. Кроме того, аллель Gly 389 чаще встречается у афроамериканцев (42%), чем у белокожих (28%) [22] и может способствовать известному снижению чувствительности к β-блокаде, которая наблюдается у афроамериканцев.
Данные сниженной реакции на атенолол у Gly 389-гомозиготных индивидуумов являются крайне интересными, и дальнейшие исследования, изучающие эффект Arg 389- Gly полиморфизма на клинические исходы у генотипированных пациентов в различных этнических группах, получающих β-блокаторы, будут иметь большое значение для прогнозирования действия этих препаратов у пациентов различных этнических групп. Интересный вопрос для акушерских анестезиологов – объясняет ли этот полиморфизм неэффективность лабеталола при лечении артериальной гипертензии, индуцированной беременностью, и преэклампсии у некоторых женщин.
β2 -адренергические рецепторы
β2 -АР расположены на поверхности многочисленных клеток гладких мышц (бронхов, матки, сосудов, и т.д.). Они обеспечивают релаксацию клеток в ответ на эндогенные катехоламины и синтетические β2 -агонисты. Некоторые SNPs идентифицированы на β2 -АР, с тремя SNPs ( Arg 16 Gly , Gln 27 Glu , Thr 164 Ile ) специфично связанными с измененными фенотипами (рис.1) [23]. Отсутствие сильной связи существует между 16 и 27 кодоном. На самом деле, Glu 27 в гомозиготном состоянии почти всегда связан с Gly 16, в то время как Gln 27 в гомозиготном состоянии может быть отражен с Arg 16, Gly 16 или Arg 16 Gly . Было определено in vitro, что Gly вариант повышает рецепторную понижающую регуляцию, хотя наличие мутантного Glu 27, как, оказалось, снижает рецепторную понижающуюся регуляцию, однако, предотвращает тахифилаксию [24].
Согласуясь с данными in vitro, что рецепторная понижающая регуляция повышается в присутствии варианта Gly 16. Бронхиальная астма - образец для гомозиготной Arg 16 - имеет повышенную реакцию на ? 2 -агонист бронходилататоры при сравнении с пациентами гомозиготными по Gly 16 [25]. Однако, современное генотипо-стратифицированное, рандомизированное, плацебоконтролируемое перекрестное исследование исходов лечения у больных с бронхиальной астмой средней тяжести, показало длительное улучшение течения заболевания во время лечения альбутеролом. В то же время, больные гомозиготные по Arg 16 не отреагировали на применение этого бронходилататора [26]. Точное объяснение этих данных и будут ли происходить наблюдаемые побочные эффекты при гомозиготности Arg 16 при более тяжелой форме бронхиальной астмы во время лечения или ингаляций кортикостероидов, остается до конца не ясным.
Гипотеза о том, что генотип β2 -АР может влиять на исходы беременности у женщин с риском преждевременных родов, протестирована с помощью фармакогенетических исследований. Оказалось, что генотип Arg 16 может иметь защитный эффект против преждевременных родов [27, 28]. Кроме того, более вероятно, что на реакцию в ответ на терапию ? 2 -агонистами в целях токолиза влияет генетический профиль женщин с преждевременными родами [29]. Остается выяснить, влияет ли генотип β2 -АР на тяжесть заболевания (т.е., что у женщин с гомозиготой Arg 16 проявляется более низкая вероятность преждевременных родов, чем женщин с другими генотипами).
Относительно эффекта генетической вариабельности β2 -АР на гемодинамическую регуляцию, было показано, что сосудистый тонус и сосудистая реактивность на β2 -агонисты (изопротеренол) варьирует согласно генетическому профилю β2 -АР в положении 16 и 27 [30-33]. В настоящее время, редкий вариант в положении 164 с несколькими гетерозиготами, Thr 164 Ile , связан с неблагоприятным прогнозом относительно застойной сердечной недостаточности [34] вследствие распада β2 -агонистов в присутствии варианта Ile 164, приводящего к сниженному сходству для рецепторов. Сниженная реакция на β2 -агонисты (тербуталин и изопротеренол), подтверждается в функциональных исследованиях на волонтерах, несет на себе редкую аллель Ile 164 [35, 36]. Однако, из-за множественной аллельной связи между всеми тремя, хорошо-описанными SNPs , трудно сделать выводы по частоте аллели в единственном локусе. Это может объяснять, почему некоторые данные исследований ex vitro , не согласуются с данными, которые можно ожидать при работе in vitro [37]. Таким образом, дальнейшие исследования должны сфокусироваться на изучении эффектов in vitro естественно происходящего гаплотипа, с точки зрения этнических различий, а не связи основанной на единственном локусе, что обеспечит дальнейшее важное понимание в функциональном эффекте полиморфизма β2 -АР.
Опиоиды
Межиндивидуумная вариабельность в болевом ощущении и восприимчивость к терапии анальгетиками в течение долгого времени является предметом многочисленных исследований. Хотя опиоиды являются наиболее широко используемыми препаратами для лечения острой и хронической боли, они демонстрируют значительную межиндивидуумную вариабельность в эффективности, побочных эффектах и профиле толерантности. С опиоидами, обезболивающий эффект которых может быть подвергнут влиянию изменений в метаболизме препаратов (вовлекающим энзим цитохрома P 450), а также мутации, кодированные для ?-опиоидных рецепторов (μ-ОР).
Цитохром P 450
Цитохром P 450 (CYP) является представителем большой семьи энзимов печени, которые катализируют фазу-1 метаболизма препарата. Один член из этой семьи, CYP 2D6 (спартеин/дебризохин оксигеназа) является особенно интересным, так как вовлекает в метаболизм более чем 100 препаратов. Первоначально он был открыт в результате поразительных различий в фармакокинетике и эффективности препаратов, метаболизируемых ферментами, такими как кодеин, декстрометорфан, метопролол, нортриптилин и многие другие. Ген, кодирующий этот энзим, является высоко полиморфным, с более чем 75 различными аллелями CYP 2D6 (http://www.imm.ki.se/cypalleles), что приводит к различной ферментативной активности с колебанием от 1 до 200%. В результате, каждый индивидуум может быть классифицирован как имеющий сверхбыстрый, повышенный, нормальный или недостаточный метаболизм [5]. CYP 2D6 отсутствует у 7-10% белокожих [38, 39], так что переход кодеина в морфин путем О-деметилирования может наблюдаться только у некоторых больных [40]. Так как кодеин должен быть конвертирован в морфин для получения обезболивающего эффекта, больные с недостаточным метаболизмом не достигают анальгезии при применении кодеина [41, 42] и чаще сталкиваются с такими побочными эффектами, как тошнота и рвота [43]. И напротив, интоксикация кодеином может быть ускорена при сверхбыстром метаболизме CYP 2D6 [44].
Рецепторы μ-опиоидов
Рецепторы μ-опиоидов (?-ОР), которые кодируются генетическим локусом OPRM 1 , стали центром многочисленных генетических исследований [45-49], так как этот рецептор является первичным местом действия многих эндогенных опиоидных пептидов, включая β-эндорфин и энкефалин, и большинства мишеней для опиоидных анальгетиков, таких как морфин, героин, фентанил и метадон. μ-ОР являются GPSR , и ряд SNPs описаны для OPRM 1 [50, 51]. В нуклеотидном положении 118, замещение аденина гуанином (A 118 G), замена остатка аспарагина в аминокислоте в положении 40 на остаток аспартата ( As - n 40 Asp ), как сообщалось, происходит с аллельной частотой 10-20% [51-53]. In vitro , полиморфизм A 118 G повышает сродство связывания с рецепторами и возможности реализации эффектов β-эндорфина [53]. Таким образом, индивидуумы, несущие вариант гена этого рецептора, могут показать различия в некоторых функциях, вызванных действием β-эндорфина на измененной ?-ОР.
Этническая вариабельность также вносит в этот вопрос существенный вклад. Частота гомозиготных и гетерозиготных G 118 субъектов равна 2% и 20% соответственно, с 11,5% аллельной частотой G 118, невзирая на пол среди белокожих пациентов [53]. У жителей Азии частота G 118 вариант является более высокой, с колебанием от 35 до 47% (у китайцев 35%; у представителей народа таи 44%; у малайцев 45%; у индусов 47%) [54] и частота среди японцев превышает 49% [52]. Интересно, что в популяции афроамериканцев этот вариант отмечается намного реже, чем во всех других этнических группах [55].
Было проведено исследование влияния in vivo полиморфизма A 118 G на сужение зрачка в ответ на введение морфина и морфин-6-глюкуронида (M6G) [56, 57]. Авторы сделали вывод, что аллель G 118 может быть одним из нескольких генов или факторов, создающих защиту против побочных эффектов опиоидов связанных с M6G. Проведено исследование взаимоотношений этого полиморфизма с реакцией на оральные опиоиды, используемых для лечения хронической боли [58]. Кроме того, два исследования сообщили, что индивидуумы с аллелью G 118 имели повышенную реакцию на кортизол при сравнении с гомозиготой A 118, что предполагает клинические проявления существующего полиморфизма [59, 60].
Частота варианты A 118 G относительно высокая в акушерской популяции различной этничности в двух разных учреждениях (в США и в Европе). Общая аллельная частота G 118 была 18,85% [61]. Тот факт, что генетическая варианта μ-ОР связана с повышенной реакцией на β-эндорфин присутствовала у более чем 30% акушерской популяции, что может иметь клинические следствия. Дальнейшие исследования для оценки влияния этого генетического варианта на обезболивание в родах и нейроаксиальную потребность в опиоидах при обезболивании родов продолжается.
Сегодня, исследовано небольшое количество мутаций/полиморфизма, вызывающих боль у человека. Среди исследований пригодных генов-кандидатов для этой связи, по крайней мере, 20 генов ( IL6, TNF α, COMT, OPRM 1 и т.д.) с функциональной SNPs были рассмотрены в качестве перспективных для дальнейших исследований [62]. Исследования генов, предположительно вовлекаемых в процесс боли, может позволить улучшить понимание генетических факторов, которые связаны с острой болью и развитием хронической нейропатической боли [62, 63].
Эндотелиальный ген синтеза оксида азота
Этот ген стал темой многочисленных исследований, так как оксид азота (NO) является «модной» молекулой, вовлеченной во многие физиологические пути метаболизма. Довольно обычный SNP генного кодирования для эндотелиальной синтетазы окиси азота (eNOS), Glu 298 Asp полиморфизм, связан с высоким риском развития артериальной гипертензии и сердечно-сосудистых заболеваний [64-71].
Риск развития преэклампсии и отслойки плаценты повышается у японок, несущих вариант Asp , но эта связь не была подтверждена в других этнических группах [72-80]. Также было показано, что женщины, несущие аллель Asp 298, имеют нарушения сосудистой адаптации (уменьшение общего периферического сосудистого сопротивления) в ранние сроки беременности, что важно для понимания генетической основы преэклампсии [81].
Кроме того, полиморфизм Glu 298 Asp также связан с усиленной реакцией на агонист α1 -АР фенилэфрин [82], предполагая, что взаимодействие между NO и катехоламинами генетически детерминировано и может формировать реакцию на многочисленные препараты, вовлекая механизмы изменения сосудистого тонуса и регуляцию артериального давления. Этот генетический вариант объясняет, почему реакция на фенилэфрин, используемый для лечения артериальной гипотонии во время спинномозговой анестезии при кесаревом сечении, является такой вариабельной между индивидуумами [83].
ДАЛЬНЕЙШЕЕ ПРИМЕНЕНИЕ
Сегодня, выбор препарата не предусматривает межиндивидуумную генетическую вариабельность. Вполне вероятно, что определенные препараты обладают потенциалом для развития серьезных побочных эффектов или являются неэффективными у определенного подкласса популяции вследствие неблагоприятного соотношения эффективность/токсичность. И напротив, фармацевтическая промышленность не поставляет на рынок препарат, который является эффективным только у 20% популяции, хотя такой препарат может оказаться эффективным для больных, несущих редкий генотип.
Прицельная терапия на генотип подразумевает, во-первых, что фармацевтическая промышленность определяет профиль эффективность/токсичность для каждого продукта согласно генотипу и устанавливает рекомендации для использования препаратов согласно генотипу. Это уже сделано для некоторых психотропных препаратов [84]. Кроме того, до начала специфической терапии каждый индивидуум должен быть генотипирован на предмет всех значимых SNP .
С прогрессом в технологии, вероятно, что каждое генетическое подмножество популяции будет пролечено специфически полученным препаратом для обеспечения искомого эффекта. Потенциальный риск, и этическая дилемма, каждого прогресса заключается в том, что препараты могут иметься в наличии только для более распространенных генетических подгрупп, и индивидуумы несущие редкие генетические варианты будут игнорироваться в пределах высоких технологий в высоко модернизированной медицинской среде. Возможно, что в будущем, антигипертензивные также как обезболивающие препараты будут созданы с учетом генетики адренергических и ?-опиоидных рецепторов.
В заключение, хотя возможно еще рано ожидать непосредственных результатов фармакогенетики для повседневной практики анестезиолога, вероятно, что прогресс в области геномики даст лучшее понимание SNPs и гаплотипов, которые изменяют реакции на препарат. Эти открытия в будущем позволят «нацеливание» анестезиологических препаратов и персонализацию стратегий обезболивания, направленных на улучшение периоперационных исходов, а также на лечение острой и хронической боли, в соответствии с генетическим профилем наших больных.
ЛИТЕРАТУРА
- Kalow W., Gunn D.R. The relation between dose of succinylcholine and duration of apnea in man. J Pharmacol Ехр Ther 1957; 120: 203-214.
- Sachidanandam R., Weissman D., Schmidt S.С ., et al. А тар of human genome sequence variation containing 1.42 million single nucleotide polymorphisms. Nature 2001; 409: 928-933.
- Wood А. J. Ethnic differences in drug disposition and response. Ther Drug Monit 1998; 20: 525-526.
- Evans W.Е , Johnson J.А. Pharmacogenomics: the inherited basis for interindividual differences in drug response. Annu Rev Genomics Hum Genet 2001; 2: 9-39.
- Weinshilboum R. Inheritance and drug response. N Engl J Med 2003; 348: 529-537.
- Evans W.Е., McLeod Н.L. Рhаrmасоgеnоmiсs drug disposition, drug targets, and side effects. N Engl J Med 2003; 348: 538-549.
- Girard Т., Treves S., Voronkov Е., Siegemund М., Urwyler А. Molecular genetic testing for malignant hyperthermia susceptibility. Anesthesiology 2004; 100: 1076-1080.
- К irstein S. L., Insel Р. А. Autonomic nervous system pharmacogenomics: а progress report. Pharmacol Rev 2004; 56: 31-52.
- Stone L.S., MacMillan L.В., К itto К.F., Limbird L.Е., Wilcox G.L. The alpha2a adrenergic receptor subtype mediates spinal analgesia evoked by alpha2 agonists and is necessary for spinal adrenergicopioid synergy. J Neurosci 1997; 17: 7157-7165.
- Kable J.W., Murrin L.С ., Bylund D.В. In vivo gene modification elucidates subtype-specific functions of alpha (2)-adrenergic receptors. J Pharmacol Exp Ther 2000; 293: 1-7.
- Link R.Е., Desai К., Hein L., et al. Cardiovascular regulation in mice lacking alpha2-adrenergic receptor subtypes b and c. Science 1996; 273: 803-805.
- Holmberg М., Fagerholm V., Scheinin М. Regional distribution of alpha( 2C )-adrenoceptors in brain and spinal cord of control mice and transgenic mice overezpressing the alpha( 2C )-subtуре : an autoradiographic study with [(3) Н ]RX821002 and [(3) Н ]rauwolscine. Neuroscience 2003; 117: 875-898.
- Hein L., Altman J.D., Kobilka В.К. Two functionally distinct alpha2-adrenergic receptors regulate sympathetic neurotransmission. Nature 1999; 402: 181-184.
- Small К.М., Forbes S.L., Rahman F.F., Bridges К.М., Liggett S.В. А four amino acid deletion polymorphism in the third intracellular loop of the human alpha 2C-adrenergic receptor confers impaired coupling to multiple effectors. J Biol Chem 2000; 275: 23059-23064.
- Small К.М., Wagoner L.Е., Levin А.М., Kardia S.L., Liggett S.В. Synergistic polymorphisms of beta1- and alpha2C-adrenergic receptors and the risk of congestive heart failure. N Engl J Med 2002; 347: 1135-1142.
- Heinonen Р., Jartti L., Jarvisalo М.J., et al. Deletion polymorphism in the alpha2B-adrenergic receptor gene is associated with flow-mediated dilatation of the brachial artery. Clin Sci (Lond) 2002; 103: 517-524.
- Snapir А., Koskenvuo J., Toikka J., et al. Effects of common polymorphisms in the alpha1A-, alpha2B-, beta1- and beta2-adrenoreceptors on haemodynamic responses to adrenaline. Clin Sci (Lond) 2003; 104: 509-520.
- Snapir А., Mikkelsson J., Perola М., Penttila А., Scheinin М., Karhunen Р.J. Variation in the alpha2B-adrenoreceptor gene as а risk factor for prehospital fatal myocardial infarction and sudden cardiac death. J А m Coll Cardiol 2003; 41: 190-194.
- Snapir А., Heinonen Р., Tuomainen Т. Р., et al. An insertion/deletion polymorphism in the alpha2B-adrenergic receptor gene is а novel genetic risk factor for acute coronary events. J А m Coll Cardiol 2001; 37: 1516-1522.
- Mason D.А., Моorе J.D., Green S.А., Liggett S.В. А gain-of-function polymorphism in а G-protein coupling domain of the human beta1-adrenergic receptor. J Biol Chem 1999; 274: 12670-12674.
- Sofowora G.G., Dishy V., Muszkat М., et al. А common beta1-adrenergic receptor polymorphism (Arg389Gly) affects blood pressure response to beta-blockade. Clin Pharmacol Ther 2003; 73: 366-371.
- Xie Н.G., Dishy V., Sofowora G., et а l. Arg389Gly beta 1-adrenoceptor polymorphism varies in frequency among different ethnic groups but does not alter response in vivo. Pharmacogenetics 2001; 11: 191-197.
- Liggett S.В. Polymorphisms of the beta2-adrenergic receptor. N Engl J Med 2002; 346: 536-538.
- Green S.А., Turki J., Innis М., Liggett S.В. А min о -terminal polymorphisms of the human beta 2-adrenergic receptor impart distinct agonist-promoted regulatory properties. Biochemistry 1994; 33: 9414-9419.
- Lima J.J., Thomason D.В., Mohamed М.Н., Eberle L.V., Self Т.Н., Johnson J.А. Impact of genetic polymorphisms of the beta2-adrenergic receptor on albuterol bronchodilator pharmacodynamics. Clin Pharmacol Ther 1999; 65: 519-525.
- Israel Е., Chinchilli V.М ., Ford J.О., еt al. Use of regularly scheduled albuterol treatment in asthma: genotype-stratified, randomised, placebo-controlled cross-over trial. Lancet 2004; 364: 1505-1512.
- Landau R., Xie Н . О ., Dishy V., е t al. beta2-Adrenergic receptor genotype and preterm delivery. Am J Obstet Gynecol 2002; 187: 1294-1298.
- Doh К., Sziller I., Vardhana S., Kovacs Е., Рарр Z., Witkin S.S. Beta2-adrenergic receptor gene polymorphisms and pregnancy outcome. J Perinat Med 2004; 32: 413-417.
- Landau R., Morales М., Antonarakis S., еt al. Genotype of the В 2 adrenergic receptor determines response to tocolysis. Anesthesiology 2003; 98(suppl 1): 10.
- Busjahn А., Li G.Н., Faulhaber Н.D., et al. beta-2 adrenergic receptor gene variations, blood pressure, and heart size in normal twins. Hypertension 2000; 35: 555-560.
- Cockcroft J.R., Gazis А.G., Cross D.J., et al. Beta (2)-adrenoceptor polymorphism determines vascular reactivity in humans. Hypertension 2000; 36: 371-375.
- Dishy V., Sofowora G.О ., Xie Н.О., et al. Тhe effect of со mm о n polymorphisms of the beta2-adrenergic receptor о n agonist-mediated vascular desensitization. N Engl J Med 2001; 345: 1030-1035.
- Hoit В. D., Suresh D. Р., Craft L., Walsh R.А ., Liggett S. В . beta2adrenergic receptor polymorphisms а t amino acid 16 differentially influence agonist-stimulated blood pressure and peripheral blood flow in normal individuals. Am Heart J 2000; 139: 537-542.
- Liggett S. В., Wagoner L.Е., Craft L.L., et al. Тhe Il е 164 beta2-adrenergic receptor polymorphism adversely affects the outcome of congestive heart failure. J Clin Invest 1998; 102: 1534-1539.
- Brodde О.Е., Buscher R., Tellkamp R., et al. Blunted cardiac responses to receptor activation in subjects with Thr164Ile beta (2)-adrenoceptors. Circulation 2001; 103: 1048-1050.
- Dishy V., Landau R., Sofowora G.О., et al. beta2-adrenoceptor Т hrI64Ile polymorphism is associated with markedly decreased vasodilator and increased vasoconstrictor sensitivity in vivo. Pharmacogenetics 2004; 14: 517-522.
- Leineweber К., Brodde О. Е. Beta2-adrenoceptor polymorphisms: relation between in vitro and in vivo phenotypes. Life Sci 2004; 74: 2803-2814.
- Alvan G., Bechtel Р., Iselius L., Gundert-Remy U. Hydroxylation polymorphisms of debrisoquine and mephenytoin in European populations. Eur J Clin Pharmacol 1990; 39: 533-537.
- Williams D.О., Patel А., Howard R.F. Pharmacogenetics of codeine metabolism in а n urban population of children and its implications for analgesic reliability. Br J Anaesth 2002; 89: 839-845.
- Dayer Р., Desmeules J., Leemann Т., Striberni R. Bioactivation of the narcotic drug codeine in human liver is mediated by the polymorphic monooxygenase catalyzing debrisoquine 4hydroxylation (cytochrome Р -450 dbl/bufI). Biochem Biophys Res Со mmun 1988; 152: 411-416.
- Desmeules J., Gascon М.Р., Dayer Р., Magistris М. Impact of environmental and genetic factors о n codeine analgesia. Eur J Clin Pharmacol 1991; 41: 23-26.
- Sindrup S.Н., Brosen К. Тhе pharmacogenetics of codeine hypoalgesia. Pharmacogenetics 1995; 5: 335-346.
- Eckhardt К., Li S., Аmmоn S., Schanzle G., Mikus G., Eichelbaum М. Sаmе incidence of adverse drug events after codeine administration irrespective of the genetically determined differences in morphine formation. Pain 1998; 76: 27-33.
- Gasche V., Daali Y., Fathi М., et al. Codeine intoxication associated with ultrarapid CYP2D6 metabolism. N Engl J Med 2004; 351: 2827-2831.
- Gaveriaux-Ruff С., Кieffer В.L. Opioid receptor genes inactivated in mice: the highlights. Neuropeptides 2002; 36: 62-71.
- К ieffer В. L., Gaveriaux-Ruff С. Exploring the opioid system by gene knockout. Prog Neurobiol 2002; 66: 285-306.
- Mogil J.S. Тhе genetic mediation of individual differences in sensitivity to pain and its inhibition. Proc Natl Acad Sci U S А 1999; 96: 7744-7751.
- Pastemak G.W. Тhе pharmacology of mu analgesics: from patients to genes. Neuroscientist 2001; 7: 220-231.
- Uhl G.R., Sora I., Wang Z. Тhе mu opiate receptor as а candidate gene for pain: polymorphisms, variations in expression, nociception, and opiate responses. Proc Natl Acad Sci U S А 1999; 96: 7752-7755.
- Grosch S., Niederberger Е., Lotsch J., et al. А rapid screening method for а single nucleotide polymorphism (SNP) in the human MOR gene. Br J Clin Pharmacol 2001; 52: 711-714.
- LaForge К.S., Shick V., Spangler R., et al. Detection of single nucleotide polymorphisms of the human mu opioid receptor gene by hybridization or single nucleotide extension on custom oligonucleotide gelpad microchips: potential in studies of addiction. Am J Med Genet 2000; 96: 604-615.
- Gelernter J., Кranzler Н., Cubells J. Genetics of two mu opioid receptor gene (OPR М I) ехо n I polymorphisms: population studies, and allele frequencies in alcohol- and drug-dependent subjects. Мо l Psychiatry 1999; 4: 476-483.
- Bond С., LaForge К. S., Tian М., et al. Single-nucleotide polymorphism in the human mu opioid receptor gene alters beta-endorphin binding and activity: possible implications for opiate addiction. Proc Natl Acad Sci U S А 1998; 95: 9608-9613.
- Tan Е.С., Tan С.Н., Karupathivan U., Yар Е.Р. Мu opioid receptor gene polymorphisms and heroin dependence in Asian populations. Neuroreport 2003; 14: 569-572.
- Crowley J.J., Oslin D.W., Patkar А.А., et al. А genetic association study of the mu opioid receptor and severe opioid dependence. Psychiatr Genet 2003; 13: 169-173.
- Lotsch J., Skarke С., Grosch S., Darimont J., Schmidt Н., Geisslinger G. Тhе polymorphism А 118G of the human mu-opioid receptor gene decreases the pupil constrictory effect of morphine-6-glucuronide but not that of morphine. Pharmacogenetics 2002; 12: 3-9.
- Lotsch J., Zimmermann М., Darimont J., et al. Does the A118G polymorphism at the mu-opioid receptor gene protect against morphine-6-glucuronide toxicity. Anesthesiology 2002; 97: 814-819.
- Kleрstаd Р., Rakvag Т. Т., Kaasa S., et al. The 118 А > G polymorphism in the Human micro-opioid receptor gene m ау increase morphine requirements in patients with pain caused by malignant disease. Acta Anaesthesiol Scand 2004; 48: 1232-1239.
- Hernandez-Avila С. А., Wand О., Luo Х., Gelernter J., Кranzler Н.R. Association between the cortisol response to opioid blockade and the Asn40Asp polymorphism а t the mu-opioid receptor locus (OPRM1). А m J Med Genet 2003; 118 В : 60-65.
- Wand G.S., МасCaul М., Yang Х., et al. Тhе mu-opioid receptor gene polymorphism (A118G) alters НРА axis activation induced by opioid receptor blockade. Neuropsychopharmacology 2002; 26: 106-114.
- Landau R., Саhаnа А., Smiley R.М., Antonarakis S.Е., Вlouin J.L. Genetic variability of mu-opioid receptor in an obstetric population. Anesthesiology 2004; 100: 1030-1033.
- Belfer I., Wu Т., Кingman А., Кrishnaraju R.К., Goldman D., Мах М.В. Candidate gene studies of human pain mechanisms: methods for optimizing choice of polymorphisms and sample size. Anesthesiology 2004; 100: 1562-1572.
- Eisenach J.С. Fishing for genes: practical ways to study genetic polymorphisms for pain. Anesthesiology 2004; 100: 1343-1344.
- Casas J.Р., Bautista L.Е., Humphries S.Е., Hingorani А.D. Endothelial nitric oxide synthase genotype and ischemic heart disease: meta-analysis of 26 studies involving 23028 subjects. Circulation 2004; 109: 1359-1365.
- Chang К., Baek S.Н ., Seung К.В., et al. Тhе Glu298Asp polymorphism in the endothelial nitric oxide synthase gene is strongly associated with coronary spasm. Coron Artery Dis 2003; 14: 293-299.
- Rossi G.Р., Cesari М., Zanchetta М., et al. Тhе Т-786 С endothelial nitric oxide synthase genotype is а novel risk factor for coronary artery disease in Caucasian patients of the GENICA study. J А m Со ll Cardiol 2003; 41: 930-937.
- Colombo М.G., Paradossi U., Andreassi М.G., et al. Endothelial nitric oxide synthase gene polymorphisms and risk of coronary artery disease. Clin Chem 2003; 49: 389-395.
- Hingorani А.D. Endothelial nitric oxide synthase polymorphisms and hypertension. Curr Hypertens Rep 2003; 5: 19-25.
- Shoji М., Tsutaya S., Saito R., Takamatu Н., Yasujima М. Positive association of endothelial nitric oxide synthase gene polymorphism with hypertension in northern Japan . Life Sci 2000; 66: 2557-2562.
- Benjafield А. V., Morris В.J. Association analyses of endothelial nitric oxide synthase gene polymorphisms in essential hypertension. А m J Hypertens 2000; 13: 994-998.
- Miyamoto Y., Saito Y., Kajiyama N., et al. Endothelial nitric oxide synthase gene is positively associated with essential hypertension. Hypertension 1998; 32: 3-8.
- Lade J.А., Moses Е.К ., Guo G., et al. Тhе eNOS gene: а candidate for the preeclampsia susceptibility locus. Hypertens Pregnancy 1999; 18: 81-93.
- Yoshimura Т., Yoshimura М., Tabata А., et al. Association of the missense Glu298Asp variant of (endothelial nitric oxide synthase gene with severe preeclampsia. J Soc Gynecol Investig 2000; 7: 238-241.
- Yoshimura Т., Yoshimura М., Tabata А., Yasue Н., Okamura Н. Тhе missense Glu298Asp variant of the endothelial nitric oxide synthase gene is strongly associated with placental abruption. Hum Genet 2001; 108: 181-183.
- Kobashi G., Yamada Н., Ohta К., et al. Endothelial nitric oxide synthase gene (NOS3) variant and hypertension in pregnancy. А m J Med Genet 2001; 103: 241-244.
- Tempfer С. В., Jirecek S., Riener Е. К., et al. Polymorphisms of thrombophilic and vasoactive genes and severe preeclampsia: а pilot study. J Soc Gynecol Investig 2004; 11: 227-231.
- Serrano N.С., Casas J.Р., Diaz L.А., et al. Endothelial NO synthase genotype and risk of preeclampsia: а multicenter case-control study. Hypertension 2004; 44: 702-707.
- Hakli Т., Romppanen Е.L., Hiltunen М., Helisalmi S., Punnonen К., Heinonen S. Endothelial nitric oxide synthase polymorphism in preeclampsia. J Soc Gynecol Investig 2003; 10: 154-157.
- Yoshimura Т., Chowdhury F.А ., Yoshimura М., Okamura Н. Genetic and environmental contributions to severe preeclampsia: lack of association with the endothelial nitric oxide synthase Glu298Asp variant in а developing country. Gynecol Obstet Invest 2003; 56: 10?13.
- Landau R., Xie Н.G., Dishy V., Wood А.J., Stein С.М., Smiley R.М. No association of, the Asp298 variant of th е endothelial nitric oxide synthase gene with preeclampsia. А m J Hypertens 2004; 17: 391-394.
- Savvidou М.D., Vallаnсе Р.J., Nicolaides К.Н., Hingorani А.D. Endothelial nitric oxide synthase gene polymorphism and maternal vascular adaptation to pregnancy. Hypertension 2001; 38: 1289-1293.
- Philip I., Plantefeve G., Vuillaumier-Barrot S., et al. G894T polymorphism in th е endothelial nitric oxide synthase gene is associated with an enhanced vascular responsiveness to phenylephrine. Circulation 1999; 99: 3096-3098.
- Landau R., Negron М., Вlouin J.L., et al. Effect of eNOS genetic polymorphism on hypotension and treatment response during spinal anesthesia for cesarean section. Anesthesiology 2004; 100(Suppl): А 52.
- Кirchheiner J., Bertilsson L., Bruus Н., Wolff А., Roots I., Bauer М. Individualized medicine-implementation of pharmacogenetic diagnostics in antidepressant drug treatment of major depressive disorders. Pharmacopsychiatry 2003; 36(Suppl 3): S235-S243.
Pharmacogenetics: implications for obstetric anesthesia.
International Journal of Obstetric Anesthesia (2005)14,300-304