Регионарная анестезия у больных с нарушениями иммунитета
Terese T. Horlocker, M.D.,
Denise J. Wedel, M.D.
Нейроаксиальная анестезия и анальгезия имеет некоторые преимущества перед системным применением опиоидов, включая лучшую анальгезию, снижение легочных осложнений, сниженную частоту окклюзии трансплантата и улучшенную подвижность сустава после больших ортопедических операций [1-4]. Кроме того, нейроаксиальная анальгезия может снижать риск инфекции посредством ослабления стрессовой реакции и защитой иммунной системы [1]. Несмотря на эти положительные моменты пациенты с измененным иммунным статусом вследствие наличия сахарного диабета, опухолей, иммуносупрессии после трансплантации органов и вследствие хронических инфекций, вызванных вирусом иммунодефицита человека (ВИЧ) или простым вирусом герпеса (ВПГ), часто не рассматриваются в качестве кандидатов для проведения нейроаксиальных методов из-за риска инфекции в спинном мозге или в пределах позвоночного канала. Эти пациенты восприимчивы к инфекциям, вызванным условно-патогенными микроорганизмами, и так как антибактериальная терапия является менее эффективной, имеют повышенную заболеваемость и смертность при сравнении с больными с нормальной иммунной системой. Таким образом, сниженный иммунный статус повышает как частоту, так и тяжесть инфекций.
Относительный риск инфекций центральной нервной системы (ЦНС) у больных с измененным иммунным статусом при сравнении с нормальным состоянием не известен. Исторически, частота тяжелых инфекций ЦНС, таких как арахноидит, менингит и абсцесс после спинальной или эпидуральной анестезии, рассматривается как крайне низкая; случаи инфекции были сообщены как отдельные сообщения о случаях или небольшие серии случаев [5-7]. Однако, современные эпидемиологические исследования, проведенные в Европе, предполагают, что частота инфекционных осложнений, связанных с нейроаксиальными методами, может расти [8, 9]. В национальном исследовании, выполненном в период с 1997 по 1998 год в Дании, Wang с соавторами [9] подсчитали, что риск персистирующих неврологических нарушений составляет 1 случай на 4343 эпидуральных аналгезий. Moen с соавторами [8] провели обзорное исследование шведского опыта начиная с 1990 года по 1999 год и сообщили о низкой частоте эпидуральных абсцессов, но была выявлена необнадеживающая связь с менингитом после спинального блока. Часто эти инфекционные осложнения имеют место у больных с нарушениями иммунитета.
Нейроаксиальная анестезия и анальгезия, и иммунная система
Существует много защитных механизмов в организме. Первый барьер (или линия защиты) - это кожа, которая поддерживает важность асептических методов во время регионарной анестезии. Однако если микроорганизм попадает в организм человека, 2 различных типа иммунологических реакций могут запускаться: гуморальные и клеточные. Гуморальный иммунитет вовлекает синтез и высвобождение антител в кровь и в другие биологические жидкости организма. Антитела, которые вырабатываются B -лимфоцитами, нейтрализуют токсины и усиливают фагоцитоз бактерий. Клеточные механизмы вызывают иммунитет к инфекционным микроорганизмам, которые уже живут и размножаются внутри клеток хозяина (т.е., вирусы, паразиты и микобактерии). Клеточно-стимулированные реакции используют действие T -лимфоцитов и фагоцитов для поглощения и разрушения вирусов, грибков и клеток, инородных для организма (включая трансплантаты ткани/органа). Примерно 70% T -лимфоцитов являются «хелперами»/индукторами клеток, которые повышают число макрофагов и нейтрофилов в ответ на инфекцию. Эти T -лимфоциты также способствуют продукции антител путем стимуляции роста и функции B -лимфоцитов. Оставшиеся 30% T -лимфоцитов являются цитотоксическими и непосредственно атакуют и лизируют клетки, несущие антиген-мишень. Несмотря на то, что есть взаимодействие между компонентами иммунной системы, каждое иммунодефицитное состояние связано с чувствительностью к подмножеству патогенов. Например, пациенты с нарушенной функцией нейтрофилов, такой как при сахарном диабете, восприимчивы к инфекциям, вызванным золотистым стафилококком и грибком рода Candida . Инфекции, вызванные вирусами, наиболее часто происходят у больных с недостаточностью T -лимфоцитов, включая пациентов с ВИЧ и лимфомой.
Экспериментальные модели и клинические исследования единообразно показывают, что реакция на хирургический стресс подавляет как клеточный, так и гуморальный иммунитет на несколько дней после операции [10]. Следовательно, иммуносупрессивные эффекты могут быть усилены и/или пролонгированы у больных с предшествующей иммунологической дисфункцией (таблица 1). Эти эффекты клинически значимы и приводят к предрасположенности не только к послеоперационным инфекционным осложнениям, но также к росту опухоли и метастазам [11, 12]. Например, транзиторное подавление иммунной функции после периоперационного переливания крови значительно повышает частоту инфекционных осложнений и может изменять частоту рецидива заболевания у больных с раком прямой кишки [13].
Таблица 1. Инфекции у больных с нарушением иммунитета.
| Ослабленная воспалительная реакция у больного с нарушением иммунитета может снижать клинические признаки и симптомы, часто связанные с инфекциями, и приводить к задержке диагностики и лечения. |
| Спектр микроорганизмов, вызывающих инвазивные инфекции, в организме с нарушенным иммунитетом гораздо более широкий, чем спектр, поражающий общую популяцию, и включает атипичные и условно-патогенные микроорганизмы. |
| Начало ранней и эффективной терапии является первостепенным при оптимизации неврологического исхода - рекомендуется консультация специалистом по инфекционным заболеваниям. |
| Длительная антибактериальная терапия (недели-месяцы) часто требуется из-за персистирующих и иммунологических нарушений. |
| Так как излечение от инфекции является трудным если она развилась, профилактика будет иметь первостепенное значение при уходе за больными с нарушенным иммунитетом. |
Анестезиологическое обеспечение теоретически может влиять на периоперационный исход посредством изменения воспалительных и эндокринных реакций на хирургический стресс [14]. Общая анестезия, за исключением больших доз опиоидов, не подавляет реакцию на хирургический стресс и таким образом может усугублять послеоперационную иммуносупрессию [15]. И наоборот, нейроаксиальная анестезия и анальгезия связаны с умеренной защитой клеточного и гуморального иммунитета. Эффекты наиболее резко выражены у больных высокого риска , которым проводятся процедуры « ниже пупка » [1]. Ослабление стрессовой реакции, связанное с регионарными методами, поддерживается при наличии сочетания общая-нейроаксиальная анестезия, при условии, что эпидуральная аналгезия продолжается в послеоперационном периоде; спинальные методы с однократным введением и эпидуральные методы в значительной степени не изменяют послеоперационное ухудшение функции иммунной системы. Эффект периферической блокады на стрессовую реакцию/иммунную функцию остается неопределенным.
Суммарно, несмотря на эти подтвержденные успехи, клиническая важность вызванных анестезией изменений в отношении периоперационной иммуносупрессии остается неизвестной. В настоящее время нет клинических исследований, оценивающих влияние выбора анестезии и аналгезии на исход после онкологических операций или у больных с нарушениями иммунитета.
Эпидемиология и патогенез менингита и эпидурального абсцесса
Бактериальный менингит - это наиболее частая форма инфекции ЦНС, с ежегодной частотой в Соединенных штатах более > 2,5 случаев на 100000 населения. Эпидемиология бактериального менингита значительно изменилась в последние годы после внедрения и в большей степени широкого использования вакцины против H . influenzae и N . meningitides . В настоящее время, Staphylo coccus pneumoniae выявляется примерно в двух третях случаев приобретенного менингита; причинные микроорганизмы нозокомиального менингита включают грам-отрицательные палочки, золотистый стафилококк и коагулаза-отрицательные стафилококки. Большинство случаев менингита связаны с текущими инфекциями (особенно инфекциями уха или респираторными инфекциями) или с травмой черепа. Дополнительные факторы риска включают измененный иммунный статус, включая инфекции ВИЧ, анамнез внутривенной наркомании или текущую травма черепа.
Пациенты с острым бактериальным менингитом могут быстро ухудшаться. Продолжительность симптомов перед проявлением часто составляет менее 24 часов. Классическая триада - лихорадка, ригидность затылочных мышц и измененное состояние психики - может не проявляться у 1/3 больных. Бактериальный менингит относится к неотложным состояниям. Смертность достигает 100% при отсутствии терапии. Даже при соответствующей антибактериальной терапии смертность остается равной приблизительно 30%. Диагноз подтверждается поясничной пункцией. Также следует выполнить посев крови. Поясничную пункцию не следует выполнять, если есть подозрение на эпидуральный абсцесс, так как в результате может произойти контаминация интратекального пространства. Атипичные микроорганизмы, особенно микроорганизмы, связанные со специфическим иммунологическим дефицитом, должны быть рассмотрены [16]. Первостепенное значение – это немедленное назначение антибактериальной терапии, которая является бактерицидной для организмов, а также связанна с высоким прохождением через гематоэнцефалический барьер.
Эпидуральный абсцесс насчитывает от 2 до 12 случаев на 100000 поступлений в третичные стационары. Значительные факторы риска включают подавление иммунитета (сахарный диабет, злокачественные опухоли, применение стероидов и ВИЧ инфекция) и инструментальные вмешательства на позвоночном столбе (травма, операция, дискография и нейроаксиальная блокада). Источником инфекции являются мягкие ткани/кожа или кости и гематогенное распространение из респираторного или мочевыделительного тракта в эпидуральное пространство [7]. Большинство инфекций - бактериальные, несмотря на то, что могут быть микобактериальные и грибковые абсцессы. Наиболее частыми выявляемыми микроорганизмами являются золотистый стафилококк (57%), стрептококки (18%) и грам-отрицательные палочки (13%) [6, 17].
Формирование абсцесса после эпидуральной или спинальной анестезии может быть поверхностным, требуя ограниченного хирургического дренирования и только внутривенного применения антибиотиков. Поверхностные инфекции проявляются местным отеком ткани, покраснением и наличием отделяемого, часто связаны с лихорадкой, но редко вызывают неврологические проблемы, если поверхностные инфекции не лечить. Диагноз может быть более трудным и часто запоздалым у больных с хроническими эпидуральными абсцессами, так как эти больные реже имеют лихорадку или повышенное число лейкоцитов при сравнении с больными с острыми абсцессами. Клиническое течение эпидуральных абсцессов прогрессирует от боли в спине и корешковых болей до слабости (включая симптомы нарушения функции кишечника и мочевого пузыря) и, в конечном счете, до паралича [18, 19]. Начальная боль в спине и корешковые симптомы могут оставаться стабильными в течение нескольких часов - недель. Однако слабость часто прогрессирует до полного паралича в течение 24 часов. Рентгенологические признаки эпидурального образования при наличии различных неврологических нарушений являются диагностическим. Магнитно-резонансное изображение поддерживается как наиболее чувствительный метод оценки при подозрении на инфекции [20-22]. Хирургическое дренирование выполняется при наличии тяжелого и/или быстро прогрессирующего нейро-дефицита. Назначение стероидов и прогрессирующее неврологическое нарушение на момент операции неблагоприятно влияет на исход. Ранняя диагностика и вмешательства являются ключевыми; полное восстановление сообщается в менее чем 40% случаев и обычно происходит у больных с симптомами продолжительностью менее 36 часов [8, 9, 17, 19].
Менингит и эпидуральный абсцесс после нейроаксиальной блокады
Нейроаксиальная анестезия редко вызывает инфекции ЦНС [8, 9]. Aromaa с соавторами [23] сообщили о 8 случаях бактериальный инфекций у больных, которым было проведено 170000 эпидуральных и 550000 спинальных анестезий (1,1 случая на 100000 блокад) по базе данных в Финляндии. Современное эпидемиологическое исследование является не обнадеживающим. В национальном исследовании, выполненном с 1997 по 1998 год в Дании, Wang с соавторами [9] сообщили, что частота эпидуральных абсцессов после эпидуральной анальгезии составляет 1 случай на 1930 катетеров. 8 из 9 пациентов с эпидуральными абсцессами имели иммунодепрессию (рак, диабет и травма). Кроме того, больные с эпидуральным абсцессом была длительная катетеризация эпидурального пространства (медиана 6 дней, от 3 до 31 дня). Часто диагностика запаздывает; время от появления первого симптома до подтверждения диагноза составляло в среднем 5 дней, S . aureus был выделен у 67% больных. Пациенты без неврологических нарушений были успешно пролечены антибиотиками, в то время как больные с неврологическим дефицитом подверглись хирургической декомпрессии (обычно только с умеренным неврологическим восстановлением). Это исследование подтвердило предположение предшествующих отдельных сообщений о случаях, что эпидуральный абсцесс с большей вероятностью происходит у больных с иммунодепрессией и что длительная эпидуральная катетеризация повышает риск эпидурального абсцесса.
В ретроспективном исследовании в течение декады проведенным в Швеции и включающем 1260000 спинальных и 450000 эпидуральных анестезий (включая 200000 проведенных для анальгезии в родах), Moen с соавторами [8] сообщили о тяжелых инфекционных осложнениях. Эпидуральный абсцесс имел место у 13 больных; 9 (70%) рассматривались как больные с иммунодепрессией в результате диабета, терапии стероидами, рака или алкоголизма. 6 пациентов получили эпидуральный блок по поводу аналгезии после травмы. Время от введения эпидурального катетера до первых симптомов колебалось от 2 дней до 5 недель (медиана 5 дней). Доминирующими симптомами были лихорадка и выраженная головная боль; у 5 развились неврологические нарушения. Положительная культура показала S. aureus . В целом, неврологическое восстановление было полным у 7 из 12 пациентов. Однако 4 из 5 пациентов с неврологическими симптомами не восстановились. Менингит был сообщен у 29 больных со средней частотой 1 случай на 53000. Подтвержденная перфорация твердой мозговой оболочки (намеренная или случайная) произошла в 25 из 29 случаев. В отличие от случаев эпидурального абсцесса, которые имели тенденцию выявляться у больных с иммунодепрессией, больные, у которых развился менингит после спинальной анестезии, по сообщениям были здоровыми и получали малые хирургические процедуры. Временной интервал между нейроаксиальной блокадой и симптомами варьировал от 8 часов до 8 дней (медиана 24 часа). Важно, что больные жаловались на головную боль, но классические симптомы менингита (лихорадка, головная боль и ригидность затылочных мышц) имели место только у 14 пациентов. Из 12 больных, у которых были получены положительные культуры: у 11 пациентов был выделен ?-гемолитический стрептококк и у 1 - S . aureus . Менингит привел к остаточным неврологическим нарушениям у 6 пациентов.
Эти большие эпидемиологические исследования отражают новые и неожиданные данные в отношении демографических данных, частоты, этиологии и прогноза инфекционных осложнений после нейроаксиальной анестезии. Эпидуральный абсцесс с большей вероятностью происходит у больных с иммунодепрессией с длительной эпидуральной катетеризацией. Наиболее частым причинным микроорганизмом был S . aureus , что предполагает колонизацию и последующую инфекцию нормальной кожной флорой (как патогенетический фактор). Задержка в диагностике и терапии приводит к неблагоприятному неврологическому восстановлению, несмотря на хирургическую декомпрессию. И наоборот, больные, у которых развивается менингит после нейроаксиальной блокады, обычно здоровые и проводимая спинальная анестезия проходит без особенностей. Микроорганизмы часто культивируются из ротовой части глотки медицинского персонала, выполняющего процедуру, предполагая ятрогенную этиологию [8, 24]. Однако, за несколькими исключениями, большие исследования и сообщения о случаях ротоглоточной флоры в качестве патогена при менингит после спинальной анестезии, исходят из Европы [24]. Более того , эта тенденция сообщается в отношении менингит а после диагностической поясничной пункции [25]. Несмотря на то, что частота серьезных инфекционных осложнений гораздо выше, чем сообщалась ранее, результаты могут быть следствием различия в сообщениях и/или в клинической практике (асептика, периоперационная антибактериальная терапия, длительность эпидуральной катетеризации и отбор больных) [8, 9]. И, наконец, несмотря на то, что современные исследования в основном освещают этиологию, факторы риска и прогноз инфекционных осложнений после нейроаксиальной блокады, подобная информация для больных, которым проводились периферические регионарные методы анестезии и инвазивные болезненные процедуры, ограничена [26-29].
Нейроаксиальная блокада у больных с иммунодепрессией
Большая серия исследований показала, что больные с иммунодефицитом имеют повышенный риск развития инфекционных осложнений при сравнении с больными с интактной иммунной функцией [8, 9]. Однако есть немного исследований, которые оценивали частоту менингита или эпидурального абсцесса у специфической популяции с иммунодефицитом. Strafford с соавторами [30] провели обзор 1620 детей, которым была проведена эпидуральная анальгезия для послеоперационного обезболивания. Эпидуральные катетеры «были оставлены» в среднем на 2 дня (от 0 до 8 дней). Ни у одного больного не развился эпидуральный абсцесс. У одного больного с остеосаркомой, метастазами в позвоночник, грудную стенку и легкие, через 10 дней после эпидуральной катетеризации была отмечена лихорадка. Катетер был удален; культуры показала грибковое поражение. Второй торакальный эпидуральный катетер был введен через 4 дня для обеспечения лучшей анальгезии. Через две недели у больной развился острый сенсорный и моторный блок на уровне T 2. МРТ показало эпидуральное скопление жидкости; была выполнена срочная ламинэктомия. Большое количество некротизированной опухоли, а также жидкости, содержащей C . tropicalis присутствовало в эпидуральном пространстве. Неврологические нарушения у этой пациентки прошли после операции. Еще 3 больных с хроническим болевым синдромом были обследованы с целью исключения эпидуральной инфекции; инфекция не была выявлена ни в одном случае. Авторы сделали вывод, что у терминально больных риск инфекции при длительной эпидуральной катетеризации допустимый, но рекомендуется тщательное мониторирование, чтобы избежать серьезных неврологических последствий.
Длительная катетеризация эпиудрального пространства у больных с нарушением иммунитета также имеет потенциальный риск развития эпидуральной инфекции. Du Pen с соавторами [31] исследовали 350 больных с раком и ВИЧ-инфицированных пациентов, у которых был введен длительный (туннельный) эпидуральный катетер. Авторы изучили 3 области катетера на наличие признаков инфекции: место введения, поверхностный «путь» катетера и эпидуральное пространство. Частота эпидуральных инфекций и инфекций, связанных с глубоко расположенным катетером, составила 1 случай на каждые 1702 дня применения катетера у 19 больных, у которых развились глубокие инфекции (n = 8) или эпидуральные (n = 15) инфекции. (У 4 из 19 больных отмечено вовлечение как глубокого катетера, так и эпидурального). Культивированные бактерии были наиболее часто представителями кожной флоры. Все 19 больных с глубокими инфекциями были пролечены удалением катетера и антибактериальной терапией; ни кому не потребовалась хирургическая декомпрессия или обработка. Катетеры были введены у 15 из 19 пациентов, которые потребовали их введения после лечения при отсутствии рецидива инфекций. Авторы дали рекомендации, как и Strafford с соавторами, что длительная эпидуральная катетеризация является безопасной, если больные тщательно наблюдаются на предмет инфекции и получают быстрое лечение при установке диагноза.
Введение эпидурально стероидов и имеющиеся заболевания теоретически повышают риск инфекции (рис. 1) [32-34]. Strong [33] описали случай, произошедший у 71-летнего мужчины с разрешающейся инфекцией herpes zoster, с дерматомным уровенем поражения T5 T6. Эпидуральный катетер был введен на уровне T6-T7, и 120 мг метилпреднизолона на 5 мл 0,25% бупивакаина были введены. Кроме того, были назначены 3 дополнительные дозы бупивакаина, катетер был удален интактным через 26 часов после введения. Через 4 дня, второй эпидуральный катетер был введен на уровне T5-T6. Была начата антибактериальная терапия перорально. 10 периодических болюсов 0,25% бупивакаина были введены за 3-дневный период, затем катетер был удален. Не было признаков инфекции в месте введения катетера. Пациент поступил повторно через 3 недели с лихорадкой, кривошеей, головной болью и болями по правому фланку. Не было отмечено неврологических нарушений. Компьютерная томограмма грудного отдела выявила эпидуральный абсцесс на уровне T5-T9. Была выполнена срочная декомпрессионная ламинэктомия. Культуры с места операции были положительными на S . aureus . Больному в течение 21 дня проводилась внутривенно антибактериальная терапия, пациент был выписан без неврологических нарушений. Факторы, способствующие эпидуральному абсцессу у этого больного, включили иммунодепрессию (что предположили по активации латентной герпетической инфекции), многократное введение катетера и сниженную иммунологическую реакцию после применения стероидов.
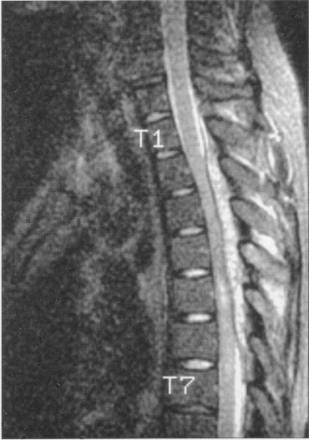 |
| Рисунок 1. Эпидуральный абсцесс грудного отдела, выявленный при магнитно-резонансном исследовании у больного, которому проводилось введение эпидурального катетера на грудном уровне при лечении герпетической невралгии. (Напечатано с разрешения авторов Horlocker T. T., Wedel D. J. Regional anesthesia and infection . In: Finucane B.T., ed. Complications of Regional Anesthesia. Philadelphia, PA: Saunders; 1999:170-183.) |
Вирус простого герпеса
Вирус простого герпеса II типа (ВПГ-2) является неизлечимым, рецидивирующим заболеванием, характеризующимся асимптомными периодами, сменяющимися вариабельными периодами рецидива генитального поражения [35]. Первичная инфекция связана с виремией и может сопровождаться различными симптомами, включая лихорадку, головную боль, лимфоаденопатию и в редких случаях асептический менингит. В противоположность, рецидивирующая или вторичная инфекция присутствует как генитальное поражение без признаков виремии. Если беременные поступают для родоразрешения с признаками активной ВПГ-2 инфекции, обычно рекомендуется родоразрешение операцией кесарева сечения, чтобы избежать поражения новорожденного вирусом, что возможно при влагалищном родоразрешении [35]. Применение центральной нейрональной блокады считается спорным вопросом из-за теоретической проблемы поражения вирусом ЦНС. Несмотря на то, что эта тема обычно обсуждается в контексте акушерской анестезии, частота и распространенность генитального герпеса резко возросла в последние двадцать лет. Следовательно, теоретический риск контаминации ЦНС присутствует в общехирургической популяции также.
Bader с соавторами [36] провели обзор анестезиологического обеспечения 169 больных, инфицированных HSV -2, родоразрешенных операцией кесарева сечения. 5 пациенток были классифицированы как имеющие первичную инфекцию, остальные 164 - вторичную. Общая (n = 59), спинальная (n = 75) и эпидуральная (n = 3) анестезия были использованы. У одной пациентки с первичной ВПГ-2 развилась транзиторная односторонняя слабость в ноге после спинальной анестезии бупивакаином. Проблемы разрешились в течение 1 недели. Несмотря на то, что эта пациентка была классифицирована акушерами как имеющая первичную инфекцию, генитальное поражение появилось за 3 недели перед родоразрешением и имелось активное течение на момент родов. Число пациенток с первичными ВПГ-2 инфекциями было очень маленьким в этом исследовании; однако, авторы предположили, что регионарная анестезия была безопасной в случаях вторичной инфекции.
Эти рекомендации согласуются с рекомендациями предшествующих исследований. Crosby с соавторами [37] провели обзор 6-летнего опыта ведения активной ВПГ-2 инфекции у беременных в 2 учреждениях. Кесарево сечение было выполнено у 89 больных беременных, все случаи с рецидивом (и активной) герпетической инфекции. Не было отмечено неврологических или инфекционных осложнений. В подобном ретроспективном обзорном исследовании Ramanathan с соавторами [38] сообщили о 43 эпидуральных анестезиях у беременных с ВПГ-2 инфекциями, которые также имели активное поражение (71%) или имели, по крайней мере, 1 рецидив при беременности. И вновь, осложнения не были отмечены у беременных или у новорожденных. У одной пациентки, которая была пролечена при беременности стероидами в целях созревания легких у плода, было выявлено заболевание в постнатальном периоде, которое прошло в течение 10 дней. Ни одно из этих исследований не включало пациенток с первичными инфекциями. Эти ограниченные результаты предполагают, что нейроаксиальная блокада у пациенток с рецидивирующими заболеваниями оказывается безопасной. Однако, риск контаминации ЦНС при первичной инфекции, когда вероятность спонтанной инфекции ЦНС может иметь место (хотя и редко) и виремия является относительно частой, остается неопределенной.
Вирус простого герпеса I типа (ВПГ-1), инфекционный возбудитель лабиального герпеса, редко вызывает генитальное поражение. Однако рецидив ВПГ-1 уже описан у беременных, получавших интратекально и эпидурально морфин в целях обезболивания [39]. Постнатальная связь является спорной, так как некоторые другие факторы, такие как эмоциональный или физический стресс, другие инфекции и роды, указываются как причины рецидива ВПГ инфекции. Valley с соавторами [40] сообщили о случае торакальной и лабиальной инфекции ВПГ-1 у пациентки, получавший эпидурально фентанил . Несмотря на то, что хирургический стресс мог быть фактором, эта пациентка не имела других известных факторов риска и поражение проявилось вблизи места введения эпидурального катетера.
ВИЧ
Риск выполнения процедур регионарной анестезии у ВИЧ-инфицированных больных главным образом неизвестен. Вовлечение ЦНС происходит в течение первых недель или месяцев при течении ВИЧ инфекции. Таким образом, внедрение вируса в субарахноидальное пространство во время спинальной анестезии не является интересным. Однако клиницисты должны иметь четкое понимание связи неврологических нарушений при ВИЧ инфекции, чтобы интерпретировать неврологические нарушения, возникшие после блокады. Например, приблизительно 90% больных с ВИЧ инфекцией имеют нейропатологические нарушения при аутопсии, а клинические симптомы сообщаются у 30% - 95% больных в поздние стадии инфекций [41]. Многие из неврологических симптомов не имеют отношения к осложнениям, связанным со спинальной или эпидуральной анестезией. Некоторые симптомы, такие как асептический менингит, хронические головные боли и полинейропатия, могут быть ошибочно приняты за проблему, связанную с введением иглы. Кроме того, условно-патогенные инфекции могут также способствовать как периферическим, так и центральным неврологическим нарушениям (таблица 2). И, наконец, ретровирусные препараты (ставудин и диданозин) также связаны с нейротоксичностью [41]. В целом, эти больные имеют высокий риск периоперационного ухудшения неврологических нарушений в результате сочетания эффектов имеющихся вирусных и условно-патогенных инфекций, терапии, регионарной анестезии, операции и положения.
Таблица 2. Неврологические осложнения инфекции,
вызванной вирусом иммунодефицита человека (ВИЧ).
| ВИЧ-ассоциированные нарушения без проявления условно-патогенных инфекций | ВИЧ-ассоциированные нарушения с проявлением условно-патогенных инфекций |
| Асептический менингит | Криптококковый менингит |
| ВИЧ-энцефалопатия | Цитомегаловирусный менингит |
| Воспалительная демиелинизирующая полинейропатия | Герпетический энцефалит |
| Множественный мононеврит | Лимфома (центральной нервной системы) |
| Миопатия | Прогрессирующая мультифокальная лейкоэнцефалопатия |
Есть разнообразные данные, определяющие риск неврологических или инфекционных осложнений у больных с ВИЧ инфекцией. Все они вовлекают больных рано при заболевании с относительно стабильным состоянием иммунной системы. Hughes с соавторами [42] сообщили о безопасном применении центральной нейроаксиальной блокады у 18 ВИЧ-инфицированных беременных. Исследуемые пациентки не показали послеродовых изменений в иммунном, инфекционном или неврологическом статусах. Avidan с соавторами [43] и Bremerich с соавторами [44] также сообщили о низкой частоте осложнений у родильниц с ВИЧ инфекцией, получавших антиретровирусную терапию, и которым проводилась спинальная анестезия. Однако, во всех 3 исследованиях (в итоге у 117 пациенток) больные были относительно здоровыми и в начальной стадией основного заболевания. Эффекты анестезии на пациенток с более запущенными стадиями заболевания не сообщаются.
В сообщении о применении эпидуральной пломбировки кровью по поводу постпункционной головной боли у ВИЧ-положительных мужчин, Tom с соавторами [45] наблюдали за 9 пациентами в течение периода от 6 до 24 месяцев. Не было выявлено осложнений, которые можно было бы связать с эпидуральной пломбировкой кровью, хотя авторы отметили высокую частоту неврологических проявлений в этой популяции.
Неинфекционные осложнения регионарного блока у больных с иммунодефицитными состояниями
Сопутствующая патология, связанная с имеющимися состояниями у больных с иммунодефицитом, может повышать риск неврологических осложнений и кровотечения после нейроаксиальных или периферических методов. Клиницист, таким образом, должен знать об имеющихся нарушениях гемостаза, вероятности метастазов в кости (особенно в позвоночник) и о побочных эффектах химиотерапевтических препаратов.
Кровотечения
Кровотечения могут происходить, если какой-либо компонент из звена коагуляции достаточно поврежден. Так как многие состояния, связанные с депрессией иммунного статуса, имеют нарушения в продукции или потреблении тромбоцитов и факторов свертывания, эти больные имеют риск не только инфекционных осложнений, но и кровотечения.
Бактериальные и вирусные инфекции (тромбоцитопения и диссеминированное внутрисосудистое свёртывание крови). Тромбоцитопения – это наиболее частое нарушение гемостаза у инфицированных больных. Как грам-положительные, так и грам-отрицательные патогенные микроорганизмы могут быть вовлечены. Несмотря на то, что степень выраженности тромбоцитопении обычно не тяжелая, в 1 исследовании примерно одна треть детей с септицемией имели число тромбоцитов менее 50000/мкл [46]. Действительная этиология тромбоцитопении при инфекциях неизвестна . Предполагаемые механизмы включают супрессию костного мозга, спленомегалию (секвестрация), бактериальные эндотоксины, непосредственное бактериальное (или вирусное) повреждение и иммунологические механизмы (антитела направленные против бактерий или вирусов оседают на тромбоцитах, приводя к их разрушению). Важно, что противоинфекционные факторы также могут приводить тромбоцитопении посредством супрессии костного мозга или иммунологического разрушения [47]. Оценка числа тромбоцитов рекомендуется у больных с пурпурой или петехиями, так как они отражают значительное нарушение гемостаза. У больных с тяжелыми (системными) инфекциями может также развиваться диссеминированное внутрисосудистое свёртывание крови (ДВС). Однако большинство больных с лабораторными тестами характерными для ДВС не имеют признаков клинически значимого кровотечения. Решение о выполнении регионарной анестезии при наличии непролеченных инфекций широко обсуждается [24]. Так как эти больные имеют риск по развитию значимых инфекционных осложнений и кровотечения, нейроаксиальные методы не следует выполнять, за исключением редких случаев.
Новообразования (геморрагические и тромбоэмболические нарушения). Нарушения гемостаза, связанные с раком, многообразны и вариабельны; каждый компонент системы гемостаза может быть нарушен (таблица 3). У больных с новообразованиями могут спонтанно развиваться тромбоэмболические или геморрагические осложнения. Эти осложнения связаны с лабораторными признаками ДВС и присутствуют у 50% больных с раком и у 90% больных с метастатическим поражением [48]. Однако клинические проявления происходят реже. В целом, у больных с солидными опухолями тромбоэмболические нарушения наиболее частые, в то время как кровотечения происходят чаще у пациентов с острыми лейкемиями. Таким образом, больные с онкопатологией могут иметь весь спектр коагулопатий - от гиперкоагуляции до фибринолиза.
Таблица 3. Нарушения гемостаза у больных с онкопатологией.
| Нарушения гемостаза | Неоплазия |
| Диссеминированное внутрисосудистое свёртывание и фибринолиз (ДВС) | Все новообразования, связанные с опухолевыми образованиями (повышенное при метастазировании) |
| Нарушение плазменных факторов свертывания | |
| Органная недостаточность | Новообразования печени |
| Ингибиторы факторов | Рак толстой кишки, простаты и легких |
| Дефицит факторов | Лейкемия ( V , VIII , XII , XIII ), множественная миелома ( X ), злокачественная меланома ( XI ), истинная полицитемия ( V ) |
| Тромбоцитарные нарушения | |
| Тромбоцитопения | Химиотерапия, опухолевая инвазия, недостаточность питания |
| Тромбоцитоз | Миелопролиферативные нарушения |
| Качественные дефекты | Миелопролиферативные нарушения |
Качественные и количественные аномалии тромбоцитов часто присутствуют у больных с онкопатологией. Тромбоцитопения, в результате сниженной продукции, повышенного разрушения или секвестрации тромбоцитов, является единственной наиболее частой причиной кровотечения у больных с онкопатологией. Подавление костного мозга в результате химиотерапии или лучевой терапии и сниженная продукция из-за вовлечения костного мозга или нарушений питания являются лидирующими этиологическими факторами количественного нарушения тромбоцитов у больных в этой популяции. В противоположность, качественные нарушения функции тромбоцитов, включая сниженную адгезию, нарушения агрегации и слабую ретракцию сгустка, являются обычными у больных с миелопролиферативными нарушениями. У этих больных риск кровотечения не коррелирует с числом тромбоцитов, а является результатом специальной оценки сцепления. Трансфузии тромбоцитов требуются редко; однако, дополнительный эффект противотромбоцитарных препаратов и антикоагулянтов должен рассматриваться у больных с качественной или количественной дисфункцией тромбоцитов. Продукция или подавление одного или более факторов свертывания крови может также непосредственно поражаться опухолью, особенно при первичном или метастатическом раке печени, множественной миеломе и других злокачественных парапротеиновых нарушениях. Целевые исследования механизмов гемостаза оправданны у больных с анамнезом или с текущей химиотерапией или с миелопролиферативными нарушениями [49]. Решение продолжать нейроаксиальные или периферические методы у больных основано на степени и характере коагулопатии, наличии альтернативных методов анестезии и аналгезии и ожидаемой продолжительности терапии. Например, больные с онкопатологией в терминальном стадии могут страдать от выраженной боли, которая не купируется системными опиоидами. Краткосрочная (не длительная) эпидуральная катетеризация может быть одобрена в отдельных случаях, несмотря на наличие тромбоцитопении и/или нейтропении [29]. Однако, решение должно быть принято на индивидуальном основании, взвесив относительный риск и успех.
Специальное решение должно быть принято в отношении выполнения нейроаксиального блока, диагностической поясничной пункции и эпидуральной пломбировки кровью у больных с острой лимфобластической лейкемией (ОЛЛ). Травматическая пункция твердой мозговой оболочки или кровь при пункции может ухудшать исход за счет попадания бластных клеток в ЦНС [50]. Следовательно, у больных с ОЛЛ с циркулирующими лейкозными клетками рекомендуется, чтобы число тромбоцитов достигало 100000/мкл (с помощью трансфузии тромбоцитов, при необходимости) перед выполнением диагностической поясничной пункции [50]. Интересно, что онкологи редко рекомендуют трансфузию тромбоцитов, чтобы избежать спинальной гематомы, если число тромбоцитов не меньше 10000/мкл, несмотря на то, что механизм трансфузии остается спорным [50, 51]. Не было отмечено спинальных гематом в серии исследования 5609 поясничных пункций, выполненных у детей с ОЛЛ, включая 1009 больных с числом тромбоцитов < 50000/мкл [50]. Экстраполирование этих рекомендаций (как с геморрагической, так и с онкологической перспективы) на нейроаксиальные методы является проблематичным. Однако так как альтернативный метод анестезии существует, будет благоразумным избегать нейроаксиальной блокады и эпидуральной пломбировки кровью у больных с известными циркулирующими лейкозными клетками. Консультация больного гематологом/онкологом для определения относительного риска и успеха может быть полезной.
Острый декомпенсированный ДВС связан с тромбоцитопенией; гипофибриногенемией; удлинением протромбинового, тромбинового и активированного частичного тромбопластинового времени; а также с повышенным уровнем продуктов деградации фибрина. Эти пациенты имеют высокий риск спонтанных или связанных с анестезией спинальных гематом и рассматриваются как «плохие кандидаты» для нейроаксиальной блокады [52]. Однако, больные с менее скоротечными (хроническими/компенсированными) формами ДВС показывают меньше тяжелых аномалий при выполнении стандартных тестов на свертывание крови и значения могут действительно быть в пределах «нормальных» границ. В некоторой степени, эти больные чаще «протромботичные». Больные с раком имеют риск развития тромбоэмболии в 6 раз выше и могут получать фармакологическую профилактику стандартным гепарином, низко-молекулярным гепарином или варфарином [53]. Так как риск в дальнейшем будет повышаться в периоперационном периоде, активная тромбопрофилактика должна быть обеспечена. Анестезиологическое обеспечение основано на антикоагулянтах, режиме дозирования и времени начала тромбопрофилактики [52].
Неврологические осложнения
Больные с иммунодефицитом часто поступают с предшествующим неврологическим нарушением, вызванным их первичным процессом заболевания (компрессия спинного мозга в результате новообразований позвоночника, периферическая нейропатия, связанная с ВИЧ или диабетом) или в результате терапии. Основываясь на теории «двойного сдавления», которая предполагает, что аксоны, поврежденные в одном месте, могут быть особенно чувствительны к повреждению [54], эти больные могут иметь повышенный риск неврологических осложнений при регионарной анестезии. Более того, последствия двойного повреждения превышают ожидаемое дополнительное нарушение, вызванное каждым изолированным повреждением [52]. Таким образом, эффекты при травме иглой, ишемии и токсичности местных анестетиков усиливаются и относительно небольшое повреждение, оказываемое на нервы ранее имеющейся дисфункцией, может приводить к новым (или ухудшать существующие) симптомам [54, 55].
Метастазы в позвоночник. Несмотря на то, что опухоль может вовлекать кости, наиболее частыми являются метастатические раки молочных желез, легких, простаты и множественная миелома. Частые места костных метастазов – это позвоночник, череп, плечевая кость, ребра, кости таза и бедра. Пациенты часто поступают с существующими патологическими переломами, требующими хирургической фиксации. Несмотря на то, что эти процедуры могут быть выполнены под нейроаксиальной блокадой, наличие метастазов в позвоночнике/компрессии спинного мозга должно рассматриваться в первую очередь.
Позвоночник, особенно на торакальном уровне, является наиболее частым местом костного метастазирования; 98% больных с онкопатологией, которые поступают с болями в спине, имеют метастазы. Например, метастазы позвоночника у больных с известной первичной опухолью уже описаны у 90% больных с раком простаты, 74% с раком молочных желез, 45% с раком легких, 29% с лимфомами или почечно-клеточным раком и 25% с раком желудочно-кишечного тракта. Поражение позвоночника не является абсолютным противопоказанием для выполнения нейроаксиальной блокады. Однако у пациентов с ростом опухоли в эпидуральное пространство могут иметься признаки компрессии спинного мозга; 3 наиболее частые опухоли, связанные с экстрадуральной компрессией - это рак простаты, молочных желез и легких [56].
Так как боли в спине у больных с раком обычно означают метастазы в кости или эпидуральные метастазы, исследования с целью определения наличия и протяженности опухолевого процесса является необходимым перед проведением нейроаксиального метода. Обследование больных с болью в спине зависит от того, есть ли текущие изменения боли в спине или какие-либо признаки неврологических нарушений. Оценка стабильной боли в спине без неврологических нарушений не является срочной и включает рентгенографическое исследование пораженных областей. И наоборот, быстро прогрессирующие боли в спине у больных с раком высоко подозрительны на эпидуральную опухоль или переломы, больные должны быть обследованы с применением магнитно-резонансной томографии или миелографии при компьютерной томографии в течение 24 часов. Усиление боли в положении на спине или в положении стоя, а также иррадиирущие боли свидетельствуют о возможном вовлечении спинного мозга или его корешков. Потеря моторной функции, гиперрефлексия или гипорефлексия, или дисфункции кишечника/мочевого пузыря подозрительны на наличие миелопатии и требуют немедленного вмешательства для предотвращения длительных неврологических нарушений [56]. Таким образом, обзорное исследование позвоночника и неврологическое обследование являются основным при анестезиологическом обеспечении больных с онкопатологией и болью в спине.
Нейропатия после противоопухолевой терапии. Неврологические осложнения противоопухолевой терапии могут быть результатом прямого токсического влияния на нервную систему или непрямого влияния в результате метаболических нарушений, вызванных препаратами. Несмотря на то, что разнообразие нейропатических состояний может расти после химиотерапии цисплатиной, сурамином, таксанами (паклитаксел и доцетаксел) или алкалоидами барвинка, периферическая нейропатия наиболее часта. Может происходить демиелинизация и потеря аксонов . Пациенты обычно поступают с парестезиями, потерей чувствительности и иногда со слабостью в пальцах рук и ног, которая прогрессирует в проксимальном направлении [57]. Частота и тяжесть варьирует между химиотерапевтическими препаратами. Винкристин – наиболее токсичен, примерно у 100% больных, получавших химиотерапию винкристином, развивается периферическая нейропатия. Отсутствие клинических признаков или симптомов не отражает отсутствие повреждения нерва; нейрофизиологическое тестирование часто показывает нарушение даже при отсутствии клинических данных, предполагающих субклиническую нейропатию. Кроме того, нейропатия может развиваться и/или прогрессировать в течение нескольких месяцев после отмены препарата. Таким образом, клиницисты поддерживают тщательную оценку риска и успеха выполнения методов регионарной анестезии у больных с текущим анамнезом химиотерапии, особенно если кумулятивная доза превышает дозы, сообщенные в таблице 4.
Таблица 4. Химиотерапевтические препараты, связанные с периферической нейропатией.
| Препарат | Процент пораженных больных | Кумулятивная доза, связанная с нейропатией | Клинические проявления |
| Цисплатина | 85% | 300 мг/м 2 | Парестезия, сниженное ощущение вибрации; начало и/или прогрессирование до 4 месяцев после отмены препарата |
| Сурамин | 10% | 350 мкг/мл (зависит от концентрации) | Уже сообщалось о наличии как демиелинизации (Гийена-Барре), так и выраженной сенсорно-моторной периферичсекой нейропатии |
| Паклитаксел | 60% | 250 мг/м 2 | Преимущественно сенсорные нарушения |
| Доцетаксел | 10% | 500 мг/м 2 | Преимущественно сенсорные нарушения |
| Винкристин | 100% (10-20% при применении других алкалоидов барвинка) | Может происходить при введении первый раз | Сенсорные и моторные нарушения |
Инфекционные осложнения периферической блокады у больных с иммунодепрессией
Инфекции ЦНС могут приводить к параличу или смерти . Только сейчас определены частота и факторы риска, связанные с менингитом и эпидуральным абсцессом. Однако, частота, диагностика и прогноз инфекционных осложнений после периферической блокады остаются неизвестными. Несколько больших исследований, вовлекающих длительные методы блокады сплетений и периферические методы, уже сообщили о высокой частоте колонизации (20%-60%) [27, 28], и о небольшом числе значимых инфекций. До настоящего времени, отмечено 3 серьезных инфекционных осложнения периферической блокады. Два из 3 произошли у больных с иммунодепрессией. Nseir с соавторами [58] сообщили о случае фатального некротизирующего фасциита после аксиллярного блока с однократным введением. 74-летняя женщина с анамнезом сахарного диабета поступила через 4 дня после операции с болью в подмышечной области, покраснением и отеком в месте введения иглы. Культуры крови и ткани показали наличие стрептококков группы A . Источником инфекции была флора кожи больной или флора ротовой части глотки медицинского работника, выполнявшего процедуру. Adam с соавторами [59] описали псоас-абсцесс, осложнивший бедренную катетеризацию (в течение 96 часов) у здоровой 35-летней женщины. бактериологическое исследование показало наличие S . aureus . Больная была успешно пролечена курсом антибактериальной терапии в течение 1 месяца. Capdevila с соавторами [27] отметили один случай псоас-абсцесса и воспаления подкожной клетчатки среди 1416 длительных регионарных методов обезболивания у больных с диабетом после введения бедренного катетера. Культура катетера показала S . aureus ; больному был проведен курс антибактериальной терапии. Авторы также выявили, что поступление в отделение интенсивной терапии, периферическая катетеризация нерва дольше 48 часов, мужской пол и отсутствие периоперационного профилактического применения антибиотиков являются факторами риска для возникновения местной инфекции/воспаления. Несмотря на то, что этого недостаточно для разработки рекомендаций на основе сообщений ограниченного числа случаев и 2 исследований на основе наблюдений, интересно отметить, что видимые факторы риска и патогены по развитию инфекционных осложнений при периферических методах являются поразительно похожими на факторы риска и патогены развития инфекция при нейроаксиальных блокадах.
Анестезиологическое обеспечение
Важно отметить, что, несмотря на то, что следующие стратегии основаны на полной оценке имеющейся информации, в некоторых случаях данных недостаточно. Эпидемиологические исследования подтверждают безопасность нейроаксиальной анестезии и анальгезии у больных с иммунодефицитом. К сожалению, с редкими осложнениями, такими как эпидуральный абсцесс и менингит, до настоящего времени недостаточно клинических исследований для точного определения обеспечения больных. Разногласия по этим рекомендациям, содержащимся в этом документе, могут быть допустимы на основе решения ответственного анестезиолога. Общее мнение вырабатывается для обеспечения безопасного и качественного ухода за больным, но не может гарантировать никакого специфического исхода. Рекомендации также являются предметом своевременного пересмотра, что будет необходимо вследствие появления новой информации и изменения практики. И, наконец, текущая информация сфокусирована на нейроаксиальных блокадах и инфекции; риск для методов блокады сплетений и периферических методов остается неопределенным. Дополнительный опыт необходим, чтобы позволить выработать рекомендации для ненейроаксиальных блокад.
Рекомендации
- Клинические исследования и эпидемиологические данные обеспечивают руководства для проведения спинальной или эпидуральной анестезии у больных с лихорадкой. Однако, что касается всех клинических установок, решение о выполнении метода регионарной анестезии должно быть сделано на индивидуальной основе, с рассмотрением альтернативных методов анестезии, успеха регионарной анестезии и риска инфекций ЦНС (которые теоретически с большей вероятностью происходят у больных с иммунодепрессией), а также риска кровотечения или неврологических осложнений (степень C).
- Ослабленная воспалительная реакция у больных с иммунодепрессией может уменьшать клинические признаки и симптомы, связанные с инфекцией. Подобным образом, спектр микроорганизмов, вызывающих инвазивные инфекции у больных с иммунодепрессией, гораздо шире, чем спектр микроорганизмов, поражающий общую популяцию. Спектр микроорганизмов, поражающих больных с иммунодепрессией, включает атипичные и условно-патогенные организмы. Консультация специалистом по инфекционным болезням рекомендуется для начала ранней и эффективной терапии (степень B).
- Задержка диагностики и терапии при инфекциях ЦНС ухудшает неврологический исход и повышает смертность (степень B).
- Риск развития эпидурального абсцесса повышается при длительной эпидуральной катетеризации (степень B).
- Нет адекватных данных в отношении безопасности спинальной и эпидуральной анестезии при наличии первичной ВПГ-2 инфекции. Однако, сообщаются виремия, лихорадка и менингит. Эти данные будут предполагать консервативный подход (степень C).
- Центральная нейроаксиальная блокада, как уже показано, является безопасной у больных с рецидивирующими инфекциями ВПГ, несмотря на то, что обострение ВПГ-1, как уже сообщалось, связано с интратекальным и эпидуральным введением опиоидов (степень B).
- Минимальные данные сатистических исследований предполагают, что нейроаксиальные и периферические блокады (включая эпидуральную пломбировку кровью) могут безопасно использоваться у ВИЧ-инфицированных больных. Наличие предшествующей неврологической патологии является обычным у этих больных и должно учитываться (степень C).
Ссылки
- Liu S., Carpenter R.L., Neal J.M. Epidural anesthesia and analgesia. Their role in postoperative outcome. Anesthesiology 1995; 82: 1474-1506.
- Tuman K.J., McCarthy R.J., March R.J., DeLaria G.A., Patel R.V., Ivankovich A.D. Effects of epidural anesthesia and analgesia on coagulation and outcome after major vascular surgery. Anesth Analg 1991; 73: 696-704.
- Modig J. The role of lumbar epidural anaesthesia as antithrombotic prophylaxis in total hip replacement. Acta Chlrurgica Scand 1985; 151: 589-594.
- Capdevila X., Barthelet Y., Biboulet P., Ryckwaert Y., Rubenovitch J., d'Athis F. Effects of perioperative analgesic technique on the surgical outcome and duration of rehabilitation after major knee surgery. Anesthesiology 1999; 91: 8-15.
- Ready L.B., Heifer D. Bacterial meningitis in parturients after epidural anesthesia. Anesthesiology 1989; 71: 988-990.
- Baker A.S., Ojemann R.G., Swartz M.N., Richardson E.P. Spinal epidural abscess. N Engl J Med 1975; 293: 463-468.
- Ericsson M., Algers G., Schliamser S.E. Spinal epidural abscesses in adults: Review and report of iatrogenic cases. Scand J Infect Dis 1990; 22: 249-257.
- Moen V., Dahlgren N., Irestedt L. Severe neurological complications after central neuraxial blockades in Sweden 1990-1999. Anesthesiology 2004; 101: 950-959.
- Wang L.P., Hauerberg J., Schmidt J.F. Incidence of spinal epidural abscess after epidural analgesia: A national 1-year survey. Anesthesiology 1999; 91: 1928-1936.
- Toft P., Svendsen P., Tonnesen E., Rasmussen J.W., Christensen N.J. Redistribution of lymphocytes after major surgical stress. Acta Anaesthesiol Scand 1993; 37: 245-249.
- Lundy J., Lovett E.J.I., Conran P. Halothane, surgery, immunosuppression and artificial pulmonary metastases. Cancer 1978; 41: 827-830.
- Tanemura H., Sakata K., Kunieda T., Saji S., Yamamoto S., Takekoshi T. Influences of operative stress on cellmediated immunity and on tumor metastasis and their prevention by non-specific immunotherapy: Experimental studies in rats. J Surg Oncol 1982; 21: 189-195.
- Mynster T., Christensen I.J., Moesgaard F., Nielsen H.J. Effects of the combination of blood transfusion and postoperative infectious complications on prognosis after surgery for colorectal cancer. Danish RANX05 Colorectal Cancer Study Group. Br J Surg 2000; 87: 1153-1162.
- Kehlet H., Dahl J.B. Anaesthesia, surgery, and challenges in postoperative recovery. Lancet 2003; 362: 1921-1928.
- Stevenson G.W., Hall S.C., Rudnick S., Seleny F.L., Stevenson H.C. The effect of anesthetic agents on the human immune response. Anesthesiology 1990; 72: 542-552.
- Kilpatrick M.E., Girgis N.I. Meningitis - A complication of spinal anesthesia. Anesth Analg 1983; 62: 513-515.
- Grewal S., Hocking G., Wildsmith J.A.W. Epidural abscess. Br J Anaesth 2006; 96: 292-302.
- Russel N.A., Vaughan R., Morley T.P. Spinal epidural infection. Can J Neurol Sci 1979; 6: 325-328.
- Danner R.L., Hartman B.J. Update of spinal epidural abscess: 35 cases and review of the literature. Rev Infect Dis 1987; 9: 265-274.
- Shintani S., Tanaka H., Irifune A., Mitoh Y., Udono H., Kadeda A., Shiigai T. Iatrogenic acute spinal epidural abscess with septic meningitis: MR findings. Clip Neurol Neurosurg 1992; 94: 253-255.
- Mamourian A.C., Dickman C.A., Drayer B.P., Sonntag V.K.H. Spinal epidural abscess: Three cases following spinal epidural injection demonstrated with magnetic resonance imaging. Anesthesiology 1993; 78: 204-207.
- Curling O.D., Gower D.J., McWhorter J.M. Changing concepts of spinal epidural abscess: A report of 29 cases. Neurosurgery 1990; 27: 185-192.
- Aromaa U., Lahdensuu M., Cozanitis D.A. Severe complications associated with epidural and spinal anaesthetics in Finland 1987-1993. A study based on patient insurance claims. Acta Anaestltesiol Scand 1997; 41: 445-452.
- Wedel D.J., Horlocker T.T. Regional anesthesia in the febrile or infected patient. Reg Anesth Pain Med 2006; 31: 324-333.
- Pandian J.D., Sarada C., Radhakrishnan V.V., Kishore A. Iatrogenic meningitis after lumbar puncture - A preventable health hazard. J Hosp Infect 2004; 56: 119-124.
- Bajwa Z.H., Ho C., Grush A., Kleefield J., Warfield C.A. Discitis associated with pregnancy and spinal anesthesia. Anesth Analg 2002; 94: 415-416.
- Capdevila X., Pirat P., Bringuier S., Gaertner E., Singelyn F., Bernard N., Choquet O., Bouaziz H., Bonnet F. Continuous peripheral nerve blocks in hospital wards after orthopedic surgery. Anesthesiology 2005; 103: 1035-1045.
- Cuvillon P., Ripart J., Lalourcey L., Veyrat E., L'Hermite J., Boisson C., Thouabtia E., Eledjam J.J. The continuous femoral nerve block catheter for postoperative analgesia: Bacterial colonization, infectious rate and adverse effects. Anesth Analg 2001; 93: 1045-1049.
- Rathmell J.P. Infectious risks of chronic pain treatments. Reg Anesth Pain Med 2006; 31: 346-352.
- Strafford M.A., Wilder R.T., Berde C.B. The risk of infection from epidural analgesia in children: A review of 1620 cases. Anesth Analg 1995; 80: 234-238.
- Du Pen S.L., Peterson D.G., Williams A., Bogosian A.J. Infection during chronic epidural catheterization: Diagnosis and treatment. Anesthesiology 1990; 73: 905-909.
- Mahendru V., Bacon D.R., Lemma M.J. Multiple epidural abscesses and spinal anesthesia in a diabetic patient. Case report. Reg Anesth 1994; 19: 66-68.
- Strong W.E. Epidural abscess associated with epidural catheterization: A rare event? Report of two cases with markedly delayed presentation. Anesthesiology 1991; 74: 943-946.
- Huang R.C., Shapiro G.S., Lim M., Sandhu H.S., Lutz G.E., Herzog R.J. Cervical epidural abscess after epidural steroid injection. Spire 2004; 29: E7-E9.
- Brown Z.A., Gardella C., Wald A., Morrow R.A., Corey L. Genital herpes complicating pregnancy [review]. Obstet Gynecol 2005; 106: 845-856.
- Bader A.M., Camann W.R., Datta S. Anesthesia for cesarean delivery in patients with herpes simplex virus type-2 infections. Reg Anesth 1990; 15: 261-263.
- Crosby E.T., Halpern S.H., Rolbin S.R. Epidural anaesthesia for caesarean section in patients with а recurrent genital herpes simplex infections: A retrospective review. Can J Anaesth 1989; 36: 701-704.
- Ramanathan S,. Sheth R., Turndorf H. Anesthesia for cesarean section in patients with genital herpes infections: A retrospective study. Anesthesiology 1986; 64: 807-809.
- Crone L.L., Conly J.M., Storgard C., Zbitnew A., Cronk S.L., Rae L.M., Greer K., Berenbaum E., Tan L.K., To T. Herpes labialis in parturients receiving epidural morphine after cesarean section. Anesthesiology 1990; 73: 208-213.
- Valley M.A., Bourke D.L., McKenzie A.M. Recurrence of thoracic and labial herpes simplex virus infection in patient receiving epidural fentanyl. Anesthesiology 1992; 76: 1056-1057.
- Schifitto G., McDermott M.P., McArthur J.C., Marder K., Sacktor N., Epstein L., Kieburtz K. Dana Consortium on the Therapy of HIV Dementia and Related Cognitive Disorders. Incidence of and risk factors for HIS associated distal sensory polyneuropathy. Neurology 2002; 58: 1764-1768.
- Hughes S.C., Dailey P.A., Landers D., Dattel B.J., Crombleholme W.R., Johnson J.L. Parturients infected with human immunodeficiency virus and regional anesthesia. Anesthesiology 1995; 82: 32-37.
- Avidan M.S., Groves P., Blott M., Welsh J., Leung T., Pozniak A., Davies E., Ball C., Zuckerman M. Low complication rate associated with cesarean section under spinal anesthesia for HIV-1-infected women on antiretroviral therapy. Anesthesiology 2002; 97: 320-324.
- Bremerich D.H., Ahr A., Buchner S., Hingott H., Kaufmann M., Faul-Burbes C., Kessler P. Anesthetic regimen for HIV positive parturients undergoing elective cesarean section [German]. Anaesthesist 2003; 52: 1124-1131.
- Tom D.J., Gulevich S.J., Shapiro H.M., Heaton R.K., Grant I. Epidural blood patch in the HIV-positive patient. An esthesiology 1992; 76: 943-947.
- Corrigan J.J. Jr. Thrombocytopenia: A laboratory sign of septicemia in infants and children. J Pediatr 19; 85: 219-221.
- George J.N., Raskob G.E., Shah S.R., Rizvi M.A., Hamilton S.A., Osborne S. Drug-induced thrombocytopenia: systematic review of published case reports. Ann Intern Med 1998; 129: 886-890.
- Bick R.L. Coagulation abnormalities in malignancy: A review. Semin Thromb Hemost 1992; 18: 353-372.
- Landolfi R., Marchioli R., Patrono C. Mechanisms of bleeding and thrombosis in myeloproliferative disoders. Thromb Haemost 1997; 78: 617-621.
- Howard S.C., Gajjar A.J., Cheng C., Kritchevsky S.B., Somes G.W., Harrison P.L., Ribeiro R.C., Rivera G.K., Rubnitz J.E., Sandlund J.T., de Armendi A.J., Razzouk B.I., Pui C.H. Risk factors for traumatic and bloody lumbar puncture in children with acute lymphoblastic leukemia. JAMA 2002; 288: 2001-2007.
- Ayerbe J., Quinones D., Prieto E., Sousa P. Spinal subarachnoid hematoma after lumbar puncture in a patient with leukemia: Report of a case and review of the literature [Spanish]. Neurocirugia 2005; 16: 447-452.
- Horlocker T.T., Wedel D.J, Benzon H., Brown D.L., Enneking F.K., Heit J.A., Mulroy M.F., Rosenquist R.W., Rowlingson J., Tryba M., Yuan C.S. Regional anesthesia in the anticoagulated patient: Defining the risks (the second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation). Reg Anesth Pairs Med 2003; 28: 172-197.
- Geerts W.H., Pineo G.F., Heit J.A., Berggvist D., Lasers M.R., Colwell C.W., Ray J.G. Prevention of venous thromboembolism: The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126: 3385-4005.
- Upton A.R., McComas A.J. The double crush in nerve-entrapment syndromes. Lancet 1973; 2: 359-362.
- Osterman A.L. The double crush syndrome. Orthop Clin North Am 1988; 19: 147-155.
- Loblaw D.A., Laperriere N.J. Emergency treatment of malignant extradural spinal cord compression: An evidence-based guideline. J Clin Oncol 1998; 16: 1613-1624.
- Hebl J.R., Horlocker T.T., Pritchard D.J. Diffuse brachial plexopathy after interscalene block in a patient receiving cisplatin chemotherapy: The pharmacologic double crush syndrome. Anesth Analy 2001; 92: 249-251.
- Nseir S., Pronnier P., Soubrier S., Onimus T., Saulnier F., Mathieu D., Durocher A. Fatal streptococcal necrotizing fasciitis as a complication of axillary brachial plexus block. Br J Anaesth 2004; 92: 427-429.
- Adam F., Jaziri S., Chauvin M. Psoas abscess complicating femoral nerve block catheter. Anesthesiology 2003; 99: 230-231.
Regional Anesthesia and Pain Medicine, Vol. 31, № 4 (July-August) 2006: 334-345