Почему эпидуральная аналгезия не всегда работает
Katherine Arendt, MD1,
Scott Segal, MD2
1Department of Anesthesiology, Mayo Clinic, Rochester, MN;
2Department of Anesthesiology, Perioperative and Pain Medicine,
Brigham and Women’s Hospital, Harvard Medical School, Boston, MA
Подавляющее большинство эпидуральных катетеров, которые используются во время родов, обеспечивают достаточное обезболивание. Однако в некоторых случаях, катетер может располагаться неправильно, анатомия человека отличается от обычной, или роды протекают быстрее, чем ожидает анестезиолог. Все это приводит к тому, что блок не наступает вовремя. В данной статье проводится обзор основы спинномозговой (эпидуральной) анальгезии в родах, причины недостаточности блокады и методы «спасения» плохо работающих катетеров.
Key words: Neuraxial labor analgesia • Combined spinal epidural technique • Dural puncture • Epidural failure
Ключевые слова: спинномозговая (эпидуральная) аналгезия в родах, комбинированная спинально-эпидуральная аналгезия, пункция твердой мозговой оболочки, недостаточность эпидурального блока
28-летняя первородящая испытывает крайне болезненные схватки. При открытии маточного зева 3 см в эпидуральное пространство вводится катетер после многочисленных попыток его установки. Манипуляцию проводил опытный анестезиолог. Спустя 2 часа акушер планировал провести влагалищное исследование, однако пациентка корчилась от боли и отказывалась от влагалищного исследования. Анестезиолог был поставлен в известность.
К счастью, подавляющее преимущество эпидуральных катетеров, которые используются во время родов, обеспечивают адекватное обезболивание. В ходе крупных исследований было выяснено, что общий уровень успеха составляет 98-99% (1, 2). Однако бывают моменты, когда катетер располагается неправильно, нарушена анатомия спинного мозга или роды протекают быстрее, чем ожидает анестезиолог и эпидуральный блок не наступает вовремя. В данной статье приводятся основы нейроаксиальной анальгезии, причины ее недостаточности и методы «спасения» плохо функционирующего катетера.
Анатомия спинного мозга и техника эпидуральной анальгезии
Эпидуральное пространство – это ространство в спинном мозге, которое располагается между желтой связкой и твердой мозговой оболочкой. Анестезиологи используют технику «потери сопротивления» для определения места расположения катетера (рисунок 1). Когда наконечник иглы находится в тоще связки введения воздуха или раствора затруднено. Когда наконечник попадает в эпидуральное пространство, данное сопротивление теряется. После этого эпидуральный катетер вводится на 3- 5 см в эпидуральное пространство (рисунок 2). После установки катетера начинают вводить анестетики, которые распространяются по нижнегрудным, поясничным и крестцовым корешкам, обеспечивая анальгезию, в среднем, на 20 минут.
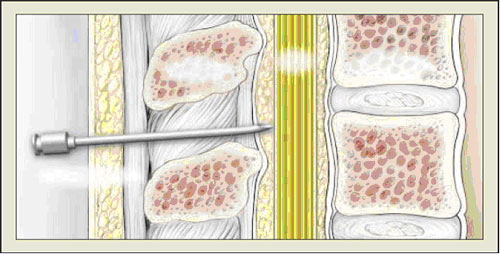 |
| Рисунок 1. Эпидуральная игла в эпидуральном пространстве. From Eltzschig HK, Lieberman ES, Camann WR. Regional anesthesia and analgesia for labor and delivery. N Engl J Med. 2003;348:319-332. Copyright © Massachusetts Medical Society. All rights reserved. |
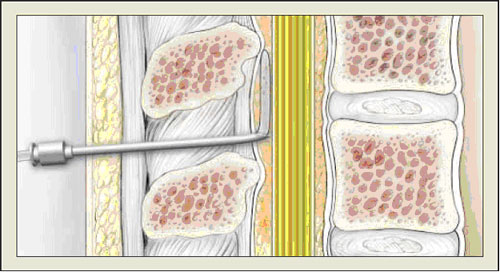 |
| Рисунок 2. Катетер введен в эпидуральное пространство. From Eltzschig HK, Lieberman ES, Camann WR. Regional anesthesia and analgesia for labor and delivery. N Engl J Med. 2003;348:319-332. Copyright © 2003 Massachusetts Medical Society. All rights reserved. |
При комбинированной спинально-эпидуральной анальгезии (КСЭА) после введения иглы в эпидуральное пространство через нее проводят тонкую спинальную иглу, которая протыкает твердую мозговую оболочку и проникает в спинномозговой канал (рисунок 3). Поток спинномозговой жидкости (СМЖ) через спинальную иглу подтверждает ее месторасположение. После того как лекарство вводится в СМЖ, спинальная игла удаляется, а через эпидуральную иглу вводится эпидуральный катетер, который вводится в эпидуральное пространство. Спинальное введение препарата обеспечивает быстрое начало аналгезии по сравнению с чисто эпидуральной анальгезии, особенно в течение 5 минут (3).
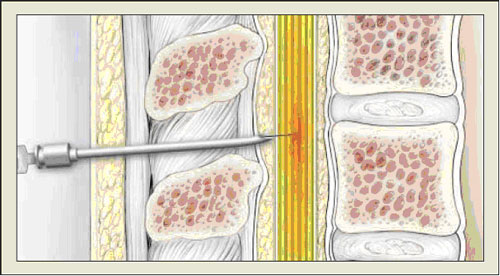 |
| Рисунок 3. Комбинированная спинально-эпидуральная аналгезия. From Eltzschig HK, Lieberman ES, Camann WR. Regional anesthesia and analgesia for labor and delivery. N Engl J Med. 2003;348:319-332. Copyright © 2003 Massachusetts Medical S ociety. All rights reserved. |
Препараты для нейроаксиальной анальгезии
И опиоиды, и местные анестетики используются при спинальной/эпидуральной аналгезии в родах. Фентанил является опиоидом выбора, так как его липофильность приводит к немедленному агонизму с μ-опиоидными в спинном мозге и минимальным побочным центральным эффектам. Бупивакаин является местным анестетиком выбора, так как по сравнению с другими анестетиками он первично блокирует чувствительные рецепторы, а не двигательные рецепторы. Это обеспечивает сохранение активности нижних конечностей. При эпидуральной анальгезии необходимо учитывать объем и концентрацию препарата, а при спинальной анальгезии учитываются барические данные (плотность по отношению к СМЖ) СМЖ и общая доза препарата.
Если эпидуральный катетер случайно попадет в спинальное пространство, это может привести к массивной передозировке, что потенциально может закончиться «высоким блоком». При этом отмечаются дыхательная недостаточность, артериальная гипотония матери и страдание плода. Таким образом, анестезиолог должен контролировать дозу и разницу во времени введения препарата, даже если пациентка испытывает выраженный болевой синдром. Как результат пациентка может родить быстрее, чем наступит эффективный блок.
Случаи эпидуральной недостаточности
Наиболее крупным обзором неудач ЭА нейроаксиальной анальгезии является ретроспективный анализ 19259 родов. Данный анализ показал, что 12% анальгезий заканчиваются неудачно (2). В 46% случаях ситуация исправляется с помощью простых манипуляций (будут описаны ниже). В 7,1% случаев проводят повторную установку катетера, в 1,9% это приходится делать несколько раз. В конце концов, 98,8% пациенток получают адекватное обезболивание. В другом исследовании был проведен анализ 4240 акушерских анестезий: в 13,1% случаев проводилась повторная катетеризация, уровень удовлетворения от анестезии достиг 98% (1). Стоит отметить, что данные исследования проводились давно и в их ходе использовались устарелое оборудование и препараты.
Причины недостаточности эпидуральной/спинальной аналгезии
В норме, продолжающееся и равномерное распределение местного анестетика в эпидуральном пространстве и по нервным окончаниям приводит к адекватному обезболиванию родов. К причинам недостаточности анальгезии относят: неправильное расположение эпидуральной иглы, неоптимальное расположение катетера, миграция катетера в эпидуральном пространстве во время родов, нарушенная анатомия спинного мозга, непредсказуемо быстрые роды. Необходимо учитывать тип катетера (multi - orifice ( c множественными отверстиями) vs single - orifice (единичное отверстие) vs newer single orifice , soft - tipped , wire - reinforced ) (4, 5), глубину введения катетера в эпидуральное пространство (6), опыт анестезиолога при ЭА (1) или СЭА (1, 2). К спорным вопросам относится использование воздуха или раствора при пробе на сопротивление (7, 8).
Анестезиолог может заметить, а может и не заметить изменение места расположения эпидуральной иглы во время пункции. Игла может войти в подкожную клетчатку, проколоть твердую мозговую оболочку и попасть в подоболочечное пространство, пройти в субдуральное пространство (между твердой оболочкой и паутинной) или в эпидуральную вену. При попадании иглы в спинномозговой канал или сосуд наблюдается подтекание ликвора или крови. Однако это наблюдается не всегда. Поэтому при введении иглы необходима попытка аспирации возможного содержимого и медленное, дробное введение первых доз препарата. Во время введения каждой дозы эпидурального анестетика анестезиолог наблюдает за возможными осложнениями: высокий блок при спинномозговом введении и симптомы токсичного действия при введении в сосуд.
Подкожное расположение
Ложная потеря сопротивления при расположении иглы в подкожной клетчатке является причиной неудачной ЭА. Местные анестетики и небольшие концентрации опиоидов не оказывают должного действия при подкожном введении. В таком случае недостаточность диагностируется меньше чем за 30 минут после первого введения. При этом наблюдается отсутствие чувствительного блока в ногах и нижней части живота. Однако в некоторых случаях роженица отмечает определенный анальгетический эффект, что наводит анестезиолога на ложный след адекватного обезболивания. Это может отсрочить время перестановки катетера.
Некоторые анестезиологи выполняют КСЭА для того, чтобы быть уверенным в том, что игла находится в эпидуральном пространстве. При введении спинальной иглы через эпидуральную иглу и получении ликвора, анестезиологи убеждают себя, что твердая мозговая оболочка находится сразу перед наконечником эпидуральной иглы. Таким образом, игла находится в эпидуральном пространстве. В это время анестезиологи могут ввести в спинномозговой канал опиоиды и/или местные анестетики. Сторонники данной техники утверждают, что КСЭА является более эффективной по сравнению с традиционной ЭА (2). Противники утверждают, что спинальная доза маскирует неправильное расположение эпидурального катетера, что может проявиться при болюсном введении препарата во время срочного кесарева сечения, что повышает риск общего обезболивания.
Альтернативным методом является пункция твердой мозговой оболочки без введения препарата для подтверждения правильного расположения эпидуральной иглы. При этом если вводить препарат в эпидуральный катетер, то наблюдается крестцовое распределение блока. Это происходит вследствие попадания небольшого количества препарата в спинномозговой канал через пунктированную твердую оболочку (9). Отрицательной стороной данного метода является повышение риска постпункционной головной боли, инфекции, респираторного дистресса. В общем, авторы рекомендуют выполнять СЭА у пациенток с ожирением или в случаях, когда тест на потерю сопротивления не точный.
Спинномозговое расположение
Если эпидуральная игла протыкает твердую мозговую оболочку и проникает в спинномозговой канал, что подтверждается свободным током ликвора, то в данном случае можно установить специальный спинальный катетер. При этом можно достичь адекватное обезболивание. Такие спинальные катетеры редко используются вследствие высокого (более 50%) риска постпункционного болевого синдрома и потенциально высокого риска инфекции.
Субдуральное расположение
Реже катетер может попасть в субдуральное пространство. Это пространство между твердой мозговой и паутинной оболочками. Если в данное пространство ввести большую дозу анестетика, то это может привести к развитию плохой аналгезии и высокого блока. Так как при этом ликвор не получить, а начало блока достаточно медленное, то и диагностировать данное осложнение достаточно тяжело. Недавние исследования показали, что данный феномен возникает чаще, чем предполагалось ранее (10).
Внутрисосудистое расположение
Эпидуральный катетер также может попасть в вену. Это возникает в 5-7% случаев (2). Чаще всего это встречается у рожениц, чем у небеременных так как беременная матка сдавливает нижнюю полую вену, что приводит к развитию коллатералей в эпидуральном пространстве. Внутривенное введение местных анестетиков не обладает анальгетическим эффектом. Однако наиболее важным аспектом является системное токсичное действие анестетиков. Это проявляется в церебральной стимуляции (звон в ушах, чувство металла во рту, беспокойство, конвульсии), и депрессии (потеря сознания), действии на сердечнососудистую систему (брадикардия, вазодилатация, гипотония, фибрилляция желудочков) и вазоконстрикции маточных артерий и гипертонусу матки. Лечение токсичного действия местных анестетиков является особой главой, которая описана в литературе (11). Гемодинамическая и дыхательная поддержка являются основными аспектами лечения, но наиболее перспективной терапией остановки сердца является лечение липидами (12).
Недостаточность аналгезии при правильном расположении катетера
Для тех, кто изучал строение эпидурального пространства, должно быть изумительно, что ЭА вообще работает. Эпидуральное пространство заполнено жиром, соединительной тканью и венозными сплетениями. Оно работает как спавшийся дренаж Пенроуза и больше похоже на контейнер, наполненный песком и камнями разных размеров. Таким образом, лекарствам необходимо пройти много препятствий, чтобы достичь нервов. В таком анатомическом лабиринте катетер может попасть в неблагоприятную среду. Если первоначальное расположение катетера и введение препарата не дает адекватное обезболивание, то анестезиолог выполняет два маневра: подтягивание катетера или введение дополнительной дозы препарата. Оба маневра являются успешными манипуляциями и применяются при одностороннем или ассиметричном блоке.
Ассиметричный блок
Ассиметричный блок может быть полностью односторонним или проявляться в виде «окон» в полном блоке, когда из аналгезии «выпадает» один или несколько дерматомов. Несмотря на правильное расположение катетера, приблизительно 5-8% эпидуральных блокад могут обеспечивать неполную аналгезию вследствие данных факторов (2). Хотя причины каждого конкретного случая неполной анальгезии остаются неизвестными, считается, что к ассиметричному блоку приводят либо анатомический барьер на пути тока анестетика, либо неблагоприятное расположение кончика катетера.
Проводилось множество исследований по изучению эпидуральной анатомии: введение смолы в эпидуральное пространства трупов (14), эпидуроскопия у трупов (15), компьютерная томографическая эпидурография (16), анатомическая диссекция с секцией криомикротомов (17). Наличие dorsal median connective tissue band ( DMCTB – задне-медиальная соединительнотканная перемычка) у некоторых пациенток также является одной из редких причин ассиметричного блока. DMCTB является артефактом (17).
Радиографические исследования показали, что эпидуральный катетер редко располагается посередине и может поворачиваться книзу (18). Анестезиологи компенсируют данный факт путем введения большого объема разведенного анестетика и/или опиоида для того, чтобы быть уверенным, что препарат пошел по обоим направлениям спинномозгового канала. Исследования также показали, что если катетер вводится не более чем на 5 см , то количество неудачных блоков становится меньше (19). Очевидно, это происходит от того, что такие катетеры меньше отклоняются в сторону. Когда это происходит, то действие анестетика может быть ослаблено с одной стороны или в одном дерматоме. Это объясняет рациональность подтягивания катетера при ассиметричном блоке.
Крестцовая недостаточность
Даже при использовании больших доз анестетика и правильном положении катетера, анестезия может недостаточной. Обычно, анестезиологи размещают катетер на уровне L2-3, L3-4, L4-5. Во время первого периода родов боль преимущественно висцеральная и распространяется через нервы T10 и L1, которые иннервируют шейку матки, матку и верхнюю часть влагалища. Во втором периоде родов, боль соматическая и распространяется через нервы S2-S4, которые иннервируют промежность. Эти нервные пути не только дальше расположены от наконечника катетера, но и больше в диаметре и окружены более тонкой твердой оболочкой. Все это затрудняет действие местных анестетиков. Более того, препараты с большей легкостью распространяются наверх, нежели вниз. Таким образом, местные анестетики, даже из правильно расположенного катетера, иногда не могут повлиять на крестцовые нервы и облегчить боль во втором периоде родов. Данный феномен приводит к тому, что многие анестезиологи предпочитают КСЭА когда роды неизбежны. Спинномозговое введение анестетика непосредственно влияет на крестцовые нервы в cauda equina , а опиоиды напрямую связываются с mu -рецепторами substantia gelatinosa в спинном мозге.
Миграция
Эпидуральная аналгезия может начать работать эффективно, но на протяжении родов анальгетический эффект может снижаться. Позиция катетера не статическая и они могут мигрировать из эпидурального пространства (причина окончания аналгезии), латерально (приводит к одностороннему блоку) или в сосуд (токсичное действие). Миграция катетеров не редкость и в 6,8% случаев приводит к недостаточной аналгезии (2).
Синдром хронической боли в спине и предшествующие операции на спине
Пациенты с хронической болью в нижней части спины входят в группу риска по развитию недостаточности эпидуральной аналгезии. У пациенток с односторонней болью пораженные нервы блокируются на 10-70 минут медленнее, чем на противоположной стороне. Это связано с тем, что анестетику тяжелее диффундировать через поврежденные участки (20). Грыжи межпозвоночных дисков могут приводить к спаечному процессу в эпидуральном пространстве, что затрудняет диффузию анестетика (21). Запущенный сколиоз затрудняет поиск эпидурального пространства, проникновение анестетика и повышает риск пункции твердой оболочки и других осложнений.
Пациенты, которые перенесли операцию на спине, особенно на спинном мозге или с целью коррекции сколиоза, также входят в группу риска по развитию недостаточности эпидуральной аналгезии. После коррекции сколиоза иногда вообще нельзя найти эпидуральное пространство из-за костных трансплантатов, шрама в данной области или дегенеративных изменений ниже места синтеза. У таких пациентов наблюдается высокий риск пункции твердой мозговой оболочки, что повышает риск развития инфекции. Некоторые анестезиологи считают, что ЭА противопоказана таким пациентам.
Повреждение эпидурального пространства могут наблюдаться и после небольших операций, что подтверждается в исследованиях на животных (22). К счастью, у пациентов, которые перенесли операции на спине, ЭА чаще всего протекает успешно: 91% против 98,7% из 1381 небеременных (23). Авторы считают, что это возможно из-за применения больших доз анестетиков и опыта анестезиолога.
Заключение
Различные факторы (анатомические, функциональные, технические) стоят на пути анестезиолога, который хочет выполнить эпидуральную аналгезию роженице. К счастью, при правильной технике успех составляет 99% (1, 2). Большие объемы разведенного анестетика, манипуляции с катетером, применение техники КСЭА и готовность заменить плохо функционирующий катетер может спасти большинство случаев неадекватной эпидуральной анальгезии.
Ключевые моменты
- К причинам недостаточности эпидуральной анальгезии относятся неправильное расположение катетера, миграция катетера во время родов, нарушенная анатомия или непредсказуемо быстрые роды.
- Ложная потеря сопротивления в подкожной клетчатке является причиной почти полной недостаточности анальгезии.
- Внутрисосудистое расположение катетера часто встречается у беременных. Введение анестетика внутривенно приводит к токсичному действию.
- Эпидуральный катетер не находится в статическом положении. Катетер может мигрировать и выходить из эпидурального пространства (полная потеря обезболивающего эффекта), отклоняться латеральнее (односторонний блок), а также может попасть в спинномозговой канал или сосуд.
- У пациенток с хронической болью в спине или перенесших операции на спине наблюдается высокая частота неудачных ЭА.
- Большие объемы разведенного анестетика, манипуляции с катетером, применение техники СЭА и готовность заменить плохо функционирующий катетер может спасти большинство случаев неадекватной эпидуральной аналгезии.
Список литературы
- Eappen S, Blinn A, Segal S. Incidence of epidural catheter replacement in parturients: a retrospective chart review. Int J Obstet Anesth. 1998;7: 220-225.
- Pan PH, Bogard TD, Owen MD. Incidence and characteristics of failures in obstetric neuraxialanalgesia and anesthesia: a retrospective analysis of 19,259 deliveries. Int J Obstet Anesth. 2004;13:227-233.
- Collis RE, Davies DW, Aveling W. Randomised comparison of combined spinal-epidural andstandard epidural analgesia in labour. Lancet. 1995;345:1413-1416.
- Segal S, Eappen S, Datta S. Superiority of multiorifice over single-orifice epidural catheters for labor analgesia and cesarean delivery. J Clin Anesth. 1997;9:109-112.
- Jaime F, Mandell GL, Vallejo MC, Ramanathan S. Uniport soft-tip, open-ended catheters versus multiport firm-tipped close-ended catheters for epidural labor analgesia: a quality assurance study. J Clin Anesth. 2000;12:89-93.
- D'Angelo R, Berkebile BL, Gerancher JC. Prospective examination of epidural catheter insertion. Anesthesiology. 1996;84:88-93.
- Arendt K, Segal S. An effectiveness study of air versus saline is used for identification of theepidural space by loss of resistance. Anesth Analg . 2008;106:A-1-A-221. Abstract A-104.
- Beilin Y, Arnold I, Telfeyan C, et al. Quality of analgesia when air versus saline is used for identification of the epidural space in the parturient. Reg Anesth Pain Med. 2000;25:596-599.
- Suzuki N, Koganemaru M, Onizuka S, Takasaki M. Dural puncture with a 26-gauge spinal needle affects spread of epidural anesthesia. Anesth Analg. 1996;82:1040-1042.
- Collier CB. Accidental subdural injection during attempted lumbar epidural block may present as a failed or inadequate block: radiographic evidence. Reg Anesth Pain Med. 2004;29:45-51.
- Weinberg GL. Current concepts in resuscitation of patients with local anesthetic cardiac toxicity. Reg Anesth Pain Med. 2002;27:568-575.
- Corman SL, Skledar SJ. Use of lipid emulsion to reverse local anesthetic-induced toxicity. Ann Pharmacother. 2007;41:1873-1877
- Beilin Y, Zahn J, Bernstein HH, et al. Treatment of incomplete analgesia after placement of an epidural catheter and administration of local anesthetic for women in labor. Anesthesiology. 1998;88:1502-1506.
- Harrison GR, Parkin IG, Shah JL. Resin injection studies of the lumbar extradural space. Br J Anaesth. 1985;57:333-336.
- Blomberg R. The dorsomedian connective tissue band in the lumbar epidural space of humans: an anatomical study using epiduroscopy in autopsy cases. Anesth Analg. 1986;65:747-752.
- Savolaine ER, Pandya JB, Greenblatt SH, Conover SR. Anatomy of the human lumbar epidural space: new insights using CT-epidurography. Anesthesiology. 1988;68:217-220.
- Hogan QH. Lumbar epidural anatomy. A new look by cryomicrotome section. Anesthesiology. 1991;75:767-775.
- Hogan Q. Epidural catheter tip position and distribution of injectate evaluated by computed tomography. Anesthesiology. 1999;90:964-970.
- Beilin Y, Bernstein HH, Zucker-Pinchoff B. The optimal distance that a multiorifice epiduralcatheter should be threaded into the epidural space. Anesth Analg. 1995;81:301-304.
- Benzon HT, Braunschweig R, Molloy RE. Delayed onset of epidural anesthesia in patients with back pain. Anesth Analg. 1981;60:874-877.
- Luyendijk W, van Voorthuisen AE. Contrast examination of the spinal epidural space. Acta Radiol Diagn (Stockh). 1966;5:1051-1066.
- LaRocca H, Macnab I. The laminectomy membrane. Studies in its evolution, characteristics, effects and prophylaxis in dogs. J Bone Joint Surg Br. 1974;56B:545-550.
- Sharrock NE, Urquhart B, Mineo R. Extradural anaesthesia in patients with previous lumbar spine surgery. Br J Anaesth. 1990;65:237-239.
Rev Obstet Gynecol. 2008;1(2):49-55