Место кеторолака в терапии острых болевых синдромов на догоспитальном этапе
А.Л.Верткин, А.В.Тополянский, Е.И.Вовк, А.В.Наумов
Наиболее частой причиной обращения больных за неотложной медицинской помощью, в том числе требующей проведения обезболивания, остается болевой синдром. Так, по данным S.McLean и соавт. (2002 г.), среди 14,5 млн. экстренных обращений умеренный болевой синдром был выявлен у двух млн. пациентов (14% случаев), выраженный – у 2,9 (20%). W.Cordell и соавт. (2002 г.) считают, что именно боль является причиной обращения пациентов за неотложной медицинской помощью в 52% случаев. В России, по данным Национального научно-практического общества скорой медицинской помощи (ННПОСМП), за последние 3 года количество вызовов скорой медицинской помощи (СМП) по поводу острых и хронических болевых синдромов возросло почти на 25%.
В то же время, согласно данным литературы,обезболивание получают не все пациенты, которые в нем нуждаются. J.Wilson и J.Pendleton (1989г .), при ретроспективном исследовании обнаружили, что из 198 пациентов, обратившихся за помощью в связи с острой болью, только 44% получили аналгезию в отделении неотложной терапии.Из них 62% ждали обезболивания больше 1 ч и в32% случаев анальгетики применялись в недостаточных дозах. По данным S.McLean и соавт. (2002г .), адекватное лечение проведено только 21% пациентов, нуждавшихся в экстренном обезболивании. И даже в тех случаях, когда обезболиваниепроводят в рамках неотложной терапии, оно далеко не всегда оказывается эффективным. Причинами этого могут быть использование малоэффективных лекарственных средств, стандартные,либо устаревшие схемы их применения, рефрактерность пациентов, особенно часто использующих анальгетики, побочные эффекты и др.(А.Е.Жуков и соавт., 2002).
Врач скорой помощи чаще всего является первым врачом, к которому обращается больной с болью. Традиционно обезболивание на догоспитальном этапе проводят метамизолом натрия (анальгин). Так в Москве частота его использования при купировании боли составила 86%, а в других регионах России – 88%. При этом применение метамизола натрия, особенно повторное, может вызывать развитие тяжелых нежелательных эффектов, таких как гематотоксический, развитие анафилактического шока, что значительно повышает риск лечения. Другие нестероидные противовоспалительные препараты (НПВП), а их только на российском рынке представлено 570 наименований («Федеральное руководство по использованию лекарственных средств», выпуск 5, 2004), используются значительно реже.
В данной публикации мы осветим дифференцированный подход к назначению современных лекарственных препаратов для терапии острой боли на догоспитальном этапе.
Боль – это субъективный феномен, включающий ощущение, указывающее на повреждение или угрозу повреждения тканей и аффективную реакцию на это ощущение.
Неприятные ощущения приводят к специфическому поведению больного и появлению вегетативных реакций, что позволяет врачу заключить, что пациент испытывает боль. Эмоциональная же реакция больного вызывает страдания, которые в зависимости от длительности болевого ощущения имеют разную клиническую характеристику (табл.1).
Таблица 1.
Клиническая характеристика боли.
| Боль | Определение | Вегетативные реакции | Эмоциональные реакции |
| Острая | Необходимый биологический сигнал о нарушении целостности организма; кратковременна | Бледность или покраснение лица, холодный пот, расширенные зрачки, тахикардия, повышение АД, изменение ритма дыхания, рвота | Агрессия, тревога |
| Хроническая | Сохраняется более 3-6 мес, теряет свое приспособительное биологическое значение | Утомляемость, нарушение сна, снижение аппетита, потеря массы тела, снижение либидо, запоры | Депрессия |
Выраженность болевого синдрома определяется рядом факторов: длительностью влияния травмирующего агента на психическую и соматическую сферы; конституциональными, генетическими и психологическими особенностями пациентов; чувством страха и тревоги; степенью самоконтроля пациентом боли и болезни; качеством социальной поддержки; знанием пациентом признаков реакции на боль, причин ее вызвавших, ее значения и последствий; депрессивными реакциями (возникающими как результат протекающего хронического заболевания) и др.
Диагностика боли
Несмотря на объективность ее существования, боль всегда субъективна. Поэтому если пациент предъявляя жалобы на боль, не делает никаких попыток (явных или скрытых) избавится от нее, стоит усомниться в ее присутствии. Напротив, если пациент страдает от боли, он всегда это демонстрирует: либо окружающим, либо самому себе, либо стремится обратиться к врачу (IASP, 1992).
Для оценки интенсивности болевого синдрома и эффективности проводимой терапии существует несколько способов (табл.2). Наиболее распространенными являются визуально-аналоговая шкала (ВАШ) и шкала облегчения боли. При применении ВАШ больной отмечает уровень выраженности болевого синдрома на 100 мм шкале(где «0» – отсутствие боли, «100» – максимальная боль) до и через 20 мин после введения препарата.
Таблица 2.
Способы градации интенсивности болевого синдрома.
| Способ | Градации боли | Когда используется |
| Пятизначная общая шкала | 0=нет боли 1=слабая (чуть-чуть) 2=умеренная (болит) 3=сильная (очень болит) 4=невыносимая (нельзя терпеть) |
При оценке/обследовании в обычных условиях |
| Словесная | количественная шкала 0..........5.........10 Нет боли – невыносимая (Какое число соответствует вашей боли?) |
При оценке/обследовании в обычных условиях |
| Визуальная аналоговая шкала (линия 10 см, скользящая линейка | Нет боли – невыносимая (От-метьте на линии, насколько сильна ваша боль) | При оценке/обследовании в обычных условиях.Может применяться у детей старше 6 лет |
| Поведенческие и психологические параметры (эти признаки следует принимать во внимание с осторожностью, т.к. они не являются специфичными) | Мимические гримасы, повышение голоса, бледность, потливость, слезотечение, расширение зрачка, тахикардия, гипертензия, дискоординация дыхания, др. | При оценке/обследовании больных в бессознательном состоянии, аутичных, критически больных пациентов |
| Оценка жизненно важных функций больного врачом | Может ли пациент осуществлять самостоятельно основные функции (например, кашель, глубокое дыхание) – Да/Нет | Соотнести с субъективными оценками. Следует использовать у всех |
Для оценки эффективности проведенного обезболивания используют шкалу облегчения боли. Через 20 мин после введения препарата пациенту задают вопрос: «Уменьшилась ли интенсивность боли у Вас после введения препарата, по сравнению с болью до введения препарата?». Возможные варианты ответа оценивают в баллах: 0 – боль нисколько не уменьшилась, 1 – немного уменьшилась, 2 – уменьшилась, 3 – сильно уменьшилась, 4 – исчезла полностью. Важно также оценивать время наступления отчетливого обезболивающего эффекта.
Лечение боли
Согласно современной стратегии лечения боли существуют несколько принципов назначения лекарственных средств:
- индивидуализированный – доза, способ введения, лекарственная форма определяются индивидуально (особенно у детей), с учетом интенсивности боли и на основании регулярного мониторинга;
- «лестницы» – ступенчатое обезболивание, при соблюдении унифицированных диагностических подходов;
- своевременности введения – интервал между введениями определяется степенью боли и фармакокинетическими особенностями действия препаратов и его лекарственной формы; возможно использование лекарственных средств длительного действия, которые, при необходимости, можно дополнять препаратами быстрого действия;
- адекватности способа введения – предпочтениеоральному введению (наиболее простой, эффективный и наименее болезненный).
Для выбора оптимального средства для обезболивания необходимо понимание принципиальной характеристики НПВП, учитывающей обезболивающую активность, избирательность в отношении циклооксигеназ (ЦОГ), биодоступность, возможность различных путей введения, быстроту достижения эффекта, отсутствие активных метаболитов, сбалансированное выведение и безопасность.
Согласно современной классификации (табл. 3) все НПВП делятся на анальгетики-антипиретики, производные парааминофенола, гетероарилуксусной, салициловой, фенилуксусной, пропионовой, антониловой кислот, оксикамы, коксибы и комбинированные препараты.
Таблица 3.
Классификация НПВС (D.Laurens, P.Bennet, 1992 с дополнениями).
| Группа НПВС | Препараты |
| анальгетики – антипиретики | пиразолоны – метамизол натрия, аминофеназол |
| парааминофенола | фенацетин, парацетамол |
| гетероарилуксусной кислоты | кеторолак |
| салициловой кислоты | ацетилсалициловая кислота, дифлунисал, салицилат натрия |
| арилуксусной кислоты | диклофенак |
| арилпропионовой кислоты | ибупрофен, кетопрофен, флурбипрофен, индометацин |
| эноликовой кислоты | пироксикам, лорноксикам, мелоксикам |
| фенамовой кислоты | мефенамовая кислота |
| другие: набуметон, коксибы | целекоксиб |
| комбинированные препараты | артротек (диклофенак\мисопростол), |
Согласно принятым положениям, все НПВП обладают обезболивающим, жаропонижающим, противовоспалительным и антиагрегантным действием. При этом они существенно отличаются по профилю безопасности, поскольку могут обладать гастротоксическим, гепатотоксическим, нефротоксическим, гематотоксическим, нейротоксическим эффектами, вызывать аллергические реакции, оказывать негативное влияние на иммунную систему и гемостаз. Главным, определяющим действие НПВП является их специфичность в отношении ЦОГ. При этом имеет значениие возможность НПВП усиливать продукцию эндогенных опиоидов и прерывать проведение болевых импульсов в спинном мозге.
Клиническая фармакология нпвп для парентерального введения
Лекарственные формы для парентерального применения, именно те, которые используются в экстренной службе, имеют метамизол натрия, его комбинации со спазмолитиками и холиноблокаторами, диклофенак натрия, кеторолак и лорноксикам.
Сегодня мы обсудим использование кеторолака для лечения острых болевых синдромов на догоспитальном этапе.
Кеторолак – производное арилуксусной кислоты. Используется в виде трометаминовой соли, что увеличивает его растворимость в воде, при этом трометаминовая соль легко расщепляется, высвобождая кеторолак.
В Северной Америке, Великобритании, некоторых других европейских странах и Гонконге кеторолак является единственным парентеральным НПВП, используемым для лечения острого болевого синдрома. Показано, что при внутримышечном введении 30 мг препарат оказывает действие, сопоставимое с эффектом 10-12 мг морфина или 50 мг меперидина (C.Brown и соавт., 1990., D.Dula и соавт., 2001, S.Henderson и соавт., 2002., C.Kenny и соавт., 1990). Преимуществом кеторолака по сравнению с наркотическими анальгетиками является отсутствие влияния на функцию дыхания, седативного и психомоторного действия. Так, при послеоперационной боли кеторолак оказался в некоторых случаях даже эффективнее морфина и мепередина (D.McGuire и соавт., 1993), а такие побочные эффекты как тошнота и рвота встречались реже. По данным F.Barber, D.Gladu (1998 г.), кеторолак при внутримышечном введении по эффективности сравним с кодеином, но реже вызывает явления диспепсии. Аналогичные результаты получены и в ряде других исследований (C.Eberson и соавт., 1999, M.Lieh-Lai и соавт., 1999).
Кеторолак продемонстрировал высокую обезболивающую эффективность в целом ряде исследований (F.Barber, D.Gladu, 1998., D.McGuire и соавт., 1993, G.Larkin и соавт., 1999, C.Eberson и соавт., 1999, J.Perez-Urizar и соавт., 2000). По сравнению с другими НПВП, кеторолак по-видимому, оказывает более выраженное обезболивающее действие (V.Swadia, M.Shah, 1999).
Кеторолак является препаратом выбора для купирования интенсивной боли, особенно при травме, однако кратковременное его использование возможно и при обострении хронической боли: у пациентов с дегенеративно-дистрофическими заболеваниями позвоночника, ревматоидным артритом, остеоартрозом и т.д. Так, при выраженной боли в спине, по данным двойного-слепого, проспективного исследования, проведенного K.Veenema и соавт. (2000 г.), эффективность кеторолака была сравнима с эффектами меперидина, а седативное действие и побочные эффекты были менее выражены. В многоцентровом исследовании, проведенном G.Innes и соавт. (1998 г.), обезболивающее действие кеторолака при боли в спине оказалось сравнимо с эффектами кодеина при значительно меньшем количестве неблагоприятных явлений. В то же время, по данным M.Neighbor и соавт. (1998 г.), однократное внутримышечное введение кеторолака в дозе 60 мг при острой боли сопоставимо по эффективности с приемом 800 мг ибупрофена.
При почечной колике внутривенное введение 30 мг кеторолака оказывало такой же обезболивающий эффект, как и внутривенное введение 2,5 г метамизола в комбинации со спазмолитиками при меньшем количестве побочных эффектов (C.Martin Carrasco и соавт., 1993). По данным E.Cohen и соавт. (1998 г.), проведших двойное слепое рандомизированное исследование, включавшее 57 пациентов с почечной коликой, обезболивающая активность кеторолака (30 мг внутримышечно) и диклофенака (75 мг внутримышечно) оказалась сопоставимой по выраженности и продолжительности.
В проспективном рандомизированном исследовании J.Nicolas Torralba и соавт. (1999 г.), включавшем 48 пациентов с почечной коликой, внутримышечное введение 30 мг кеторолака оказалось более эффективным, чем подкожное применение трамадола в дозе 1 мг/кг массы тела.
Согласно экспериментальным данным, кеторолак, блокируя синтез простагландинов в почке,уменьшает перистальтику мочевых путей и спазм, снижает давление в них, а также уменьшает почечный кровоток (A.Perlmutter и соавт., 1993 г.).
Кеторолак оказывает анальгетическое и жаропонижающее действие, противоспалительный эффект выражен незначительно. Его действие связано с подавлением активности циклооксигеназы, фермента, регулирующего синтез простагландинов, простациклина, тромбоксана А2 из арахидоновой кислоты. Кеторолак подавляет активность обеих форм циклооксигеназы (ЦОГ-1 и ЦОГ-2). Он не действует на опиатные рецепторы, поэтому не вызывает побочных реакций со стороны ЦНС, угнетения дыхания и пареза гладкой мускулатуры.
Препарат быстро всасывается, обладает высокой биодоступностью (80 – 100%), что обеспечивает быстрое наступление анальгезии. После приема внутрь 10 мг эффект развивается через 10 – 60 минут, после внутримышечного введения 30 мг – через 15 – 75 минут. Продолжительность действия у кеторолака до 10 часов.
Кеторолак связывается с белками плазмы крови на 90 – 99%. Он подвергается печеночному метаболизму, выводится почками (90%) и кишечником (6%). Период полувыведения у пожилых пациентов больше чем у молодых (4,7 – 8,6 часов и 3,8 – 6,3 часов, соответственно). Выведение препарата замедляется у больных с нарушенной функцией почек.
Применение кеторолака противопоказано при реакциях гиперчувствительности, гиповолемии, тяжелой почечной и печеночной недостаточности, пептических язвах, язвенной болезни желудка и двенадцатиперстной кишки, нарушениях гемостаза, беременности, родах, кормлении грудью, детям до 16 лет.
Частота развития побочных эффектов при применении кеторолака составляет 2,7%. Наиболее часто встречаются диспепсические симптомы. Тяжелые побочные симптомы: геморрагические осложнения, нарушение функции почек, острая анафилаксия – встречаются значительно реже.
Кеторолак выпускается в 2-х формах: таблетки для приема внутрь по 10 мг и раствор для парентерального введения в ампулах по 30 мг/1 мл.
Сравнительная эффективность и безопасность применения различных нпвп на догоспитальном этапе
Систематического сравнительного анализа эффективности и безопасности парентерального применения на догоспитальном этапе НПВП не проводилось. Поэтому в рамках программы ННПОСМП было проведено первое сравнительное открытое многоцентровое контролируемое клиническое исследование эффективности и безопасности парентерального применения на догоспитальном этапе метамизола натрия, диклофенака натрия, кеторолака и лорноксикама при болевых синдромах различного происхождения.
В исследование включали пациентов старше 18 лет с острой болью или обострением хронического болевого синдрома при воспалительных заболеваниях суставов, дегенеративно-дистрофических заболеваниях позвоночника (артралгии, люмбаго, ишалгия и т.д.), посттравматическими болевыми синдромами, почечной коликой.
Критериями исключения были возраст менее 18 лет, беременность, лактация, реакция гиперчувствительности на НПВП (в том числе на анальгин, аспирин) в анамнезе, заболевания системы кроветворения, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, застойная сердечная недостаточность, бронхиальная астма, выраженные нарушения функции печени и/или почек, систолическое артериальное давление ниже 100 мм рт. ст., проводимая в момент исследования антибиотикотерапия фторхинолонами или макролидами.
Всего в исследовании приняли участие 1011 больных, средний возраст которых составил 54,1±0,46 года, в том числе 498 мужчин и 513 женщин. На догоспитальном этапе внутримышечно вводили метамизол натрия (2 мл 50% раствора внутримышечно), диклофенак (3 мл – 75 мг внутримышечно), или кеторолак (препарат Кеторол производства компании «Д-р Редди’c Лабораторис Лтд» 30 мг/1 мл внутримышечно), или лорноксикам (8 мг/2 мл внутримышечно).
В зависимости от проведенной терапии больные были разделены на 5 сопоставимых групп: 240 больных (средний возраст 57,51±0,9 года) составили группу приема метамизола, 153 пациента (средний возраст – 54,17±1,1 года) – диклофенака натрия, 318 пациентов (средний возраст 51,68±0,9 года) – кеторолака, 95 пациентов (средний возраст 58,94±1,3 года) – лорноксикама.
Из принявших участие в исследовании 553 пациента (54,7%) обратились за неотложной помощью в связи со скелетно-мышечной болью, 244 (24,1%) – по поводу травмы, 214 (21,2%) – с почечной коликой.
При скелетно-мышечной боли ее уменьшение наступало через 20 мин после внутримышечного введения НПВП. Средняя разница интенсивности боли до и после лечения, оцененная с помощью ВАШ, в группе метамизола составила 52,7±1,8, диклофенака – 57,7±4,6, кеторолака – 69,3±1,9, лорноксикама – 70,8±4,7.
По критериям ВАШ лучшей эффективностью обладал лорноксикам и кеторолак, худшей – метамизол; диклофенак занял промежуточное положение. Метамизол достоверно уступал диклофенаку (р<0,05), кеторолаку (р<0,01) и лорноксикаму (р<0,01); диклофенак достоверно (р<0,05) уступал кеторолаку и лорноксикаму, кеторолак и лорноксикам значимо между собой по этому показателю не различались. (рис.1).
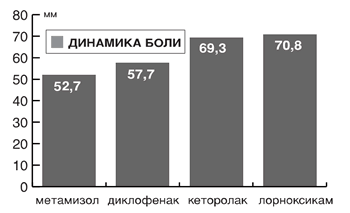 |
Рис. 1. Динамика интенсивности болевого синдрома через 20 мин после введения различных НПВП при использовании ВАШ (средняя разница показателей). |
Согласно результатам оценки динамики болевого синдрома с использованием ВАШ кеторолак превосходит метамизол натрия в 1,3 раза.
Повторные вызовы по поводу скелетно-мышечной боли были отмечены в 18% случаев в группе метамизола, в 9,4% – диклофенака, в 6,2% – кеторолака и лорноксикама (рис. 2) По количеству повторных вызовов препараты расположились следующим образом: метамизол> диклофенак>кеторолак=лорноксикам.
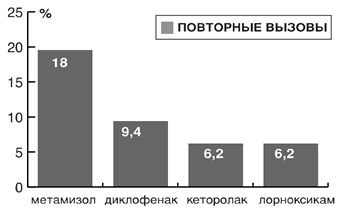 |
Рис. 2. Частота повторных вызовов СМП при неэффективности НПВС |
Важно отметить, что эффективность всех НПВП была одинаковой у больных моложе и старше 60 лет.
Метамизол приносил заметное уменьшение боли через 26,9±0,47 мин., диклофенак – 20,0±0,5 мин., кеторолак – 12,4±0,33 мин, лорноксикам – 12,3±0,6 мин (рис. 3). По этому показателю метамизол достоверно (р<0,01) уступал остальным препаратам, диклофенак уступал кеторолаку и лорноксикаму; последние два препарата значимо друг от друга не отличались.
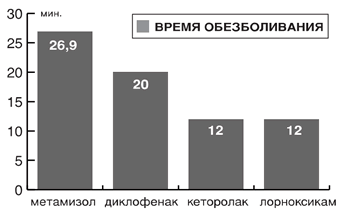 |
Рис. 3. Время развития отчетливого обезболивающего действия после внутримышечного введения НПВП. |
Таким образом, по скорости наступления отчетливого обезболивающего действия препараты распределились так:
лорноксикам = кеторолак > диклофенак > метамизол.
Средняя разница интенсивности боли, возникшей в связи с травмой до и после лечения, оцененная с помощью ВАШ, в группе метамизола составила 58,9±3,0, диклофенака – 60,0±4,6, кеторолака – 77,8±1,9, лорноксикама – 68,0±4,7 (рис. 4). По этому показателю метамизол достоверно не отличался от диклофенака, но достоверно уступал кеторолаку и лорноксикаму (Р<0,01); диклофенак достоверно (Р<0,01) уступал кеторолаку и лорноксикаму, кеторолак превосходил по анальгетической активности лорноксикам и остальные анальгетики.
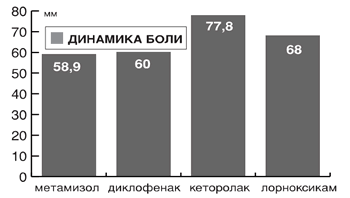 |
Рис. 4. Динамика интенсивности посттравматической боли через 20 мин после введения различных НПВП при использовании ВАШ (средняя разница показателей). |
Таким образом, согласно оценке динамики боли с помощью ВАШ, по силе обезболивающего действия при травме исследуемые препараты можно расположить так:
кеторолак > лорноксикам > диклофенак=метамизол.
Оценка снижения интенсивности болевого синдрома при почечной колике с использованием ВАШ также показала преимущество использования кеторолака перед метамизолом.
Таким образом, по силе обезболивающего действия при почечной колике исследуемые препараты можно расположить так:
кеторолак > метамизол.
Различные обезболивающие средства по-разному переносились больными. Среди системных нежелательных явлений наиболее часто встречались дискомфорт в эпигастрии, сонливость, головокружение, анорексия, чаще они наблюдались после использования метамизола. Следует отметить, что случаев аллергических реакций и повышения кровоточивости (естественно без учета возможных побочных явлений на отдаленном этапе) в нашем исследовании не зарегистрировано, т.е. однократное применение всех исследуемых препаратов представляется вполне безопасным. В то же время, применение метамизола в 32 случаях и диклофенака – в 11 случаях вызывало местные реакции – боль в месте инъекции. Кроме того, зарегистрирован один случай развития некроза в месте инъекции после применения диклофенака и два случая возникновения инфильтратов после инъекций метамизола. После введения метамизола 5 пациентов беспокоила тошнота, у 4 отмечалась сонливость, у 5 – дискомфорт в эпигастрии.
 |
Рис. 5. Динамика интенсивности боли при почечной колике через 20 мин после введения различных НПВП при использовании ВАШ (средняя разница показателей). |
Выводы
Приведённые результаты свидетельствуют о целесообразности использования кеторолака на догоспитальном этапе лечения острой боли, причём кеторолак (Кеторол) является наиболее эффективным при травме и острой скелетно-мышечной боли в сравнении с другими анальгетиками и НПВП. Применение метамизола не оправдано с позиций эффективность/безопасность.
Фармакоэкономический анализ применения
различных обезболивающих средств на догоспитальном этапе.*
| Показатель | Метамизол (анальгин) n=240 | Диклофенак (вольтарен) п=153 | Кеторолак (кеторол) п=318 | Лорноксикам (ксефокам) п=95 |
| Количество единиц лекарства | 1 амп. (2 мл 50% раствора) | 1 амп. (3 мл, 75 мг) |
1 амп. (1 мл, 30 мг) |
1 фл. (8 мг) |
| Стоимость единицы лекарства (руб.) | 0,63 | 36,36 | 10,86 | 97,23 |
| Количество повторных вызовов | 32 | 9 | 11 | 3 |
| Стоимость повторных вызовов, руб. | 25600 | 7200 | 8800 | 2700 |
| Общая стоимость лечения, руб. | 25751,2 | 12763,08 | 12253,48 | 11936,85 |
| Средние затраты на одного пациента (С), руб. |
107,29 | 83,42 | 38,53 | 125,65 |
| Эффективность (Ef)* | 67,9% | 69,9% | 82,4% | 87% |
| Затраты на единицу эффективности (СЕА=С/Ef), руб. | 1,58 | 1,19 | 0,46 | 1,44 |
Примечания:
* Материалы опубликованы в журнале «Врач Скорой помощи», 6/ 2006.
** – критерий эффективности лечения – уменьшение интенсивности болевого синдрома не менее, чем на 50%.
Материалы опубликованы в журнале доказательной медицины для практикующих врачей «CONSILIUM medicum» 2006/8/№2