Обезболивание родильниц после кесарева сечения адьювантным введением морфина при спинальной анестезии
И.А. Ловков, В.Н. Щипунов
МУЗ «Родильный дом», г. Северодвинск
Введение
Морфин, наряду с другими опиоидными анальгетиками, традиционно используется для системного послеоперационного обезболивания. В акушерстве, после абдоминального родоразрешения, морфин применяют реже, предпочитая парентеральное введение промедола. Это обусловлено сравнительно невысокой травматичностью операции кесарева сечения, позволяющей использовать наркотические анальгетики с менее выраженным анальгетическим и токсическим действием. Общеизвестны негативные аспекты парентерального введения морфина – высокий наркогенный потенциал, тошнота, рвота, обстипация, брадикардия, угнетения дыхания и сознания. У родильниц препарат тормозит и послеродовую инволюцию матки. Однако все побочные эффекты морфина дозозависимы, поэтому закономерно желание анестезиологов обеспечить послеоперационное болеутоление меньшими дозировками наркотического анальгетика, используя методы нейроаксиальной блокады. Эпидуральное обезболивание морфином в дозе 4 – 5 мг в нашем отделении успешно использовано после 563 акушерских и 2732 гинекологических операций. В последние годы для послеоперационной анальгезии мы применяем также постоянную эпидуральную инфузию 0,2% ропивакаина. Сколько-нибудь явных преимуществ у этой методики не выявляется: однократное эпидуральное введение морфина устраняет боль после операции длительно, до 24 – 32 часов, без ненужного на этом этапе моторного и симпатического блока, не говоря уже об очевидном экономическом эффекте. Значительных финансовых затрат требуют и современные методики мультимодальной анальгезии. Интратекальное введение морфина также может обеспечить полноценное послеоперационное обезболивание. Субарахноидальное введение опиоидов сдерживается только отсутствием официального разрешения Фармкомитета. Тем не менее применение морфина для спинальной анестезии и анальгезии нередко, но негласно практикуется отечественными анестезиологами. Кроме того, в последние годы интратекальное использование опиатов допускается авторитетными российскими изданиями. Например, Национальное руководство по акушерству 2009 года рекомендует в ряду методов обезболивания родов субдуральную аналгезию с применением опиоидных анальгетиков, а также добавление опиоидов к местному анестетику для субарахноидального введения при комбинированной спинально-эпидуральной аналгезии в родах. За рубежом интратекальное введение опиоидов (intrathecalopioids), в частности, добавление морфина к местным анестетикам при операциях под спинальной анестезией давно является нормальной, повседневной практикой, своего рода «классикой жанра». Допустимость наркотических анальгетиков в качестве адъювантов или основных препаратов для субарахноидального и эпидурального введения основано на обширном и многолетнем международном практическом опыте применения опиоидов для регионарной анальгезии / анестезии в родах и операции кесарева сечения Выраженные гидрофильные свойства препарата замедляют начало действия после субарахноидального введения до 30 – 60 минут, но анальгетический эффект продолжается от 8-ми до 24 часов (по некоторым источникам – до 29 – 32 часов). После абдоминального родоразрешения в условиях спинальной анестезии действие морфина, введённого вместе с маркаином, развивается на фоне сохраняющейся блокады местным анестетиком, что позволяет и устранить боль после операции, и предупредить её развитие. В известной мере соблюдается принцип упреждающей (pre-emptive) анальгезии. Полноценное обезболивание позволяет рано активизировать родильницу, даёт ей возможность ухаживать за новорождённым, ускоряет заживление операционных швов и инволюцию матки, снижает вероятность развития лохиометры, пареза кишечника, гнойно-воспалительных и тромбоэмболических осложнений. Интратекальное применение морфина соответствует современному тренду – fasttracksurgery, направленному на максимально быструю мобилизацию пациента после хирургической агрессии. Для адекватного послеоперационного обезболивания субарахноидально необходимо вводить минимально достаточные дозы морфина, памятуя о возможности побочных паранаркотических эффектов – тошноты, рвоты, брадикардии, отсроченного угнетения дыхания, избыточной седации, зуда кожи, задержки мочеиспускания, нарушения терморегуляции, реактивации герпетической инфекции, депрессии плода. Диапазон дозировок морфина в литературе очень широк – от 0,1 до 2 мг, чаще рекомендуют использовать 0,2 – 0,3 мг. Поскольку аналгезия при интратекальном введении морфина достигается дозами, в 10 – 25 раз меньшими, чем при эпидуральном введении, дозозависимые побочные эффекты минимизируются, большинство из них эффективно устраняются внутривенным введением налоксона. Самое грозное осложнение – поздняя депрессия дыхания в результате церебрального распространения морфина в ликворе – предупреждается тщательным наблюдением за родильницей после операции в палате интенсивной терапии не менее 24-х часов. При этом недостаточно следить лишь за частотой дыхания и пульсом, гиперкапния может развиться на фоне нормальной частоты дыхания. Для адекватной оценки вентиляции целесообразны пульсоксиметрия и капнография. Не менее важна динамическая оценка уровня сознания: ухудшение позволяет заподозрить угнетение дыхания и риск апноэ. Ещё одним предиктором развития угрожающей гиповентиляции является миоз. Нельзя параллельно вводить транквилизаторы, потенцирующие депрессорное действие морфина. Послеоперационная палата должна быть оснащена необходимым для ИВЛ оборудованием.
Цель нашего исследования – показать, как соотносится с действительностью послеоперационное анальгетическое действие морфина, вводимого в качестве адъюванта при операциях кесарева сечения под спинальной анестезии, оценить выраженность побочных эффектов и безопасность практического применения.
Материалы и методы
Материал исследования составили 120 родильниц в возрасте 18 – 39 лет, перенёсших операции кесарева сечения при сроках беременности 38 – 40 недель. Функциональное состояние всех пациенток соответствовало I – II классу по шкале ASA. Критерием включения в исследование было отсутствие у них акушерской и экстрагенитальной патологии в стадии декомпенсации, патологической кровопотери, пре- и интранатальной гипоксии плода. В плановом порядке оперирована 71 беременная женщина, по срочным показаниям – 49 беременных и рожениц. Длительность операции составляла в среднем 36 минут. Пациентки случайным образом были разделены на две группы в зависимости от избранной методики послеоперационного обезболивания. Группы не отличались по возрасту, антропометрическим характеристикам, сроку гестации, классу по ASA, ургентности, объёму и продолжительности операции.
В обеих группах выполняли СА на уровне L2 – L3 в положении на левом боку. Интратекально вводили 0,5% раствор бупивакаина (Маркаин спинал хэви фирмы «AstraZeneca») в дозе 10-12 мг. В качестве антиэметика за 5 – 7 минут до люмбальной пункции внутривенно вводились 4 мг дексазона и 1,25 мг дроперидола. В основной группе (n=60)в качестве адъюванта вводили 100 – 150 мкг морфина гидрохлорида (Московский эндокринный завод). Послеоперационное обезболивание поддерживалось парентеральным введением анальгина 3 г/сутки. В контрольной группе для послеоперационного обезболивания использовали внутримышечные инъекции кеторолака трометамина (кеторола) по 30 мг три раза в сутки. Промедол по 20 мг или трамадол 100 мг «по требованию» пациенткам вводился в обеих группах. Все пациентки в течении первых послеоперационных суток находились в палате интенсивной терапии. Качество послеоперационной анальгезии оценивали по интенсивности болевого синдрома в покое и при активации родильницы с использованием стомиллиметровой визуально-аналоговой шкалы (ВАШ), по необходимости дополнительного введения анальгетиков в ответ на просьбу пациентки, а также по удовлетворённости пациенток качеством обезболивания. В течение первых суток послеоперационного периода, помимо стандартного мониторинга, тщательно контролировали частоту дыхания, следили за уровнем сознания, наличием миоза. В исследуемых группах оценивали общий расход анальгетиков, а также отслеживали частоту побочных реакций и послеоперационных осложнений. В палате интенсивного наблюдения проводилась ранняя мобилизация пациенток: через 4-6 часов после операции женщине предлагалась сесть в постели, ещё через час-два она начинала ходить. Энтеральное питание после операции временными рамками не ограничивали.
Результаты и обсуждение
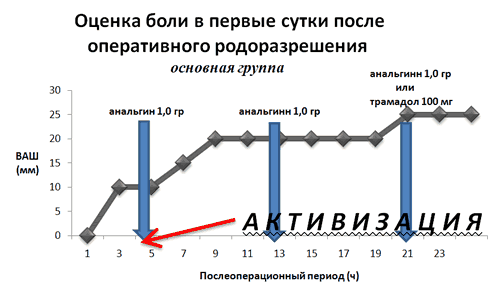
Интратекальное введение морфина в качестве адъюванта значительно улучшило качество обезболивания после кесарева сечения. В первые сутки послеоперационного периода у родильниц основной группы отмечались достоверно более низкие оценки по ВАШ в покое и при активизации (см. диаграмму), с достоверным уменьшением необходимости потенцирования болеутоления. Адекватное послеоперационное обезболивание у 54 (99,1%) пациенток основной группы достигнуто без дополнительного назначения анальгетиков, тогда как в контрольной группе 58 (96,6%) пациенток нуждались во внеплановом использовании наркотического анальгетика. Побочные эффекты морфина в виде тошноты и/или рвоты наблюдались в 18,3% пациенток основной группы против 8,3% в контрольной группе и носили большей частью эпизодический, однократный характер. Лишь в одном случае тошнота и рвота носила изнуряющий характер, продолжаясь в течение нескольких часов. Причиной этого послужилоошибочное введение значительно избыточной дозы морфина. Активные жалобы на кожный зуд в области лица, шеи и груди умеренной интенсивности предъявляли 20% пациенток основной группы.Купирования этого состояния налоксоном не потребовалось. Оценка новорождённых по шкале Апгар при рождении, не отличалась между двумя исследуемыми группами. Мониторирование частоты дыхания в первые послеоперационные сутки не выявило каких-либо отклонений от физиологической.
 |
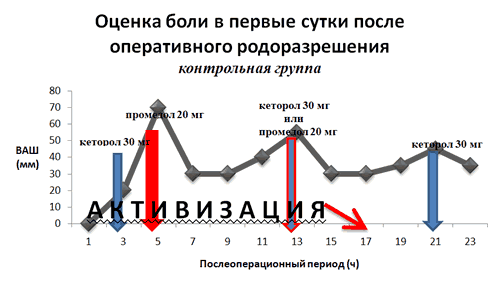 |
В целом послеоперационное обезболивание родильницы оценили:
- в основной группе: как «хорошее» – 52 женщины (99,1%) и как «удовлетворительное» – 8 женщин (0,9%);
- в контрольной группе: как «хорошее» – 17 женщин (28,3%), как «удовлетворительное» – 34 женщины (56,6%), как «неудовлетворительное» – 9 женщин (15%).
Побочные эффекты:
- основная группа: озноб – 4 случая (6,%), кожный зуд – 12 случаев (20%), тошнота и рвота – 9 случаев (15%), задержка мочеиспускания – 4 случая (6,6%).
- контрольная группа: озноб – 4 случая (6,6%), тошнота и рвота – 5 случаев (8,3%), нарушение моторики кишечника – 9 случаев (15%), задержка мочеиспускания – 2 случая (3,3%).
Выводы
Применение морфина в качестве адъюванта при спинальной анестезии обеспечивает полноценное и безопасное преодоление болей, раннюю мобилизацию и адаптацию родильниц в первые сутки после операции кесарева сечения. Незначительное количество побочных эффектов интратекального введения морфина не влияет на удовлетворённость женщин качеством обезболивания. Недостаточное количество наблюдений не позволяет считать метод оптимальным, но он может быть оправданным для применения в практике оперативного акушерства.
Литература:
- Акушерство. Национальное руководство / Под ред. Э.К. Айламазяна, В.И. Кулакова, В.Е. Радзинского, Г.М. Савельевой. М., 2009. Глава 13.
- Руководство по акушерской аналгезии и анестезии / Под рук. Г.Х. МакМорланда и Г.Ф. Маркс: Пер. с англ. М., 1998.
- Овечкин А.М., Свиридов С.В. Послеоперационная боль и обезболивание: современное состояние проблемы. // "Регионарная анестезия и лечение острой боли" Том 1, № 0, 2006 год.
- Крафт Т.М., Аптон П.М. Ключевые вопросы и темы в анестезиологии.: Пер. с англ. М., 1997. – С. 424 – 428.
- Морган-мл. Дж.Э., Михаил М.С. Клиническая анестезиология. Книга 1.: Пер. с англ. С-Пб., 1998. – С. 398 – 401.
- РафмеллДж.Р., Нил Дж.М., Вискоуми К.М. Регионарная анестезия.: Пер. с англ. М., 2007. – С. 163 – 164.
- Шурыгин И.А. Спинальная анестезия при кесаревом сечении. С-Пб., 2004.
- Ловков И.А., Щипунов В.Н. Оптимизация послеоперационного обезболивания при абдоминальном родоразрешении. // "Регионарная анестезия и лечение острой боли" Том 4, №3, 2010 год
- Meylan N, Elia N, Lysakowski C, Tramer M.R. Benefit and risk of intrathecal morphine without local anaesthetic in patients undergoing major surgery: meta-analysis of randomized trials. British Journal of Anaesthesia 2009; 102: 156–67.
- Gehling M., Tryba M. Risks and side-effects of intrathecal morphine combined with spinal anaesthesia: a meta-analysis. Anaesthesia Volume 64 Issue 6, Pages 643 – 651
- Apfel1 C. C., Cakmakkaya O. S., Frings G., Kranke P., Malhotra A., Stader A., Turan A., Biedler A., Kolodzie K. Droperidol has comparable clinical efficacy against both nausea and vomiting. BJA Advance Access published on September 1, 2009, DOI
- 1093/bja/aep177. Br. J. Anaesth. 103: 359-363.
- ZarateЕ., Latham Р., Fast-Track Cardiac Anesthesia: Use of RemifentanilCombined with Intrathecal Morphine as an Alternative toSufentanilDuringDesflurane Anesthesia. Anesthesia & Analgesia 2000;91:283–7