Особенности периоперационного обезболивания пациентов с заболеваниями системы крови
Е. М. Шулутко1 , О. К. Левченко1 , Э. Г. Гемджян1 , В. М. Городецкий2
1 ФГБУ "Гематологический научный центр МЗ РФ", 125167, Москва;
2 ГБОУ ДПО "Российская медицинская академия последипломного образования МЗ РФ", 123995, Москва
Резюме
Периоперационное обезболивание пациентов с заболеваниями системы крови сопряжено с рядом особенностей ввиду тяжелых нарушений свертывания крови. Ограничения в использовании традиционных методов обезболивания связаны с высоким риском геморрагических осложнений. В настоящем исследовании представлены возможные пути проведения периоперационного обезболивания с учетом влияния современных препаратов на гемостаз.
Ключевые слова: периоперационное обезболивание, нарушение свертывания крови
Гемофилия - наиболее известное наследственное заболевание плазменного гемостаза, связанное с дефицитом VIII или IX факторов свертывания. Специфической особенностью данного заболевания, в отличие от других геморрагических диа тезов, является поражение опорно-двигательного аппарата вследствие повторных кровоизлияний [1]. В настоящее время благодаря разработке ре комбинантных VIII и IX факторов свертывания больным гемофилией выполняют реконструктивно-восстановительные операции на крупных суставах, существенно улучшая их качество жизни. Среди геморрагических диатезов наиболее часто встречаются тромбоцитопении. Под тромбоцито пенией принято понимать состояние, при котором количество тромбоцитов в крови менее 150*109/л [2]. Снижение тромбоцитов может быть обуслов лено разными причинами:
- недостаточная продукция тромбоцитов в костном мозге,
- секвестрация их в сосудах или селезенке,
- повышение деструкции или потребление
Одним из этапов лечения гематологических заболеваний, сопровождающихся тромбоцитопенией (болезнь Верльгофа или хроническая иммунопатологическая тромбоцитопеническая пурпура (ИТП), апластическая анемия (АА), различные виды лимфом, сублейкемический миелоз или первичный миелофиброз), является спленэктомия [3]. Хирургические вмешательства у гематологических пациентов сопряжены с высоким риском геморрагических осложнений. Анестезиологическое пособие во время операции и послеоперационное обезболивание также представляют серьезную проблему. Известно, что многие препараты, которые используются для анестезии, угнетают функцию тромбоцитов. В большей степени таким свойством обладает галотан, вызывающий необратимую дезагрегацию тромбоцитов, в меньшей степени - закись азота и современные ингаляционные анестетики [4]. Из препаратов для внутривенной Особенности периоперационного обезболивания пациентов с заболеваниями системы крови анестезии дезагрегацию тромбоцитов вызывают пропофол и тиопентал. Наркотические анальгетики и миорелаксанты практически не влияют на систему гемостаза [5]. Современные направления в проведении периоперационного обезболивания также ограничены в гематологической клинике. Так, максимально широкое применение локальной и/или регионарной анальгезии и использование НПВП в качестве "первого шага" послеоперационного обезболивания (по рекомендациям ВОЗ) абсолютно противопоказаны при гипокоагуляционных состояниях, в связи с высоким риском развития геморрагических осложнений [6].
Обзор отечественной и зарубежной литературы показал, что сообщений о периоперационном обезболивании пациентов с гематологическими заболеваниями недостаточно. Эта проблема актуальна, требует разработки современных схем обезболивания, не влияющих на гемостаз и эффективно купирующих болевой синдром.
Цель исследования: разработка рекомендаций по проведению периоперационного обезболивания пациентов с заболеваниями системы крови.
Материалы и методы
В настоящее исследование мы включили 103 пациентов с различными заболеваниями системы крови, которым выполнялись оперативные вмешательства в ФГБУ ГНЦ МЗ РФ. В проспективное рандомизированное исследование по изучению периоперационных схем обезболивания вошло 36 больных тяжелой формой врожденной гемофилии (А или В) в возрасте от 22 до 57 лет, которым было выполнено тотальное эндопротезирование коленного (n=28) или тазобедренного (8) суставов и 27 пациентов в возрасте от 29 до 63 лет, страдающих ИТП (n=12), сублейкемическим миелозом (n=5), АА (n=4), различными видами лимфом (n=6), сопровождающимися тромбоцитопенией, которым была выполнена лапароскопическая спленэктомия (ЛСЭ). Всем пациентам операции выполнялись в условиях комбинированной эндотрахеальной анестезии с использованием стандартных схем премедикации - атропин, димедрол; вводная анестезия - диприван, фентанил (дробно), миорелаксация - тракриум, листенон. Поддержание анестезии: севоран, закись азота, фентанил (дробно).
Физическое состояние пациентов оценивалось по классификации Американской ассоциации анестезиологов (ASA): состояние 14 пациентов было оценено как ASA III (пациенты с тяжелым системным некомпенсированным заболеванием), остальные 49 - ASA II (пациенты с системными расстройствами средней тяжести). Наиболее частыми сопутствующими заболеваниями у больных гемофилией являлись гепатит С (n=34), язвенная болезнь желудка (n=4), хронический гастрит (n=19), у пациентов с тромбоцитопенией - медикаментозный синдром Иценко-Кушинга (n=9), хронический гастрит (n=17).
Ретроспективная часть исследования (60 пациентов) выполнена для выявления опиоидсберегающего эффекта схем анальгезии у больных гемофилией. В предоперационном периоде проводился целевой сбор информации относительно хронического болевого синдрома и приема обезболивающих средств. У больных гемофилией в раннем послеоперационном периоде изучали анальгетические свойства и опиоидсберегающий эффект следующих схем обезболивания:
- парацетамол (4 г/сут внутривенно капельно) + тримеперидин (n=14);
- кетамин (внутривенно инфузия 2 мкг/кг/мин) + парацетамол (4 г/сут внутривенно капельно) + тримеперидин (n=10);
- дексмедетомидин (внутривенно инфузия 0,2- 0,7 мкг/кг/ч) + тримеперидин (n=10).
У пациентов с тромбоцитопенией применялись схемы:
- нефопам по 20 мг (внутривенно капельно, в течение часа) каждые 4 ч (100 мг/сут) + тримеперидин (n=7);
- парацетамол по 1 г внутривенно капельно каждые 6 ч (суммарная суточная доза - 4 г/сут) + тримеперидин (n=10);
- глюкокортикостероиды (преднизолон 1 мг/кг внутривенно) + парацетамол (4 г/сут внутривенно капельно) + тримеперидин (n=10).
В последнюю группу вошли пациенты, которые получали преднизолон в средней дозе от 50 до 75 мг/сут в схеме лечения основного заболевания. Пациенты всех групп тримеперидин получали по требованию (по 5-10 мг внутривенно струйно). Первое введение анальгетиков проводилось во время анестезии (превентивная анальгезия). С целью определения эффективности проводимого обезболивания осуществлялся мониторинг боли через 4, 8, 12, 18 ч после операции по 100-балльной визуально-аналоговой (VAS) и числовой рейтинговой шкалам (NRS). С целью определения влияния анальгетиков на гемостаз до и после введения выполнялась тромбоэластограмма (ТЭГ) и коагулограмма.
Статистический анализ. Динамику изменения мониторируемых показателей оценивали по различию средних, используя двусторонний одновыборочной (при отслеживании одной и той же группы) и двухвыборочный (при мониторировании разных групп) t-критерий Стьюдента для множественных измерений. Выбор средней арифметической для характеристики распределений переменных и t-критерия для оценки их различия обусловлен свойствами распределений. Для категориальных переменных применили частотный анализ. Для расчетов использовали статистические пакеты IBM SPSS Statistics 21.0, BIOSTAT и SAS 9.3 (применили процедуры ТТЕST и JLM). Пороговый уровень статистической значимости р принят равным 0,05. Данные представлены преимущественно в виде арифметических средних и стандартных отклонений.
Результаты
Предоперационное анкетирование показало, что в анамнезе у 66% больных гемофилией были одна или две перенесенные ортопедические операции в условиях комбинированной эндотрахеальной анестезии с последующим длительным обезболиванием, в том числе наркотическими анальгетиками. Также 66% пациентов указали на необходимость постоянного применения нестероидных противовоспалительных препаратов (НПВП) в домашних условиях. В связи с интенсивными болями 29% опрошенных часто принимали трамадол или омнопон. Необходимо отметить, что предикторами выраженного болевого синдрома у больных гемофилией, помимо сниженного болевого порога и нарушения толерантности к боли на фоне хронического болевого синдрома и длительного приема анальгетиков, являются также такие характерологические особенности, как реактивная тревожность, повышенная ажитация, нервная возбудимость, ожидание интенсивности боли и выраженная симпатоадреналовая реакция на боль. При опросе пациентов с тромбоцитопениями не отмечалось каких-либо болевых или характерологических особенностей.
Анальгетический и опиоидсберегающий эффекты изучаемых схем периоперационного обезболивания. Сравнение кривых динамики интенсивности боли (по шкале NRS) у больных гемофилией при разных схемах обезболивания показывает, что кривые соответствующие использованию парацетамола и кетамина имеют однонаправленность изменения боли (в сторону снижения) от исходной величины к конечной:
- для схемы обезболивания парацетамол с тримеперидином: с 5 до 4, с однократным подъемом до 6 баллов через 8 ч после операции;
- для схемы кетамин + парацетамол + тримеперидин: боль исходно была несколько выше, отмечалось снижение интенсивности с 6 до 4 баллов; интересно, что при включении в схему анальгезии кетамина за 14-часовой период боль снизилась по сравнению с исходной на 30% (р < 0,05), тогда как без кетамина - на 20%,
- для схемы дексмедетомидин + тримеперидин отмечался изначально сравнительно высокий уровень боли и было зарегистрировано дальнейшее его повышение с 6 до 7 баллов (рис. 1).
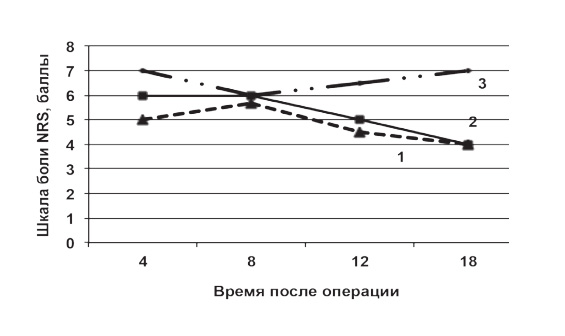
Рис. 1. Динамика боли у больных гемофилией после ортопедической операции при использовании схем:
1. Парацетамол + тримеперидин.
2. Кетамин + парацетамол + тримеперидин.
3. Дексмедетомидин + тримеперидин
Однако введение дексмедетомидина в послеоперационном периоде способствовало профилактике послеоперационной дрожи, снижению ажитации, возбуждения, тахикардии, нормализации сна у больных гемофилией. При ретроспективном анализе послеоперационной потребности в наркотических анальгетиках у больных гемофилией (60 пациентов) выявлено, что средняя суточная доза тримеперидина при монотерапии у пациентов, отмечавших послеоперационную боль в диапазоне "средняя - слабая", составила 80 мг.
Сравнение этих данных позволяет сделать заключение, что применение разработанной нами схемы, включающей парацетамол в периоперационном обезболивании больных гемофилией при ортопедических операциях, сопровождалось опиоидсберегающим эффектом (уменьшение суточной дозы тримеперидина в среднем с 80 до 45 мг, т. е. примерно на 40%). При использовании дексмедетомидина требовалось в среднем 70 мг/сут тримеперидина, т. е. опиоидсберегающий эффект был минимальным (рис. 2).
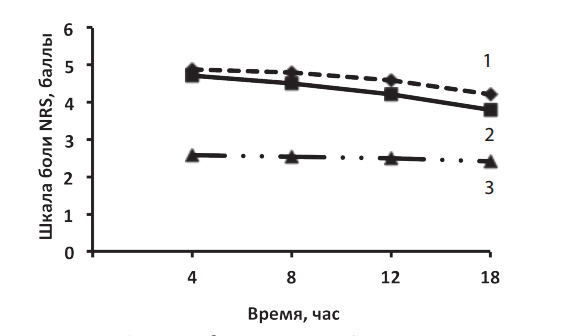
Рис. 2. Опиоидсберегающий эффект анальгетиков у больных гемофилией в первые сутки после ортопедических операций (по оси ординат - расход тримеперидина, мг/сут)
Сравнение кривых динамики интенсивности боли при трех разных схемах обезболивания у пациентов с тромбоцитопенией демонстрирует снижение боли:
- для схемы обезболивания нефопамом с тримеперидином: с 5,3 до 4,3 (по шкале NRS) и с 46,5 до 37,1 (по шкале VAS);
- для схемы обезболивания парацетамолом и тримеперидином: с 5,0 до 4,0 (шкала NRS) и с 43,8 до 34,3 (шкала VAS);
- для схемы преднизолон с парацетамолом и тримеперидином: с 2,6 до 2,3 (шкала NRS) и с 21,4 до 18,1 (шкала VAS) (рис. 3)
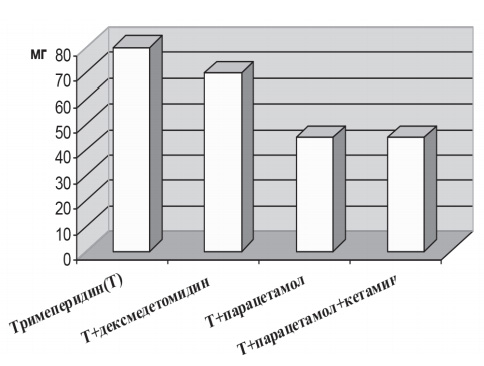
Рис. 3. Динамика боли по шкале NRS у пациентов, перенесших лапароскопическую спленэктомию по поводу заболевания системы крови, протекающего с тромбоцитопенией, при обезболивании по схемам:
1. Нефопам + тримеперидин.
2. Парацетамол + тримеперидин.
3. ГКС + парацетамол + тримеперидин.
В сравнении с двумя первыми схемами обезболивания выделяется третья схема - обезболивание парацетамолом и тримеперидином на фоне назначения преднизолона: здесь изначально уровень боли был сравнительно низким и эффективно достигалось его дальнейшее снижение (р<0,05).
При сравнении расхода наркотических анальгетиков выявлено, что при применении нефопама средняя суточная доза тримеперидина составила 43 мг, парацетамола - 28 мг, комбинации парацетамола с преднизолоном - 20 мг (рис. 4), т. е. обнаружена четкая тенденция уменьшения количества вводимых наркотических анальгетиков при наличии в схеме обезболивания преднизолона.
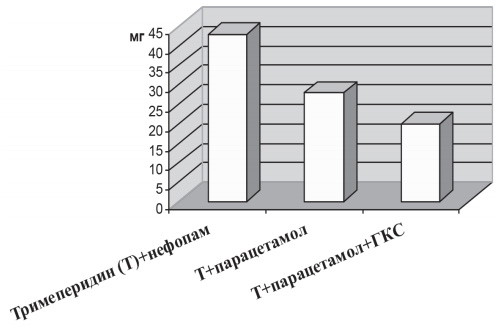
Рис. 4. Опиоидснижающий эффект схем анальгезии в первые сутки после ЛСЭ у пациентов с тромбоцитопенией (по оси ординат - расход тримеперидина, мг/сут)
Побочные эффекты препаратов, используемых для обезболивания. В группе больных, получавших кетамин, наблюдались: длительный период пробуждения после анестезии, неадекватность, спутанность сознания в послеоперационном периоде (n=7), повышение АД и ЧСС (n=5), послеоперационная дрожь (n=3) и рвота (n=1). У всех пациентов, получавших дексмедетомидин, регистрировались гемодинамические нарушения: у 4 из 10 отмечалось снижение АД до 70 /40 мм рт. ст. в первые 2 ч введения, что быстро корректировалось уменьшением скорости введения препарата. Гипотензия сопровождалась, как правило, снижением ЧСС, при этом уменьшения ЧСС ниже 80 в минуту не отмечалось. Схема нефопам + тримеперидин применялась только у двух пациентов, страдавших гемофилией. В обоих случаях введение нефопама приходилось прекращать в связи с развившимся побочным действием - трудно купируемой синусовой тахикардией с ЧСС свыше 140 уд/мин. При использовании нефопама у пациентов с тромбоцитопенией также отмечалась синусовая тахикардия: ЧСС возрастала с 79,86±14,23 уд/мин (до введения нефопама) до 112,91±22,33 уд/мин (р=0,006) (после введения нефопама).
Высокая частота гепатита С у больных гемофилией требует особого внимания при назначении им гепатотропных препаратов. Показатели ферментов АЛТ и АСТ до введения парацетамола были соответственно: 36,3±19,3 Ед/л и 40,8±25,1 Ед\л, через сутки после его применения: 35,2±11,4 Ед\л, и 33,8±18,2 Ед\л, т.е. клинически и статистически значимого увеличения активности печеночных ферментов при назначении парацетамола в течение суток не было найдено.
Влияние препаратов, используемых для обезболивания, на гемостаз. Результаты исследования показывают, что показатели ТЭГ (табл. 1), значения АЧТВ (у больных гемофилией А и В) и уровень факторов свертывания VIII (у больных гемофилией А) и IX (у больных гемофилией В) до и после введения парацетамола (табл. 2) статистически не изменялись. Статистически незначимыми были изменения ТЭГ и у пациентов с тромбоцитопениями до и после введения парацетамола и нефопама.
Таблица 1. Показатели тромбоэластограммы до и после введения парацетамола на пике и плато активности факторов VIII и IX (9 пациентов)
| Параметр | Норма | Пик активности факторов | Плато активности факторов | ||||
| До | После | Р | До | После | Р | ||
| CI | 3-3 | 0,66±1,1 | 1,66±1,2 | 0,04 | 0,71 ±0,8 | 1,31±0,9 | 0,03 |
| K, мин | 2-9 | 3,7±0,8 | 3,0±0,8 | 0,06 | 4,1±2,6 | 3,8±1,9 | 0,39 |
| R, мин | 9-27 | 12,6±1,5 | 11,1±3,3 | 0,19 | 13,0±3,6 | 13,7±3,1 | 0,37 |
| MA, мм | 44-64 | 57,6±5,7 | 59,6±6,1 | 0,29 | 55,7±8,2 | 57±7,1 | 0,31 |
| Угол, град. | 22-58 | 44,2±6,9 | 49,7±9,1 | 0,27 | 44,2±12,2 | 46,7±12,6 | 0,74 |
Таблица 2. Значения АЧТВ и факторов VIII и IX до и после введения парацетамола (9 пациентов)
| Показатель | Норма | До | После | Р |
| АЧТВ, сек | 29-34 | 37,4±5,2 | 38,8 ± 4,3 | 0,09 |
| Фактор IX, % | 60-90 | 67,1±2,8 | 66,5±9,2 | 0,11 |
| Фактор VIII, % | 60-120 | 119,6±18,2 | 107,1±13,0 | 0,12 |
При применении парацетамола особое внимание уделялось уровню тромбоцитов, т. к. известно, что в очень редких случаях препарат может вызывать тромбоцитопению [7]. Как показано в таблице 3, в течение первых суток наблюдения у всех пациентов сохранялась тромбоцитопения. Практически во всех случаях отмечался "постспленэктомический" рост количества тромбоцитов. Лишь у больных апластической анемией уровень тромбоцитов оставался неизменным, что объяснялось особенностями заболевания.
Таблица 3. Изменение числа тромбоцитов до и через 18 часов после спленэктомии
| Диагноз (количество больных) | Количество тромбоцитов (109 /л) до СЭ | Количество тромбоцитов (109 /л) через 18 ч после СЭ | Р | Трансфузии концентрата тромбоцитов |
| ИТП (n=12) | 37,67±26,65 | 100,1±43,59 | 0,02 | - |
| Сублейкемический миелоз (n=5) | 43,2±35,21 | 88,4±18,88 | 0,35 | - |
| АА (n=4) | 37±4,2 | 34,5±13,4 | 0,825 | + |
| Лимфомы (n=6) | 88,75±44,89 | 116±42,29 | 0,411 | - |
Результаты и обсуждение
Сложность проведения обезболивания в гематологической клинике обусловлена рядом ограничений и противопоказаний к использованию некоторых видов анальгезии. В работе проведено изучение обезболивающего действия и влияния на гемостаз у гематологических больных практически всех известных на сегодняшний день препаратов, используемых для обезболивания. Полученные данные по эффективности и безопасности применения современных препаратов для послеоперационного обезболивания пациентов с заболеваниями системы крови суммированы в таблице 5.
Таблица 4. Показатели ТЭГ до и после введения нефопама пациентам с тромбоцитопенией
| Параметр | Норма | До нефопама | После нефопама | P |
| R, min | 9-27 | 14,57±4,39 | 13,14±4,85 | 0,569 |
| K, min | 2-9 | 6±3,05 | 6±2,31 | 0,997 |
| Angle, deg | 22-58 | 33,43±14,02 | 36±11,75 | 0,686 |
| MA, mm | 44-64 | 48,71±11,04 | 46,57±10,44 | 0,698 |
| CI | -3-3 | 0,86±1,3 | 1,75±1,4 | 0,091 |
Таблица 5. Эффективность и безопасность применения современных анальгетиков у пациентов с заболеваниями системы крови
| Фармакологическая группа | Препарат | Обезболивающий эффект | Послеоперационная дрожь | Влияние на гемостаз |
| Ингибитор ЦОГ-2 в ЦНС | Парацетамол | ++ | Редко | - |
| Опиоидные анальгетики | Фентанил, тримеперидин | +++ | ++ | - |
| Высокоселективный агонист α2-адренорецепторов | Дексмедетомидин | - | - | - |
| Неконкурентный агонист NMDA-рецепторов | Кетамин | + | ++ | - |
| Ингибитор обратного захвата серотонина, норадреналина, дофамина | Нефопам | + | Редко | - |
| НПВП: неселективные ** | Декскетопрофен, диклофенак, мовалис, кетопрофен, кеторолак | ++ | - | ++ |
| НПВП: селективные ингибиторы ЦОГ-2* | Найз, целекоксиб, эторикоксиб | ++ | - | - |
| Антиконвульсанты* | Габапентин, прегабалин | + | - |
| Фармакологическая группа | Препарат | Частые побочные эффекты | Рекомендации по использованию препаратов у больных: | |
| гемофилией (после ортопедических операций) | тромбоцитопенией (после лапароскопической спленэктомии) | |||
| Ингибитор ЦОГ-2 в ЦНС | Парацетамол | - | +++ | +++ |
| Опиоидные анальгетики | Фентанил, тримеперидин | Наркотическая зависимость, гипералгезия | ++ | + |
| Высокоселективный агонист α2-адренорецепторов | Дексмедетомидин | Артериальная гипотензия, брадикардия | + | - |
| Неконкурентный агонист NMDA-рецепторов | Кетамин | Возбуждение и галлюцинации в периоде выхода из наркоза | + | - |
| Ингибитор обратного захвата серотонина, норадреналина, дофамина | Нефопам | Тахикардия, нарушения ритма, задержка мочеиспускания | - | + |
| НПВП: неселективные ** | Декскетопрофен, диклофенак, мовалис, кетопрофен, кеторолак | Дезагрегация тромбоцитов, повреждение слизистой желудка | - | - |
| НПВП: селективные ингибиторы ЦОГ-2* | Найз, целекоксиб, эторикоксиб | Кардиоваскулярные осложнения | - | - |
| Антиконвульсанты* | Габапентин, прегабалин | Головокружение тошнота | - | - |
* Действие препарата не изучалось, т. к. он не имеет форм для внутривенного введения.
** Препараты не использовались вследствие известного отрицательного воздействия на гемостаз и повреждение слизистой желудка.
Использование регионарных методов (спинально-эпидуральная анестезия, различные виды блокад) у больных с гипокоагуляцией чревато развитием геморрагических осложнений (гематом, в том числе эпидуральных) [8]. Несмотря на то что в общей популяции процент эпидуральных гематом невелик и регионарные методы анальгезии выполняются пациентам, принимающим антикоагулянты, следует предполагать, что преимущества регионарной анестезии должны быть существенно большими, чем риск эпидуральной гематомы. Значимое нарушение гемостаза и быстрая элиминация вводимого фактора VIII или IX у больных гемофилией, глубокая тромбоцитопения у пациентов с АА, ИТП, гемобластозами не позволяют предположить этого. Мощное противовоспалительное, анальгетическое, опиоидсберегающее действие НПВП, делает их золотым стандартом обезболивания [9]. Однако назначение НПВП в гематологии сопряжено с двумя серьезными проблемами: гастропатия и нарушение гемокоагуляции. Как известно, простагландины (PGE1, PGE2) участвуют в сохранении целостности клеток слизистой оболочки желудка, снижают кислотность (усиливают выработку бикарбонатов в желудке), улучшают кровоснабжение, способствуют выработке слизи. Подавление синтеза простагландинов НПВП приводит к нарушению их гастропротекторной функции и изъязвлению слизистой оболочки желудка.
Эффективность сочетанного применения НПВП и Н2 -блокаторов или омепразола (в качестве профилактики вышеуказанных нарушений) до сих пор остается неясной и дискутабельной [10]. Необходимо учитывать, что у пациентов с тромбоцитопенией часты геморрагические гастриты, а хронический гастрит, язвенная болезнь желудка и двенадцатиперстной кишки являются второй по частоте встречаемости патологией у больных гемофилией. Кроме того, НПВП угнетают функцию тромбоцитов, блокируя активность ЦОГ.
Необходимо отметить, что ацетилсалициловая кислота (аспирин) вызывает необратимое влияние на ЦОГ и, соответственно, функцию тромбоцитов, дезагрегация тромбоцитов сохраняется в течение всего периода жизни тромбоцитов (6-10 дней) [11]. Остальные НПВП подавляют ЦОГ тромбоцитов временно: функция тромбоцитов возвращается к нормальным значениям через 5 периодов полураспада НПВП. Так, к примеру, если T 1/2 кеторолака 3-8 ч, то дезагрегация тромбоцитов будет на протяжении 15-40 ч (!), или, если взять самый "короткоживущий" НПВП диклофенак (T 1/2 2 ч), то функция тромбоцитов будет нарушена на протяжении 10 ч, что также немало, когда речь идет о раннем послеоперационном периоде у гематологических пациентов.
Таким образом, несмотря на временное блокирование агрегации тромбоцитов при использовании НПВП, применение их абсолютно противопоказано у пациентов с системными заболеваниями крови, протекающими с гипокоагуляцией. Полностью отказались использовать в гематологии блокатор ЦОГ-2 в ЦНС - метамизол (анальгин). Последний способен угнетать кроветворение: может вызывать агранулоцитоз, что объясняется образованием антител к гранулоцитам, связывающим пиразолон, при повторном введении препарата [12]. По данным статистики, в странах Центральной Европы случаи гаптенового агранулоцитоза составляют 1-5:1000 000 в общей популяции, у пациентов с онкогематологическими заболеваниями такие исследования не проводились.
Необходимо отметить, что единственным парентеральным путем введения любых препаратов, в том числе анальгетиков, у больных с тяжелыми гипокоагуляционными нарушениями является внутривенный. Внутримышечное введение у пациентов с тромбоцитопениями и гемофилиями чревато развитием серьезных гематом, а в условиях иммунодефицита - инфекционными осложнениями. Учитывая многокомпонентный механизм послеоперационной боли, перспективным является использование габапептиноидов и ингибиторов ЦОГ-2. Однако в России препараты этих групп имеются лишь в формах для приема внутрь, что затрудняет их использование в периоперационном периоде. Применение у данной категории больных селективных НПВП - ингибиторов циклооксигеназы-2 (ЦОГ-2), не оказывающих влияния на функцию тромбоцитов и слизистую желудка, ограничено в связи с вызываемыми ими побочными эффектами в виде кардиоваскулярных осложнений (инфаркт миокарда, инсульт) [13]. Большей части пациентов с тромбоцитопенией до операции проводится лечение ГКС, часто осложняющееся артериальной гипертензией, сахарным диабетом, гиперлипидемией (в рамках медикаментозного синдрома Иценко-Кушинга), т. е. заболеваниями, при которых следует воздерживаться от назначения селективных НПВП.
Эффективность и безопасность применения различных современных анальгетических препаратов (парацетамол, кетамин, дексмедетомидин, нефопам, тримеперидин) у больных гематологической клиники ранее не изучались. Больные гемофилией представляют специфическую и сложную группу в плане проведения послеоперационного обезболивания. У них часто наблюдается низкий болевой порог, сформировавшийся из-за вынужденного использования обезболивающих препаратов в связи с хроническим болевым синдромом и после операций по поводу рецидивирующих гемартрозов. Методом выбора при хирургических вмешательствах у больных гемофилией является комбинированная эндотрахеальная анестезия. У всех пациентов мы придерживались принципов проведения мультимодальной, превентивной, опиоидсберегающей анальгезии.
Проведенное исследование показало, что у больных гемофилией эффективное снижение боли в раннем послеоперационном периоде после эндопротезирования коленного или тазобедренного суставов достигается мультимодальной анальгезией с использованием ненаркотического анальгетика парацетамола (4 г/сут) и тримеперидина (≈45 мг/сут). По нашим оценкам, при проведении периоперационного обезболивания у пациентов с гемофилией парацетамол обладает 40%-м опиоидсберегающим эффектом. Результаты исследования показателей гемостаза на фоне применения парацетамола позволяют заключить, что препарат может безопасно использоваться у пациентов с гемофилией и, возможно, с гипокоагуляционными состояниями другого генеза.
По данным ТЭГ отмечается даже некоторая тенденция к гиперкоагуляции, что, учитывая исходную гипокоагуляцию и риск кровотечений у больных гемофилией, имеет положительное значение. Изменений активности печеночных ферментов обнаружено не было, следовательно, не выявлено гепатотоксичности парацетамола при применении его в дозе до 4 г в течение суток у больных гемофилией и гепатитом С. Установили, что при включении в периоперационное обезболивание малых доз кетамина при высокотравматичных операциях у больных гемофилией, интенсивность послеоперационной боли несколько снижается, однако при этом отмечаются побочные эффекты: спутанность сознания при пробуждении после анестезии, послеоперационная дрожь. Необходимо учитывать, что выбор обезболивания во многом зависит от травматичности операции. Например, кетамин используется, в основном, при операциях с высокой травматичностью. ЛСЭ, по данным литературы, относится к хирургическим вмешательствам со средней травматичностью, поэтому у пациентов с тромбоцитопениями при ЛСЭ кетамин не использовался. При назначении в послеоперационном периоде дексмедетомидина анальгетического и опиоидсберегающего эффектов не выявлено, однако отмечен ряд других положительных эффектов: у больных гемофилией в послеоперационном периоде препарат способствовал снижению ажитации, возбуждения, тахикардии, нормализации сна. При применении дексмедетомидина не отмечалось послеоперационной дрожи. Исследование применения нефопама у пациентов с гемофилией было ограничено, т.к. сопряжено с высоким риском развития труднокупируемой синусовой тахикардии. При периоперационном обезболивании пациентов, перенесших ЛСЭ, нефопам несколько уступает парацетамолу по анальгетическим свойствам и обладает частыми побочными эффектами (тахикардия, жажда). При этом нефопам не влияет на уровень тромбоцитов, а также на состояние гемостаза по данным ТЭГ. Отличительной особенностью пациентов с иммунной тромбоцитопенией является то, что большинство из них в предоперационном периоде получали глюкокортикостероиды (ГКС) в рамках терапии основного заболевания [14]. Во время операции этим пациентам продолжали вводить ГКС. Исследованием установлено, что использование ГКС в схеме обезболивания парацетамол + тримеперидин значительно снижает интенсивность послеоперационной боли и уменьшает расход наркотических анальгетиков. Необходимо отметить, что ГКС, помимо противовоспалительного и обезболивающего эффектов, повышают риск инфекционных осложнений вследствие иммуносупрессивного действия. Инфекционные осложнения (в том числе бактериемия, пневмония, парапроктит) возникают достоверно чаще у больных, получающих ГКС (66,2% против 33,8%) [15]. Нельзя не учитывать также постспленэктомическую повышенную склонность к инфекционным заболеваниям. В связи с этим лишь с целью усиления обезболивания использование ГКС нецелесообразно. Однако прогнозировать наилучшее обезболивание у больных, получающих периоперационно ГКС, весьма обоснованно.
Заключение
Основные принципы лечения боли у пациентов с заболеваниями системы крови сводятся к использованию мультимодальной анальгезии: базовая терапия (парацетамол) + опиаты внутривенно; превентивная анальгезия - начало базовой терапии до возникновения боли; исключение локальной и/или регионарной анальгезии; контроль результатов лечения (шкалы боли). Для проведения послеоперационного обезболивания у больных гемофилией и тромбоцитопенией рекомендовано использование схемы парацетамол (4 г/сут) и тримеперидин (по требованию). Значимо повышает обезболивающий эффект данной схемы обезболивания периоперационное введение ГКС (преднизолон) в рамках лечения основного заболевания.
Литература
- Андреев Ю. Н. Многоликая гемофилия. М.: Ньюдиамед; 2006.
- Афанасьев Б. В., Волкова О. Я. Гематология. Руководство для врачей. Санкт-Петербург: СпецЛит; 2008.
- Михайлова Е. А., Савченко В. Г., Устинова Е. Н., Виноградова М. А. и др. Спленэктомия в программной терапии апластической анемии. Терапевтический архив. 2006; 78 (8): 52-57.
- Kozek-Langenecker S. A. The effects of drugs used in anaesthesia on platelet membrane receptors and on platelet function. Curr Drug Targets. 2002 Jun; 3 (3): 247-258.
- Fourcade O., Simon M. F., Litt L., Samii K., Chap H. Propofol inhibits human platelet aggregation induced by proinflammatory lipid mediators. Anesth Analg. 2004 Aug; 99 (2): 393-398.
- Бутров А. В., Кондрашенко Е. Н. Пути оптимизации послеоперационного обезболивания. Русский медицинский журнал. 2012; 20 (18): 94-98.
- Moulis G., Sommet A., Sailler L., Lapeyre-Mestre M., Montastruc J. L. Drug-induced immune thrombocytopenia: a descriptive survey in the French PharmacoVigilance database. Platelets. 2012; 23 (6): 490-494.
- Морган Дж. Эд., Михаил М. С. Клиническая анестезиология. 2-е изд., М.-СПб.: БИНОМ-Невский диалект, 2001. Книга 1.
- Бутров А. В., Борисов А. Ю. Современные подходы к фармакотерапии послеоперационной боли с применением синтетических опиоидов и ненаркотических анальгетиков. Русский медицинский журнал. 2004; 324: 14-34.
- Masso Gonzalez E. L., Patrignani P., Tacconelli S. et al. Variability among nonsteroidal antiinflammatory drugs in risk of upper gastrointestinal bleeding. Arthritis Rheum. 2010; 62 (6): 1592- 1601.
- Barkun A. N., Bardou M., Pham C. Q., Martel M. Proton pump inhibitors vs. histamine 2 receptor antagonists for stress-related mucosal bleeding prophylaxis in critically ill patients: a meta-analysis. Am J Gastroenterol. 2012; 107 (4): 507-520.
- Баринов А. Н., ред. Справочник: лечение боли. М.: "МЕДпресс-информ"; 2011.
- Rattray B., Nugent D. J., Young G. Rofecoxib as adjunctive therapy for haemophilic arthropathy. Haemophilia 2005; 11 (3): 240-244.
- Масчан А. А., Румянцев А. Г., Ковалева Л. Г. и др. Рекомендации российского совета экспертов по диагностике и лечению больных первичной иммунной тромбоцитопенией. Онкогематология. 2010; 3: 36-45.
- Виноградова М. А., Клясова Г. А., Трушина Е. Е., Устинова Е. Н., Михайлова Е. А. Инфекционные осложнения в дебюте апластической анемии. Гематология и трансфузиология. 2007; 4: 16-21.