Отдельные главы из монографии «Спинномозговая анестезия в акушерстве».
Постпункционная головная боль. Часть 1
Из всех теневых сторон спинномозговой анестезии это самая тягостная и неприятная.
…Надежно устранить появление головных болей мы до сих пор не можем… С. С. Юдин
Постпункционная головная боль (ПГБ) громогласно заявила о себе как о типичном осложнении спинномозговой анестезии сразу же в самом начале освоения этого метода обезболивания. Как известно, первая в истории медицины спинномозговая анестезия была проведена немецким хирургом Августом Биром (August Bier, 1861–1949) 16 августа 1897 г. Операция (резекция голеностопного сустава) и обезболивание прошли успешно, но в послеоперационном периоде у пациента развилась тяжелая головная боль, сопровождавшаяся неукротимой рвотой.
Если вернуться к истории спинномозговой анестезии, то можно увидеть, что развитие и освоение нейроаксиальных методов анестезии всегда были неразрывно связаны с борьбой по уменьшению частоты ПГБ, неприятной спутницы столь совершенных в других отношениях методов обезболивания. Эта борьба продолжается и в настоящее время. Однако, к великому сожалению, речь идет пока лишь об уменьшении частоты ПГБ, поскольку, несмотря на ощутимый прогресс в разработке игл и лекарственных препаратов, полностью устранить это осложнение спинномозговой анестезии не удается.
В природе возникновения ПГБ по‑прежнему имеется очень много белых пятен, и на многие вопросы исследователи этой проблемы до сих пор не нашли убедительных ответов. Именно поэтому мы и решили выделить рассуждения о постпункционной головной боли в материалах отдельной главы.
Частота возникновения ПГБ В 1898 г., в первый год существования метода спинномозговой анестезии, частота возникновения ПГБ составляла 66 % [1]. Понятно, что такая высокая частота головной боли была обусловлена применением несовершенных спинномозговых игл слишком большого калибра.
В акушерской практике спинномозговую анальгезию для обезболивания родов впервые применил швейцарский акушер-гинеколог Оскар Крайс (Oskar Kreis, 1872–1958). В 1900 г. он сообщил о 6 случаях обезболивания родов посредством интратекального введения 0,01 г кокаина [2]. Вскоре, в 1901 г., акушер-гинеколог из США Уильям Раджли Стоун (William Rudgely Stone) сообщил уже о 35 случаях обезболивания родов этим методом [3]. Возможность использовать субарахноидальную инъекцию кокаина не только для смягчения боли в родах, но и для анестезии при кесаревом сечении была реализована в том же самом году в Англии и в 1902 г. – в США. Но многие из этих случаев анестезии были омрачены развитием постпункционной головной боли.
Следует отметить, что внедрение метода спинномозговой анестезии в акушерскую практику было весьма тернистым и болезненным. Наряду с высокой частотой таких осложнений, как ПГБ, тошнота и рвота, спинномозговая анестезия во время операций кесарева сечения сопровождалась чрезвычайно высокой интраоперационной смертностью и считалась довольно опасным методом обезболивания в акушерстве. Так, в 1930 г. частота случаев интраоперационной смертности во время операций кесарева сечения под спинномозговой анестезией составляла 1 на 139 случаев анестезий [4].
Все это, вместе взятое, привело к значительному ограничению применения спинномозговой анестезии в акушерстве. Не случайно период с 1900 по 1930 г. довольно часто упоминается как «самый мрачный этап развития акушерской анестезиологии». Зато в это время получили развитие методы психопрофилактической подготовки к родам и концепция «естественного деторождения».
С появлением игл калибром 22–24 G частота случаев возникновения ПГБ существенно снизилась, и в 1956 г. она уже составляла всего 11 % [5].
Применение для спинномозговой пункции конических игл малого калибра (25–29 G) привело к еще более значительному снижению частоты этого осложнения. Зависимость частоты возникновения ПГБ от диаметра и типа спинномозговых игл будет более подробно рассмотрена в следующих разделах этой главы.
Хотя ПГБ относится к неврологическим осложнениям метода, похоже, что сами неврологи в своей деятельности не очень стремятся к снижению частоты этого осложнения посредством применения игл малого калибра. И в настоящее время диагностические люмбальные пункции в большинстве случаев осуществляются режущими иглами калибром 20 и даже 18 G с обусловленной этим обстоятельством высокой частотой ПГБ.
Если в анестезиологии отмечается отчетливая всеобщая тенденция к отказу от применения спинномозговых игл калибром более чем 22 G, в неврологических периодических изданиях самыми революционными считаются статьи о профилактике ПГБ с рекомендациями применять для диагностических пункций иглы калибром 20 G [6].
Во многом такое положение вещей обусловлено очень важным для практикующих невропатологов обстоятельством: хотя адекватное для диагностической пункции истечение ликвора и может быть достигнуто при использовании игл калибром 22 G, еще более благоприятным для этой цели является применение игл большего калибра (20 G).
Говоря о частоте синдрома ПГБ в акушерстве, будет совершенно уместным упомянуть и такое осложнение, как непреднамеренный прокол твердой мозговой оболочки во время проведения эпидуральной анестезии, которое может происходить в 0,18–3,6 % случаев [7]. Частота возникновения постпункционной головной боли при проколе твердой мозговой оболочки иглой Туохи калибром 16 G составляет 81 % [8].
По данным мультицентрового исследования «Безопасность спинномозговой анестезии при операциях кесарева сечения» (г. Петрозаводск) на июнь 2004 г., частота возникновения ПГБ составляла 2,61 %.
Клиническая физиология головной боли
Начиная обсуждение проблемы ПГБ в акушерстве, следует отметить, что головная боль у беременных женщин представляет собой довольно распространенное явление. Возникновение у родильницы жалоб на головную боль не должно сразу же направлять ход клинического мышления лечащего врача в русло гипердиагностики синдрома ПГБ.
Хорошо известен факт того, что из числа родильниц, вообще не получавших никакого анестезиологического пособия во время родоразрешения, 25 % женщин предъявляют в послеродовом периоде жалобы на головную боль различной степени выраженности [9].
Для возникновения головной боли у родильницы имеется достаточно большое количество самых разнообразных причин. К счастью, в большинстве таких случаев имеют место эпизоды обычной, неспецифической, головной боли, обусловленной утомлением женщины либо ее эмоциональным напряжением и тревогой за состояние ребенка.
В более серьезных случаях причинами головной боли в послеродовом периоде могут стать, например, преэклампсия, менингит, субдуральная гематома, тромбоз венозных синусов или предмет нашего обсуждения – синдром ПГБ.
Механизмы возникновения головной боли до сих пор однозначно не определены. Известно, что чувствительность различных структур к боли зависит от плотности размещенных в них рецепторов. В области головы эти рецепторы имеются в коже, подкожной клетчатке, мышцах, сухожильном шлеме. В более глубоких структурах они присутствуют в сосудах мягких тканей головы, надкостнице черепа, оболочках мозга (особенно в участках, прилегающих к оболочечным структурам), внутричерепных артериях, венах и нервах.
Однако сам головной мозг нечувствителен к боли, и до сегодняшнего дня так окончательно и не установлено, вызывается ли головная боль раздражением специфических рецепторов – ноцицепторов или же она может, например, возникать при чрезмерном раздражении различных типов рецепторов (стенки сосудов, венозных синусов и т. д.). Таким образом, любой раздражающий фактор в области головы или шеи может привести к головной боли.
Молодые женщины, как правило, не страдают головными болями, причинами которых могут быть артриты или иррадиация от чувствительных ветвей корешков С1–2, но напряжение мышц скальпа или шеи, имевшее место в послеоперационном или послеродовом периоде, может спровоцировать у них возникновение головной боли. К этим внечерепным (экстракраниальным) причинам головной боли может относиться и раздражение таких чувствительных образований, как система тройничного нерва и черепномозговых нервов IV, IX и X пар, а также венозных синусов и артерий. Высвобождение нейрокининов, брадикининов и пептидов вблизи сосудистой стенки вызывает их раздражение, а система тройничного нерва и связанных с ним сосудов может передавать эти болевые ощущения.
Например, патологические процессы в области глаз или орбиты, хронические синуситы и заболевания уха, иногда обостряющиеся в послеоперационном или послеродовом периоде, могут сопровождаться болевым синдромом. Задержка жидкости в синусах или позади барабанной перепонки, достаточно часто возникающая во время беременности и в послеродовом периоде, также может приводить к появлению боли. Однако такие головные боли отличаются своей локальностью и отсутствием связи с изменением положения тела.
Причиной для появления головной боли у родильницы может стать раздражение сосудистых рецепторов, обусловленное избыточным растяжением сосудов пульсовым объемом или избыточным кровенаполнением дилатированных сосудов. Например, так называемая венозная головная боль обусловлена перерастяжением внутричерепных вен при их избыточном кровенаполнении и повышением давления в венозных синусах. Она чаще всего проявляется при нарушении венозного оттока из полости черепа (например, тромбоз венозных синусов). Эта боль локализуется преимущественно в области затылка, что объясняется раздражением области слияния внутричерепных венозных синусов, где наиболее высока плотность чувствительных рецепторов. Паретическая вазодилатация при выраженной артериальной гипотонии также может приводить к появлению головной боли.
Мышечная головная боль возникает при длительном напряжении или сдавлении мышц мягких покровов головы. Больные при этом испытывают ощущение сдавления или стягивания головы тугой повязкой. У родильниц, перенесших операцию кесарева сечения, появление такой боли может быть обусловлено длительным вынужденным положением лежа на спине без подушки.
Головная боль у родильниц в раннем послеоперационном или в послеродовом периоде может быть и проявлением нейротоксического действия лидокаина. В этом случае мы имеем дело с токсической головной болью. Однако это явление характерно не для спинномозговой, а для эпидуральной анестезии, так как передозировка местного анестетика более возможна именно при этом методе обезболивания, поскольку токсическое действие лидокаина на различные органы и системы зависит от его концентрации в плазме (рис. 9.1).
Основоположник спинномозговой анестезии немецкий хирург Август Бир первым предположил, что причиной головной боли после люмбальной пункции является истечение ликвора через отверстие, остающееся в твердой мозговой оболочке, и что эта головная боль никак не связана с действием вводимых медикаментов. Справедливость предположения A. Бира подтверждает тот факт, что возникновение синдрома ПГБ после эпидуральной анестезии, как правило, является следствием непреднамеренной пункции твердой мозговой оболочки. Поскольку эпидуральные иглы, в отличие от спинномозговых, имеют гораздо больший внешний диаметр (16–18 G), то истечение ликвора через перфорационное отверстие в твердой мозговой оболочке, выполненное такой толстой иглой, будет более интенсивным.

В этом случае мы имеем дело с одним из видов ликвородинамической головной боли, которая наступает при изменениях внутричерепного давления (гипертензия или гипотония) и дислокации внутричерепных структур. К такой патологии относятся, например, головные боли, возникающие при низком ликворном давлении – синдроме G. Schaltenbrand (спонтанная аликворея; спонтанная внутричерепная гипотония) [10]. Этот синдром развивается достаточно редко. Его основным клиническим признаком является наличие постуральной головной боли без предшествующей травмы или поясничной пункции. Головная боль носит постуральный характер, усиливается в положении сидя или стоя и уменьшается в положении лежа.
Как правило, эта боль является довольно интенсивной и обычно вовлекает весь череп, хотя она может быть локализована в затылочной или лобной областях. Другие проявления этого синдрома включают тугоподвижность шеи, тошноту и рвоту, фотофобию, анорексию, общую слабость, головокружение, нарушения слуха и диплопию.
Для подтверждения диагноза этого синдрома требуется проведение диагностической люмбальной пункции. Снижение ликворного давления до уровня менее чем 70 мм вод. ст. в положении больного на боку считается достаточным критерием для диагностики синдрома G. Schaltenbrand [11], хотя показатели ликворного давления у таких больных находятся в пределах 30 мм вод. ст. Анализ цереброспинальной жидкости обычно выявляет повышенное содержание белка и повышенное количество эритроцитов и лейкоцитов.
Головная боль и другие клинические проявления спонтанной внутричерепной гипотонии могут наблюдаться у больного на протяжении довольно длительного времени, от нескольких недель до нескольких месяцев, с постепенным, спонтанным разрешением заболевания [12]. Лечение при спонтанной внутричерепной гипотонии включает постельный режим, назначение кофеина и стероидов, применение абдоминального бандажа, эпидуральное введение солевых растворов и пломбирование эпидурального пространства «заплаткой» из аутокрови.
Существуют различные теории, пытающиеся объяснить этиологию и патогенез спонтанной внутричерепной гипотонии. Чаще всего их объясняют либо утечкой ликвора через «маленькие поры» в твердой мозговой оболочке, либо снижением продукции ликвора, либо его гиперабсорбцией. Однако убедительных научных доказательств в поддержку какой-либо из этих гипотез нет. Столь высокая схожесть клинической симптоматики синдрома спонтанной внутричерепной гипотонии с синдромом ПГБ подтверждает теорию этиологической роли истечения ликвора при этом осложнении спинномозговой анестезии. Интересно, что, несмотря на различие теорий этиопатогенеза спонтанной внутричерепной гипотонии и синдрома ПГБ, наиболее эффективным методом их лечения считается эпидуральное введение аутокрови.
Тяжесть состояния больных при развитии синдрома ПГБ зависит от интенсивности истечения ликвора в эпидуральное пространство. В связи с этим большое значение имеют размер и форма отверстия, оставленного в твердой мозговой оболочке иглой. Количество истекающей спинномозговой жидкости зависит от трех основных факторов:
- размеров и формы дефекта твердой мозговой оболочки;
- градиента давления между субдуральным и эпидуральным пространством, который в положении сидя составляет около 40–50 мм вод. ст.;
- продукции спинномозговой жидкости.
Продукция ликвора представляет собой довольно интенсивный процесс. Ликвор вырабатывается со скоростью 0,35 мл / мин, или около 500 мл / сут.
В связи с этим становится понятным, почему после наложения «кровяной заплаты» и устранения утечки ликвора через дефект в твердой мозговой оболочке головная боль устраняется. У человека, находящегося в горизонтальном положении, ликворное давление в поясничном отделе, цистернах головного мозга и общее внутричерепное давление уравниваются, и нормальные величины давления составляют от 60 до 180 мм вод. ст. В положении стоя эти показатели расходятся, и внутричерепное давление становится отрицательным [13]. Ортостатические головные боли возникают при снижении внутричерепного давления на 10 % [14].
Ликвор в полости черепа выполняет роль своеобразной жидкостной подушки, на которой в относительно плавающем состоянии покоится головной мозг. Это приспособление природы позволяет несколько уменьшить относительную массу головного мозга, определяющую натяжение в полости черепа венозных сплетений, связок и других структур, поддерживающих мозг по отношению к большим синусам твердой мозговой оболочки, мозжечковому намету и костям основания черепа.
В вертикальном положении головной мозг под действием гравитации стремится к смещению вниз, от чего его защищает поддерживающая сила окружающего ликвора. Таким образом, уменьшение общего количества спинномозговой жидкости приводит к увеличению натяжения поддерживающих структур головного мозга, венозных синусов, мозговых сосудов и твердой мозговой оболочки, а следовательно, и к раздражению расположенных в этих структурах рецепторов.
Очень важным моментом в возникновении ПГБ считается также и то, что основные компоненты интракраниальной системы (паренхима мозга, ликвор, внутрисосудистый объем крови) по своей природе несжимаемы, и поэтому любое изменение объема одного из этих компонентов на фоне постоянного уровня внутричерепного давления неизбежно приведет к компенсаторным изменениям величин других компонентов. Этот принцип перераспределения объемов известен в нейрохирургии под названием концепции Монро–Келли. Таким образом, при усиленной потере ликвора компенсаторные механизмы, направленные на заполнение освободившегося внутричерепного объема, вызывают дилатацию мозговых сосудов и увеличение их кровенаполнения, что, в свою очередь, также обусловливает возникновение головной боли.
Справедливости ради следует заметить, что доктрина Монро–Келли, ранее безраздельно господствовавшая в нейрохирургии, несколько устарела. Согласно этой доктрине существование какого‑либо внутреннего, регулирующего мозговое кровенаполнение механизма отрицается и навязывается представление о постоянстве количества крови в черепной коробке, в связи с чем мозговой кровоток якобы находится в исключительной зависимости от уровня общего артериального давления. В настоящее время убедительно доказано, что мозговой кровоток относительно независим от общего артериального давления. Сосуды мозга на всем протяжении имеют собственный регуляторный аппарат, обеспечивающий адекватный мозговой кровоток и перераспределяющий контроль в зависимости от активности отдельных зон головного мозга. Возможно, именно в этом противоречии заложена основа для существования некоторых «белых пятен» в теории этиопатогенеза ПГБ, речь о которых пойдет далее.
Генерированные, благодаря вышеописанным механизмам, болевые импульсы передаются из намета мозжечка по системе тройничного нерва (V пара) в лобную область, ниже намета мозжечка – по языкоглоточному и блуждающему нервам (IX, X пары) и по верхним шейным нервам (С1,2,3) к затылку и шее. В тяжелых случаях натяжение затрагивает черепно-мозговые нервы (чаще всего группу глазодвигательных нервов). Это иногда приводит к временному параличу n. abducens и возникновению нарушений зрения.
Следующий компонент этой модели – давление в эпидуральном пространстве. Чем ниже оно будет относительно давления спинномозговой жидкости, тем в большей степени градиент давления между субдуральным и эпидуральным пространством будет способствовать истечению ликвора.
Дуральный мешок представляет собой эластическую структуру, в которой на жидкостное содержимое (в данном случае ликвор и введенные лекарства) воздействует давление в эпидуральном пространстве. Подтверждением этому служит тот факт, что при введении в эпидуральное пространство солевых растворов увеличивается уровень спинномозговой анестезии [15].
У полных больных, благодаря высокому внутрибрюшному давлению, градиент давления между суби эпидуральным пространствами значительно ниже, чем у худых пациентов. Поэтому синдром ПГБ чаще возникает у последних. У женщин после родов полностью устраняются явления аортокавальной компрессии и происходит резкое снижение внутрибрюшного давления, что, в свою очередь, приводит к снижению давления в эпидуральном пространстве.
Продукция ликвора при этом остается прежней, и он устремляется через дефект твердой мозговой оболочки в сторону наименьшего давления. В связи с этим у родильниц синдром ПГБ возникает намного чаще, чем у обычных хирургических больных.
У молодых пациентов эластичность твердой мозговой оболочки выше, чем у пожилых людей, следовательно, и растяжение отверстия со стороны субдурального пространства у них будет происходить в большей степени. Поэтому регистрируемая частота возникновения ПГБ у пациентов пожилого возраста значительно ниже.
Теория Августа Бира, объясняющая механизм возникновения головной боли после спинномозговой анестезии, и сегодня остается общепризнанной. Но так ли однозначно это толкование? Повидимому, истечение ликвора через оставшийся дефект твердой мозговой оболочки – это значимая, но все‑таки далеко не единственная этиологическая причина ПГБ.
Спустя 50 лет после того, как Август Бир выдвинул свое предположение о механизме возникновения постпункционной головной боли, J. Lawrence Pool, выполнив с помощью эндоскопической техники эпидуроскопию у 2 больных, перенесших за 4 дня до этого спинномозговую анестезию, обнаружил у них достаточно большие дефекты в твердой мозговой оболочке, через которые в эпидуральное пространство постоянно дренировался ликвор. Тем не менее эти больные совершенно не предъявляли каких-либо жалоб по поводу головной боли [14].
Таким образом, остается бесспорным только одно: к возникновению синдрома ПГБ приводит нарушение целостности твердой мозговой оболочки. Но если бы он возникал только по этой причине, то головная боль развивалась бы в 100 % случаев спинномозговых пункций, а она, к счастью, наблюдается намного реже. Следовательно, на основании всех вышеперечисленных клинико-физиологических механизмов можно сделать вывод о том, что данный процесс зависит от ряда факторов, анализ которых позволяет выработать ряд мер по профилактике и лечению синдрома ПГБ.
Факторы, влияющие на частоту возникновения ПГБ
Возраст
Частота этого осложнения значительно уменьшается у детей моложе 13 и взрослых старше 60 лет. Максимальная частота отмечается в возрастной группе от 18 до 30 лет. Тем не менее в педиатрии это тоже очень серьезная проблема, так как частота ПГБ у детей составляет около 8 %.
Более низкая частота возникновения ПГБ у пациентов пожилого возраста объясняется снижением эластичности волокон твердой мозговой оболочки, уменьшением объема и увеличением давления в эпидуральном пространстве, уменьшением чувствительности рецепторов твердой мозговой оболочки и сосудов.
Масса тела
Частота случаев ПГБ значительно выше у пациентов с низким индексом массы тела (вес / рост).
Пол
ПГБ встречается в 2 раза чаще у женщин, чем у мужчин. При этом наибольшему риску подвержены молодые женщины с низким индексом массы тела. У молодых женщин волокна твердой мозговой оболочки отличаются большей эластичностью, что значительно способствует расхождению краев дефекта в твердой мозговой оболочке и зиянию в ней отверстия. Повышенный уровень эстрогенов увеличивает чувствительность рецепторов к субстанции Р, что также может объяснять более высокую частоту головной боли у женщин.
Несмотря на то что прогестерон увеличивает порог чувствительности к болевым раздражителям, ПГБ встречается у рожениц и родильниц намного чаще, чем в хирургической практике. Повидимому, увеличению частоты постпункционных головных болей у родильниц способствуют следующие обстоятельства:
- во время схваток и потуг увеличивается истечение ликвора через дефект в твердой мозговой оболочке;
- дегидратация, развивающаяся в послеродовом периоде вследствие кровопотери и увеличения диуреза, уменьшает продукцию ликвора;
- снижение давления в эпидуральном пространстве после извлечения плода.
Головная боль в анамнезе
Наличие у больных в предшествующем субдуральной или эпидуральной пункции анамнезе частых эпизодов головной боли в 3 раза увеличивает риск возникновения ПГБ по сравнению с популяцией больных, не страдающих головными болями до выполнения процедуры [16]. Более того, если после пункции у этих больных возникают головные боли, то они носят более тяжелый характер и сохраняются дольше, чем у других пациентов.
Диаметр иглы
Пожалуй, самым важным фактором, который влияет на развитие ПГБ, является диаметр пункционной иглы: чем больше диаметр иглы, тем выше риск возникновения головных болей и выраженнее их интенсивность.
Мы уже приводили ранее статистику головных болей в 1898 г., когда пункционные иглы были более чем несовершенны. В настоящее время для спинномозговой анестезии используют иглы калибром 22–30 G. ПГБ после пункции иглами 22 G возникает в 6–10 % случаев. В сравнении с этим головная боль после пункции иглами малого калибра встречается только в 0,6–1 % случаев, то есть она прямым образом зависит от внешнего диаметра иглы [17].
Тем не менее в патофизиологии ПГБ есть еще немало загадочных фактов, поэтому к оценке данного фактора – диаметра применяемой иглы – нельзя подходить однозначно. Например, остается совершенно непонятным: почему иногда в случаях непреднамеренного прокола твердой мозговой оболочки толстой эпидуральной иглой постпункционная головная боль не возникает вообще и в то же время данное осложнение совершенно неожиданно появляется при использовании разрекламированных тончайших спинальных игл? Хорошо известно, что свободное истечение цереброспинальной жидкости через дефект в твердой мозговой оболочке не всегда является обязательным следствием ее пункции, даже если она выполнялась иглой Туохи калибром 16 G [18].
Кроме того, время от времени в литературе появляются сообщения, которые ставят под сомнение истинность причинно-следственных отношений потери ликвора и ПГБ. Так, в 1995 г. J. Iqbal и соавт. [19] исследовали с помощью метода магнитно-ядерной томографии зависимость появления головной боли от объема утечки ликвора после люмбальной пункции. Они не нашли абсолютно никакой корреляции между количеством потерянной цереброспинальной жидкости и частотой появления головной боли. Таким образом, они сделали вывод, что объем потери ликвора не влияет на частоту возникновения ПГБ.
К числу совершенно загадочных относится, например, и тот факт, что при равном отношении к технологии процедуры пункции и к методике обезболивания существуют отделения анестезии, где данное осложнение считается экзотической редкостью, при том что в других отделениях в этом же городе, и даже в этой же больнице, ПГБ возникает с крайне высокой частотой.
Наверное, именно в связи с этим явлением нам не представляется возможным привести точные данные о возникновении синдрома ПГБ в зависимости от применения конкретного типа и диаметра иглы. Противоречивость литературных данных по этому вопросу наглядно отражена в табл. 9.1.
И в то же время, говоря о роли такого фактора, как диаметр используемой иглы, совершенно невозможно полностью игнорировать приведенные в таблице данные.
Наверное, у многих читателей, широко практикующих спинномозговую анестезию, некоторые показатели частоты ПГБ, приведенные в таблице, вызовут недоумение. Пользуясь возможностью проиллюстрировать тезис о белых пятнах в патофизиологии ПГБ, сообщаем, что в нашем отделении частота возникновения ПГБ находится в пределах 1 %. При этом в подавляющем большинстве случаев спинномозговой анестезии наши врачи используют только иглы Квинке калибром 22 G.
По данным проводимого нами мультицентрового исследования «Безопасность спинномозговой анестезии при операциях кесарева сечения» на июнь 2004 г., частота возникновения ПГБ при использовании игл калибром 20 G составляла 50 %, 22 G – 4,9 %, 25 G – 2,2 %, 27 G – 0,92 %, 29 G – 0 %.
Расположение среза иглы во время пункции Широко распространено мнение, что коллагеновые волокна твердой мозговой оболочки ориентированы в продольном направлении, то есть параллельно оси спинного мозга. Еще в 1926 г. Г. М. Грини [33] сообщил, что при спинномозговой пункции срезом иглы параллельно волокнам твердой мозговой оболочки остается небольшой дефект, а следовательно, количество истекающей через этот дефект спинномозговой жидкости должно быть меньше, чем после пункции в тех случаях, когда игла была направлена перпендикулярно волокнам.
В 1930 г. это предположение творчески развил Гастон Лабат (G. Labat). Из его вывода, впоследствии широко известного как «постулат Гастона Лабата», следовало, что анестезиолог при осуществлении люмбальной пункции обязан располагать срез иглы вдоль оси спинного мозга, чтобы «раздвигать, а не разрезать» волокна твердой мозговой оболочки. Согласно этому постулату, перфорационное отверстие в твердой мозговой оболочке получается щелевидным, и утечка ликвора в эпидуральное пространство оказывается незначительной, что должно существенно способствовать снижению частоты ПГБ [34].
В 1946 г. C. Franksson и T. Gordh [35] внесли свой вклад в дальнейшее развитие этой теории, дополнительно указав на то, что использование игл малого диаметра приводит к уменьшению количества разрушенных кончиком иглы коллагеновых волокон твердой мозговой оболочки.
Обусловленная этим меньшая площадь отверстия в твердой мозговой оболочке способствует, в свою очередь, снижению объема общей утечки ликвора из субарахноидального пространства. Эти авторы сделали также дополнительный акцент на том, что при расположении среза иглы в продольном направлении снижается количество поврежденных волокон твердой мозговой оболочки.
Для того чтобы последователям Гастона Лабата было легче выполнять требования его постулата, дизайн современных спинномозговых игл предусматривает обязательное наличие специальных насечек на павильоне иглы и выступе на рукоятке мандрена, строго соответствующих ориентации среза иглы. Это позволяет избежать краниальной или сакральной ориентации среза иглы во время пункции (рис. 9.2).
Несмотря на все имеющиеся противоречия, следует признать, что концепция Грини–Лабата в практическом отношении оказалась достаточно существенной и эффективной. Согласно литературным данным, при перпендикулярном расположении среза иглы во время пункции по отношению к волокнам твердой мозговой оболочки частота возникновения ПГБ на 50 % выше, чем при параллельном расположении среза иглы, поэтому игнорировать связь ориентации среза иглы и частоты возникновения ПГБ невозможно.
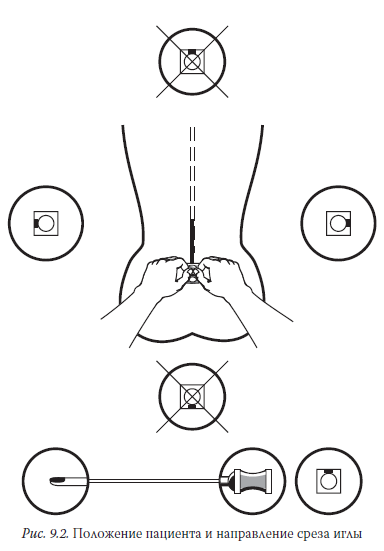
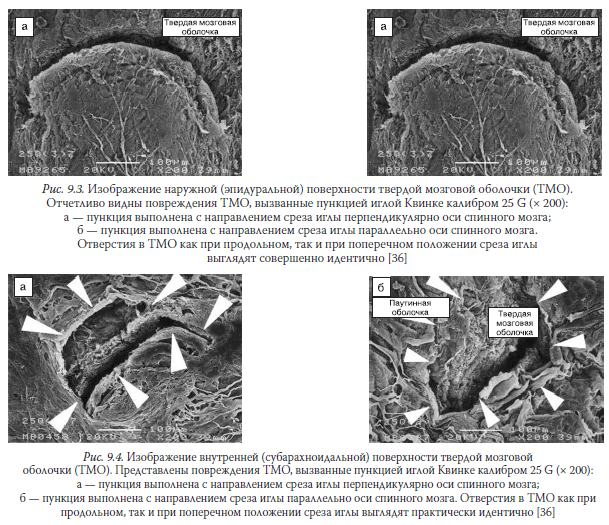
Тем не менее с относительно недавнего времени существует и абсолютно противоположная точка зрения на эту проблему. Современные исследования, использующие сканирующую электронную микроскопию, показали, что волокна твердой мозговой оболочки располагаются хаотично, а не строго продольно [37]. Выяснилось, что наружная поверхность твердой мозговой оболочки формируется из коллагеновых волокон, идущих в продольном, горизонтальном и косом направлениях [38]. Более того, при электронной микроскопии постпункционные отверстия в твердой мозговой оболочке как при продольном, так и при поперечном расположении среза иглы выглядят совершенно идентично (рис. 9.3 и 9.4).
Все вышесказанное не является какой-либо попыткой с нашей стороны призвать читателей к немедленному отказу от почтительного отношения к концепции Грини–Лабата. Более того, мы продолжаем считать, что именно строгое следование ее требованиям позволило нам в свое время избежать многих неприятностей, связанных с возникновением синдрома ПГБ после спинномозговых пункций, которые выполнялись режущими иглами. По всей видимости, в основе практической эффективности данного постулата лежат какие-то другие, неизвестные пока исследователям механизмы.
Дизайн иглы
Не вызывает сомнений, что величина и форма постпункционного дефекта в твердой мозговой оболочке будут обусловлены типом иглы, которую мы применяем для пункции. Следовательно, должна существовать и какая‑то зависимость интенсивности и частоты постпункционных головных болей от данного фактора.
В настоящее время надежды анестезиологов снизить частоту возникновения ПГБ связаны с применением пункционных игл малого калибра (25 G и более), либо конических игл с нережущим кончиком. Считается, что конические спинномозговые иглы («карандашного» типа) являются атравматичными, так как при пенетрации твердой мозговой оболочки они не разрезают, а просто раздвигают ее волокна, и, таким образом, впоследствии снижается утечка цереброспинальной жидкости. Именно это мнение и продекларировали в 1951 г. J. R. Hart и R. J. Whitacre, представляя вниманию анестезиологической общественности свою иглу «карандашного» типа (pencil-point needle) [39]. При этом авторы не предъявили каких-либо прямых доказательств своей теории, ограничившись лишь дедуктивным предположением, что частота ПГБ при использовании таких игл должна стать значительно ниже [40].
И хотя эта теория, начиная с 1951 г., получила самое широкое распространение, наряду с ней имелись и другие мнения, достаточно аргументированно подтвержденные результатами исследований, в которых не было выявлено связи между типом иглы и частотой возникновения ПГБ [41].
Чтобы понять патофизиологию синдрома ПГБ, M. A. Reina и соавт. в 2000 г. провели ряд интересных исследований, в которых была применена сканирующая электронная микроскопия.
Наибольший интерес представляют результаты исследования, в котором сравнивалась морфология отверстий в твердой мозговой оболочке после пункций иглами Квинке и Уайтакра [37].
В данном исследовании авторы использовали препараты твердой мозговой оболочки, изъятой у умерших доноров сразу же после их смерти. Препараты подвергались пункциям иглами Уайтакра (25 G) и Квинке (25 G). Полученные результаты стали более чем обескураживающими даже для самих экспериментаторов. Как и ожидалось, существенные различия в морфологии повреждений твердой мозговой оболочки, вызванных различными типами игл, действительно были выявлены, однако эти данные электронной микроскопии совершенно противоречили как ожидаемым результатам, так и основным положениям господствовавшей концепции J. R. Hart и R. J. Whitacre.
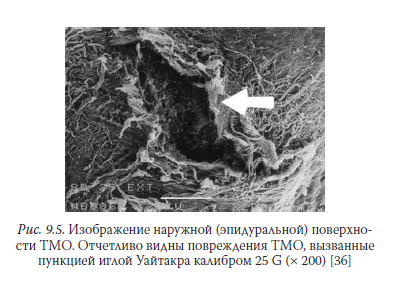
Оказалось, что «атравматичные» иглы Уайтакра вызывают более грубые повреждения твердой мозговой оболочки, чем это предполагалось ранее. На самом деле они не раздвигают, как это принято считать, а разрывают волокна твердой мозговой оболочки, вызывая интенсивный воспалительный отек краев ранки. На наружной (эпидуральной) поверхности твердой мозговой оболочки повреждения, вызванные иглами Уайтакра, были либо округлыми, овальными, эллиптическими, либо звездообразными. Границы всех исследованных повреждений были очень грубыми из-за разрыва коллагеновых волокон (рис. 9.5).
Заслуживало также внимания и то, что область поперечного сечения повреждений уменьшалась или даже исчезала по мере углубления иглы в слои твердой мозговой мембраны.
Зато границы повреждений, вызванные иглами Квинке, были ровными, четко обрезанными, и имели U-образную форму независимо от направления среза иглы при пенетрации твердой мозговой оболочки. При этом коллагеновые волокна на границе повреждений всегда были аккуратно срезаны.
Во всех случаях пункций иглами Квинке эти повреждения как бы формировали «крыло» из твердой мозговой оболочки, что несколько напоминает приоткрытую крышку бидона (см. рис. 9.3).
Повреждения, вызванные иглами Уайтакра на внутренней поверхности твердой мозговой оболочки (рис. 9.6), имели схожую морфологию и характеристики с повреждениями на наружной поверхности (см. рис. 9.5). Было также отмечено значительное разрушение коллагеновых волокон на границе повреждения, вызванное эффектом «прорывания» якобы атравматичной иглы.

Кроме того, в исследовании совершенно не было выявлено никаких различий в площади повреждений твердой мозговой оболочки, вызванных двумя различными типами игл одинакового калибра – 25 G. Основываясь на этих наблюдениях, авторы выдвинули гипотезу, что более низкая частота ПГБ, связанная с использованием конических игл, может быть результатом снижения потери ликвора из-за «отечной пробки» («edematous plug»), сформировавшейся после выраженной воспалительной реакции в области пункции.
Однако дизайн игл «карандашного» типа оказался не столь совершенным, как об этом сообщали рекламные проспекты, и несостоятельность тезиса о так называемой атравматичности этих игл была вскоре убедительно подтверждена реальной практической действительностью. Как известно, природа не любит пустоты, и снижение частоты ПГБ, достигнутое применением конических игл (Уайтакра, Шпротте), незамедлительно компенсировалось повышением степени риска и частоты возникновения других серьезных неприятностей, связанных со спинномозговой пункцией.
Во-первых, применение этих игл довольно часто бывает омрачено длительным ожиданием момента, когда же в павильоне иглы появится ликвор.
Надо заметить, что данное обстоятельство иногда очень существенно и непредсказуемо может сказаться на последующих действиях раздосадованного неудачей начинающего анестезиолога, что повышает риск технических осложнений пункции.
Во-вторых, было достоверно отмечено увеличение количества случаев возникновения парестезий у больных во время процедуры пункции такими иглами. Причина заключается в том, что анестезиолог вынужден несколько глубже вводить коническую иглу в субарахноидальное пространство из-за более проксимального расположения выходного отверстия иглы по отношению к ее кончику.
Эта особенность дизайна конических игл существенно повышает риск травмы не только спинномозговых корешков, но и даже вещества спинного мозга [30].
Наверное, самое удачное решение устранить эти проблемы за счет принципиальных изменений дизайна иглы в настоящее время воплощено в иглах типа Atraucan (B. Braun) (рис. 9.7).
Несомненными достоинствами данного типа игл являются атравматичный срез кончика иглы и узкое лезвие режущей кромки. В этом случае применение термина «атравматичность» по отношению к дизайну иглы действительно приемлемо и оправданно. Относительно ожидаемого снижения частоты ПГБ вследствие применения таких игл следует заметить, что первые сообщения по данному поводу являются более чем многообещающими [30].
Заканчивая наши размышления о значении дизайна пункционной иглы в профилактике возникновения ПГБ, считаем необходимым заметить, что очень часто исследования, выполненные различными авторами, но использующими один и тот же тип иглы, дают весьма противоречивые результаты. Следовательно, существуют и другие факторы, дающие объяснение этим противоречиям. Например, с помощью метода электронной сканирующей микроскопии удалось выявить, что даже среди игл одного типа, изготовленных одним и тем же производителем, имеются существенные различия по их качеству. На кончиках некоторых игл обнаруживаются трещины, разломы, налипшие металлические фрагменты, заусеницы, что, конечно же, также может сказываться на морфологии дефекта в твердой мозговой оболочке. Кроме того, иглы могут повреждаться при их контакте с костными структурами во время пункции, а техника выполнения пункции у разных исследователей не может быть абсолютно одинаковой.
Технические трудности во время спинномозговой пункции
Убедительные статистические данные показывают, что технические трудности при осуществлении люмбальной пункции и многократность попыток ее выполнения значительно увеличивают вероятность развития ПГБ [42]. Наиболее приемлемыми объяснениями такой причинно-следственной связи считаются потенциальная возможность образования сразу нескольких дефектов в твердой мозговой оболочке с последующей более значимой потерей ликвора, а также имеющаяся при «трудной» пункции высокая вероятность прохождения иглы транзитом через субарахноидальное пространство с повторным повреждением твердой мозговой оболочки кончиком иглы и его выходом в переднее эпидуральное пространство.
Контакт иглы с костными структурами во время «трудной» пункции может привести к деформации кончика иглы, что, в свою очередь, вызывает образование более грубых дефектов в твердой мозговой оболочке. Корреляция между частотой случаев столкновения кончика иглы с костными структурами во время пункции и частотой ПГБ была убедительно показана на примере хорошо организованных исследований [43–45].
По данным мультицентрового исследования «Безопасность спинномозговой анестезии при операциях кесарева сечения» (г. Петрозаводск) на июнь 2004 г., частота возникновения ПГБ после пункций, выполненных без технических трудностей, составляет всего 1,79 %. Выполнение пункции после второй попытки и более приводит к повышению частоты возникновения ПГБ до 14,29 %.
Качество пункционных игл
Низкое качество спинномозговых игл и наличие дефектов на их кончиках также может существенно повышать степень повреждения твердой мозговой оболочки во время ее пенетрации.
Например, заусеницы или налипшие на кончик в процессе изготовления иглы инородные металлические фрагменты могут воздействовать на твердую мозговую оболочку как маленькие лезвия, разрезающие дополнительное количество коллагеновых волокон во время пункции (рис. 9.8–9.14)3 [40].




Использование игл с тупыми или «сколотыми» в процессе изготовления кончиками приводит к возникновению эффекта «палатки» во время пенетрации твердой мозговой оболочки (рис. 9.14).
Анестезиологи обязаны уделять повышенное внимание к качеству расходных материалов, применяемых ими для обеспечения регионарной анестезии, с целью повысить безопасность этих методов и максимально снизить возможные осложнения. Попытка решить проблему оснащения за счет закупок дешевых игл фирм-производителей с низкой репутацией может обернуться значительными моральными и материальными потерями вследствие повышения частоты осложнений анестезии.
Следует иметь в виду, что информация о качестве принадлежностей для регионарной анестезии, предоставляемая фирмами-изготовителями, не всегда является полной, особенно в тех случаях, когда истинное качество этих принадлежностей не соответствует требованиям безопасности.
Качество принадлежностей для регионарной анестезии в настоящее время должно стать одним из самых значительных факторов, рассматриваемых во время анализа и оценки осложнений анестезии. Наиболее благоприятную возможность для оценки качества принадлежностей для регионарной анестезии, таких как иглы, катетеры, фильтры и т. д., предоставляет метод сканирующей электронной микроскопии [45].
Так, результаты исследований качества спинномозговых игл, проведенных с помощью метода сканирующей электронной микроскопии, позволили выявить значительные различия в качестве принадлежностей для регионарной анестезии, изготовляемых разными компаниями, но под одним названием [46].
О том, что спинномозговые иглы одного типа, изготовленные различными производителями, могут сильно отличаться друг от друга по качеству, было хорошо известно и до появления метода сканирующей электронной микроскопии. Однако, благодаря этим исследованиям, выяснилось, что и среди игл от одних и тех же производителей, не обременяющих себя заботой о развитии технологий производства и безопасности больных, могут быть весьма существенные различия по качеству (рис. 9.15–9.17) [40].


Доступ
Считается, что выполнение пункции из парамедианного (околосрединного) доступа способствует снижению частоты возникновения ПГБ. Проверка правильности этого утверждения является одной из текущих задач нашего продолжающегося мультицентрового исследования. Последователям такого подхода в профилактике ПГБ даем дополнительную рекомендацию: при выполнении пункции из парамедианного доступа желательно ориентировать срез иглы медиально, что будет способствовать формированию дефекта в твердой мозговой оболочке в виде закрывающейся крышки или люка.
Способ извлечения иглы
Интересно, что частота ПГБ значительно уменьшается, если перед извлечением иглы из субарахноидального пространства в ее просвет снова вставляется мандрен [47]. По-видимому, это можно объяснить негативным влиянием градиента давления между атмосферным воздухом и ликвором, который приводит к увеличению дефекта в твердой мозговой оболочке в момент извлечения иглы.
Практическое значение этого фактора нам пришлось познать на собственном опыте. В начале освоения метода спинномозговой анестезии мы извлекали иглу из субарахноидального пространства без мандрена, но вместе со шприцем. Частота ПГБ в нашем отделении тогда составляла 10 %, что соответствует литературным мировым данным по частоте ПГБ для игл калибром 22 G. Не исключено также, что такая высокая частота головных болей была обусловлена и тем, что мы в то время применяли для спинномозговой анестезии только лидокаин, для которого характерна более высокая частота развития ПГБ.
После того как мы стали извлекать иглу из субарахноидального пространства с предварительно введенным мандреном, частота ПГБ снизилась до 6,85 %. Контроль техники выполнения субдуральной пункции врачами отделения выявил еще один очень интересный и важный нюанс.
Оказывается, значительная часть врачей нашего отделения (3 из 5) во время выполнения пункции использовала совершенно лишний технический прием. После достижения кончиком иглы желтой связки мандрен извлекался из иглы и перфорация твердой мозговой оболочки («для надежности») производилась уже полой иглой. Устранение данного недостатка техники пункции и выполнение прокола твердой мозговой оболочки только иглой с мандреном привели к тому, что частота возникновения ПГБ в нашем отделении снизилась до 2,88 %. К настоящему времени она колеблется в пределах до 1 %. По всей видимости, основной причиной дальнейшего снижения частоты этого осложнения следует считать возросшее техническое мастерство дежурантов.
По данным мультицентрового исследования «Безопасность спинномозговой анестезии при операциях кесарева сечения» (г. Петрозаводск) на июнь 2004 г., частота возникновения ПГБ при извлечении иглы из субарахноидального пространства с предварительно введенным мандреном составляет всего 1,28 %. Пренебрежение этим правилом приводит к повышению частоты ПГБ до 6,34 %.
Положение пациентки во время пункции
Во время процедуры пункции больным стараются придать максимально согнутое положение, чтобы облегчить тем самым прохождение иглы до субарахноидального пространства.
Тем не менее есть довольно серьезные основания считать, что именно при таком максимально согнутом положении позвоночника происходит натяжение волокон твердой мозговой оболочки с последующим образованием в ней более значительного по последствиям постпункционного дефекта. Считается также, что именно в таком положении значительно увеличивается и риск расслоения волокон твердой мозговой оболочки. В последнее время появились многочисленные сообщения о более низкой частоте ПГБ при выполнении пункции в более свободном положении пациентки (на боку, спина согнута, но не напряжена).
Имеются также значительные расхождения по частоте возникновения ПГБ в зависимости от того, в каком положении, сидя или лежа на боку, находилась пациентка при выполнении пункции. По данным мультицентрового исследования «Безопасность спинномозговой анестезии при операциях кесарева сечения» (г. Петрозаводск) на июнь 2004 г., частота возникновения ПГБ при выполнении пункции пациенткам, находящимся в положении лежа на боку, составляет 2,1 %, при выполнении пункции в положении сидя – 4,55 %. Тем не менее все врачи нашего отделения по-прежнему предпочитают выполнять спинномозговую пункцию при положении пациентки сидя.
Состав раствора, вводимого субарахноидально
Долгое время было принято считать, что на частоту постпункционных головных болей совершенно не влияет качественный состав вводимых анестетиков. И все же в последние годы появилось достаточно много сообщений, достоверно выявляющих прямую зависимость между видом анестетика и частотой возникновения ПГБ (лидокин > бупивакаин > тетракаин > прокаин) [48]. Это замечание также относится и к добавлению растворов глюкозы к растворам местных анестетиков.
Большинство исследователей отмечают значительное уменьшение частоты ПГБ при добавлении к растворам местных анестетиков адреналина и наркотических анальгетиков.
Пузырек воздуха, используемого для идентификации эпидурального пространства
К причинам, вызывающим постпункционную головную боль, относят также и попадание воздуха в субарахноидальное пространство из-за нарушения техники идентификации эпидурального пространства. При использовании воздуха во время выполнения теста «потери сопротивления» ПГБ встречается в 6,4 раза чаще, чем при использовании солевых растворов [49]. Компьютерная томография у этих больных позволяет обнаружить пузырьки воздуха в таких глубоких структурах, как желудочки Сильвиева водопровода и в цистернах. Такую ПГБ от головной боли, возникающей вследствие истечения ликвора, отличают быстрое возникновение, отсутствие четкой связи с изменением положения тела и короткая продолжительность. Если принять во внимание, что при выполнении пункции эпидурального пространства невозможно полностью исключить вероятность непреднамеренного прокола иглой твердой мозговой оболочки, то размер пузырька воздуха при выполнении теста на «потерю сопротивления» не должен превышать 0,2 см3.
К этим основным факторам, определяющим риск возникновения ПГБ при осуществлении нейроаксиальных методов анестезии, мы бы хотели добавить и такие факторы, как уровень практической и теоретической подготовки анестезиолога и степень усталости анестезиолога-дежуранта к моменту выполнения им спинномозговой пункции.
Литература
- Wulf H. F. The centennial of spinal anesthesia. Anesthesiology. 1998; 89: 500–506.
- Kreis O. Uber Medullarnarkose bei Gebarenden. Zentralbl Gyna..kol. 1900; 28: 724–729.
- Stone W. R. Cocainization of the spinal cord by means of lumbar puncture during labor . Am. J. Obstet. Gynecol. 1901; 63: 145– 155.
- Gogarten W., Van Aken H. A century of regional analgesia in obstetrics . Anesth. Analg. 2000; 91.
- Vandam L. D., Dripps R. D. Longterm followup of patients who received 10 098 spinal anesthetics. JAMA. 1956; 161: 586–591.
- Thomas S. R., Jamieson D. R., Muir K. W. Randomised controlled trial of atraumatic versus standard needles for diagnostic lumbar puncture . Br. Med. J. 2000; 321: 986–990.
- Gleeson C., Reynolds F. Accidental dural puncture rates in UK obstetric practice . Int. J. Obstet. Anesth. 1998; 7: 242–246.
- Stride P. C., Cooper G. M. Dural taps revisited. A 20year survey from Birmingham Maternity Hospital. Anaesthesia. 1993; 48: 247–255.
- Grove L. H. Backache, headache and bladder dysfunction after delivery . Br. J. Anaesth. 1973; 45: 1147–1149.
- Rando T. A., Fishman R. A. Spontaneous intracranial hypotension: Report of two cases and review of the literature. Neurology. 1992; 42: 481–487.
- Baker C. C. Headache due to spontaneous low spinal fluid pressure . Minn. Med. 1983; 66: 325–328.
- Pannullo S. C., Reich J. B., Krol G., Deck M. D. F., Posner J. B. MRI changes in intracranial hypotension. Neurology. 1993; 43: 919– 926.
- Miller J. D. Volume and pressure in the cerebrospinal axis. Clin. Neurosurg. 1975; 22: 76–105.
- Kunkle E. C., Ray B. S., Wolf H. G. Experimental studies on headache: analysis of the headache associated with changes in intracranial pressure. Arch. Neurol. Psychiatry. 1943; 49: 323– 358.
- Raskin N. H. Lumbar puncture headache: a review. Headache. 1990; 31 (4): 197–200.
- Clark J. W., Solomon G. D., De Senanayake P. Substance P concentration and history of headache in relation to postlumbar puncture headache: Towards prevention. J. Neurol. Neurosurg. Psychiatry. 1996; 60: 681–683.
- Hopkinson J. M., Samaan A. K., Russell I. F., Birks R. J., Patrick M. R. A comparative multicentre trial of spinal needles for caesarean section. Anaesthesia. 1997; 52: 1005–1111.
- Holloway T. E., Telford R. J. Observations on deliberate dural puncture with a Tuohy needle: depth measurements. Anaesthesia. 1991; 46: 722–724.
- Iqbal J., Davis L. E., Orrison W. W. Jr. An MRI study of lumbar puncture headaches. Headache. 1995; 35: 420–422.
- Tourtellotte W. W., Henderson W. G., Tucker R. P., Gilland O., Walker J. E., Kokman E. A randomized, doubleblind clinical trial comparing the 22 versus 26 gauge needle in the production of the postlumbar puncture syndrome in normal individuals. Headache. 1972; 12: 73–78.
- Geurts J. W., Haanschoten M. C., Van Wijk R. M., Kraak H., Besse T. C. Postdural puncture headache in young patients. A comparative study between the use of 0.52 mm (25gauge) and 0.33 mm (29gauge) spinal needles. Acta Anaesth. Scand. 1990; 34: 350–353.
- Flaatten H., Rodt S. A., Vamnes J., Rosland J., Wisborg T., Koller M. E. Postdural puncture headache. A comparison between 26and 29gauge needles in young patients. Anaesthesia, 1989; 44: 147–149.
- Corbey M. P., Bach A. B., Lech K., Frorup A. M. Grading of severity of postdural puncture headache after 27gauge Quincke and Whitacre needles . Acta Anaesth. Scand. 1997; 41: 779–784.
- Frumin M. J. Spinal anaesthesia using a 32gauge needle. Anesthesiology. 1969; 30.
- Kang S. B., Goodnough D. E., Lee Y. K. et al. Comparison of 26and 27G needles for spinal anesthesia for ambulatory surgery patients. Anesthesiology. 1992; 76: 734–738.
- Campbell D. C., Douglas M. J., Pavy T. J., Merrick P., Flanagan M. L., McMorland G. H. Comparison of the 25gauge Whitacre with the 24gauge Sprotte spinal needle for elective Caesarean section: cost implications. Can. J. Anaesth. 1993; 40: 1131–1135.
- Carrie L. E. Whitacre and pencilpoint needles: some points to consider. Anaesthesia. 1990; 45: 1097–1098.
- Sears D. H., Leeman M. I., Jassy L. J., O’Donnell L. A., Allen S. G., Reisner L. S. The frequency of postdural puncture headache in obstetric patients: a prospective study comparing the 24gauge versus the 22gauge Sprotte needle. J. Clin. Anesth. 1994; 6: 42–46.
- Quaynor H., Tronstad A., Heldaas O. Frequency and severity of headache after lumbar myelography using a 25gauge pencilpoint (Whitacre) spinal needle. Neuroradiology. 1995; 37: 553– 556.
- Sharma S. K., Gambling D. R., Joshi G. P., Sidawi J. E., Herrera E. R. Comparison of 26gauge Atraucan and 25gauge Whitacre needles: insertion characteristics and complications. Can. J. Anaesth. 1995; 42: 706–710.
- Vallejo M. C., Mandell G. L., Sabo D. P., Ramanathan S. Postdural puncture headache: a randomized comparison of five spinal needles in obstetric patients. Anesth. Analg. 2000; 91: 916–920.
- Costigan S. N., Sprigge J. S. Dural puncture: the patients’ perspective. A patient survey of cases at a DGH maternity unit 1983–1993. Acta Anaesth. Scand. 1996; 40: 710–714.
- Greene H. M. Lumbar puncture and the prevention of post puncture headache. JAMA 1926; 86: 391–392.
- Labat G. The trend of subarachnoid block. Surg. Clin. North. Am. 1930; 10: 671–675.
- Franksson C., Gordh T. Headache after spinal anesthesia and a technique for lessening its frequency. Acta Chir. Scand. 1946; 94: 443–454.
- Reina M. A., De Leon Casasola O. A, Lo´pez A., Andres J., Martin S., Mora M. An in vitro study of dural lesions produced by 25 Gauge Quincke and Whitacre needles evaluated by scanning electron microscopy. Reg. Anesth. Pain. Med. 2000; 25: 393–402.
- Reina M. A., Dittmann M., Lopez Garcia A., Van Zundert A. New perspectives in the microscopic structure of human dura mater in the dorsolumbar region. Reg. Anesth. 1997; 22: 161– 166.
- Fink B. R., Walker S. Orientation of fibers in human dorsal lumbar dura mater in relation to lumbar puncture. Anesth. Analg. 1989; 69: 768–772.
- Hart J. R., Whitacre R. J. Рencilpoint needle in prevention of postspinal headache. JAMA. 1951; 147: 657–658.
- Lo´pez A., Reina M. A., Mache´s F., Casasola O. L., Andre´s J. A., Trapero J. G. Electron microscopy in quality control of equipment used in regional anesthesia. Techniques in Regional Anesthesia & Pain Management. 2002; 6: 4
- Schultz A. M., Ulbing S., Kaider A., Lehofer F. Postdural puncture headache and back pain after spinal anesthesia with 27gauge Quincke and 26gauge Atraucan needles. Reg. Anesth. 1996; 21; 461–464.
- Seeberger M., Kaufmann M., Staender S., Schneider M., Scheidegger D. Repeated dural punctures increase the incidence of postdural puncture headache. Anesth. Analg. 1996; 82: 302– 305.
- Jokinen M. J., Pitkanen M. T., Lehtonen E., Rosenberg P. H. Deformed spinal needle tips and associated dural perforations examined by scanning electron microscopy. Acta Anaesth. Scand. 1996; 40: 687–690.
- Puolakka R., Andersson L. C., Rosemberg P. H. Microscopic analysis of three different spinal needle tips after experimental subarachnoid puncture. Reg. Anesth. Pain Med. 2000; 25: 163– 169.
- Parker R. K., White P. F. A microscopic analysis of cutbevel versus pencilpoint spinal needles. Anesth. Analg. 1997; 85: 1101– 1104.
- De Andre´s J. A., Bolinches R., Nalda M. A. Importance of the needle in regional anesthesia. Rev. Esp. Anest. Reanim. 1990; 37: 71–74.
- Vilming S. T., Kloster R. Lumbar puncture and headache. Replacing the stylet before withdrawing the needle may help to prevent headache. Br. Med. J. 1998; 17: 1018–1019.
- Naulty J. S., Hertwig L., Datta S. Influence of local anesthetic solution on postdural puncture hedache. Anesthesiology. 1985; 63: 454.
- Aida S., Taga K., Yamakura T., Endoh H., Shimoji K. Headache after attempted epidural block: the role of intrathecal air. Anesthesiology. 1998; 88: 76–81.