Гематологические изменения у ВИЧ-инфицированных беременных на фоне химиопрофилактики антиретровирусными препаратами.
Е.М. Шифман1, Е.В. Ройтман3, Л.В. Кругова2, В.Я.Вартанов2, Н.Н.Хуторская2
1ФГБУ «Научный центр акушерства и гинекологии и перинатологии им. В. И. Кулакова» Минздравсоцразвития России, Москва;
2Межрайонный перинатальный центр, МУЗ «Клиническая больница
№ 5», Тольятти
3ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д.Рогачева» Минздравсоцразвития, Москва
Статья опубликована в журнале "Акушерство и гинекология".- 2012.- 4/2. – С.39-46.
Введение: Применение антиретровирусной терапии и химиопрофилактики, во время беременности и в родах, а также элективное кесарево сечение снизили риск перинатальной передачи ВИЧ-инфекции до 1-2 % [1]. Однако, на сегодняшний день не существует ни одного антиретровирусного препарата, который был бы полностью лишен побочных эффектов [2]. С учетом высоких доз принимаемых препаратов и длительностью терапии, более или менее выраженные побочные эффекты антиретровирусной терапии (АРВТ) и химиопрофилакти наблюдаются практически у всех, получающих ее пациенток (по крайней мере, в течение первых недель) [3].
Угнетение кроветворения при проведении химиопрофилактики антиретровирусными препаратами у беременных имеет огромное значение, так как понимание генеза данного осложнения помогает провести правильную коррекцию возникших нарушений в периоперационном периоде при абдоминальном родоразрешении. Некоторые антиретровирусные препараты, особенно нуклеозидные ингибиторы обратной транскриптазы, угнетают кроветворение, эритропоэз и вызывают анемию. Для анемии, возникающей вследствие применения нуклеозидных ингибиторов обратной транскриптазы, в частности зидовудина, характерно развитие макроцитоза (средний объем эритроцитов > 100 fl), что может быть использовано как объективный критерий угнетения кроветворения на фоне АРВТ [4]. Необходимо отметить, что поскольку макроцитарная анемия, вызываемая препаратом, не связана с дефицитом витамина В12 или фолиевой кислоты, то она не поддается лечению данными витаминами. Препаратами выбора для коррекции анемии на фоне АРВТ служит рекомбинантный эритропоэтин и препраты железа. В отличие от анемии ВИЧ-инфицированных беременных, снижение уровня гемоглобина и эритроцитов при физиологически протекающей беременности объясняется гиперволемической гемодилюцией (возрастанием ОЦК на 30-33% к концу беременности), а также увеличенной потребносью в железе. При дефиците железа характерен микроцитоз, анизоцитоз и пойкилоцитоз, что необходимо учитывать при дифференциальной диагностики анемий во время беременности.
Изменения гемостаза у ВИЧ-инфицированных беременных на фоне АРВТ и химиопрофилактики, согласно литературным данным, весьма противоречивы и напрямую связаны с нарушением функции печени, которые чаще возникают при приеме ненуклеозидных ингибиторов обратной транскриптазы [5]. Согласно исследованиям de Andrade C.M. et al. [6] у беременных женщин, получавших антиретровирусные препараты, при родоразрешении отмечались эпизоды кровотечений за счет активации фибринолиза, что объясняется токсическим действием препаратов на функцию печени. Токсическое поражение печени обычно развивается в течение первых недель от начала химиопрофилактики [7,8]. С другой стороны, по данным Fabricius E. е.а. [9], эндотелиальное повреждениие, вызванное циркулирующими иммунными комплексами при ВИЧ-инфекции, приводит к развитию патологического фибринолиза, особенно при обширных оперативных вмешательствах. Как указывалось выше, у ВИЧ-инфицированных беременных пациенток при приеме ненуклеозидных ингибиторов обратной транскриптазы снижается выработка факторов свертывания крови. В то же время, при оперативном родоразрешении большое количество активатора плазминогена поступает в кровоток, однако его инактивация в печени может быть снижена. Не исключается возможность и уменьшения выработки антиплазмина патологически измененной печенью [10]. Если активность печеночных ферментов превышает верхнюю границу нормы более чем в 3,5 раза, проводят дополнительное обследование беременных, включая УЗИ брюшной полости, а также решают вопрос о смене препаратов [11].
Вторичная тромбоцитопения, возникающая на фоне приема антиретровирусных прпепаратов, обусловлена сниженной выработкой тромбоцитов и ускоренной их деструкцией. Нуклеозидные ингибиторы обратной транскриптазы способны подавляюще действовать на мегакариоцитарный росток красного костного мозга и снижать выработку тромбоцитов [12, 13].
Вышеприведенные осложнения значительно увеличивают риск анестезиологического пособия и оперативного родоразрешения, а, следовательно, диктуют необходимость адекватной коррекции.
Цель исследования: на основании показателей гемограммы, гемостазиограммы, тромбоэластограммы выявить характер анемии, тромбоцитопении, гемокоагуляционных нарушений у ВИЧ-инфицированных беременных, получающих препараты для химиопрофилактики, а также определить пути их коррекции.
Материал и методы исследования.
На базе Межрайонного Перинатального Центра МУЗ Клиническая больница № 5 г.о. Тольятти в период с декабря 2009 г. по ноябрь 2011 г выполнялось проспективное контролируемое, клиническое исследование с участием 162 ВИЧ-инфицированных беременных с III стадией заболевания по классификации В.И. Покровского. Статистическая обработка и анализ полученных данных проводилсь на базе ФБГУ «Научный центр акушерства и гинекологии и перинатологии им. В. И. Кулакова» Минздравсоцразвития Российской Федерации. Исследуемые больные основной группы получали АРВТ, начинающуюся после 14 недель беременности и представленную следующими препаратами: калетра (лопинавир + ритонавир) 0,4 г. х 2 раза в день, комбивир (ламивудин + зидовудин) 0,45 г. 2 раза в день, никавир (фосфазид) 0,6 г.х 2 раза вдень.
Контрольная группа (КГ) включала 139 пациенток с физиологическим течением беременности. В исследование основной группы были включены ВИЧ-инфицированные беременные с III-ей стадией заболевания, со сроком гестации 37-38 недель, которым выполнялось плановое элективное кесарево сечение. Пациентки основной и контрольной групп были сопоставимы по возрасту, сроку гестации, антропометрическим данным (см. таблицу № 1).
Таблица 1
Некоторые характеристики больных, включенных в исследование
| Показатель | Основная группа (n=162) |
Контрольная группа (n=139) |
| Возраст, годы | 28,9±6,9 | 29,2±5,7* |
| Рост, см | 163,9±7,28 | 162,6±6,4* |
| Вес, кг | 75,3±5,4 | 78,4±6,3* |
| Срок гестации | 37,8±0,82 | 38,2±0,74* |
| ASA (II-III) | 85/77 | 92/47 |
Примечание: * Р> 0,05
При дальнейшем проведении исследования пациентки основной группы были рандомизированны на 2 подгруппы: I подгруппа – ВИЧ-инфицированные беременные, получающие специфическую предоперационную терапию, направленную на коррекцию анемии, тромбоцитопении, нормализацию функции печени и профилактику возможных гипокоагуляционных кровотечений; II подгруппа – ВИЧ-инфицированные беременные, которым не проводилась специфическая предоперационная подготовка. КГ была представлена пациентками с физиологическим течением беременности, сроком гестации 37-38 недель, которым также выполнялось плановое традиционное кесарево сечение. Критерии исключения из исследования для ВИЧ-инфицированных беременных были следующие: наличие I, II, IV стадии ВИЧ-инфекции, отказ от приема антиретровирусных препаратов во время беременности, наличие тяжелых соматических заболеваний у ВИЧ-инфицированных беременных, влияющих на изучаемые показатели. Критерием исключения из исследования для беременных с физиологическим течением беременности служило наличие тяжелых соматических заболеваний, влияющих на изучаемые показатели.
У всех больных основной группы (первой подгруппы) после измерения стартовых параметров и регистрации стартовых анализов в течение семи дней проводили предоперационную подготовку направленную на коррекцию анемии, тромбоцитопении, нормализацию функции печени и профилактику возможных гипокоагуляционных кровотечений. Терапия была представлена активатором синтеза протромбина – викасолом в дозировке 0,4 мг/кг, преднизолоном в дозе 3,4 мг/кг, адеметионином в дозировке 5,3 мг/кг, рекомбинантным эритропоэтином в дозировке 200 МЕ/кг/нед и железом (III) гидроксид декстраном в дозировке 1,8 мг/кг. За 30-40 минут до начала оперативного вмешательства начинали введение транексамовой кислоты в дозировке 10 мг/кг путем внутривенной инфузии в изотоническом растворе хлорида натрия (см. таблицу №2).
Таблица 2
Дозы препаратов для предоперационной подготовки ВИЧ-инфицированных пациенток.
| Препарат | Дозировка |
| Железа (III)-гидроксид декстран | 1,8 мг/кг |
| рекомбинантный эритропоэтин | 200 МЕ/кг/нед |
| викасол | 0,4 мг/кг |
| транексамовая кислота | 10мг/кг* |
| преднизолон | 3,4 мг/кг** |
| адеметионин | 5,3мг/кг |
Примечание: * - транексамовая кислота назначалсась за 30-40 минут до оперативного вмешательства; **преднизолон назначался в режиме пульс-терапии в течение 3дней;
Предоперационная подготовка в контрольной группе и второй подгруппе основной группы не проводилась. Премедикация накануне оперативного вмешательства в обеих группах была представлена рутинным назначением реланиума (10 мг в/м) и ингибитора протонной помпы омеза (20 мг перорально).
Оперативное вмешательство в обеих группах проводилось в условиях спинальной анестезии маркаином 0,5% - 12,9±0,68 мг с выполнением Гарвардского стандарта мониторинга.
Определение гематологических показателей проводилось на автоматическом гематологическом анализаторе «Sysmex КХ-21». Для проведения фотометрических биохимических исследований нами использовался полуавтоматический анализатор «Stat Fax 1904 Plus», который измеряет оптическую плотность и рассчитывает концентрацию или активность ферментов по фактору, либо по стандарту. Определение основных показателей гемостаза (МНО, АЧТВ, время свертывания, активность антитромбина III) осуществлялось на программируемом оптико-механическом коагулометре «Минилаб-701». Концентрацию фибриногена определяли высокоточным хронометрическим методом Клаусса, с автоматическим построением калибровочного графика. Для экспресс-оценки гематологических (гемоглобин, гематокрит), биохимических показателей крови и электролитов (глюкоза, креатинин, мочевина, K+, Na+, Cl+), а также с целью определения кислотно-щелочного состояния и газов крови непосредственно в операционной нами использовался портативный биохимический анализатор IRMA TRU POINT. Также проводились рутинные биохимические обследования: общий белок, щелочная фосфотаза (ЩФ), аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ), билирубин крови.
Статистический анализ полученных данных включал описательную статистику по каждому исследуемому показателю, а также проверку гипотезы о статистической значимости различия средних значений 2 групп с помощью критерия Стьюдента при уровне значимости, равном 0,05. Для сравнения частот осложнений были рассчитаны частотные характеристики выборок в обеих группах, относительный риск (ОР) и 95% доверительный интервал ОР. Вся процедура обработки данных выполнена с использованием программного пакета статистических программ SPSS 6.O. Различия между выборками считались достоверными при Р < 0,05.
Результаты исследования и их обсуждение.
Как указывалось выше, одной из причин для развития анемии у ВИЧ-инфцированных беременных являются специфические эффекты на гемопоэз антиретроворусных препаратов, а вследствие этого сниженная и неэффективная продукция, повышенное разрушение эритроцитов. Обычно эти побочные эффекты наиболее выражены во время беременности [14]. В таблице № 3 представлена динамика некоторых показателей гематологических показателей.
Таблица 3
Динамика некоторых гематологических показателей у обследованных нами пациенток
| Изучаемые показатели |
Группы | Этапы исследования | ||||
| I | II | III | IV | V | ||
| Число эритроцитов х1012/л |
КГ | 3,97±0,64 |
3,84±0,49 Р>0,05 |
3,79±0,62 Р>0,05 |
3,78±0,68 Р>0,05 |
3,76±0,82 Р>0,05 |
| ОГ I | 2,75±0,46 Р1< 0,01 |
3,69±0,41 Р1< 0,05 |
3,45±0,54 Р1< 0,01 |
3,41±0,48 Р1<0,01 |
3,38±0,35 Р1 < 0,01 |
|
| ОГ II | 2,81±0,4* Р2<0, 01 |
2,84±0,47*** Р2<0,01 |
2,73±0,41*** Р2<0,01 |
2,71±0,35*** Р2<0,01 |
2,65±0,49*** Р2<0,01 |
|
| Гемоглобин, г/л | КГ | 123,8±8,96 |
121,3±10,5 Р>0,05 |
120,9±11,5 Р>0,05 |
120,3±15,3 Р>0,05 |
119,5±12,3 Р<0,05 |
| ОГ I | 93,8±7,74 Р1<0,01 |
118,3±11,2 Р1>0,05 |
115,8±6,89 Р1< 0,01 |
114,9±7,23 Р1< 0,01 |
115,3±6,74 Р1< 0,01 |
|
| ОГ II | 94,5±5,43* Р2<0,01 |
93,9±6,23*** Р2<0,01 |
92,4±4,89*** Р2<0,01 |
92,9±5,68*** Р2<0,01 |
91,8±4,96*** Р2<0,01 |
|
| Гематокрит,% | КГ |
0,38±0,08 | 0,37±0,09 Р>0,05 |
0,37±0,05 Р>0,05 |
0,36±0,07 Р>0,05 |
0,38±0,07 Р>0,05 |
| ОГ I | 0,26±0,07 Р1<0,01 |
0,35±0,08 Р1>0,05 |
0,35±0,07 Р1< 0,05 |
0,34±0,05 Р1< 0,05 |
0,34±0,06 Р1< 0,01 |
|
| ОГ II | 0,27±0,09* Р2<0,01 |
0,27±0,06*** Р2<0,01 |
0,26±0,04*** Р2<0,01 |
0,25±0,08*** Р2<0,01 |
0,27±0,07*** Р2<0,01 |
|
| MCV, fl |
КГ |
85,4±4,8 |
86,4±7,5 Р>0,05 |
85,8±8,13 Р>0,05 |
84,8±7,89 Р>0,05 |
85,3±9,72 Р>0,05 |
| ОГ I | 109,7±6,29 Р1<0, 01 |
88,2±9,3 Р1>0,05 |
87,3±10,1 Р1> 0,05 |
86,9±8,86 Р1> 0,05 |
86,5±6,74 Р1>0,05 |
|
| ОГ II | 110,3±5,34* Р2<0,01 |
109,4±4,12*** Р2< 0,01 |
110,1±3,98*** Р2< 0,01 |
109,7±4,71*** Р2< 0,01 |
109,1±5,67*** Р2<0,01 |
|
| MCH, fl |
КГ | 29,4±2,42 | 29,1±2,36 Р>0,05 |
28,7±3,94 Р>0,05 |
29,3±3,71 Р>0,05 |
28,9±2,84 Р>0,05 00 |
| ОГ I | 28,6±3,15 Р1>0,05 |
29,7±2,78 Р1>0,05 | 28,3±2,12 Р1>0,05 | 28,8±2,93 Р1>0,05 | 29,5±2,94 Р1>0,05 | |
| ОГ II | 28,9±1,68* |
29,3±2,41* Р2>0,05 |
28,4±1,75* Р2>0,05 |
29,1±2,15* Р2>0,05 |
29,4±3,87* Р2>0,05 |
|
| MCHC, г/л |
КГ | 345,6±18,7 | 346,2±17,3 Р>0,05 |
346,8±16,8 Р>0,05 |
346,4±17,1 Р>0,05 |
346,7±20,9 Р>0,05 |
| ОГ I | 320,4±17,5 Р1<0,05 | 346,9±66,8 Р1>0,05 | 346,5±17,1 Р1>0,05 | 346,1±15,6 Р1>0,05 | 347,1±18,9 Р1>0,05 | |
| ОГ II | 319,9±19,4* Р2<0,01 |
320,1±16,5*** Р2<0,01 |
317,9±24,7*** Р2<0,01 |
318,2±25,2*** Р2<0,01 |
319,5±21,9*** Р2<0,01 |
|
Примечание: Р – достоверность различий в контрольной группе на этапах исследования, Р1 – достоверность различий между КГ и I группой; Р2– достоверность различий между КГ и II группой; Р3 -*, достоверность различий между I и II группами. Р3 > 0,05 - * ; Р3 < 0,05 - **; Р3 < 0,01-***. n в КГ=139, в основной группе = 162
Как видно из таблицы №3, к 7 суткам лечения количество эритроцитов в I подгруппе увеличилось (2,75±0,46х1012/л на I этапе исследования против 3,69±0,41х1012/л на II этапе исследования), оставаясь незначительно ниже, чем у женщин с физиологическим течением беременности (P1<0,05). На последующих этапах количество эритроцитов в ОГ I было также достоверно ниже (P1<0,01). Однако, по сравнению с ОГ II, количество эритроцитов у пациенток ОГ I, начиная со II этапа исследования было достоверно выше (3,69±0,41х1012/л против 2,84±0,47х1012/л, Р3 < 0,01), что свидетельствует о правильной тактике предоперационной подготовки.
Показательной была и динамика гемоглобина, уровень которого при поступлении был на 24,1% ниже, чем в контрольной группе. У пациенток ОГ I величина гемоглобина, также как и количество эритроцитов в процессе лечения имела тенденцию к увеличению, составляя на 5 сутки лечения 118,3±11,2 г/л против 93,8±7,74 г/л на начальном этапе (P1>0,05). Хотя это и свидетельствует о правильной ориентации лечебных мероприятий, однако, сохраняющиеся статистически достоверные различия по количеству эритроцитов и уровню гемоглобина между ОГ I и группой контроля на последующих этапах исследования, следует трактовать как результат специфического влияния антиретровирусных препаратов на гемопоэз.
Увеличенный при поступлении средний объем эритроцитов (MCV в основной группе был на 28,8% выше чем в контрольной группе) расценивался нами как патогномоничный признак анемии при приеме антиретровирусных препаратов. Проведенная комплексная терапия в ОГ I способствовала значительному снижению данного параметра (P1>0,05 начиная со II этапа исследования), что нельзя сказать о показателях среднего объема эритроцитов в ОГ II (P2<0,01 на всех этапах исследования, Р3<0,01 начиная со II этапа исследования).
Оценивая динамику среднего содержания гемоглобина в эритроците (MCH) отметим, что при поступлении ВИЧ-инфицированных пациенток в стационар, различие с КГ по данному показателю было статистически недостоверным(28,6±3,15фл в ОГI против 29,4±2,42фл в КГ и 28,9±1,68 фл в ОГ II против 29,4±2,42фл в КГ), что прослеживалось и на последующих этапах (Р1>0,05, Р2>0,05, Р3>0,05). Тем не менее, показатель средней концентрации гемоглобина в эритроците (MCHС) на исходном этапе в основной группе был на 7,4% ниже, чем в контрольной группе (320,1±18,5 г/л против 345,6±18,7 г/л). В дальнейшем статистическое различие данного показателя не было достоверным в ОГ I (P>0,05). Данный факт – закономерное влияние проводимой специфической терапии, направленной на нормализацию показателей эритропоэза.
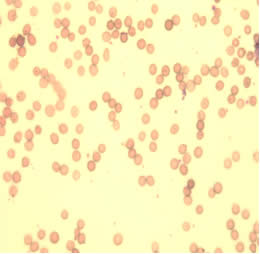
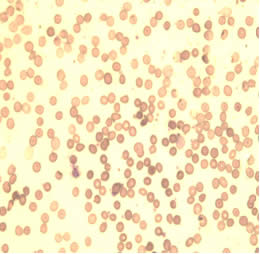
Помимо лабораторных данных, нарушения гемопоэза, обусловленные приемом антиретровирусных препаратов, иллюстрирует и морфологическая картина эритроцитов, которые представлены на слайдах 1,2.
| Слайд 1 | ||
 |
 |
|
Рис 1. |
Рис 2. |
|
На слайде 1 отражена микроскопическая картина эритроцитов пациентки С., которая принимала комбинацию из трех антиретровирусных препаратов с 14 недель беременности. Как мы видим, на рисунке 1 и 2 практически отсутствуют клетки правильной двояковогнутой формы, характерен выраженный пойкилоцитоз, анизоцитоз, гипохромия красных кровяных телец. Среди представленных эритроцитов преобладают сфероциты, что указывает об аномалии мембраны эритроцитов, нарушении их деформируемости и готовности клеток к гемолизу. Также на рисунке 1 и 2 имеется небольшое количество кодоцитов и шистоцитов, что косвенно указывает на нарушение функции печени. Повышена и агрегационная способность эритроцитов (наиболее наглядно отражено на рисунке 2). Данное состояние приводит к нарушению транскаппилярного обмена, выбросу биологически активных веществ, нарушению функционирования тромбоцитов.
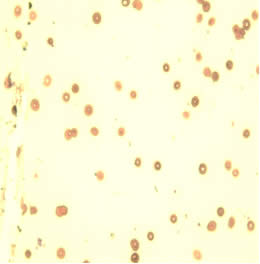
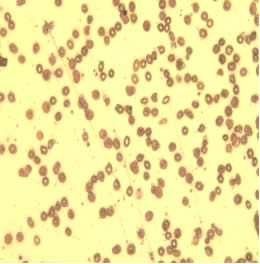
На слайде 2 представлены эритроциты пациентки С. после проведения комплексной предоперационной подготовки. На данном слайде эритроциты уменьшены в объеме, появились клетки правильной двояковогнутой формы, менее выражены анизоцитоз, пойкилоцитоз, гипохромия эритроцитов. Патологические формы эритроцитов, такие как кодоциты, сфероциты, шистоциты практически отсутствуют, что говорит о более эффективном функционировании эритроцитов.
| Слайд 2 | ||
 |
 |
|
Рис 1. |
Рис 2. |
|
Существенным фактором риска развития расстройств гемокоагуляции у ВИЧ-инфицированных женщин на фоне приема АРВТ является тромбоцитопения, обусловленная снижением выработки тромбоцитов, и ускоренной их деструкцией. Так, нуклеозидные ингибиторы обратной транскриптазы способны подавляюще действовать на мегакриоцитарный росток красного костного мозга и снижать выработку тромбоцитов [15]. Помимо тромбоцитопении, развитие коагулопатии также связано и с нарушением синтетической функции печени и пониженным образованием факторов свертывания крови, в основном на фоне приема ненуклеозидных ингибиторов обратной транскриптазы и ингибиторов протеаз [16,17].
При анализе лабораторных показателей свертывающей системы крови было выявлено статистически достоверное снижение количества тромбоцитов в основной группе, обеих подгруппах на I и II этапах исследования. Однако, предоперационная подготовка пациенток I подгруппы привела к достоверному увеличению количества тромбоцитов у данной категории пациенток по сравнению со II подгруппой. Также предоперационная подготовка пациенток I подгруппы привела к достоверному снижению уровня АЧТВ, МНО, ПВ, D- димера, а также увеличению времени спонтанного эуглобулинового лизиса и уровня фибриногена. Различия по анализируемым показателям между I и II подгруппами были также статистически достоверными, начиная со II этапа исследования, что также указывает на адекватность выбранной лечебной концепции.
Таблица 4
Показатели свертывающей системы крови у обследованных больных на этапах исследования
| Показатель | Группа | Исходные значения |
Перед операцией | На этапе гемостаза | В конце операции | Через 4 часа после операции |
| Тромбоциты, х109/л |
КГ | 255,4 ± 28,3 |
259,1 ±21,4 Р>0,05 |
251,2 ±15,1 Р>0,05 |
253,8 ±1204 Р>0,05 |
252,3 ± 199,3 Р>0,05 |
| I | 155,7 ±7,2 Р1<0,001 |
192,3 ±8,3 Р1<0,01 |
185,4 ±6,9 Р1<0,01 |
181,4 ±10,7 Р1<0,01 |
182,3 ±8,4 Р1<0,01 |
|
| II | 158,9 ± 10,3* Р2<0,001 |
157,4 ±7,4** Р2<0,001 |
123,5 ±9,2*** Р2<0,001 |
122,8 ±6,4*** Р2<0,001 |
124,0 ±7,8*** Р2<0,001 |
|
| АЧТВ, с | КГ | 26,7±3,4 |
27,6±4,1 Р>0,05 |
27,4±3,1 Р>0,05 |
27,6±2,9 Р>0,05 |
26,5±2,6 Р>0,05 |
| I | 35,6±4,8 Р1<0,01 |
28,9±3,7 Р1>0,05 |
28,7±2,9 Р1>0,05 |
28,8±3,1 Р1>0,05 |
27,3±2,8 Р1>0,05 |
|
| II | 34,9±1,7* Р2<0,01 |
34,2±0,9*** Р2<0001 |
35,8±1,3*** Р2<0,01 |
36,3±1,1*** Р2<0,01 |
37,8±0,7*** Р2<0,01 |
|
| Фибриноген, г/л | КГ | 4,3±0,71 |
4,1±0,65 Р>0,05 |
4,2±0,68 Р<0,05 |
4,1±0,65 Р<0,05 |
4,4±0,49 Р>0,05 |
| I | 1,9±0,37 Р1<0,01 |
3,9±0,61 Р1>0,05 |
3,8±0,42 Р1>0,05 |
3,8±0,57 Р1>0,05 |
4,1±0,53 Р1>0,05 |
|
| II | 2,1±0,41* Р2<0,01 |
2,18±0,34*** Р2<0,01 |
2,05±0,25*** Р2<0,01 |
1,98±0,31*** Р2<0,01 |
2,02±0,38*** Р2<0,01 |
|
| МНО | КГ | 0,92±0,08 |
0,95±0,1 Р>0,05 |
0,94±0,06 Р>0,05 |
0,95±0,09 Р>0,05 |
0,91±0,08 Р>0,05 |
| I | 1,28±0,09 Р1<0,01 |
0,98±0,12 Р1>0,05 |
0,97±0,1 Р1>0,05 |
0,96±0,08 Р1>0,05 |
0,94±0,07 Р1>0,05 |
|
| II | 1,31±0,14* Р2<0,01 |
1,42±0,11*** Р2<0,01 |
1,38±0,09*** Р2<0,01 |
1,35±0,12*** Р2<0,01 |
1,28±0,08*** Р2<0,01 |
|
| Протромбиновое время, с | КГ |
12,2±0,9 |
12,5±1,2 Р>0,05 |
12,6±1,1 Р>0,05 |
12,3 ±1,1 Р>0,05 |
11,9±01,4 Р>0,05 |
| I | 14,8±1,2 Р1<0,01 |
12,9±1,5 Р1>0,05 |
12,8±1,3 Р1>0,05 |
12,5±1,9 Р1>0,05 |
12,4±1,6 Р1>0,05 |
|
| II | 14,5±0,9* Р2<0,01 |
15,1±1,1*** Р2<0,01 |
15,9±1,6*** Р2<0,01 |
15,3±1,7*** Р2<0,01 |
15,4±1,5*** Р2<0,01 |
|
| Спонтанный эуглобиновый лизис, мин | КГ |
194,4±17,2 |
193,7±15,4 Р>0,05 |
191,5±18,7 Р>0,05 |
189,3±17,6 Р>0,05 |
192,4±17,8 Р>0,05 |
| I | 175,6±16,1 Р1<0,01 |
189,1±21,3 Р1>0,05 |
188,5±17,3 Р1>0,05 |
187,2±18,3 Р1>0,05 |
189,7±19,5 Р1>0,05 |
|
| II | 174,9±18,7* Р2<0,01 |
173,2±19,4*** Р2<0,01 |
168,7±18,8*** Р2<0,01 |
167,4±17,5*** Р2<0,01 |
173,4±16,2*** Р2<0,01 |
|
| D-димер, мкг/мл | КГ |
0,54±0,12 |
0,56±0,08 Р>0,05 |
0,56±0,07 Р>0,05 |
0,55±0,05 Р>0,05 |
0,54±0,08 Р>0,05 |
| I | 1,2±0,1 Р1<0,01 |
0,58±0,06 Р1>0,05 |
0,59±0,06 Р1>0,05 |
0,57±0,05 Р1>0,05 |
0,56±0,09 Р1>0,05 |
|
| II | 1,2±0,08* Р2<0,01 |
0,9±0,07*** Р2<0,01 |
1,1±0,1*** Р2<0,01 |
1,3±0,14*** Р2<0,01 |
1,1±0,16*** Р2<0,01 |
Примечание: Р – достоверность различий в контрольной группе на этапах исследования, Р1 – достоверность различий между КГ и I группой; Р2– достоверность различий между КГ и II группой; Р3 -*, достоверность различий между I и II группами. Р3 > 0,05 - * ; Р3 < 0,05 - **; Р3 < 0,01-***. n в КГ=139, в основной группе = 162
Учитывая противоречивость литературных данных и неоднозначность лабораторных показателей свертывающей системы крови, нами была выполнена тромбоэластография (ТЭГ) в обеих группах, на всех этапах исследования. Методом ТЭГ отслеживается процесс образования сгустка и его дальнейший лизис при заданной температуре пациента. В ходе проведенного исследования было выявлена достоверно значимая склонность к гипокоагуляции у пациенток основной группы как за счет невысокого уровня тромбоцитов (показатель MA), так и за счет недостаточности ферментативной части системы гемостаза (показатели r, к, a). Однако, у пациенток ОГ I на II этапе исследования отмечалось достоверное снижение показателей r и к, a также достоверное увеличение показателя а и МА по сравнению с ОГ II. По отношению к КГ, показатели ОГ I имели достоверные отличия, за исключением показателя r. Достоверное увеличение показателя LY 30% в основной группе на начальном этапе исследования свидетельствовало о склонности ВИЧ-инфицированных беременных к патологическому фибринолизу. Предоперационная подготовка пациенток I подгруппы привела к достоверному снижению данного показателя.
Коагуляционный индекс (CI – показывает состояние системы гемостаза в общей совокупности) был достоверно ниже в основной группе, даже у пациенток, получающих предоперационную подготовку, тем не менее в основной группе I эти изменении были достоверно менее значимыми по сравнению с основной группой II (таблица 5).
Таблица 5
Показатели тромбоэластографии в контрольной и исследуемой группах на этапах исследования
| Показатель | Группа | Исходные значения |
Перед операцией | На этапе гемостаза | В конце операции | Через 4 часа после опрации |
| r | Контр. | 18,4±2,9 |
17,8±1,8 р >0,05 |
17,5±2,6 р >0,05 |
17,9±1,7 р >0,05 |
18,2±2,1 р >0,05 |
| Осн.I | 25,4±2,7 Р1<0,01 |
18,5±2,2 Р1>0,05 |
18,2±2,3 Р1>0,05 |
18,6±2,7 Р1>0,05 |
19,1±3,2 Р1>0,05 |
|
| Осн.II | 26,2±3,2* Р2<0,01 |
25,8±2,7*** Р2<0,01 |
30,4±1,5*** Р2<0,01 |
31,2±1,6*** Р2<0,01 |
28,4±1,5*** Р2<0,01 |
|
| k | Контр. | 5,2±0,7 |
5,4±0,8 р >0,05 |
5,3±0,6 р >0,05 |
5,1±0,9 р >0,05 |
5,3±0,5 р >0,05 |
| Осн.I | 12,8±2,7 Р1<0,01 |
8,5±1,1 Р1<0,01 |
9,4±1,4 Р1<0,01 |
8,9±1,2 Р1<0,01 |
9,1±2,1 Р1<0,01 |
|
| Осн.II | 12,3±2,8* Р2<0,01 |
12,5±2,7*** Р2<0,01 |
13,2±3,1*** Р2<0,01 |
13,6±3,9*** Р2<0,01 |
12,9±3,3*** Р2<0,01 |
|
| a | Контр. | 38,3±3,55 |
39,3±3,9 р >0,05 |
39,1±2,9 р >0,05 |
38,5±3,1 р >0,05 |
38,1±3,2 р >0,05 |
| Осн.I | 15,7±1,7 Р1<0,01 |
22,8±2,7 Р1<0,01 |
23,1±2,2 Р1<0,01 |
22,6±2,5 Р1<0,01 |
23,8±2,8 Р1<0,01 |
|
| Осн.II | 16,1±1,9* Р2<0,01 |
15,4±1,7*** Р2<0,01 |
14,8±1,6*** Р2<0,01 |
13,7±1,5*** Р2<0,01 |
15,2±1,7*** Р2<0,01 |
|
| MA | Контр. | 54,2±5,5 |
55,9±5,7 р >0,05 |
55,1±6,2 р >0,05 |
54,4±5,8 р >0,05 |
54,7±5,6 р >0,05 |
| Осн.I | 36,8±3,1 Р1<0,01 |
45,5±4,9 Р1<0,01 |
44,3±4,2 Р1<0,01 |
44,7±5,1 Р1<0,01 |
45,1±4,7 Р1<0,01 |
|
| Осн.II | 36,3±3,8* Р2<0,01 |
36,8±3,9*** Р2<0,01 |
35,7±2,7*** Р2<0,01 |
35,1±3,1*** Р2<0,01 |
34,9±3,3*** Р2<0,01 |
|
| LY 30% | Контр. | 6,4±0,2 |
6,2±0,3 р >0,05 |
6,7±0,45 р >0,05 |
6,1±0,35 р >0,05 |
5,9±0,4 р >0,05 |
| Осн.I | 4,8±0,17 Р1<0,001 |
5,9±0,3 Р1>0,05 |
6,8±0,3 Р1>0,05 |
6,2±0,3 Р1>0,05 |
6,4±0,5 Р1>0,05 |
|
| Осн.II | 4,3±0,15 Р2<0,001 |
4,2±0,25 Р2<0,001 |
4,6±0,2 Р2<0,001 |
4,1±0,25 Р2<0,001 |
4,8±0,24 Р2<0,001 |
|
| CI | Контр. | 2,15±0,4 |
2,11±0,3 р >0,05 |
2,18±0,3 р >0,05 |
2,4±0,2 р >0,05 |
2,16±0,2 р >0,05 |
| Осн.I | -2,4±0,08 Р1<0,01 |
-1,3±0,04 Р1<0,01 |
-1,4±0,045 Р1<0,01 |
-1,8±0,06 Р1<0,01 |
-1,2±0,02 Р1<0,01 |
|
| Осн.II | -2,1±0,2* Р2<0,01 |
-2,3±0,2*** Р2<0,01 |
-2,6±0,3*** Р2<0,01 |
-2,4±0,2*** Р2<0,01 |
-1,9±0,1*** Р2<0,01 |
Примечание: Р – достоверность различий на этапах исследования. Р1 – достоверность различий между КГ и I группой; Р2– достоверность различий между КГ и II группой; * - достоверность различий между I и II группами. * - Р > 0,05; ** - Р < 0,05; *** - Р < 0,01. n – количество наблюдений; в КГ n =139, в основной группе n = 162.
Для иллюстрации вышесказанного приводим тромбоэластограмму ВИЧ-инфицированной пациентки П. на начальном этапе исследования. Как мы видим, исходные показатели тромбоэластограммы свидетельствуют о дефиците плазменных факторов свертывания и тромбоцитов.
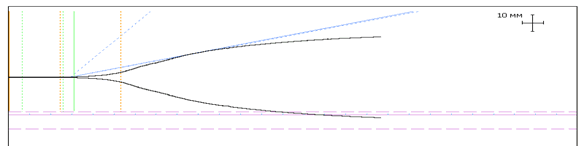 |
После проведенной предоперационной подготовки основные показатели тромбоэластограммы нормализовались, что наглядно отображает эффективность выбранной лечебной тактики у ВИЧ-инфицированных беременных на этапе предоперационной подготовки.
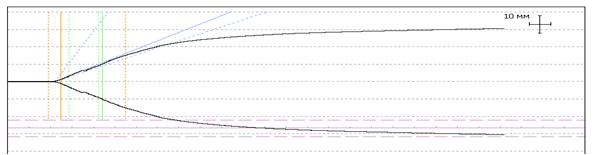 |
Заключение: Как литературные данные, так и наши наблюдения свидетельствуют о том, что прием антиретровирусных вызывает определенные изменения в системе гомеостаза, при этом чаще всего возникает анемия, тромбоцитопения и гипокоагуляционные сдвиги. Причиной развития анемии является нарушение эритропоэза. Развитие коагулопатии связано с нарушением синтетической функции печени и пониженным образованием факторов свертывания крови. Разработанная нами целенаправленная предоперационная подготовка ВИЧ-инфицированных беременных помогает нивелировать возникшие изменения. Терапия преднизолоном не привела к достоверному увеличению количества тромбоцитов, следовательно необходимы альтернативне пути коррекции данных нарушений. Проведенные исследования подчеркивают необходимость дальнейшего изучения проблемы и целесообоазность подбора альтернативных схем химиопрофилактики.
Список литературы:
- European Collaborative Study. Exposure to antiretroviral therapy in utero or early life: the health of uninfected children born to HIV-infected women. J Acquir Immune Defic Syndr 2003; 32: 380-7.
- Clarke S.M., Mulcahy F., Healy C.M., et al. The efficacy and tolerability of combination antiretroviral therapy in pregnancy: infant and maternal outcome. Internat J STD AIDS, 2000. 11(4):220-3.
- Приказ МЗ РФ N 606 от 19.12.2003 "Об утверждении инструкции по профилактике передачи ВИЧ-инфекции от матери ребенку и образца информированного согласия на проведение химиопрофилактики ВИЧ"
- Lorenzi P., Spicher V.M., Laubereau B., et al. Antiretroviral therapies in pregnancy: maternal, fetal and neonatal effects. Swiss HIV Cohort Study, the Swiss Collaborative HIV and Pregnancy Study, and the Swiss Neonatal HIV Study. AIDS,2008. 12(18):F241-7
- Watts D.H., Balasubramanian R., Maupin R.T., et al. Maternal toxicity and pregnancy complications in human immunodeficiency virus-infected women receiving antiretroviral therapy: PACTG 316. Am J Obstet Gynecol 2004; 190:
- de Andrade, C.M. Duarte, G. Quintana, S.M. Montes, M.B.A. Toloi, M.R.T. Effect of antiretroviral therapy on hemostasis in Brazilian pregnant women with HIV infection. J. Blood Coagulation and fibrinolysis.2007, Vol/ 18; NUMB 8, pages 769-774.
- Spire B., Duran S., Souville M., et al. Highly active antiretroviral therapies (HAART) in HIV-infected patients: from a predictive to a dynamic approach. // Soc. Sci. Med. — 2002. — Vol. 54. — P.1481-1496.
- Hill J.B., Sheffield JS, Zeeman G.G., Wendel GD. Hepatotoxicity with antiretroviral treatment of pregnant women. Obstet Gynecol., 2001; 98: 909-11
- Fabricius EM, Schramm W, Goebel FD, Schmitz K, Patzak A, Hammel G; International Conference on AIDS. Fibrinolysis and endothelin in retinal and conjunctival microangiopathy in HIV-infection. Int Conf AIDS. 2002 Jul 19-24; 8: 77 (abstract no. PuB 7172).
- Richard O., Judith E.А.,Helen Ogefere O., Evelyn Omokaro U., and Chinedu C. Haemorheologic and fibrinolytic activity in Nigerian HIV infected patients. Health Sci. 2008 December; 8(4): 217–219
- Kontorinis N., Dieterich D.T. Toxicity of non-nucleoside analogue reverse transcriptase inhibitors. Semin Liver Dis, 2003. 23(2):P. 173-182
- Ananworanich J., Pharnuphak N., Nuesch R., Apateerapong W., et al . Recurrent thrombocytopenia associated with structured treatment interruption in patients with human immunodeficiency virus infection. Clin Infect Dis . 2003; 37: 723-725.
- Swindells, S., Zheng, J. & Gendelman, H. E. (2006) HIV-associated dementia: new insights into disease pathogenesis and therapeutic interventions. AID S Patient Care and STDs, 13, P.153–163.
- Henry D.H., Beall G.N., Benson C.A., et al. Recombinant human erythropoietin in the treatment of anemia associated with human immunodeficiency virus infection and zidovudine therapy. Ann Intern Med. 2002;117:739-748.
- Ananworanich J., Pharnuphak N., Nuesch R., Apateerapong W., et al . Recurrent thrombocytopenia associated with structured treatment interruption in patients with human immunodeficiency virus infection. Clin Infect Dis . 2003; 37:723-725.
- E. Jong , Louw S., Meijers J.C., de Kruif M.D., ten Cate H., Buller H.R., Mulder J.W., van Gorp E.C. The hemostatic balance in HIV-infected patients with and without antiretroviral therapy: partial restoration with antiretroviral therapy. (AIDS Patient Care STDS. 2009 Dec;23(12):P.1001-1007.
- Yu-Min P. Shen. Thrombosis and a Hypercoagulable State in HIV-Infected Patients. University of Texas Southwestern Medical Center at Dallas, Dallas, Texas. Clinical and Applied Thrombosis/Hemostasis, Vol. 10, No. 3, 277-280 (2004), DOI: 10.1177/107602960401000311

