Эффективность антиоксидантной защиты при хирургической коррекции
врожденных пороков сердца с искусственным кровообращением
К.м.н. Ю.А. Бахарева, д.м.н. З.З. Надирадзе
Ключевые слова: врожденные пороки сердца, цитофлавин, искусственное кровообращение, антигипоксанты.
Недостаточное поступление кислорода в ткани сердца вследствие гипоксемии или неадекватной перфузии приводит к нарушению процессов окислительного фосфорилирования, активации анаэробного гликолиза и прогрессирующему снижению уровня макроэргических соединений в клетках миокарда. Нарастающий энергетический дефицит проявляется нарушением работы ионных насосов, обеспечивающих поддержание интрацеллюлярного водно-электролитного гомеостаза.
Результаты хирургического лечения врожденных пороков сердца в большой степени обусловлены эффективностью защиты миокарда от повреждений, возникающих в период его ишемии и реперфузии. Реперфузионные повреждения являются следствием как непосредственно ишемии, так и последующего восстановления кровотока в сердце и имеют самостоятельное значение, специфические черты. В основе реперфузионных повреждений лежат такие еще не полностью изученные механизмы, как «кальциевый парадокс», то есть перегрузка миоцитов кальцием [6, 7]; «кислородный парадокс» — массивное повреждение клеточных структур свободными радикалами кислорода [5, 11, 12]; реперфузионный внутриклеточный отек [10] и др.
Довольно длительный период многие авторы исследуют проблему кардиопротекции. На данный момент опубликованы результаты многих исследований, в которых авторы пытаются дать ответ на вопрос, как лучше всего защитить клетки сердца от ишемии и реперфузии [14].
Обнаружено, что после возобновления коронарного кровообращения активность кардиомиоцитов восстанавливается с некоторым замедлением. Итак, обеспечение соответствующей перфузией и кислородом клеток сердечной мышцы, несмотря на сохранившуюся их жизнеспособность, не является единственным условием обеспечения сократительной способности сердца. Изучение процесса «оглушения» миокарда после ишемического эпизода позволило кардиохирургам выяснить причину гемодинамической дисфункции сердечной мышцы у многих больных после операции на сердце с применением искусственного кровообращения [9].
В организме в процессе взаимодействия биологических объектов из группы радикалов вырабатываются так называемые стабильные радикалы, оказывающие антиоксидантное действие. Они тормозят развитие деструктивных процессов и замедляют гибель клеток [1].
Существующая в организме физиологическая антиоксидантная система может в определенной степени снизить повреждающее воздействие свободных радикалов, однако ее возможности весьма ограниченны. В связи с этим в настоящее время изучаются лекарственные препараты, активизирующие анаэробную продукцию макроэргов в условиях дефицита кислорода и обладающие антиоксидантной активностью. Имеются ферментные и неферментные антиоксиданты. К неферментным антиоксидантам относятся такие препараты, как аскорбиновая кислота, церулоплазмин, витамин Е, каротин, убихинон, эмоксипин и др., к ферментным антиоксидантам — супероксиддисмутаза, глутатионпероксидаза и каталаза. Антиоксиданты широко применяются в клинической практике для лечения больных в критических состояниях, но обладают недостаточно выраженной фармакокинетикой [4].
В настоящее время фармацевтической компанией НТФФ «Полисан» (Россия, Санкт-Петербург) предложен препарат цитофлавин. Он оказывает антиоксидантное и антигипоксическое действие, положительно влияя на процессы энергообразования в клетке, уменьшая продукцию свободных радикалов, восстанавливая активность ферментов антиоксидантной защиты. Цитофлавин улучшает окислительный метаболизм в условиях ишемии, препятствуя резкому снижению уровня аденозинтрифосфата (АТФ), стимулирует активность аденилатциклазы, что позволяет осуществлять анаэробный метаболизм глюкозы без образования лактата. Препарат активизирует внутриклеточный синтез белка и нуклеиновых кислот, сохраняя аппарат рибосом, ферментативные процессы цикла Кребса, способствует утилизации глюкозы, синтезу и внутриклеточному накоплению АТФ и других макроэргов.
Цитофлавин обладает антигипоксическими свойствами, улучшает оксигенацию крови, ограничивает зону ишемического повреждения и стимулирует репаративные процессы. Данный препарат успешно применяется для лечения тяжелых форм интоксикации, токсических и гипоксических энцефалопатий [2]. Имеются сообщения об успешном применении данного препарата при кардиохирургических операциях. Например, использование цитофлавина при операциях коронарного шунтирования на работающем сердце с целью профилактики нежелательных изменений гемодинамики и возникновения дизритмий при пережатии коронарной артерии в момент наложения анастомоза [3]. Учитывая, что цитофлавин обладает механизмом биохимической коррекции тканевого транспорта кислорода и последствий гипоксических нарушений, мы сделали предположение о перспективности его использования при операциях у детей в условиях искусственного кровообращения.
Цель исследования — изучение влияния цитофлавина в качестве компонента антиоксидантной и антигипоксической зашиты миокарда при операциях с искусственным кровообращением у детей.
Материал и методы
Проведено рандомизированное контролируемое исследование, в которое были включены 42 пациента, оперированных в возрасте от 6 мес до 3 лет по поводу врожденных пороков сердца. Рандомизацию проводили путем случайного включения. Все пациенты в зависимости от применяемой методики защиты миокарда были разделены на 2 группы. В 1-ю группу (сравнения) вошли 22 пациента, которым локальную защиту миокарда проводили только препаратом консол по стандартной методике. В основной (2-й) группе помимо кардиоплегии для защиты миокарда использовали препарат цитофлавин, который вводили в кардиотомный резервуар аппарата искусственного кровообращения в расчетной дозе 1 мл/кг.
Инфузию цитофлавина проводили с момента начала согревания пациента в течение 5—10 мин, после чего снимали зажим с аорты. Скорость введения приготовленного раствора 5—10 мл/мин. Расчетную дозу разводили в 5 или 10% растворе глюкозы в соотношении 1:5. Группы достоверно не различались по полу, возрасту, массе тела, росту, степени анестезиологического риска, времени окклюзии аорты и продолжительности искусственного кровообращения.
За 15 мин до операции проводили стандартную премедикацию. Пациентов оперировали в условиях многокомпонентной анестезии с интубацией трахеи и искусственной вентиляцией легких. Поддержание анестезии осуществляли постоянным введением фентанила (до 10 мкг/кг в час) в сочетании с ингаляцией севорана (0,8—2,5 об.%). Миоплегию поддерживали инфузией тракриума.
Искусственное кровообращение проводили по принятой в кардиохирургическом отделении методике: использовали аппарат Stockert (Германия) с системами контроля давления, температуры, гематокрита, сатурации, наличия воздуха в магистралях и уровня перфузата в резервуарах. Применяли одноразовые перфузионные наборы, оснащенные мембранными оксигенаторами («Sorin Groop», Италия).
Искусственное кровообращение у пациентов обеих групп проводили в субнормотермическом режиме (32—34 °С).
Во время операции регистрировали в динамике электрокардиограмму, частоту сердечных сокращений, данные пульсоксиметрии, инвазивное артериальное давление — систолическое, диастолическое, среднее в лучевой артерии; а также центральное венозное давление. С помощью аппарата ATL HDI 5000cv («Philips», Германия) для эхокардиографии рассчитывали следующие показатели: ударный объем и минутный объем кровообращения. Кроме того оценивали эффективность применяемой методики.
С этой целью определяли показатели тканевого компонента транспорта кислорода, кислородного баланса организма и уровень лактата сыворотки.
Для расчета транспорта кислорода использовали программное обеспечение к мультипараметрическому монитору MP-60 («Philips», Германия) и газоанализатору ABL800 Flex («Radiometer», Дания), что позволяет вычислить следующие показатели: потребление кислорода (VO2), содержание кислорода в артериальной крови, кислородную емкость крови (СаО2), доставку кислорода (DO2), коэффициент утилизации кислорода (КУО2). Тканевый компонент транспорта кислорода оценивали: исходно — после интубации трахеи, на момент канюляции, после прекращения искусственного кровообращения, в конце операции, перед переводом больного в палату интенсивной терапии и реанимации и через 3 ч после операции. Кроме того исследовали уровень гемоглобина в обеих группах с целью исключения его влияния на достоверность показателей.
Результаты обследования каждого пациента обработаны и представлены для дальнейшего изучения в виде электронных таблиц. Статистическую обработку полученных данных проводили с использованием пакета программ Statistica 6.0 («Stat Soft inc.», США). Характер распределения оценивали по результатам тестов на нормальность Колмогорова— Смирнова, Шапиро—Уилка. Ненормальным считали распределение, при котором по одному из указанных тестов имелись достоверные отличия от распределения Гаусса. Показатели количественных признаков приведены в значении медианы с указанием нижнего и верхнего квартилей. Для оценки межгрупповых различий полученных значений применяли U-критерий Манна—Уитни.
Результаты и обсуждение
Транспорт кислорода в организме осуществляется несколькими составляющими: поступление кислорода в легкие, доставка кислорода тканям, утилизация и тканевое потребление кислорода. Эти компоненты влияют на скорость метаболических процессов в органах.
Если скорость метаболических процессов повышена, нормальный уровень потребления кислорода не обязательно будет адекватным. Когда быстрота обмена веществ превышает возможность снабжения тканей кислородом, они переключаются на анаэробный тип дыхания и вырабатывают молочную кислоту. Способность выведения молочной кислоты из крови помогает различить ее нормальную и патологическую продукцию. Повышение лактата в сыворотке крови, продолжающееся в течение нескольких часов, расценивают как тканевую ишемию. Уровень лактата в крови можно измерить в верхней полой вене, легочной артерии или на периферии. После анализа показателей нами выявлено, что уровень лактата в настоящем исследовании не имеет значимых межгрупповых различий (табл. 1) и не превышает уровня нормальных значений, что свидетельствует об отсутствии у пациентов тканевой ишемии.
Таблица 1. Уровень лактата крови (медиана, квартили)
Период исследования |
1-я группа (n=15) |
2-я группа (n=14) |
p |
Исходные данные |
1,50 (1,00—2,00) |
1,65 (1,20—2,10) |
>0,05 |
Канюляция |
1,70 (1,30—2,40) |
1,65 (1,30—2,20) |
>0,05 |
После ИК |
1,60 (1,30—2,00) |
1,75 (1,50—2,20) |
>0,05 |
Конец операции |
1,70 (1,40—1,90) |
1,90 (1,70—2,10) |
>0,05 |
Через 3 ч |
1,80 (1,40—2,10) |
1,75 (1,60—1,90) |
>0,05 |
КУО2 представляет собой процент кислорода, поглощаемый из капиллярного русла клетками.
Большинство тканей не в состоянии запасать кислород, поэтому поступление его из капилляров зависит от метаболических потребностей клеток. КУО2 может изменяться также при снижении доставки кислорода. Способность компенсировать снижение уровня кислорода в крови увеличением его поглощения — характерная особенность микроциркуляторного русла всех органов и тканей за исключением сердца и диафрагмы. Уровень кислорода в этих тканях очень чувствителен к малейшим изменениям кровотока.
Содержание кислорода в артериальной крови (СаО2) в нашем исследовании достоверных межгрупповых различий не имело, КУО2 также в группах существенно не различался (табл. 2).
Таблица 2. Транспорт кислорода (медиана, квартили)
Период исследования |
1-я группа (n=15) |
2-я группа (n=14) |
p |
|
| VO2 | ||||
Исходные данные |
53,60 (43,50—63,40) |
59,05 (48,50—66,70) |
>0,05 |
|
Канюляция |
54,60 (45,60—67,30) |
56,65 (47,60—63,50) |
>0,05 |
|
После ИК |
54,30 (47,50—62,30) |
67,30 (56,30—75,60) |
0,02 |
|
Конец операции |
53,80 (45,60—58,60) |
60,50 (56,30—67,80) |
0,02 |
|
Через 3 часа |
56,40 (47,80—65,40) |
68,35 (57,80—76,50) |
0,02 |
|
| CaO2 | ||||
Исходные данные |
18,30 (17,50—19,30) |
18,70 (17,80—19,20) |
>0,05 |
|
Канюляция |
18,30 (17,60—18,70) |
18,15 (17,50—18,70) |
>0,05 |
|
После ИК |
18,20 (17,40—18,70) |
18,45 (17,30—19,30) |
>0,05 |
|
Конец операции |
17,70 (16,90—18,30) |
17,90 (16,80—18,40) |
>0,05 |
|
Через 3 ч |
17,50 (16,70—18,60) |
17,70 (16,80—18,60) |
>0,05 |
|
DO2 |
||||
Исходные данные |
249,6 (212,4—274,5) |
238,5 (214,6—274,5) |
>0,05 |
|
Канюляция |
236,4 (215,8—269,7) |
235,4 (215,8—256,7) |
>0,05 |
|
После ИК |
237,4 (216,5—253,4) |
251,6 (239,4—259,7) |
0,02 |
|
Конец операции |
227,5 (215,6—243,6) |
246,5 (227,4—268,7) |
0,03 |
|
Через 3 ч |
233,4 (219,6—253,1) |
275,3 (247,8—285,6) |
0,001 |
|
КУО2 |
||||
Исходные данные |
17,60 (15,40—19,20) |
17,55 (15,60—18,70) |
>0,05 |
|
Канюляция |
17,40 (16,50—19,40) |
17,60 (15,60—19,40) |
>0,05 |
|
После ИК |
17,60 (16,50—19,80) |
17,70 (16,70—19,50) |
>0,05 |
|
Конец операции |
17,60 (16,50—19,50) |
17,60 (16,40—19,40) |
>0,05 |
|
Через 3 ч |
17,60 (16,50—19,40) |
17,50 (16,50—18,70) |
>0,05 |
|
Таблица 3. Показатели гемоглобина (медиана, квартили)
Период исследования |
1-я группа (n=15) |
2-я группа (n=14) |
p |
Исходные данные |
130,0 (128,0—134,0) |
132,0 (130,0—134,0) |
>0,05 |
Если поглощение кислорода снижается, показатель потребления кислорода у пациентов с сердечной патологией будет определять скорость метаболических процессов.
VO2 — это важный этап оксигенации клеток и представляет собой обеспечение тканевого метаболизма. Поскольку данный показатель тесно связан с гемоглобином, анемия будет определять изменения величины VO2. В табл. 3 представлены результаты анализа содержания гемоглобина, как видно, существенных различий нет. Анализ показал, что потребление кислорода тканями увеличивалось после искусственного кровообращения, в конце операции и через 3 ч после нее в группе, где использовали антиоксидант цитофлавин, при этом содержание кислорода в артериальной крови не менялось (см. табл. 2).
Для того чтобы коронарное кровообращение обеспечивало метаболические потребности миокарда, нужна высокая объемная скорость кровотока, поэтому особое внимание стоит обратить на поддержание минутного объема крови у пациентов с сердечной патологией. У наблюдавшихся нами больных при восстановлении самостоятельного кровообращения в крови находилась максимальная концентрация вводимого антиоксиданта, что способствовало снижению повреждающего действия свободных радикалов на момент снятия зажима с аорты.
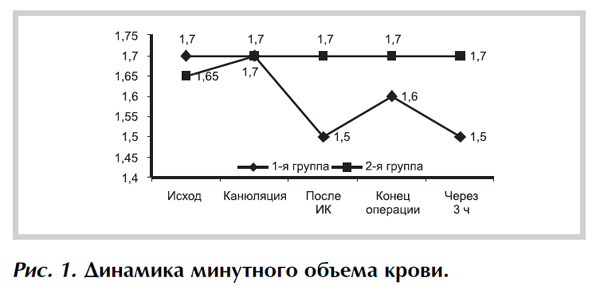
Технологию защиты миокарда предполагали использовать в данном случае не только на этапе ишемии, но и на этапе реперфузии. Мы сравнили показатели минутного объема крови в обеих группах.
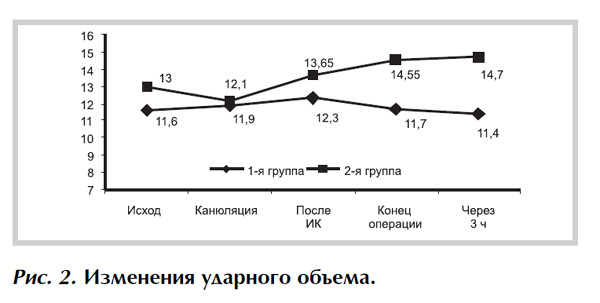
Применение цитофлавина не приводило к снижению этого показателя как после искусственного кровообращения, так и в конце операции, в отличие от группы сравнения. Данная динамика сохранилась и через 3 ч после операции (рис. 1). При анализе ударного объема показатели также были существенно выше во 2-й группе по сравнению с 1-й, в постокклюзионном периоде, в конце операции и через 3 ч после нее (рис. 2), что свидетельствует о сохранении достаточного кровотока для обеспечения адекватного транспорта кислорода.
DO2 — еще один важный компонент метаболических тканевых процессов — представляет собой скорость транспорта кислорода артериальной кровью. Критический уровень доставки кислорода отмечен при различных клинических состояниях, например при операциях с искусственным кровообращением [8, 13]. В нашей работе группа, в которой использовали препарат цитофлавин, отличается от группы сравнения высокими цифрами DO2 как после искусственного кровообращения, так и в конце операции, а также через 3 ч после нее (см. табл. 2), что вполне может объясняться сохранностью клеток миокарда и соответственно высокого минутного объема крови.
Таким образом, на основании полученных в нашем исследовании результатов можно сделать вывод о том, что обеспечивая адекватный кислородный баланс сердечной мышцы в период реперфузии, цитофлавин положительно влияет на сохранность миокардиоцитов при восстановлении кровообращения в ишемизированном миокарде. Это позволяет избежать снижения производительности сердечно-сосудистой системы в постперфузионном периоде и тем самым поддерживать адекватный кислородный транспорт во всем организме.
Имеющиеся сведения об эффективности применения препарата в комбинированной фармакотерапии ишемических и реперфузионных повреждений миокарда могут расширить показания к применению цитофлавина в сердечно-сосудистой хирургии.
- Ливанов Г.А., Ботоцыренов Б.В., Глушков С.И. и др. Применение цитофлавина при токсической и постгипоксической энцефалопатии. Пособие для врачей. Ст-Петербург: 2004.
- Ливанов Г.А., Мороз В.В., Батоцыренов Б.В. и др. Пути фармакологической коррекции последствий гипоксии при критических состояниях у больных с острыми отравлениями. Анест и реаниматол 2003; 2: 51—54.
- Оболенский С.В., Николаев А.А., Аббясов И.Г. и др. Интраоперационная защита миокарда в коронарной хирургии на работающем сердце. Вестник академии им И.И. Мечникова 2003; 4: 4: 114— 117.
- Федин А.И., Румянцева С.А., Кузнецов О.Р., Евсеев В.Н. Антиоксидантная и энергопротекторная терапия ишемического инсульта. Методическое пособие. М 2004.
- Bical O., Gerhardt M.F., Paumier D. et al. Comparison of different types of cardioplegia and reperfusion on myocardial metabolism and free radical activity. Circulation 1991; 84: 5 Suppl: 111: 375—379.
- Follete D.M., Fey K., Buckberg G.D. et al. Reducing postischemic damage by temporary modification of reperfusate calcium, potassium, pH and osmolarity. J Thorac Cardiovasc Surg 1981; 82: 221.
- Follete D.M., Fey K., Livesay J. et al. The benefitial effects of citrate reperfusion of ischemic heart on cardiopulmonary bypass. Surg Forum 1976; 27: 244.
- Komatsu Т., Shibutani К., Okamoto К. et al. Critical level of oxygen delivery after cardiopulmonary bypass. Crit Care Med 1987; 15: 194— 197.
- Kubler W., Haas M. Cardioprotection: definition, classification and fundamental principles. Heart 1996; 75: 330—333.
- Okamoto F., Allen B.S., Buckberg G.D. et al. Studies of controlled reperfusion after ischemia. Reperfusate composition: interaction of marked hyperglycemia and marked hyperosmolarity in allowing immediate contractile activity after four hours of regional ischemia. J Thorac Cardiovasc Surg 1986; 92: 583—593.
- Pearson P.J., Lin P.J., Schaff H.V. Production of endotelium-derived contracting factor is enhanced after coronary reperfusion. Ann Thorac Surg 1991; 51: 788—793.
- Radi R., Beckman J.S., Bush K.M. et al. Peroxynitrite — indused membrane lipid peroxidation: the cytotoxic potential of superoxide and nitric oxide. Arch Biochem Biophys 1991; 288: 481—487.
- Rashkin M.C., Bosken С., Baughman R.P. Oxygen delivery in critically ill patients. Relationship to blood lactate and survival. Chest 1985; 87: 580—584.
- Wysocki H. Cardioprotection — promise or disappointment. Terapia 2004; 9: 23—29.

