Ершов А.Л.
Осложнения и побочные эффекты длительной искусственной вентиляции легких
со стороны пищеварительной системы. Обзор литературы.
(Институт исследований в хирургии, Форт Сэм Хьюстон, Сан Антонио, США)
Нет необходимости доказывать выраженный лечебный эффект искусственной вентиляции легких (ИВЛ) при многих вариантах как острой, так и хронической дыхательной недостаточности. Известно также, что ИВЛ не является абсолютно безопасным видом респираторной поддержки, – при определенных обстоятельствах этот метод может явиться непосредственной причиной, или, что случается чаще, благоприятным фоном для возникновения разнообразных патологических реакций в организме больного.
Лечение и интенсивный уход за больным на ИВЛ – процесс, требующий от медицинского персонала не только существенных затрат времени и физических сил, но и разностороннего опыта. Неслучайно в США считается правилом, что в ОРИТ за каждым таким больным должна быть закреплена индивидуальная круглосуточная медсестра, которая не должна отвлекаться для оказания плановой медпомощи другим пациентам отделения. Кроме того, больной на ИВЛ в течение суток многократно осматривается дежурным реаниматологом, респираторным терапевтом, а также ежедневно консультируется врачом-диетологом, рентгенологом, бронхологом и, по необходимости, другими специалистами клиники.
За рубежом уделяется пристальное внимание вопросам патогенеза, лечения и профилактики осложнений и побочных эффектов ИВЛ. Только в англоязычной прессе в течение года по этой теме публикуется несколько тысяч статей. Такой большой поток информации обусловлен как высокой частотой возникновения осложнений, так и тем влиянием, которое они оказывают на важнейшие показатели качества работы ОРИТ (сроки пребывания больного в палате интенсивного наблюдения, суммараная стоимость лечения, уровень летальности и т.д.) [65, 83]
Подавляющая часть публикаций по проблеме осложнений ИВЛ касается патологии, возникающей на уровне легких (вентилятор-индуцированное повреждение легких, вентилятор-ассоциированная пневмония, баротравма и т.д.). Внелегочные осложнения освещаются в печати заметно хуже. Пожалуй, среди этой группы побочных эффектов ИВЛ наиболее изученными являются изменения в системе гемодинамики [19, 34]. В меньшей степени известны практическим реаниматологам такие осложнения, как снижение контрактильной способности диафрагмы [71], неврологические нарушения [46], возникновение острых психопатий [24] и посттравматического стресс-синдрома [72], изменения в структуре и функции желудочно-кишечной системы [53, 54], почек [9, 60], а также ряда других органов. Патогенетические механизмы реализации повреждающего воздействия ИВЛ при большинстве внелегочных осложнений многкомпонентны и носят опосредованный характер.
У больных ОРИТ динамика основного заболевания, функциональное состояние желудочно-кишечного тракта (ЖКТ) и адекватность легочной вентиляции находятся в постоянном динамическом взаимодействии. Кроме того, частота возникновения и тяжесть осложнений со стороны ЖКТ у больных реанимационного профиля может зависеть от ряда факторов, непосредственно влияющих систему пищеварения. К ним относятся: состояние после хирургического вмещательства на органах пищеварения, особенности проводимого питания больного, адекватность мер медикаментозной и немедикаментозной профилактики эрозивного гастрита и острых язв; прямой или опосредованный повреждающий эффект лекарственных препаратов, назначаемых больным во время ИВЛ, и т.д. (рис 1). Частота выявляемости тех или иных дисфункций пищеварительной системы во время длительной ИВЛ и наиболее типичные варианты патологии обобщены в таблицах 1 и 2 [53].
Снижение параметров спланхического кровообращения в целом и локальная гипоперфузия пищеварительной системы представляются наиболее значимыми механизмами негативного влияния ИВЛ на функциональное состояние ЖКТ [57]. Выполнение ИВЛ, особенно с положительным давлением конца вдоха (ПДКВ), приводит к повышению внутригрудного давления, снижению венозного возврата за счет уменьшение градиента между средним давлением в венозной системе и давлением в правом предсердии [81]. Уменьшение преднагрузки вызывает снижение сердечного выброса и гипотонию, которая более выражена у пациентов с фоновой гиповолемией, а также у лиц со сниженной способностью венозного русла к вазоконстрикции (например, – при назначении во время ИВЛ опиатов) [26].
Некоторые отличительные особенности сосудистой системы пищеварительной системы предрасполагают к гипоперфузии и ишемизации слизистой оболочки ЖКТ. Среди анатомических структур желудка и кишечника наиболее чувствительными к нарушениям микроциркуляции является мукозный слой [21, 70]. Сосуды, располагающиеся в нем, обладают весьма ограниченной способностью к ауторегуляции ответных реакций, возникающих в ходе снижения параметров системного кровотока, - компенсаторный спазм сохраняется долгое время даже после нормализации параметров общей гемодинамики [40]. Во вторых, архитектура сосудистых сплетений слизистой оболочки ЖКТ обладает особенностями, схожими с медуллярным слоем почек, т.е. допускает шунтирование артериальной крови с формированием феномена обкрадывания верхушечной (дистальной) части ворсинок кишечника даже в условиях сравнительно стабильной гемодинамики. Наконец, содержание кислорода в сосудах, питающих мукозный слой ЖКТ, существенно снижено за счет выраженной гемодилюции, обусловленной абсорбцией жидкости и нутриентов из просвета кишечной трубки. В капиллярном русле кишечника показатель гематокрита может снижаться до 10% [53].
Проведение ИВЛ с положительными значениями давления конца вдоха (ПДКВ) сопровождается активизацией системы ренин-ангиотезин-альдостерон и повышением в крови уровня катехоламинов (симпатическая активация). Первоначально это было продемонстрировано в экспериментальных исследованиях, а недавно подтверждено в клинических условиях [4, 37]. Симпатомиметические эффекты, обусловленные ИВЛ, резко нарастают при одновременном введении пациентам с нестабильной гемодинамикой экзогенных катехоламинов [2]. Снижение показателей системной и локальной гемодинамики в условиях ИВЛ с ПДКВ и повышенного сосудистого сопротивления приводит к гипоксии слизистой оболочки желудка и кишечника и повреждению ее целостности (образование эрозий, язв), а также замедлению скорости опорожнения желудка и снижению перистальтической активности кишечника [2, 42].
Возможно, большую опасность, чем собственно гипоперфузия, представляет «реперфузионное повреждение», приводящее к более грубому повреждению эпителиальных клеток ЖКТ. Этот феномен описан при непродолжительных, но повторяющихся эпизодах ишемии кишечника [75]. Считается, что именно реперфузионное повреждение играет ведущую роль в формировании у больных реанимационного профиля синдрома острой неокклюзивной мезентериальной ишемии [6, 58].
Исследования, проводимые на протяжении последних 10 лет, подтвердили высокую значимость в развитии легочных и внелегочных осложнений ИВЛ дисбаланса цитокинов [10]. Во время ИВЛ фактор некроза опухолей, интерлейкин (ИЛ)-1, ИЛ-8 и целый ряд других цитокинов, относящихся к провоспалительным медиаторам, способны высвобождаться из легких в системный кровоток и вызывать дистанционное повреждение во многих органах в том числе - ЖКТ [13, 7, 27, 82]. Было показано, что указанный механизм может быть вовлечен в патогенез синдрома спланхической гипоперфузии, а так же участвовать в гипотонии и атонии кишечника [52]. С другой стороны, по некоторым экспериментальным данным, выбор режима ИВЛ способен оказывать корригирующее воздействие на локальную продукцию цитокинов в ишемизированном кишечнике [10].
Существенная часть побочных эффектов ИВЛ обусловлена медикаментозными назначениями, а также разнообразными методиками обеспечивающими проведение этого вида респираторной поддержки. Среди лекарственных препаратов, используемых у данной группы больных, с наибольшей частотой приводят к различным дисфункциям ЖКТ опиаты и седативные средства (особенно бензодиазепины) [47]. Назначение медикаментов из этих групп способно привести к угнетению моторики желудка и кишечника, а также вызвать дилятацию венозного русла в ЖКТ и снижение перфузии кишечника. К другим лекарственным соединениям, применение которых может сопровождаться клинически значимыми побочными эффектами со стороны ЖКТ, относятся вазопрессоры, отдельные антибиотики, а также некоторые наполнители таблетированных препаратов (в частности, – сорбитол) [53].
Эрозивные и язвенные кровотечения. Повреждения мукозного слоя (ПМС) ЖКТ, обусловленные стрессом, представляют собой наиболее частую причину возникновения желудочных и кишечных кровотечений у больных ОРИТ, в том числе – среди пациентов на длительной ИВЛ. Уже через несколько часов после развития критического состояния при эндоскопии желудка становятся заметными субэпитальные петехии, часть из которых способна быстро прогрессировать в эрозии и язвы. По истечению суток эрозивный гастрит и стрессорные язвы желудка выявляются уже у 74-100% пациентов ОРИТ, имевших эпизод острой гипоксии [76, 77, 78]. В типичных случаях петехии локализуются в области дна желудка. В пилорическом отделе ПМС форимруются реже и позднее, чем фундальные, но как правило, охватывают более глубокие слои. Кроме того, кровотечения из пилорических и 12-перстных язв чаще отличаются массивностью и хуже поддаются консервативному лечению [77, 79].
Точечные субэпителиальные геморрагии и эрозии в желудке как правило асимптомны, однако, при целенаправленном обследовании нередко удается выявить признаки желудочного кровотечения в виде положительной реакции кала на «скрытую кровь». Более яркая симптоматика в виде отчетливой примеси крови в желудочном содержимом («кофейной гущи») или мелены свидетельствует о язвенным поражениям слизистой оболочки ЖКТ [77]. Отмечено, что среди больных, нуждающихся в длительной респираторной поддержке, наибольшее число желудочных кровотечений наступает в течение первых двух недель ИВЛ [15].
С точки зрения практического удобства к желудочно-кишечным кровотечениям, несущим угрозу жизни больного, в США принято относить ситуации, когда: 1) отмечается снижение систолического артериального давления > 20 мм Hg (при отстутствии других причин для гипотензии), 2) объем кровопотери предопределяет необходимость в проведении гемотрансфузи. Отказ от назначения профилактической противоязвенной терапии повышает вероятность образования стрессорных язв. В этих условиях язвенное кровотечение той или иной степени выраженности отмечается у 25% больных [68]. Далее, среди лиц с язвенным кровотечением у 20% отмечается кровопотеря, которая соответствует критериям «угрожающая жизни». Таким образом, тяжелое желудочно-кишечное кровотечение обнаруживается у 3-4% больных ОРИТ, не получающих специфической противоязвенной терапии [15]. У этих пациентов сроки пребывания в ОРИТ возрастают в среднем на 11 дней [53], а стоимость лечения – на 12 тысяч долларов США [15].
Профилактика кровотечений. В последнее десятилетие в западных странах было отмечено существенное снижение частоты возникновения кровотечений из стрессорных язв желудка [87]. Убедительного объяснения этому наблюдению пока не найдено. Вероятно, в какой-то мере это обусловлено повышением качества медицинского обслуживания больных ОРИТ и, возможно, более эффективной профилактикой гипоперфузии и ацидоза в слизистой оболочке желудка и кишечника [39].
В исследовании, включившем наблюдение за 167 пациентами ОРИТ, Zandstra и Stoutenbeek [88] показали, что применение агрессивной гемодинамической поддержки, обеспечивающей адекватную перфузию слизистого слоя желудка, приводило к практически полному исчезновению случаев язвенного кровотечения (снижение частоты до 0,6%). Так как стабилизация гемодинамики на достаточном уровне достижима далеко не у всех реанимационных больных, использование других методов профилактики повреждений слизистого слоя ЖКТ представляется практически оправданным. В патогенезе язвенной болезни существеная роль отводится свободной соляной кислоте. В связи с этим, большинство используемых в настоящее время методов профилактики в ОРИТ основываются преимущественно на применении препаратов, препятствующих образованию соляной кислоты, нейтрализующей её или защищающих стенки желудка от воздействий HCl. В настоящее время в реанимационной практике используются практически все известные противоязвенные препараты и результаты их профилактического использования достаточно близкие [39]. Возможно, некоторыми преимуществами обладают ингибиторы протонной помпы (эзомепразол, лансопразол, пантопразол и др.) [77]. Существовавшее в 90-х гг. мнение о большей безопасности (риск ВАП!) и эффективности сукралфата в настоящее время поставлено под сомнение [17]. При профилактическом назначении антацидов у больных на длительной ИВЛ измерение кислотности желудочного сока рекомендуется проводить по крайней мере один раз в сутки, считается желательным повышение рН желудочного сока выше 4,0. Частота введения антацидов рекомендована с интервалом в 1-2 часа. Применение Н2-блокторов даже в высоких дозах не гарантирует достижения указанного значения рН [80].
Другим, немедикаментозным методом профилактики кровотечений из стрессорных язв ЖКТ во время длительной ИВЛ считается назначение энтерального питания, которое, по некоторым данным, обладает эффективностью, не уступающей назначению противоязвенных препаратов [23, 64]. Механизм защитного действия энтерального питания до настоящего времени полностью не раскрыт. Однако, существуют предположения, что цитопротективный эффект может быть отчасти объяснен восстановлением энергетических источников в клетках эпителия желудка и ощелачивающим эффектом вводимой пищи [41, 67]. Заканчивая краткое рассмотрение подходов к профилактике кровотечений из ПМС, следует упомянуть о возможном повышении риска развития ВАП при назначении противоязвеных средств во время ИВЛ.
Эзофагиты. Повреждение слизистого слоя пищевода наблюдаются практически у половины больных, находящихся на длительной ИВЛ [85] и составляют у них около 25% от всех кровотечений из верхних этажей ЖКТ [61]. Предполагается, что ведущими механизмами возникновения эзофагитов могут служить желудочные зонды, гастроэзофагальный рефлюкс и дуоденогастральный рефлюкс (заброс желчи) [53, 61].
Желудочные зонды (как постоянные, так и устанавливаемые лишь на непродолжительное время) приводят к механическому повреждению целостности слизистой оболочки и изменяют нормальный тонус мышечных сфинктеров пищевода, провоцируюя гастроэзофагальный рефлюкс [32]. Считается, что введение желудочного зонда резко увеличивают вероятность и дуоденогастрального заброса, причем частота этого нежелательного феномена не зависит ни от размеров зонда, ни от его локализации [ 48, 59 ], но может быть связана с положением туловища больного в постели (желательно приподнять головной конец койки на 30-40o) [ 51 ].
Вероятность возникновения эзофагита увеличивается при нарушении эвакуационной функции желудка (определяется как сохранение питательной смеси в желудке к моменту очередного планового введения зондового питания), а также при росте микробного числа в содержимом желудка (возрастает при забросе желчи в результате дуоденогастрального рефлюкса) [59].
Снижение моторики ЖКТ. Такие типичные проявления пониженной моторики ЖКТ, как застойное содержимое в желудке, снижение частоты возникновения кишечных шумов при аускультации брюшной полости, вздутие живота, задержка отхождения кишечных газов отмечается у половины больных, нуждающихся в длительной ИВЛ [16]. С наибольшей частотой встречается застой в желудке (39%). Гипомоторика толстого кишечника выявляется несколько реже (16%). Большинство больных с явлениями нарушения моторики ЖКТ не способны к усвоению зондового питатания. Также у этой группы больных часто выявляется дуоденогастральный рефлюкс и колонизация желудка кишечной грам-отрицатоельной микрофлорой [16].
Достаточно эффективной мерой профилактики является коррекция электролитных нарушений (К, Mg ) и рациональный подход при оценке целесообразности назначения препаратов, угнетающих перистальтику кишечника (впервую очередь – опиатов, допамина в дозах > 5 µg /кг/мин, фенотиазидов, дилтиазема, веропамила, лекарств, обладающих антихолинергическими эффектами). Нередко для декомпрессии ЖКТ используются введение постоянного зонда в желудок, введение в прямую кишку газоотводной трубки, в отдельных случаях – колоноскопия. Ректальные трубки вызывают выраженный дискомфорт у больных, изязвление слизистой кишки, инфекционные осложнения и даже перфорацию rectum [52, 53] .
К числу препаратов со стимулирующим эффектом на перестальтику кишечника относят эритромицин (200 мг х 1 раз в день) [25, 44]. Этот антибиотик не только вызывает повышение моторики пилорического отдела желудка, но и синхронизирует возникающие сокращения с перистальтическими волнами 12-перстной кишки. Другим эффективным препаратом для профилактики и лечения снижения моторики ЖКТ является метоклопрамид (10 мг х 2 р в день). Его применение позволяет резко ослабить угнетающий эффект допамина на перистальтку желудка и кишечника. Цисаприд (10 мг х 2 р в день), нередко используемый для стимуляции моторики ЖКТ, обладает выраженными побочными эффектами, среди которых наиболее опасными являются сердечные аритмии и высокий риск внезапной смерти больных [53].
Диаррея. Понос наблюдается почти у 50% больных, длительно находящихся на лечении в ОРИТ и он особенно вероятен среди пациентов, нуждающихся в ИВЛ [66, 86]. Несколько факторов могут быть вовлечены в патогенез диарреи у пациентов реанимационного профиля. Одной из наиболее распространенных причин являются погрешности в проведении зондового энтерального питания (12-25% от всех случаев поноса) [86]. Smith с соавт. [74] обнаружил достоверное повышение вероятности возникновения диарреи при скорости введения питательной смеси > 50 мл/час, а также при использовании гиперосмолярных смесей. С другой стороны, Heimburger с соавт. [28, 29] не нашел никакой связи между осмолярностью питательных смесей и вероятностью возникновения поноса. Другими возможными причинами поноса могут оказаться высокое содержание жиров в назначенном зондовом питании, кишечная инфекция (в частности, вызванная Clostridium difficile), назначение некоторых медикаментов, гипоальбуминемия, длительное голодание и т.д. Сравнительно недавно к числу вероятных причин возникновения поноса у больных реанимационного профиля был отнесен избыток желчных кислот в просвете кишечника. Исследования, выполненные на лабораторных животных, показали, что голодание в течение нескольких суток приводит к диффузной атрофии слизистой оболочки тонкого кишечника [73]. Hernandez с соавт. [31] получили аналогичные данные в ходе изучения биопсийного материала 12-перстной кишки, взятого у пациентов ОРИТ, не получавших энтерального питания более 4 дней. С теоретической точки зрения, нарушения функции слизистого слоя в дистальном отделе подвздошной кишки могут вызывать грубые нарушения обмена желчных кислот. Для проверки этого предположения DeMeo с соавт. [18] провели изучение концентрации желчных кислот в кале у больных реанимационного профиля, не получавших энтерального питания более 5 дней. Из 19 обследованных больных тяжелый понос после начала энтерального питания возник у 18 (95%). У 85% больных концентрация желчных кислот в кале превышала нормальное значение в 5-10 раз. В этом исследовании назначение препаратов, связывающих желчные кислоты, привело к существенному улучшению состояния больных.
Нерациональное назначение антибиотиков служит причиной наступления поноса у 20-50% больных реанимационного профиля [14]. Понос выявляется у 5-38% больных, получающих антибиотики [14]. Частота обнаружения этого осложнения в ходе проведения антибиотикотерапии увеличилась за последнее годы в 5 раз [36]. 15%-25% поносов, обусловленных приемом антибиотиков, связаны с дисбактериозом и колонизацией кишечника C . difficile . Проведение ИВЛ рассматривается как один из факторов риска для роста указанного микроорганизма [33]. Те случаи, котрые не связаны с размножением указанного возбудителя, как правило ассоциированы с прямым действием антимикробных препаратов на двигательную активность тонкого кишечника, уменьшением ферментации сахаров в ЖКТ, выраженным повреждением кишечной стенки.
Поносы, обусловленные дисфункцией кишечника на фоне приема антибиотиков, обычно прекращаются вскоре после отмены препарата. Поносы, обуслолвенные C . difficile могут протекать очень тяжело и способны приводить не только к удлинению сроков госпитализации (в среднем на 3 недели [3]), но и к смерти больного. Ощутимые технические трудности в микробиологическом выявлении этого возбудителя могут затруднять своевременную этиологическую диагностику кишечной патологии. Первым шагом в лечении поноса, обусловленного C . difficile должно стать прекращение антибиотикотерапии (если для этого нет строгих противопоказаний). Пероральное назначение метронидазола остается остаётся средством выбора при лечении энтеритов, вызванных C . difficile . Ванкомицин следует считать средством резерва и назначать ( per os ) лишь при полном отстуствии эффекта от метронидазола или при индивидуальной непереносимости этого препарата. Кроме того, вместо метронидазола ванкомицин назначают беременным [52, 53].
Изоосмолярное зондовое питание может оказаться средством выбора при поносах, вызыванных предшествующим назначением гиперсомолярных смесей. Искусственно создавать гипоосмолярные питательные смеси (за счет разведения их водой) не имеет смысла, так как прекращению поноса это не способствует [28, 29]. Добавление в зондовое питание смесей, основанных на цельных или ферментативно модифицированных белках (Peptamine , Nestle , Deerfield и др.) не играет существенной роли в лечении диарреи у больных в критическом состоянии [29].
Общая гемодинамика и функциональное состояние ЖКТ . Как упоминалось выше, ИВЛ оказывает достаточно заметное влияние на системную гемодинмаку, особенно в тех случаях, когда применяется ПДКВ. Изучение особенностей перфузии ЖКТ при разных режимах ИВЛ проводилось преимущественно на экспериментальных моделях [1, 49], которые, как представляется, достаточно точно отражают процессы, происходящие в организме больного человека. В исследованях на животных было показано, что применение ПДКВ = 10 см Н2О сопровождалось уменьшением сердечного выброса на 31%, а мезентериального кровотока – на 75% [45]. В данном эксперименте инфузионная терапия способствовала почти полной нормализации сердечного выброса, но в меньшей степени влияла на показатели мезентереального кровотока, – они составляли не более 45% от физиологического уровня. По видимому, этот феномен обусловлен длительным артериолоспазмом. В пользу такого продположения свидетельствует и хороший клинический эффект от применения допексамина (мощный b2 - адреностимулятор, агонист дофаминовых рецепторов), который обладает способностью препятствовать спазму артериол в кишечной стенке и избирательно улучшать мезентериальный кровоток во время ИВЛ [5, 43]. По экспериментальным данным при ишемии слизистой оболочки ЖКТ выраженным нормализующим эффектом на локальную перфузию также обладает длительная инфузия нового инотропного вазодилататора (инодилататора) левосимендана [69] .
По результатам исследований, полученным около 20 лет назад, применение ПДКВ способствует снижению кровотока не только в кишечнике, но и в поджелудочной железе и желудке [20]. Этот эффект может быть даже более выраженным, чем снижение перфузии в кишечнике. В экспериментальных моделях было показано, что применение ПДКВ = 15 Н2О в течение 24 часов сопровождается развитием острого панкреатита у значительной части лабораторный животных [38]. В доступной литературе не удалось найти данных о роли ИВЛ в возникновении острого панкреатита у пациентов реанимационного профиля.
В экспериментах было доказано негативное влияние ПДКВ на показатели портального и печеночного артериального кровотока, а также на уровень оксигенации крови в печеночных венах (диагностический показатель адекватности снабжения печени кислородом) [11]. Эти изменения поддавались коррекции при использовании интенсивной инфузионной терапии и, что интересно, также регрессировали при назначении энтерального питания [62].
Результаты выполненных к настоящему времени исследований не позволяют с уверенностью считать увеличение внутрибрюшного давления во время ИВЛ с ПДКВ существенным фатором в снижении спланхической гемодинамике. Однако, этот механизм (в сочетании с компрессией, вызывамой более низким расположением диафрагмы при ПДКВ) может оказаться задействованным в механизмах нарушения кровотока в печени [8]. Этот эффект особенно заметен у больных с гипоксемией, гипотензией, а также при любых других патологических состояниях, ухудшающих снабжение печени кислородом [53].
Острый акалькулезный холецистит. Частота возникновения острого акалькулезного холецистиа (ОАХ) у больных, находящихся в ОРИТ, колеблется от 0,2% до 3% [63]. Разумеется, кроме ИВЛ у данной группы пациентов имеются и другие факторы риска, такие как шок, сепсис, многочисленные гемотрансфузии, дегидратация, длительное отсутствие энтерального питания, назначение некоторых медикаментов, способствующих развитию гипокинезии желчного пузыря (опиаты, седативные препараты и др.) и т.д. Патогенез ОАХ сложный и включает по меньшей мере два основных фактора, воздействующих на эпителий желчноного пузыря: ишемический и химический (желчный). Снижение спланхического кровообращения под вляиением ИВЛ может иметь прямое повреждающее действие на эпителий желчного пузыря за счет ухудшения локальной гипоперфузии. В результате ишемии возникает гипомоторика желчного пузыря, приводящая к застою желчи. По некоторым данным гипотония желчного пузыря значительно чаще встречается у больных, находящихся на ИВЛ, по сравнению с пациентами ОРИТ с аналогичной патологией, но не нуждающихся в данном методе респираторной поддержки [22, 55].
Снижение интенсивности и частоты сокращений желчного пузыря начинают выявляться уже через 24 часа после начала ИВЛ [55]. Ранняя диагностика и активная лечебная тактика позволяет существенно снизить риск наступления летального исхода, вероятность которого в запущенных случаях ОАХ достигает 50% [50]. Своевременное выявление данного осложнения у больных в критическом состоянии представляет собой достаточно сложную задачу (тяжесть основной и сопутствующей патлогии, нечеткая клиническая симптоматика, отсутствие патогномонических лабораторных критериев и т.д.). Диагностический поиск в первую очередь должен учитывать результаты ультразвукового исследования брюшной полости. Ведущими УЗИ-проявлениями ОАХ являются: утолщение стенок и расширение желчного пузыря в сочетании с обнаружение «хлопьев» желчи в его просвете (при отсутствии асцита или гипоальбуминемии) [53, 84]. Перечисленные признаки не обладают 100% специфичностью и чувствительностью, но являются весомым диагностическим аргументом. Проведение повторных УЗИ-исседований позволяет оценивать характер выявленных изменений в динамике, что существенно повышает информативность метода [35]. Предложены специальные шкалы, позволяющие дать оценку вероятности ОАХ у больного в баллах [30]. Имеются указания на существенно более высокую диагностическую чувствительность и специфичность компьютерной томографии и магнитно-ядерного резонанса по сравнению с УЗИ [56], однако выполнение этих методов исследования у больных в критическом состоянии представляет определенные технические трудности, особенно у пациентов на ИВЛ.
Проведение холецистэктомии является наиболее традиционным методом лечения ОАХ. У лиц в тяжелом и крайнетяжелом состоянии методом выбора может оказаться чрезкожная холецистостомия [50]. Другой альтернативой может явиться эндоскопическая транспапиллярная холецистостомия [12].
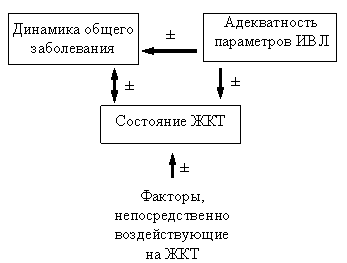
Рис 1. Взаимодействие различных факторов , определяющих функциональное состояние желудочно-кишечного тракта у больных реанимационного профиля во время искусственной вентиляции легких. Обозначена возможность позитивного (+) и негативного (-) влияния отдельных звеньев представленной системы.
Таблица 1. Частота выявляемости различных изменений со стороны органов пищеварительной системы у больных, находящихся на длительной искусственной вентиляции легких (по Multlu G . с соавт., 2001).
Осложнение |
Частота выявляемости (%) |
| Эрозивный эзофагит | 48 |
| Стресс-обусловленное повреждение мукозного слоя ЖКТ: - асимптомное - кровотечение, выявляемое при углубленном обследовании больного - кровотечение, выявляемое при осмотре больного |
74-100 5-25 3-4 |
| Понос | 15-51 |
| Ослабление перистальтики кишечника | 50 |
| Наличие застоя в желудке | 39 |
| Запоры | 15 |
| Кишечная непроходимость | 4-10 |
| Острый акалькулезный холецистит | 0,2-3 |
Список литературы
- Ackland G. Grocott M.P., Mythen M.G. Understanding gastrointestinal perfusion in critical care: so near, and yet so far // Crit Care.-2000.-V.5,№5-P.269-281.
- Aneman A., Ponten J., Fandriks L., et al. Hemodynamic, sympathetic and angiotensin II responses to PEEP ventilation before and during administration of isoflurane // Acta Anaesthesiol. Scand.-1997.-V.41,Jan(1Pt.1)-P.41-48.
- Archibald L.K., Banerjee S.N., Jarvis W.R. Secular trends in hospital-acquired Clostridium difficile disease in the United States, 1987-2001 // J. Infect. Dis.-2004.- V.189,№9.-P.1585-1589.
- Barbieri A., Siniscalchi A., De Pietri L., et al. Modifications of plasma concentrations of hormonal and tissue factors during mechanical ventilation with positive end-expiratory pressure // Int Angiol.-2004.-V.23,№2.-P.177-184.
- Bartsch S., Bruning A., Reimann F.M., et al. Haemodynamic effects of dopexamine on postprandial splanchnic hyperaemia // Eur J Clin Invest.-2004.- V34,№4.- P.268-274.
- Bassiouny H.S. Nonocclusive mesenteric ischemia // Surg Clin North Am.-1997.- V.77, №2.- P.319-326.
- Bellomo R. The cytokine network in the critically ill // Anaesth Intensive Care.-1992.- V.20,№3.-P.288-302.
- Beyer J., Messmer K. The effect of PEEP ventilation on hemodynamics and regional blood flow (author's transl) // Klin Wochenschr. -1981.-V.59,№23.-P.1289-1295.
- Bonventre J.V. Pathophysiology of ischemic acute renal failure. Inflammation, lung-kidney cross-talk, and biomarkers // Contrib Nephrol.- 2004.-V.144.- P.19-30.
- Bouadma L., Schortgen F., Ricard J.D., et al. Ventilation strategy affects cytokine release after mesenteric ischemia-reperfusion in rats // Crit Care Med.- 2004.-V.32, №7.- P.1563-1569.
- Brienza N., Revelly J.P., Ayuse T., et al. Effects of PEEP on liver arterial and venous blood flows // Am J Respir Crit Care Med.-1995.- V.152, №2.- P.504-510.
- Brugge W.R., Friedman L.S. A new endoscopic procedure provides insight into an old disease: acute acalculous cholecystitis // Gastroenterology.-1994.- V.106, №6.-P.1718-1720.
- Chu E.K., Whitehead T., Slutsky A.S. Effects of cyclic opening and closing at low- and high-volume ventilation on bronchoalveolar lavage cytokines // Crit Care Med.- 2004.- V.32,№1.-P.168-174.
- Cleary R.K. Clostridium difficile-associated diarrhea and colitis: clinical manifestations, diagnosis, and treatment // Dis Colon Rectum.-1998.-V.41,№11.-P.1435-1449.
- Cook D.J., Griffith L.E., Walter S.D., et al. The attributable mortality and length of intensive care unit stay of clinically important gastrointestinal bleeding in critically ill patients // Crit Care.-2001.-V.5,№6.-P.368-375.
- Dark D.S., Pingleton S.K. Nonhemorrhagic gastrointestinal complications in acute respiratory failure // Crit Care Med.-1989.-V.17,№8.- P.755-758.
- Darlong V., Jayalakhsmi T.S., Kaul H.L., Tandon R. Stress ulcer prophylaxis in patients on ventilator // Trop Gastroenterol.-2003.-V.24,№3.- P.124-128.
- DeMeo M., Kolli S., Keshavarzian A., et al. Beneficial effect of a bile acid resin binder on enteral feeding induced diarrhea // Am J Gastroenterol.-1998.-V.93,№6.-P.967-671.
- Faehnrich J.A., Noone R.B.Jr., White W.D., et al. Effects of positive-pressure ventilation, pericardial effusion, and cardiac tamponade on respiratory variation in transmitral flow velocities // J Cardiothorac Vasc Anesth.-2003.-V.17,№1.-P.45-50.
- Fleischer G.M., Beau I., Herden P., et al. Is there a PEEP-induced pancreatitis in experiments? // Langenbecks Arch Chir.-1984.-V.362,№3.-P.185-192.
- Fournell A., Schwarte L.A., Kindgen-Milles D., et al. Assessment of microvascular oxygen saturation in gastric mucosa in volunteers breathing continuous positive airway pressure // Crit Care Med.-2003.-V.31,№6.- P.1705-1710.
- Gately J.F., Thomas E.J. Acute cholecystitis occurring as a complication of other diseases // Arch Surg.-1983.-V.118,№10.-P.1137-1141.
- Gottschlich M.M., Jenkins M.E., Mayes T., et al. The 2002 Clinical Research Award. An evaluation of the safety of early vs delayed enteral support and effects on clinical, nutritional, and endocrine outcomes after severe burns // J Burn Care Rehabil. 2002.-V.23,№6.-P.401-415.
- Granberg A., Engberg I.B., Lundberg D. Acute confusion and unreal experiences in intensive care patients in relation to the ICU syndrome. Part II // Intensive Crit Care Nurs.-1999.- V.15,№1.-P.19-33.
- Griffith D.P., McNally A.T., Battey C.H., et al. Intravenous erythromycin facilitates bedside placement of postpyloric feeding tubes in critically ill adults: a double-blind, randomized, placebo-controlled study // Crit Care Med.-2003.-V.31,№1.-P.39-44.
- Grossmann M., Abiose A., Tangphao O., et al. Morphine-induced venodilation in humans // Clin Pharmacol Ther.-1996.-V.60,№5.-P.554-560.
- Haitsma J.J., Uhlig S., Goggel R., et al. Ventilator-induced lung injury leads to loss of alveolar and systemic compartmentalization of tumor necrosis factor-alpha // Intensive Care Med.-2000.-V.26,№10.-P.1515-1522.
- Heimburger D.C., Geels W.J., Thiesse K.T., Bartolucci A.A. Randomized trial of tolerance and efficacy of a small-peptide enteral feeding formula versus a whole-protein formula // Nutrition.-1995.-V.11,№4.-P.360-364.
- Heimburger D.C., Sockwell D.G., Geels W.J. Diarrhea with enteral feeding: prospective reappraisal of putative causes // Nutrition.-1994.-V.10 б №5.-P.392-396.
- Helbich T.H., Mallek R., Madl C., et al. Sonomorphology of the gallbladder in critically ill patients. Value of a scoring system and follow-up examinations // Acta Radiol.-1997.- V.38,№1.-P.129-134.
- Hernandez G., Velasco N., Wainstein C., et al. Gut mucosal atrophy after a short enteral fasting period in critically ill patients // J Crit Care.-1999.-V.14,№2.-P.73-77.
- Ibanez J., Penafiel A., Raurich J.M., et al. Gastroesophageal reflux in intubated patients receiving enteral nutrition: effect of supine and semirecumbent positions // JPEN J Parenter Enteral Nutr.-1992.-V.16,№5.-P.419-422.
- Ibrahim E.H., Mehringer L., Prentice D., et al. Early versus late enteral feeding of mechanically ventilated patients: results of a clinical trial // JPEN J Parenter Enteral Nutr.-2002.-V.26,№3.-P.174-181.
- Jardin F., Vieillard-Baron A. Right ventricular function and positive pressure ventilation in clinical practice: from hemodynamic subsets to respirator settings // Intensive Care Med.-2003.-V.29,№9.-P.1426-1434.
- Jeffrey R.B.Jr., Sommer F.G. Follow-up sonography in suspected acalculous cholecystitis: preliminary clinical experience // J Ultrasound Med.-1993.-V.12,№4.-P.183-187.
- Jobe B.A., Grasley A., Deveney K.E., et al. Clostridium difficile colitis: an increasing hospital-acquired illness // Am J Surg.-1995.-V.169,№5.-P.480-483.
- Kaczmarczyk G., Vogel S., Krebs M., et al. Vasopressin and renin-angiotensin maintain arterial pressure during PEEP in nonexpanded, conscious dogs // Am J Physiol.-1996.-V.271,№5(Pt 2).-P.1396-402.
- Kahle M., Lippert J., Willemer S., et al. Effects of positive end-expiratory pressure (PEEP) ventilation on the exocrine pancreas in minipigs // Res Exp Med (Berl).-1991.-V.191,№5.-P.309-325.
- Kantorova I., Svoboda P., Scheer P., et al. Stress ulcer prophylaxis in critically ill patients: a randomized controlled trial // Hepatogastroenterology.-2004.-V.51,№57.-P.757-761.
- Kiefer P., Nunes S., Kosonen P., et al. Effect of positive end-expiratory pressure on splanchnic perfusion in acute lung injury // Intensive Care Med.-2000.-V.26,№4.-P.376-383.
- Kitchen P., Forbes A. Parenteral nutrition // Curr Opin Gastroenterol.-2003.- V.19,№2.-P.144-147.
- Klemm K., Moody F.G. Regional intestinal blood flow and nitric oxide synthase inhibition during sepsis in the rat // Ann Surg.-1998.-V.227,№1.-P.126-133.
- Lehtipalo S., Biber B., Frojse R., et al. Effects of dopexamine and positive end-expiratory pressure on intestinal blood flow and oxygenation: the perfusion pressure perspective // Chest.-2003.-V.124,№2.-P.688-698.
- Levy H., Hayes J., Boivin M., Tomba T. Transpyloric feeding tube placement in critically ill patients using electromyogram and erythromycin infusion // Chest.-2004.- V.125,№2.-P.587-591.
- Love R., Choe E., Lippton H., et al. Positive end-expiratory pressure decreases mesenteric blood flow despite normalization of cardiac output // J Trauma.-1995.- V.39,№2.-P.195-199.
- Maher J., Rutledge F., Remtulla H., et al. Neuromuscular disorders associated with failure to wean from the ventilator // Intensive Care Med.-1995.-V.21,№9.-P.737-743.
- Marik P.E., Kaufman D. The effects of neuromuscular paralysis on systemic and splanchnic oxygen utilization in mechanically ventilated patients // Chest.-1996.- V.109,№4.-P.1038-1042.
- Meert K.L., Daphtary K.M., Metheny N.A. Gastric vs small-bowel feeding in critically ill children receiving mechanical ventilation: a randomized controlled trial // Chest.-2004.-V.126,№3.-P.872-878.
- Meisner F.G., Habler O.P., Kemming G.I., et al. Changes in p(i)CO(2) reflect splanchnic mucosal ischaemia more reliably than changes in pH(i) during haemorrhagic shock // Langenbecks Arch Surg.-2001.-V.386,№5.-P.333-338.
- Melin M.M., Sarr M.G., Bender C.E., et al. Percutaneous cholecystostomy: a valuable technique in high-risk patients with presumed acute cholecystitis // Br J Surg.-1995.- V.82,№9.-P.1274-1277.
- Metheny N.A., Schallom M.E., Edwards S.J. Effect of gastrointestinal motility and feeding tube site on aspiration risk in critically ill patients: a review // Heart Lung.- 2004.-V.33,№3.-P.131-145.
- Milla P.J. Inflammatory cells and the regulation of gut motility // J Pediatr Gastroenterol Nutr.-2004.-V.39 (Suppl 3).-S.750.
- Mutlu G.M., Mutlu E.A., Factor P. GI complications in patients receiving mechanical ventilation // Chest.-2001.-V.119,№4.-P.1222-1241.
- Mutlu G.M., Mutlu E.A., Factor P. Prevention and treatment of gastrointestinal complications in patients on mechanical ventilation // Am J Respir Med.-2003.- V.2,№5.-P.:395-411.
- Nies C., Zielke A., Hasse C., et al. Atony of the gallbladder as a risk factor for acalculous cholecystitis. What is the effect of intensive care? // Zentralbl Chir.- 1994.-V.119,№2.-P.75-80.
- Noone T.C., Semelka R.C., Chaney D.M., et al. Abdominal imaging studies: comparison of diagnostic accuracies resulting from ultrasound, computed tomography, and magnetic resonance imaging in the same individual // Magn Reson Imaging.-2004.-V.22,№1.-P.19-24.
- Nunes S., Rothen H.U., Brander L., et al. Changes in splanchnic circulation during an alveolar recruitment maneuver in healthy porcine lungs // Anesth Analg.-2004.- V.98,№5.-P.1432-1438.
- Oldenburg W.A., Lau L.L., Rodenberg T.J. et al. Acute mesenteric ischemia: a clinical review // Arch Intern Med.-2004.-V.24,164(10).-P.1054-1062.
- Orozco-Levi M., Felez M., Martinez-Miralles E., et al. Gastro-oesophageal reflux in mechanically ventilated patients: effects of an oesophageal balloon // Eur Respir J.- 2003.-V.22,№2.-P.348-353.
- Pannu N., Mehta R.L. Effect of mechanical ventilation on the kidney // Best Pract Res Clin Anaesthesiol.-2004.-V.18,№1.-P.189-203.
- Plaisier P.W., van Buuren H.R., Bruining H.A. An analysis of upper GI endoscopy done for patients in surgical intensive care: high incidence of, and morbidity from reflux oesophagitis // Eur J Surg.-1997.-V.163,№12.-P.903-907.
- Purcell P.N., Branson R.D., Hurst J.M, et al. Gut feeding and hepatic hemodynamics during PEEP ventilation for acute lung injury // J Surg Res.-1992.-V.53,№4.-P.335-341.
- Rady M.Y., Kodavatiganti R., Ryan T. Perioperative predictors of acute cholecystitis after cardiovascular surgery // Chest. 1998.-V.114,№1.-P.76-84.
- Raff T., Germann G., Hartmann B. The value of early enteral nutrition in the prophylaxis of stress ulceration in the severely burned patient // Burns.-1997.-V.23,№4.-P.313-318.
- Rello J., Lorente C., Diaz E., et al. Incidence, etiology, and outcome of nosocomial pneumonia in ICU patients requiring percutaneous tracheotomy for mechanical ventilation // Chest.-2003.-V.124,№6.-P.2239-2243.
- Ringel A.F., Jameson G.L., Foster E.S. Diarrhea in the intensive care patient // Crit Care Clin.-1995.- V.11,№2.-P.465-477.
- Ruiz-Santana S., Ortiz E., Gonzalez B., et al. Stress-induced gastroduodenal lesions and total parenteral nutrition in critically ill patients: frequency, complications, and the value of prophylactic treatment. A prospective, randomized study // Crit Care Med.-1991 Jul;19(7):887-91.
- Schuster D.P., Rowley H., Feinstein S., et al. Prospective evaluation of the risk of upper gastrointestinal bleeding after admission to a medical intensive care unit // Am J Med.-1984.-V.76,№4.-623-630.
- Schwarte L.A., Picker O., Bornstein S.R., et al. Levosimendan is superior to milrinone and dobutamine in selectively increasing microvascular gastric mucosal oxygenation in dogs // Crit Care Med.-2005.-V.33,№1.-P.135-142.
- Severinghaus J.W. Continuous positive airway pressure, shock therapy, and gastric mucosal oxygenation // Crit Care Med.-2003.-V.31,№6.-P.1870-1871.
- Shanely R.A., Zergeroglu M.A., Lennon S.L., et al. Mechanical ventilation-induced diaphragmatic atrophy is associated with oxidative injury and increased proteolytic activity // Am J Respir Crit Care Med.-2002.-V.166,№10.-P.1369-1374.
- Shaw R.J., Harvey J.E., Nelson K.L., et al. Linguistic analysis to assess medically related posttraumatic stress symptoms // Psychosomatics.-2001.-V.42,№1.-P.35-40.
- Silk D.B. Enteral vs parenteral nutrition // Clin Nutr.-2003.-V.22.(Suppl 2).-P.43-48.
- Smith C.E., Marien L., Brogdon C., et al. Diarrhea associated with tube feeding in mechanically ventilated critically ill patients // Nurs Res.-1990.-V.39,№3.-P.148-152.
- Spain D.A., Kawabe T., Keelan P.C., et al. Decreased alpha-adrenergic response in the intestinal microcirculation after "two-hit" hemorrhage/resuscitation and bacteremia // J Surg Res.-1999.-V.84,№2.-P.180-185.
- Spirt M.J. Stress-related Mucosal Disease // Curr Treat Options Gastroenterol.-2003.- V.6,№2.-P.135-145.
- Spirt M.J.. Stress-related mucosal disease: risk factors and prophylactic therapy // Clin Ther.-2004.-V.26,№2.-P.197-213.
- Sung J.J. The role of acid suppression in the management and prevention of gastrointestinal hemorrhage associated with gastroduodenal ulcers // Gastroenterol Clin North Am.-2003.-V.32(3 Suppl).-S.11-23.
- Terdiman J.P., Ostroff J.W. Gastrointestinal bleeding in the hospitalized patient: a case-control study to assess risk factors, causes, and outcome // Am J Med.-1998.- V.104,№4.-P.349-354.
- Tryba M., Cook D. Current guidelines on stress ulcer prophylaxis // Drugs.-1997.- V.54,№4.-P.581-596.
- Tyberg J.V., Grant D.A., Kingma I., et al. Effects of positive intrathoracic pressure on pulmonary and systemic hemodynamics // Respir Physiol.-2000.-V.119,№2-3.-P.171-179.
- Uhlig S., Ranieri M., Slutsky A.S. Biotrauma hypothesis of ventilator-induced lung injury // Am J Respir Crit Care Med.-2004.-V.169,№2.-P.314-315
- Vincent J.L. Ventilator-associated pneumonia // J Hosp Infect.-2004.-V.57,№4.-P.272-280.
- Wang A.J., Wang T.E., Lin C.C., et al. Clinical predictors of severe gallbladder complications in acute acalculous cholecystitis // World J Gastroenterol.-2003.- V.9,№12.-P.2821-2823.
- Wilmer A., Tack J., Frans E., et al. Duodenogastroesophageal reflux and esophageal mucosal injury in mechanically ventilated patients // Gastroenterology.-1999.- V.116,№6.-P.1293-1299.
- Wu T.J., Liu Z.J., Zhao Y.M., et al. Clinical analysis of the factors related to diarrhea in intensive care unit // Zhongguo Wei Zhong Bing Ji Jiu Yi Xue.-2004.-V.16,№12.-P.747-749.
- Yang Y.X., Lewis J.D. Prevention and treatment of stress ulcers in critically ill patients // Semin Gastrointest Dis.-2003.-V.14,№1.-P.11-19.
- Zandstra D.F., Stoutenbeek C.P. The virtual absence of stress-ulceration related bleeding in ICU patients receiving prolonged mechanical ventilation without any prophylaxis. A prospective cohort study // Intensive Care Med.-1994.-V.20,№5.-P.335-340.

