Рабочий форум сайта CRITICAL
Кесарево сечение глазами анестезиолога (доклад)
Калинин А.Л. (главный врач)
Городской родильный дом г.Находка
Уважаемые коллеги! Я хочу поблагодарить за предоставленную мне возможность поделиться некоторыми нашими представлениями об операции кесарево сечение, которая в нашем родильном доме по результатам прошлого года составила 16,3 % от всех родов. Я буду говорить об очень простых и, на первый взгляд, очевидных вещах, которым, по моему мнению, уделяется недостаточно внимания в родильных домах. По крайней мере, такое впечатление складывается при общении с коллегами, работающими в акушерских стационарах, как Приморского края, так и других регионов России.
 |
Несколько лет назад при общении на Форуме Русского анестезиологического сервера с коллегами-анестезиологами, получившими образование в России и работающими ныне в Германии, я услышал о понятии Fast-Track хирургии, определение которого вы видите на слайде. При этом речь шла о таких калечащих операциях, как, например, гемиколонэктомия, при которых пациенты на пятые-шестые сутки послеоперационного периода полностью себя обслуживали и выписывались из стационара. Нам показалось уместным применение этих принципов к операции кесарево сечение.
 |
На основании концепции Fast-Track хирургии в нашем родильном доме сформировался следующий подход к операции кесарево сечение, состоящий из адекватного обезболивания, раннего энтерального питания и ранней физической активизации. В определении Fast-Track хирургии есть еще и необходимость «малоинвазивной оперативной техники», но это абсолютная прерогатива коллег акушеров-гинекологов. Далее мне бы хотелось более подробно остановиться на каждом из этих пунктов.
 |
Разговор об адекватном обезболивании мне бы хотелось начать с напоминания о содержании 5 пункта статьи 30 «Основ Законодательства Российской Федерации об охране здоровья граждан», гласящего, что при обращении за медицинской помощью и ее получении пациент имеет право на «…. облегчение боли, связанной с заболеванием и/или медицинским вмешательством, доступными способами и средствами». Т.е. несоблюдение этого условия чревато судебными исками, при этом только сам пациент, в конечном итоге, может судить о качестве обезболивания.
 |
Адекватное обезболивание, по нашим представлениям, достигается назначением НСПВ препаратов с момента премедикации с последующим плановым назначением их в послеоперационном периоде, применением регионарной анестезии во всех случаях, когда это возможно, и индивидуальным подбором послеоперационной анальгезии в зависимости от оценки болевого синдрома по визуально-аналоговой шкале.
 |
Об эффективности назначения НСПВ препаратов с момента премедикации и улучшения при этом качества как интра-, так и послеоперационного обезболивания известно давно и, на мой взгляд, этот тезис в комментариях не нуждается. Мы работаем с ортофеном, назначая его в/м 75 мг за 30-60 мин. до операции и по 150 мг/сут в послеоперационном периоде.
 |
Преимущество регионарной анестезии в акушерстве также доказано, однако, по необъяснимым для меня причинам, в Приморском крае менее 10% кесаревых сечений выполняются под регионарным обезболиванием. Мы работаем со спинальной анестезией 10 лет, в нашем родильном доме в настоящий момент этот процент около 50. Исходя из опыта родильных домов и перинатальных центров других регионов России, где регионарная анестезия широко применяется, этот процент может и должен составлять не менее 80. Поэтому мне бы хотелось еще раз остановиться на тех причинах, которые, на наш взгляд, делают регионарную, а точнее, спинальную анестезию, анестезией выбора при операции кесарево сечение.
1. Роженица остается в сознании. Следовательно, исключается риск невозможности интубации или аспирационного пневмонита. Более того, многие роженицы желают оставаться в сознании во время кесарева сечения, чтобы присутствовать при рождении ребенка. Также исключается возможность неадекватной анальгезии, которая случается при проведении общей анестезии.
2. Превосходная анальгезия. Спинальная анестезия местными анестетиками (2 % раствор лидокаина или 0,5 % раствор бупивакаина) в комбинации с опиоидами обеспечивают отличную анальгезию для операции кесарево сечение.
3. Быстрое начало. В период подготовки к операции уже через две минуты может быть начата обработка брюшной стенки. В общем на выполнение спинальной анестезии затрачивается столько же времени, сколько и на общую анестезию.
4. Более легкое исполнение. Спинальная анестезия, по сравнению с эпидуральной или общей, является более легкой в исполнении благодаря возможности точно определить конечный ориентир введения иглы.
5. Отсутствие системной токсичности. Ввиду использования для спинальной анестезии небольшой дозы местного анестетика даже при ошибочном внутрисосудистом введении токсические реакции со стороны ЦНС и сердечно-сосудистой системы, как правило, не возникают.
6. Исключение раздражения верхних дыхательных путей. В связи с этим спинальная анестезия более предпочтительна, чем общая, у пациенток с патологией легких. Кроме этого исключаются рефлекторные реакции со стороны ССС, имеющие место при проведении общей анестезии.
7. Отсутствие угнетающего влияния на плод. При сравнении новорожденных, рожденных путем операции кесарево сечение выявлено, что неврологическая симптоматика у новорожденных после ЭТН выявляется в 2,5 чаще и носит более грубый характер по сравнению с новорожденными после СМА. Данное исследование было проведено в нашем родильном доме, результаты его публиковались на Сайте критической медицины Critical.ru
 |
Позвольте предложить вашему вниманию протокол выполнения спинальной анестезии, принятый в нашем родильном доме. Выполнение каждого пункта данного протокола считается у нас обязательным и, на наш взгляд, предупреждает развитие осложнений, возможных при данном методе обезболивания.
 |
Я хочу обратить ваше внимание на то, что в протоколе отсутствует преинфузия перед выполнением анестезии. На своем опыте мы убедились, что без преинфузии СМА протекает гемодинамически более стабильно, чем с ней. Данное наблюдение впоследствии было доказано в мультицентровом исследовании по безопасности СМА в акушерстве, организованном Республиканским перинатальным центром Карелии.
 |
Я думаю, что утверждение, что каждый человек индивидуален с точки зрения переносимости боли и потребности в обезболивании, не требует приведения каких-либо доказательств, это факт общеизвестный. Я также не сомневаюсь, что большинство анестезиологов, хирургов и акушеров-гинекологов знают, что такое визуально-аналоговая шкала оценки боли. Именно поэтому абсолютно не понятно, почему в отделениях, где лечатся послеоперационные больные, пренебрегают таким простым и эффективным способом оценки выраженности болевого синдрома.
 |
Я позволю себе напомнить, как выглядит расстановка баллов в этой шкале. По моему твердому убеждению, обезболивание только тогда может считаться адекватным, когда выраженность болевого синдрома не превышает двух баллов. И только на фоне такого обезболивания возможна ранняя физическая активизация после операции.
 |
Послеоперационную анальгезию можно разделить на две группы по контролю либо самим пациентом, либо медперсоналом. С первой группой все понятно, здесь анальгезия по определению будет адекватной, поскольку степень ее контролируется самим пациентом и от медперсонала требуется только правильное программирование оборудования. А вот во второй группе требуется умение пациента оценить свои болевые ощущения, чтобы медицинский персонал мог обеспечить качественное обезболивание. Ну и, конечно же, здесь наибольшее значение играет квалификация медперсонала и его желание обеспечить пациенту комфортный послеоперационный период. Вне всякого сомнения, ЭДА комбинацией опиатов и МА вне конкуренции по эффективности, однако у меня вызывает большие сомнения необходимость подвергать пациента дополнительной инвазивной процедуре только с целью послеоперационного обезболивания, как это делается в некоторых родильных домах, если этого можно достичь другими методами, используя оценку боли по ВАШ. И совершенно другое дело, если эпидуральный катетер устанавливался ранее для обезболивания родов, либо операции. В этом случае, конечно же, имеет смысл оставить его для проведения качественного послеоперационного обезболивания.
 |
Из всех приведенных на предыдущем слайде методах обезболивания мне бы хотелось отдельно остановиться на продленной контролируемой медперсоналом в/в анальгезии опиатами. Учитывая, что шприцевые дозаторы сейчас есть практически во всех лечебных учреждениях, совершенно непонятно, почему этим методом достижения адекватного послеоперационного обезболивания практически не пользуются, несмотря на его исключительную эффективность и управляемость. Мы работам с морфином, поэтому я привожу методику применения этого анальгетика. Хочу особенно обратить ваше внимание на последовательность мониторинга, поскольку именно так мы гарантированы от осложнений применения опиатов.
 |
Ранее энтеральное питание проводится по следующей схеме:
- Питье без ограничения сразу после операции
- Начало энтерального питания адаптированными смесями через 5-6 часов после операции
- В первый послеоперационный день – нулевой стол + адаптированные смеси и кисломолочные продукты
- Во второй послеоперационный день – первый стол
- В третий послеоперационный день – пятнадцатый стол
 |
Физическая активизация осуществляется следующим способом. В раннем послеоперационном периоде родильнице разрешатся поворачиваться в постели как только она становится в состоянии это делать, в среднем это через 1,5-2 часа независимо от вида анестезии. Через 6 часов родильнице разрешается сидеть на постели, вставать и ходить по палате. Инфузионная терапия в раннем послеоперационном периоде ограничивается до 800-1200 мл изотонических кристаллоидов. В первый послеоперационный день родильница становится полностью мобильна и способна к самообслуживанию и уходу за новорожденным. Заместительная инфузионная терапия с первого послеоперационного дня не проводится. Отсутствие необходимости проведении в/в инфузионной терапии вытекает из физиологии беременности.
 |
Для того, чтобы напомнить об особенностях инфузионной терапии в акушерской практике, я хочу обратиться к материалам, которые были представлены нашими коллегами из Екатеринбурга на V Всероссийской междисциплинарной научно-практической конференции «Критические состояния в акушерстве и неонатологии», которая прошла в этом году в г.Балашиха.
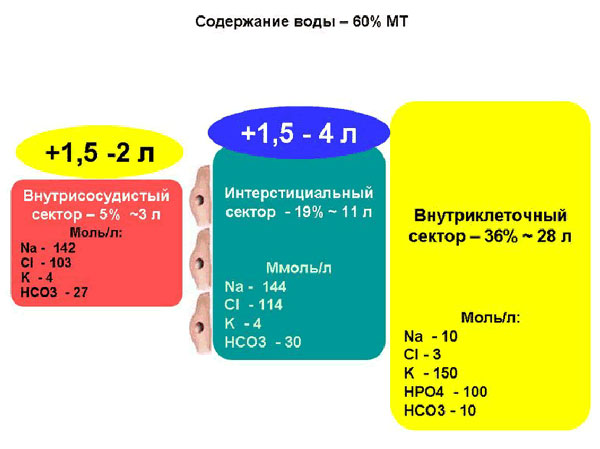 |
Общеизвестно, что ОЦК при физиологической беременности увеличивается в среднем на 1,5 – 2,0 л, а содержание воды в интерстициальном секторе – на 1,5 - 4 л. По нашим наблюдениям, основанным на динамике ЦВД и диуреза, наиболее активный возврат эндогенной жидкости в сосудистое русло начинается именно с первого послеоперационного дня, чем и обусловлено отсутствие необходимости в продолжении инфузионной терапии, тем более, что пациентку в энтеральном приеме жидкости никто не ограничивает.
 |
Еще в 2005 г. мы провели небольшое сравнительное исследование. В первой и второй группе было по 30 исследуемых, оперированных в плановом порядке по поводу рубца на матке и имевших неосложненый послеоперационный период. Оценивалась продолжительность и потребность в послеоперационном обезболивании, клиническое состояние пациентов при проведении различных вариантов инфузионной терапии и восстановление функции кишечника на фоне раннего энтерального питания и ранней физической активизации. Перед вами варианты послеоперационного обезболивания, применявшиеся в 1 и 2 группах.
 |
Потребность в обезболивании в первой группе отмечалась до 8 дней. Во второй группе анальгетики вводились максимум 4 дня. У 5 пациенток дополнение НСПВ препаратов опиатами не понадобилось, 23-м оказалось достаточно планового назначения 150 мг/сут ортофена с однократным в/м введением 10 мг морфина «по требованию», и только в двух случаях понадобилось проведение в/в контролируемой анальгезии морфином.
 |
На слайде вы видите объем и продолжительность инфузионной терапии, которая проводилась в послеоперационном периоде. По второй группе следует сделать замечание, что продолжительность и объем ИТ определяются тем, что в тот период в роддоме была принята методика проведения утеротонической терапии в/в капельным введением метилэргометрина, чем и определяется продолжительность ИТ. Объем же вводимых растворов с первых п/операционных суток составлял 200-400 мл/сут в зависимости от того, какие изотонические кристаллоиды были в наличии. Суточный диурез во второй группе оставался в пределах нормы, что подтверждает отсутствие необходимости в проведении нагрузочной инфузионной терапии при неосложненном течении послеоперационного периода при кесаревом сечении.
 |
Стоит обратить внимание на такой немаловажный момент, как хорошее восстановление функции кишечника на фоне раннего энтерального питания и ранней физической активизации без применения очистительных клизм и медикаментозной стимуляции кишечника.
 |
На основании всего выше изложенного мне кажется достаточно обоснованным вывод, что применение концепции Fast-Track хирургии для ведения послеоперационного периода после кесарева сечения позволяет сократить необоснованный расход медикаментов и расходного материала, уменьшить трудовые затраты медицинского персонала и обеспечить родильницам более быструю, естественную и качественную физическую и психологическую реабилитацию.
 |
Уважаемые коллеги! Я уверен, что в родильном доме наши пациенты должны выглядеть именно так! Благодарю за внимание!

