Anesthetic Pharmacology
Preclinical Pharmacology
Section Editor: Marcel E. Durieux
Clinical Pharmacology
Section Editor: Tony Gin
Morphine in Postoperative Patients:
Pharmacokinetics
and Pharmacodynamics of Metabolites
Jean Xavier Mazoit, MD, PhD
Karin Butscher, MD
Kamran Samii, MD
Морфин в лечении послеоперационных больных:
фармакокинетика и фармакодинамика метаболитов
Основа: в настоящее время применение морфина в послеоперационном периоде весьма различно. Авторы провели анализ фармакокинетики и фармакодинамики, учитывая потенциальный эффект двух основных метаболитов морфина.
Методы: 50 пациентов с умеренным или выраженным болевым синдромом получали морфин в/в с последующим в/м введением в послеоперационном периоде. Через определенные интервалы времени определялась концентрация морфина, морфин-6-глюкуронида (М-6-G), морфин-3-глюкуронида (M-3-G) и интенсивности болевого синдрома. Фармакокинетика и фармакодинамика определялась с помощью системы NONMEM.
Результаты: показатели фармакокинетики были предсказуемы. Клиренс M-6-G и M-3-G значительно снижался у пациентов с почечной недостаточностью. Фармакодинамика была менее предсказуемой, с важными особенностями. M-6-G был в 7,8 раз более сильным, чем морфин, но среднее время пиковой концентрации после болюсного введения составлял 4,25 часа у M-6-G и 0,33 часа у морфина. M-3- G обладает умеренным ингибирующим действием на анальгетическое действие морфина и M-6-G. Время пиковой концентрации M-3-G после болюсного введения морфина составило 10 часов.
Выводы: M-6-G является сильным опиоидным агонистом, а M-3-G умеренным антагонистом. Оба плохо выводятся у пациентов с почечной недостаточностью. Однако метаболизм морфина был быстрее по сравнению с переносом метаболитов через гематоэнцефалический барьер, что является процессом ограничения. Вследствие плохой анальгезии у некоторых пациентов на 1 и 2 сутки послеоперационного периода вследствие действия M-3-G, необходимо учитывать возможность перехода на другие молекулы.
Морфин является предпочтительным препаратом для обезболивания пациентов в раннем послеоперационном периоде. Однако существуют различные дозировки введения и до сих пор сложно подобрать дозу, которая необходима пациенту (1). Различие в потреблении морфина описано как у больных раком, так и у пациентов в послеоперационном периоде (1, 2). Фармакогеномные факторы лишь частично объясняют данное различие, а вот индивидуальные и биологические факторы еще предстоит выяснить.
Известны некоторые фармакокинетические факторы. Например, морфин-6-глюкуронида, активный метаболит морфина, плохо экскретируется у пациентов с почечной недостаточностью и усиливает продолжительность и силу действия морфина. В норме M-6-G плохо проникает через гематоэнцефалический барьер. Однако после приема одной дозы морфина per os пациентом, находящимся на гемодиализе, концентрация M-6-G в плазме значительно повышается, а уровень в ликворе через 24 часа превышает нормальную концентрацию в 15 раз (по сравнению с пациентами с нормальной функцией почек) (5). Также описывается разница в распространении метаболизма морфина (6, 7), но это преимущественно связано с генетическим полиморфизмом в UPD-глюкуронозилтрансферазы (UGT) 2 B 7 (8, 9). Клинически это проявляется только после приема per os , так как первоначально препарат проходит через печень.
Считается, что причиной вариабельности эффекта морфина являются фармакодинамические факторы. Интенсивность боли среди людей зависит от множества факторов, таких как размер операционной раны, восприятия боли человеком, предыдущий опыт наличия болевого синдрома (10, 11). Ответ организма на прием морфина крайне вариабелен. Однако такая вариабельность не объясняется полиморфизмом μ-опиоидных рецепторов (12, 13). Считается, что демографические факторы, такие как возраст (14) или пол (15) являются предрасполагающими факторами, которые определяют потребность в морфине. Однако не один из этих факторов не объясняет индивидуальную вариабельность необходимости в морфине. Более того эти данные крайне противоречивы (14, 15). И наконец, противоречивым остается возможный вклад морфина и его 6-глюкуронид метаболита в антиноцицепцию (16, 17).
Авторы разработали исследование с целью оценки роли морфина и его метаболитов в анальгезии, особенно заостряя внимание на фармакокинетике.
Методы
Пациенты и модель исследования
В исследовании принимали участие 50 пациентов (25 мужчин и 25 женщин). Протокол был одобрен комитетом по этике в ходе инициации исследования ( INSERM 91CN05, 1990). Все пациенты оформили письменное согласие. Вследствие необходимости в большом количестве времени на компьютерную обработку во время исследования, было невозможно закончить моделирующую часть исследования. Клиническая часть была опубликована в другом источнике (18). Исследование было разработано таким образом, что в него вошли 50 пациентов с умеренной и сильной болью для изучения фармакокинетического-фармакодинамического (PK-PD) сегмента. Никто из пациентов ранее не принимал морфин, и никто не был похож на наркомана. Когда пациенты поступали в восстановительную палату (PACU), то интенсивность болевого синдрома оценивалась с помощью визуальной аналоговой шкалы (VAS) – от 0 см = нет боли, до 10 см = самая сильная боль, которую можно представить. Если показатель VAS превышал 4 см , то пациенты включались в PK-PD сегмент исследования. Они получали морфин титрованием - болюсно по 3 мг каждые 10 минут. Титрование прекращалось при достижении показателей VAS менее 3 см . Если пациенты получали 0 или 3 мг морфина, то они исключались из исследования. Если они получали, как минимум, 6 мг морфина в/в при титровании, то они в случайном порядке распределялись на две группы: низкая или высокая поддерживающая доза в/м (18). Пациенты в группах высокой и низкой доз получали, 2/3 и 1/2 общей титрируемой дозе через 3 часа после титрования. В последующем 1/2 и 1/3 от титрируемой дозы каждые 4 часа.
Анализ крови и определение интенсивности боли
Через 10 минут после окончания в/в титрования, до первого в/м введения, через 30 минут после первого в/м введения и на следующее утро осуществлялся забор 5 мл крови в пробирки с гепарином (Vacutainer®). Дополнительные анализы выполнялись в случае клинической необходимости. В 6 случаях (3 мужчины и 3 женщины) это выполнялось более часто. Интенсивность боли отмечалась в PACU до каждой инъекции и во время забора крови. Когда пациенты переводились в палату, интенсивность боли также отмечалась до второго в/м введения и каждый раз при заборе крови.
Анализ проб
Кровь быстро центрифугировалась, и плазма хранилась при температуре –20С до проведения анализа. Для определения морфина и глюкуронидов в плазме использовалась хроматография высокого разрешения в комбинации с калорометрическим и флуорометрическим определением (19, 20). Ограничения для определения составляли 3,5, 10 и 22 nM для морфина, M-6-G и M-3-G соответственно.
Процедура моделирования
Фармакокинетика (концентрации в плазме морфина, M-6-G, M-3-G) и фармакодинамика (интенсивность боли) определялись отдельно с использованием нелинейного смешанного эффекта моделирования с помощью NONMEM, версия V, уровень 1.1 (21). Для обоих шагов использовалась процедура ADVAN5.
Логарифм концентрации против времени определялся с помощью метода оценки первой очереди с дополнительной моделью ошибки. Две различные ошибки использовались для счета наблюдаемой разницы в определении ошибок между морфином и глюкуронидами (посредством разницы между калориметрическим и флуорометрическим определением). The post hoc Bayesian parameter оценивает приобретенное в ходе фармакокинетического шага и используется для определения фармакодинамической информации. Авторы использовали метод условной оценки с взаимодействием для определения интенсивности боли против данных времени с дополнительной моделью ошибки.
Фармакокинетическая модель была заимствована у Lotsch и коллег (22) (рисунок 1). Так как в ходе исследования не брались анализы мочи, и так как расчет уровня метаболической структуры глюкуронидов требует обычного объема распределения, авторы зафиксировали клиренс неглюкуронидов и назначили обычный объем распределения для M-6-G и M-3- G . Клиренс неглюкуронидов (прямой неизмененный мочевой клиренс и метаболический клиренс неглюкуронидов) был зафиксирован на значение 26,0+/-12,0 л/час, используя данные Hasselstrom & Sawe (23). Данный объем это результат добавления мочевого клиренса 9,0+/-2,0 л/час и немочевого, неметаболического клиренса 17,2+/-10,9 л/час, учитывая произвольную корреляцию в 50% между двумя величинами. Фармакодинамическая модель являлась E max моделью (24). Для PK-PD в модель успешно ввели ковариацию и протестировали по сравнению с полной моделью без ковариаций. К ковариациям, которые тестировались для фармакокинетики, относились масса тела, поверхность тела, возраст, пол и клиренс креатинина (CRCL). Они определялись по формуле Cockcroft - Gault (25). Для фармакодинамики к ковариациям относились пол и возраст. Ингибирующий эффект M-3-G определялся по формуле Gaddum :
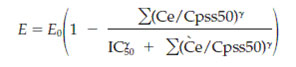
где E0 базальная интенсивность боли (VAS0), ∑( Ce /Cpss50)γ сумма концентраций морфина и M-6-G в их соответствующем эффекте отделения (Cpss 50 нормализует концентрации, концентрация молекулы в центральном отделении ведет к половине максимального эффекта в устойчивом состоянии), γ коэффициент Хилла. IC50 = 1 + (CeM3G/Cpss50M3G)γ , где CeM3G концентрация M-3-G в центральной отделении ведет к половине максимального эффекта в устойчивом состоянии (рис. 1 и дополнение 1, доступны он-лайн на www.anesthesia-analgesia.org). В случае отсутствия ингибирования формула упрощалась до
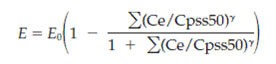
Также определялось время, варьирующее базальную интенсивность боли. Для определения вариабельности структурных параметров использовалась непараметрическая Bootstrap. Однако, вследствие большой компьютерной напряженности, было сделано лишь 400 копий для кинетики и 160 для динамики.
Начальная интенсивность боли при поступлении в PACU, и титрируемая доза морфина определялась между полами и методами хирургического вмешательства с помощью тестов Mann - Whitney & Kruskall - Wallis . Различные модели тестировались с использованием log - likelihood ratio test для модели с группировкой, учитывая принцип экономии. Вследствие асимптотической природы конвергенции и тестов, консервативная величина в 0,01 была выбрана как статистически достоверная.
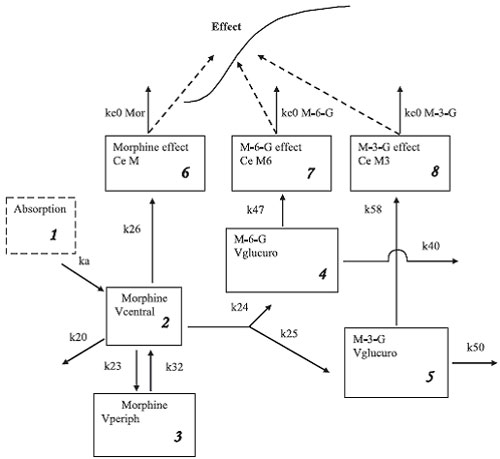 |
| Рисунок 1. Фармакокинетическая-фармакодинамическая модель. Фармакокинетика описана как модель первого порядка у млекопитающих с пятью отделениями (отделения 1-5). Фармакодинамическая модель это расширение фармакокинетической модели с тремя отделениями эффекта, привязанных к концентрациям морфина, морфин-6-глюкуронида и морфин-3-глюкуронида (отделения 6, 7, 8 соответственно). k a это константа абсорбции уровня после в/м введения. k 24 и k 25 константы уровня метаболизма морфина в глюкурониды. Элиминация из каждого действующего отделения осуществляется через ke 0. Константа описывает статистически временную дистанцию между центральными и действующими отделениями. Так как концентрация в отделениях действия известна как scaling factor (масштабный коэффициент), авторы использовали Cpss50, статистическую концентрацию в центральном отделении, которая ведет к половине максимального действия, как нормализующий фактор: Cp/Cpss50 (methods & ref. 24). Окончательный эффект возникает при добавлении эффекта каждого препарата (морфин и агонисты M-6-G, антагонисты M-3-G) (Methods and Appendix, available online at http://www.anesthesia-analgesia.org/) |
Результаты
Всего было определено 225, 226 и 216 временных концентраций для морфина, M-6-G, M-3-G соответственно (рис. 2). У 50 пациентов определено 450 показателей VAS . Демографические данные отображены в таблице 1. Авторы не исследовали значимую разницу в интенсивности первоначальной боли (VAS0) или титрируемой дозы между полами и методами операции. Авторы также не смогли получить значимое различие между возрастом пациентов и видом операции. Несмотря на ограниченное количество опорных точек (1,5 и 1,8 точки на субъект на структурный параметр в среднем для модели PK и PD соответственно), подгонка ( fitting ) была адекватной (рис. 3).
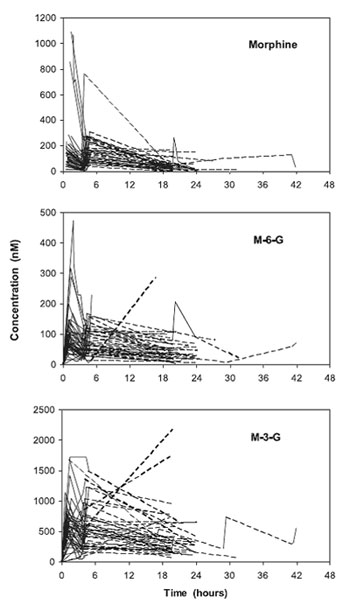 |
| Рисунок 2. Определяемые концентрации морфина, M-6-G и M-3-G у каждого пациента. |
Таблица 1. Демографические показатели у 50 пациентов.
| Операция | Пол (м/ж) | Возраст (годы) | Вес (кг) | CRCL (мл/мин) | VAS (см) | Титруемая доза (мг) |
| Брюшная полость | 6/6 | 54±19 | 75±14 | 81±27 | 10 (4,5-10) | 15 (9-30) |
| Лодыжка | 2/1 | 46±8 | 70±20 | 93±12 | 9 (8-10) | 18 (9-21) |
| Плечо | 5/4 | 57±8 | 69±20 | 84±32 | 7,5 (6-10) | 15 (9-27) |
| Колено | 6/3 | 52±22 | 69±17 | 87±32 | 10 (8-10) | 21 (9-30) |
| Бедро | 3/7 | 52±15 | 64±14 | 81±26 | 7,5 (7-10) | 10,5 (6-30) |
| Позвоночник (дискэктомия) | 3/5 | 41±4 | 68±13 | 91±14 | 8 (7-10) | 12 (9-18) |
| Всего | 25/25 | 51±15 | 69±17 | 85±26 | 8,5 (4,5-10) | 12 (3-30) |
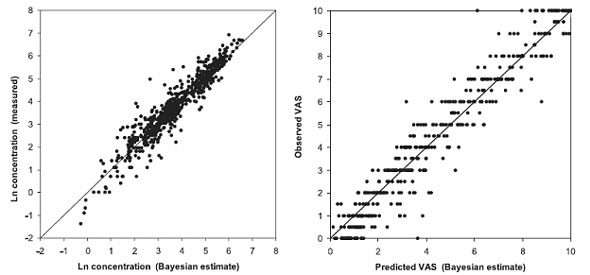 |
| Рисунок 3. Адекватность подгонки (показателей фармакокинетики (PK) – концентрация-время (слева) и фармакодинамика (PD) визуальная аналоговая шкала (VAS)-время (справа)). PK была моделирована как логарифм концентрации с методом первого порядка, а PD моделирована с условным методом. |
Фармакокинетика
Слияние уровня клиренса креатинина и модели значительно улучшило подгонку (целевая функция уменьшилась с 124,8 до 92,05). Клиренс M-6-G и M-3-G из морфина составил 13,7 и 62,3 л/час, соответственно. Уровень клиренса M-6-G составил 12,7, 6,36 и 3,18 л/час у пациентов с CRCL 120, 60, 30 мл/час соответственно. Уровень клиренса M-3-G составил 6,85, 3,43, 1,71 л/час у пациентов с CRCL 120, 60, 30 мл/мин, соответственно (таблица 2). Другие ковариации не вошли в модель: масса тела, поверхность тела, возраст и пол не влияли на клиренс и объем.
Таблица 2. Параметры фармакокинетики и фармакодинамики.
| Структурный параметр (значение популяции) | 95% доверительный интервал (Bootstrap) | |
| Фармакокинетика | ||
| ka (h-1) | 1,03 (23%) | 0,832-2,3 |
| CL (л/час) | 102 (13%) | 86,2-129 |
| CLNON CLUCURO (л/час) | 26,0 (фиксировано) | (фиксировано) |
| CLPERIPH (л/час) | 101 (21%) | 67,8-170 |
| Vc (л) | 14,2 (26%) | 8,83-40,3 |
| VPERIPH (л) | 258 (18%) | 231-759 |
| VGLUCURO (л) | 20,8 (17%) | 10,4-23,9* |
| QR | 4,54 (16%) | 4,01-5,51 |
| CLM-6-G (л/час) | уклон 0,106 (18%)† | 0,069-0,134 |
| CLM-6-G (л/час) | уклон 0,0571 (22%)† | 0,0462-0,0683 |
| Фармакодинамика | ||
| Ke0MOR (h-1) | 0,418 (32%) T1/2 ke0m = 1,66 час | 0,321-0,623 |
| Ke0M-6-G (h-1 ) | 0,240 (40%) T1/2 ke0M-6-G = 2,89 ч | 0,193-0,337 |
| Ke0M-6-G (h-1 ) | 0,240 (40%) T1/2 ke0M-6-G = 2,89 ч | T1/2 ke0M-6-G = 2,89 ч |
| Cpss50 MOR (nM) | 124 (20%) | 105-168 |
| Cpss50 M-6-G (nM) | 12,8 (29%) | 10,6-17,8 |
| Cpss50 M-3-G (nM)‡ | 880 (84%) | 610-2880 |
| Структурные параметры – значение средней популяции с коэффициентом вариации Данные в скобках – проценты MOR – морфин, M-6-G – морфин-6-глюкуронид, M-3-G – морфин-3-глюкуронид, k a – константа уровня абсорбции после в/м введения, CL – общий клиренс ( MOR ), CLNON CLUCURO – клиренс неглюкуронидов (MOR), CLPERIPH – клиренс внутри отделений (MOR), Vc – объем центральных отделений, VPERIPH – объем периферических отделений ( MOR ), VGLUCURO – объем распределения (M-6-G и M-3-G), QR – уровень метаболической формации (M-3-G/M-6-G); CLM-6-G and CLM-3-G _ клиренс элиминации ( M -6- G and M -3- G , соответственно), Ke 0 – константа уровня перехода из центрального в периферическое отделение, Cpss 50 – концентрация в центральном отделении ведет к половине |
Фармакодинамика
Модель с ингибированием M-3-G значительно улучшила подгонку (целевая функция уменьшилась с 856,1 до 749,9 когда к морфину было добавлено влияние M -6- G и до 698,1 когда к влиянию морфина и M-6-G было добавлено влияние M-3-G). M -3- G Cpss 50 (концентрация в центральном отделе ведет к уменьшению эффекта M-6-G и морфина на половину) составил 880 nM (таблица 2). Концентрация M-3-G в плазме была зафиксирована выше этого значения, как минимум 1 раз, у 13 из 50 пациентов (рис. 2). Не одна из ковариаций (пол, возраст, CRCL) не вошла в модель. Объединение показателей VAS 0 не улучшило подгонку. Невозможно было дифференцировать два метаболита для постоянной уровня переноса из центрального отделения до отделения эффекта (ke 0). Время полураспада (T1/2 ke0) M-6-G и M-3-G составило 2,89 часа, по сравнению с 1,66 часа у морфина. M-6- G Cpss 50 был в 9,7 раз ниже, чем Cpss 50 морфина (M-6-G был в 10 раз сильнее, чем морфин, но со значительной разницей между временем наступления эффекта). Параметры вариабельности для морфина и M-6-G Cpss50 были неопределяемыми. Коэффициент Хилла значительно не отличался от 2. Значительная отрицательная корреляция наблюдалась между показателями VAS и уровнем концентрации M-6-G/M-3-G через 4 часа после приема препарата (рис. 4).
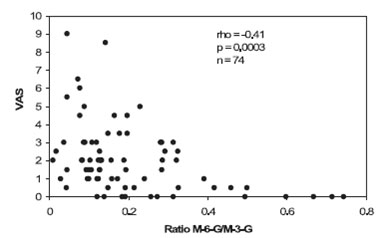 |
| Рисунок 4. Корреляция между уровнем концентрации M-6-G/M-3-G и VAS (данные через 4 часа после начала введения морфина, при окончании исследования). Несмотря на предполагаемую важность во временном промежутке между концентрацией метаболита плазме и его эффекта, ясно, что спустя несколько часов уровень коррелирует с подавлением боли. |
Обсуждение
Основным выводом, полученным в ходе изучения PK-PD морфина в послеоперацонном периоде, является то, что антиноцицептивное действие определяется его собственными метаболитами. У таких пациентов с умеренным и тяжелым болевым синдромом ни возраст, ни вес, ни пол не влияют на кинетику или действие морфина. Почечная недостаточность приводит к снижению клиренса глюкуронидных метаболитов, тем самым усиливая их действие на морфин, как минимум, в первые часы после введения. M-6-G действует как агонист, а M-3-G как антагонист.
Кинетика морфина, которая была рассчитана по смешанному эффекту регрессии, схожа с описанной в литературе, либо на добровольцах (22, 23), либо на пациентах (4, 6). Фиксируя клиренс неглюкуронидов морфина, авторы смогли рассчитать метаболизм и клиренс M-6-G и M-3-G . Эти данные схожи с теми, которые уже опубликованы в литературе. Они были рассчитаны либо после биотрансформации морфина, либо после прямого применения метаболитов добровольцам или пациентам (4, 22, 23, 26). Показатели метаболического клиренса M-6-G и M-3-G из морфина были близки к ранее опубликованным (13,7 и 62,3 л/час, соответственно) (23). Как уже говорилось, клиренс обоих метаболитов снижен у пациентов с почечной недостаточностью. При сравнении с пациентами с идеальной функцией почек (CRCL = 120 мл/час), у пациентов с CRCL около 30 мл/час клиренс был ниже в 4 раза. Так как М-6-G в 10 раз сильнее морфина, пациенты с почечной недостаточностью входят в группу высокого риска по развитию дыхательной недостаточности. Риск является отсроченным, так как глюкурониды морфина проникают через гематоэнцефалический барьер с некоторой задержкой. Период полураспада для обоих метаболитов составил 2,89 часа, для морфина 1,66 часа. Однако время между инъекцией и действием должно учитываться как процесс биотрансформации (рис. 5).
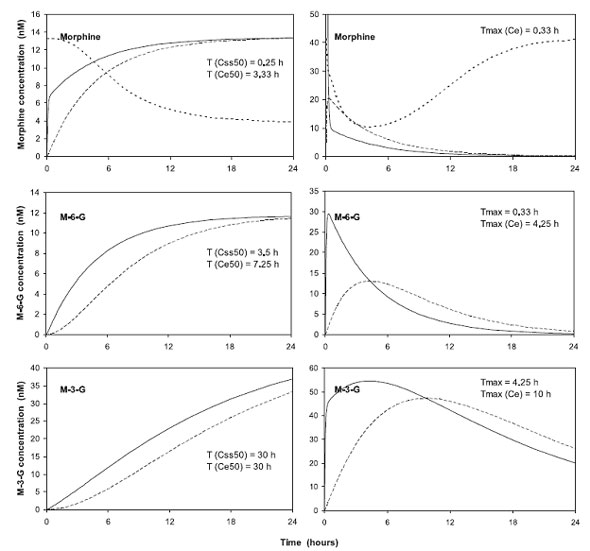 |
| Рисунок 5. Симуляция концентраций морфина (на верху), M-6-G (середина), M-3-G (внизу) после постоянной инфузии произвольной дозы в 10 мг морфина в течение 1 дня (0,42 мг/час) (слева) или после единичной болюсной дозы 10 мг (справа). Для симуляции использовались типичные средние параметры. Непрерывная линия обозначает концентрацию в центральном отделении (кровь), а пунктирная линия в отделении действия. T (Css50) и T (Ce50) – это время половины статистической концентрации в центральном отделении и отделении действия, соответственно. TMAX и ТMAX(Ce) – это время пиковых концентраций в отделениях (центральное и действие, соответственно). В верхних квадратах (морфин) представлены показатели VAS – толстая пунктирная линия. После в/в введения единичной болюсной дозы наблюдается быстрое снижение интенсивности болевого синдрома с последующим замедлением снижения (максимум через 4 часа). |
Фармакодинамические параметры указывают на важную вариабельность между составляющими, которая отражает обычную вариабельность в интенсивности боли между пациентами и дозой морфина, необходимой для облегчения боли (таблица 2).
Слепые эксперименты показали, что морфин и M -6- G имеют сродство с обоими µ рецепторами (27). Поведенческие исследования на грызунах и исследования на добровольцах и пациентах показали большую разницу, в зависимости от условий экспериментов (16, 17, 27). У животных и пациентов, больных раком, которые получают M-6-G на протяжении длительного периода времени, M-6-G в 2-100 раз сильнее, чем морфин, а в случаях непродолжительного применения обеспечивают лишь слабый анальгетический эффект. У пациентов, которые получают M-6-G в качестве послеоперационного анальгетика, наблюдается недостаточный эффект при введении единичной дозы в 0,1 мг/кг (17) в конце операции. Тот же эффект наблюдается если морфин вводится в послеоперационном периоде самим пациентом в соотношении 1:1 (28). Морфин сильнее M-6-G только в первые 4 часа лечения. У наших пациентов, когда показатели VAS наносились на график в сравнении с уровнем концентрации M-6-G/M-3-G на 4 час после приема, наблюдалась значительная отрицательная корреляция (рис. 3). Это еще одна дополнительная причина думать о том, чтоM-6-G является важным фактором анальгезии. У пациентов с тяжелой послеоперационной болью, M-6-G был в 10 раз сильнее морфина (таблица 2), однако отмечалась важная задержка между введением и началом действия. Это объясняет тот факт, почему эффект M-6-G проявляется лишь через несколько часов после введения морфина (рис. 5). Это также объясняет отсроченный эффект морфина при приеме per os в послеоперационном периоде (29). Эффект развивается через 12 часов после приема (29).
После парентерального введения метаболизм осуществляется быстрее, по сравнению со скоростью проникновения через гематоэнцефалический барьер. Хотя медленное проникновение морфина было описано и раньше (4, 5), к данному феномену было обращено немного внимания. Переход через гематоэнцефалический барьер является ограниченным процессом, что может объяснять задержку развития дыхательной недостаточности на фоне почечной недостаточности и тот факт, что, несмотря на множественные исследования, эффект M-6-G остается весьма спорным.
Не возраст, не пол, не вес не улучшали фармакодинамическую модель. Однако это может объяснять небольшое количество пациентов, которые принимали участие в исследовании. Влияние возраст на морфин остается спорным вопросом. Macintyre & Jarvis (14) показали, что пожилым пациентам требуется меньше морфина, чем молодым в течение первых суток послеоперационного периода. Другие авторы не нашли корреляции между возрастом и дозой морфина, которую применяют в PACU (15, 30, 31), однако все они отмечают, что пожилым пациентам требуется меньше морфина при переводе в палату. Авторы данной статьи не смогли доказать данный факт. Также они не нашли влияние пола на интенсивность болевого синдрома или на потребность в морфине. Однако в литературе имеются данные о половом влиянии на интенсивность болевого синдрома и действие опиоидов (15, 32-34).
M-3-G является основным метаболитом морфина. Обычно его рассматривают как неактивную субстанцию, хотя исследования на животных и человеке показали его антианальгетический эффект и активность молекулы (35, 36). M-3-G вводился добровольцам лишь в двух исследованиях (37, 38). Особых выводов сделать нельзя, так как за исследуемыми наблюдали лишь 2 часа. Авторы показали, что M-3-G обладает антиноцицептивным эффектом. Это влияние умеренное и достигает максимума лишь через 9-18 часов после начала анальгезии (рис. 5). Однако это может быть важным в случаях с пациентами, которые недостаточно обезболены при переводе в палату. В таких случаях целесообразно применять другие препараты, например, фентанил.
В заключении можно сказать, что действие морфина, который используется в качестве анальгетика, определяется его собственными метаболитами. M-6-G является опиоидным агонистом, а M-3-G антагонистом. Оба плохо экскретируются у пациентов с почечной недостаточностью. Вследствие длительного промежутка времени от момента введения до начала действия, влияние метаболитов начинает проявляться с важной отсрочкой. С целью предотвращения дыхательной недостаточности у пациентов с почечной недостаточностью целесообразно применение других опиоидов, например, фентанила. Вследствие того, что может наблюдаться плохой анальгетический эффект из-за аккумуляции M-3-G через 1-2 дня после начала терапии, необходимо также предусмотреть переход на другие опиоиды, если существует подозрение на данных механизм недостаточности анальгезии.
Список литературы
- Aubrun F, Langeron O, Quesnel C, Coriat P, Riou B. Relationships between measurement of pain using visual analog score and morphine requirements during postoperative intravenous morphine titration. Anesthesiology 2003;98:1415–21.
- Hanks GW, Reid C. Contribution to variability in response to opioids. Support Care Cancer 2005;13:145–52.
- Osborne RJ, Joel SP, Slevin ML. Morphine intoxication in renal failure: the role of morphine-6-glucuronide. BMJ 1986;292:1548–9.
- Meineke I, Freudenthaler S, Hofmann U, Schaeffeler E, Mikus G, Schwab M, Prange HW, Gleiter CH, Brockmoller J. Pharmacokinetic modelling of morphine, morphine-3-glucuronide and morphine-6-glucuronide in plasma and cerebrospinal fluid of neurosurgical patients after short-term infusion of morphine. Br J Clin Pharmacol 2002;54:592– 603.
- D'Honneur G, Gilton A, Sandouk P, Scherrmann JM, Duvaldestin P. Plasma and cerebrospinal fluid concentrations of morphine and morphine glucuronides after oral morphine. The influence of renal failure. Anesthesiology 1994;81:87–93.
- Mazoit JX, Sandouk P, Scherrmann JM, Roche A. Extrahepatic metabolism of morphine occurs in humans. Clin Pharmacol Ther 1990;48:613– 8.
- Faura CC, Collins SL, Moore RA, McQuay HJ. Systematic review of factors affecting the ratios of morphine and its major metabolites. Pain 1998;74:43–53.
- Holthe M, Klepstad P, Zahlsen K, Borchgrevink PC, Hagen L, Dale O, Kaasa S, Krokan HE, Skorpen F. Morphine glucuronideto-morphine plasma ratios are unaffected by the UGT2B7 H268Y and UGT1A1*28 polymorphisms in cancer patients on chronic morphine therapy. Eur J Clin Pharmacol 2002;58:353– 6.
- Duguay Y, Baar C, Skorpen F, Guillemette C. A novel functional polymorphism in the uridine diphosphateglucuronosyltransferase 2B7 promoter with significant impact on promoter activity. Clin Pharmacol Ther 2004;75: 223–33.
- Mogil JS. The genetic mediation of individual differences in sensitivity to pain and its inhibition. Proc Natl Acad Sci USA 1999;96:7744 –51.
- Brennum J, Kjeldsen M, Jensen K, Jensen TS. Measurements of human pressure-pain thresholds on fingers and toes. Pain 1989;38:211–7.
- Lotsch J, Geisslinger G. Are mu-opioid receptor polymorphisms important for clinical opioid therapy? Trends Mol Med 2005;11:82–9.
- Romberg RR, Olofsen E, Bijl H, Taschner PE, Teppema LJ, Sarton EY, van Kleef JW, Dahan A. Polymorphism of mu-opioid receptor gene (OPRM1:c. 118A_G) does not protect against opioid-induced respiratory depression despite reduced analgesic response. Anesthesiology 2005;102:522–30.
- Macintyre PE, Jarvis DA. Age is the best predictor of postoperative morphine requirements. Pain 1996;64:357– 64.
- Aubrun F, Salvi N, Coriat P, Riou B. Sex- and Age-related differences in morphine requirements for postoperative pain relief. Anesthesiology 2005;103:156–60.
- Portenoy RK, Thaler HT, Inturrisi CE, Friedlander-Klar H, Foley KM. The metabolite morphine-6-glucuronide contributes to the analgesia produced by morphine infusion in patients with pain and normal renal function. Clin Pharmacol Ther 1992;51:422–31.
- Motamed C, Mazoit X, Ghanouchi K, Guirimand F, Abhay K, Lieutaud T, Bensaid S, Fernandez C, Duvaldestin P. Preemptive intravenous morphine-6-glucuronide is ineffective for postoperative pain relief. Anesthesiology 2000;92:355– 60.
- Butscher K, Mazoit JX, Samii K. Can immediate opioid requirements in the post-anaesthesia care unit be used to determine analgesic requirements on the ward? Can J Anaesth 1995;42: 461–6.
- Joel SP, Osborne RJ, Slevin ML. An improved method for the simultaneous determination of morphine and its principal glucuronide metabolites. J Chromatogr 1988;430:394 –9.
- Milne RW, Nation RL, Reynolds GD, Somogyi AA, van Crugten JT. High-performance liquid chromatographic determination of morphine and its 3- and 6-gucuronide metabolites: improvements to the method and application to stability studies. J Chromatogr 1991;565:4757– 64.
- Sheiner LB, Beal SL, Boeckmann AJ. NONMEM Project Group, University of California at San Francisco , San Francisco , CA , 1990.
- Lotsch J, Skarke C, Schmidt H, Liefhold J, Geisslinger G. Pharmacokinetic modeling to predict morphine and morphine-6-glucuronide plasma concentrations in healthy young volunteers. Clin Pharmacol Ther 2002;72:151– 62.
- Hasselstro?m J, Sa?we J. Morphine pharmacokinetics and metabolism in humans. Enterohepatic cycling and relative contribution of metabolites to active opioid concentrations. Clin Pharmacokinet 1993;24:344 –54.
- Holford NH, Sheiner LB. Understanding the dose-effect relationship: clinical application of pharmacokinetic-pharmacodynamic models. Clin Pharmacokinet 1981;6:429–53.
- Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31– 41.
- Romberg R, Olofsen E, Sarton E, den Hartigh J, Taschner PE, Dahan A. Pharmacokinetic-pharmacodynamic modeling of morphine-6-glucuronide-induced analgesia in healthy volunteers: absence of sex differences. Anesthesiology 2004;100:120–33.
- Lotsch J. Opioid metabolites. J Pain Symptom Manage 2005; 29:S10 –S24.
- Hanna MH, Elliott KM, Fung M. Randomized, double-blind study of the analgesic efficacy of morphine-6-glucuronide versus morphine sulfate for postoperative pain in major surgery. Anesthesiology 2005;102:815–21.
- Manoir BD, Bourget P, Langlois M, Szekely B, Fischler M, Chauvin M, Paci A, Fletcher D. Evaluation of the pharmacokinetic profile and analgesic efficacy of oral morphine after total hip arthroplasty. Eur J Anaesthesiol 2006;23:748 –54.
- Gagliese L, Weizblit N, Ellis W, Chan VW. The measurement of postoperative pain: a comparison of intensity scales in younger and older surgical patients. Pain 2005;117:412–20.
- Aubrun F, Bunge D, Langeron O, Saillant G, Coriat P, Riou B. Postoperative morphine consumption in the elderly patient. Anesthesiology 2003;99:160 –5.
- Bradbury J. Why do men and women feel and react to pain differently? Research suggests men and women may not process pain signals the same way. Lancet 2003;361:2052–3.
- Craft RM. Sex differences in opioid analgesia: “from mouse to man”. Clin J Pain 2003;19:175– 86.
- Sarton E, Olofsen E, Romberg R, den Hartigh J, Kest B, Nieuwenhuijs D, Burm A, Teppema L, Dahan A. Sex differences in morphine analgesia: an experimental study in healthy volunteers. Anesthesiology 2000;93:1245–54.
- Andersen G, Christrup L, Sjogren P. Relationships among morphine metabolism, pain and side effects during long-term treatment: an update. J Pain Symptom Manage 2003;25:74 –91.
- Skarke C, Geisslinger G, Lotsch J. Is morphine-3-glucuronide of therapeutic relevance? Pain 2005;116:177– 80.
- Pennson RT, Joel SP, Bakhshi K, Clark SJ, Langford RM, Slevin ML. Randomized placebo-controlled trial of the activity of the morphine glucuronides. Clin Pharmacol Ther 2000;68:667–76.
- Penson RT, Joel SP, Clark S, Gloyne A, Slevin ML. Limited phase I study of morphine-3-glucuronide. J Pharm Sci 2001; 90:1810–6

