European Journal of Anaesthesiology 2006; 23: 990-998
The «propofol infusion syndrome»:
the facts, their interpretation and implications for patient care
K. Ahlen, C. J. Buckley, D. B. Goodale, A. H. Pulsford
«Синдром инфузии пропофола»:
факты, их интерпретация и влияние на ведение больного
Резюме
Astra Zeneca (производитель DiprivanTM ) представляет обзор так называемого «синдрома инфузии пропофола», освещая трудности анализа неполной имеющейся информации. Представлены и обсуждаются теории возникновения «синдрома»; которые включают митохондриальную токсичность, повреждение на уровне митохондрий, нарушение тканевой оксигенации и дефицит углеводов. Представлен и обсуждается обзор опубликованных и конфиденциальных данных; сделан вывод, что основными факторами риска развития «синдрома» являются недостаточная доставка кислорода, сепсис, выраженные церебральные нарушения и введение высоких доз пропофола. В некоторых сообщениях отмечена высокая липемия, которая вероятно была следствием недостаточной регуляции печеночных липидов, что в свою очередь, возможно, было связано с недостаточной оксигенацией и/или с недостатком глюкозы. В ряде случаев повышенная липемия была первым признаком развития «синдрома инфузии пропофола», этот признак не следует оценивать как доброкачественный. Липемия может приводить к секвестрации пропофола в липидной фазе, приводя к снижению уровней свободного пропофола и к явной нечувствительности к препарату. В заключение, Astra Zeneca рекомендует адекватную поддержку гемодинамики и обеспечение доставки кислорода, адекватное поступление глюкозы и соблюдение рекомендованных режимов дозирования пропофола совместно с активным ведением липемии в целях предотвращения и лечения «синдрома инфузии пропофола».
История вопроса
Более 10 лет назад появилось небольшое число публикаций о «необъяснимых» и «неожиданных» случаях смерти у пациентов педиатрических отделений интенсивной терапии, которым проводилась седация пропофолом [1, 2]. Эти сообщения главным образом упоминали детей в возрасте младше 4 лет с инфекциями верхних дыхательных путей, получавших высокие и часто дополнительные дозы пропофола. У детей развивался «синдром», характеризующийся несколькими или всеми признаками, представленными в таблице 1.
Таблица 1. Признаки неблагоприятных эффектов в сообщениях.
| Метаболический ацидоз |
| Рефрактерная сердечная недостаточность |
| Прогрессирующая и рефрактерная брадикардия |
| Лихорадка |
| Липемия |
| Признаки мышечного повреждения: повышение креатин фосфокиназы (КФК), миоглобулинемия и/или миоглобинурия |
В 1992 году Управление по контролю за продуктами и лекарствами США ( FDA ) провело обзор этих сообщений и сделало вывод, что у детей пропофол имеет «не-идентифицируемую связь с неблагоприятными эффектами на сердце», но необходимо проведение дальнейших исследований [3], так как ограниченная информация в сообщениях по этим случаям не дает четкого понимания причинной связи. В 1994 году производитель добавил предупреждение в аннотацию к препарату DiprivanTM , которая заключалась в следующем:
«...несмотря на то, что причинное взаимоотношение не было установлено, серьезные неблагоприятные последствия (включая смертельные исходы) отмечались в эпизодических сообщениях нелицензированного ( ICU ) применения; эти случаи встречались более часто у детей с инфекциями дыхательных путей, получавшими дозы препарата, превышающие дозы, рекомендуемые для взрослых».
В 1998 году Bray провел анализ 18 случаев с несовместимым сочетанием клинических признаков, которые он рассматривал как «синдром». Он предложил название и выдвинул предположение, что мышечное повреждение следует считать критерием диагностики [4].
Позднее, Hatch предложил исследование пропофола для педиатрической седации в ICU , но сделал отступление, что «дети с текущим сепсисом или исходно с проблемами дыхания по возможности должны быть исключены» из таких исследований. Кроме того «скорости инфузии должны соответствовать скорости, используемой у взрослых, даже если другие препараты будут использованы для обеспечения адекватной седации» [5].
Серьезные неблагоприятные исходы были сообщены у больных с крупом и эпиглотитом; несмотря на то, что обсуждение применения DiprivanTM для седации у этих больных все еще продолжалось, был разработан протокол для исследования 0859 IL -0068. Дети с указанными патологическими состояниями были исключены из клинического исследования как «мера предосторожности». Таким образом, нет информации относительно безопасности DiprivanTM для седации у этих детей в ICU , а производитель впоследствии считал противопоказанием применение пропофола у больных в детских ICU , что было отмечено в аннотации к препарату:
« DiprivanTM противопоказан для проведения седации у детей всех возрастных групп с крупом и эпиглотитом, получающих интенсивную терапию».
В 2001 году Cremer с коллегами [6] опубликовали ретроспективное исследование семи взрослых пациентов с травмами головы со смертельными исходами после появления клинических признаков схожих с признаками, описанными Bray . Авторы представили критерии диагностики «синдрома инфузии пропофола взрослых» (показаны в таблице 2). С тех пор было опубликовано небольшое число сообщений, подобных сообщению Cremer с коллегами, о больных с тяжелыми травмами [7, 8]. Производитель регистрировал дополнительные сообщения подобных случаев в базе данных фармакологического надзора как часть продолжающегося фармакологического надзора за препаратом.
Таблица 2. Критерии, предложенные для диагностики
«синдрома инфузии пропофола взрослых».
| Прогрессирующая миокардиальная недостаточность с нарушениями ритма (сердечный выброс зависит от тахикардии) |
| Два из следующих признака: метаболический ацидоз, гиперкалиемия и признаки разрушения мышечных клеток, не ограниченных только фазой реанимации |
| Отсутствие известных причин миокардиальной недостаточности |
| Нет доказательств в пользу сепсиса, полиорганной недостаточности, нет известных причин гиперкалиемии, метаболического ацидоза или рабдомиолиза |
| Возраст 18-55 лет |
Пациентов, у которых был описан этот синдром, грубо можно разделить на три группы: ( i ) пациенты с тяжелыми множественными ранениями, ( ii ) пациенты, получающие лечение по поводу эпилептического статуса или получающие детоксикацию от опиатов, или ( iii ) критические больные с сепсисом.
Резюме – Сообщения представили историю случаев неблагоприятных последствий, произошедших у тяжелых больных на фоне седации пропофолом, часто в «высоких» дозах. В большинстве сообщений у детей сепсис (обычно респираторного генеза) был показанием для проведения терапии в условиях ICU . У взрослых и некоторых детей повышенное внутричерепное давление рефрактерное к лечению, или другие состояния (как описано выше), послужили причиной для проведения интенсивной терапии в ICU . Было описано ухудшение до метаболического ацидоза и органной недостаточности.
Исследования седации в детских ICU
В 2002 году Cornfield с коллегами сообщили об исследовании пропофола у 109 детей. Удовлетворительная седация была получена при применении доз до 50 мкг/кг/мин (3 мг/кг/час) плюс болюсные дозы 1 мг/кг не чаще чем через 1 час по потребности. Здесь не было выявлено метаболических или гемодинамических нарушений [9].
В ретроспективном исследовании Pepperman и Macrae у 106 больных, получавших пропофол, не было выявлено необъяснимого метаболического ацидоза и не было обнаружено различий в смертности. Авторы сделали вывод, что «пропофол сопоставим с другими седативными препаратами в положительном отношении». Интересно, что исследователи отметили, что 78% из всех наблюдаемых случаев метаболического ацидоза были диагностированы у детей младше 3 лет [10].
В 1999 году производитель выполнил исследование DiprivanTM при педиатрической седации в ICU у более чем 300 больных в США (исследование 08591 L -0068) в целях определения - вызывала ли ЭДТК ( EDTA ), включенная как микробиологический ингибитор роста, повышенное выделение цинка как у взрослых. Вторичные конечные результаты включали метаболический мониторинг, оценку безопасности и эффективности. Несмотря на то, что исследование не было разработано для определения различий в смертности, неожиданно была показана более высокая частота смертей в группе DiprivanTM в период назначения препарата и до 30 дней после прекращения введения препарата при сравнении со «стандартным седативным препаратом» (11% против 4%). Эта частота не была статистически значимой, а более детальное изучение данных показало, что признаки, описанные Cremer или Bray , не были выявлены у пациентов перед наступлением смерти. В течение первых 7 дней терапии в ICU была отмечена тенденция к повышению избытка оснований ( BE ) (рисунок 1). Если пропофол повреждал дыхательную цепь ферментов, то можно ожидать снижение BE и отклонение от группы «стандартного седативного препарата». Таким образом, не была подтверждена связь с развитием ацидоза зависимым от времени.
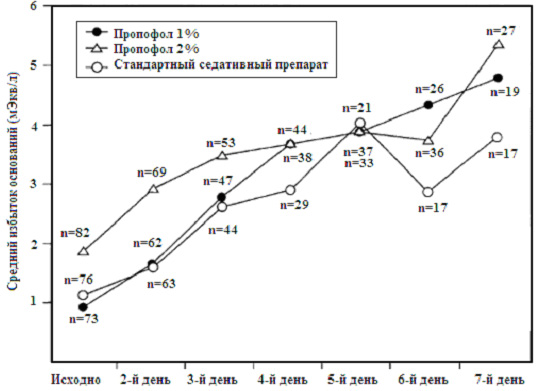 |
| Рисунок 1. Исследование Astra Zeneca 0859 IL -0068: средний избыток оснований артериальной крови (мЭкв/л) по дням исследования. |
Распространенное лицензированное разрешение
В небольшом числе авторитетных источников было дано одобрение для широкого применения препарата при проведении седации в педиатрии в ICU , но FDA , которое рассматривало результаты исследования как возможный сигнал безопасности, инструктировало производителя в письме «Уважаемый врач» с указанием, что DiprivanTM не следует применять для седации в педиатрии в ICU в США. Позднее, распорядительные органы власти не одобрили, и даже аннулировали одобрение этого показания к применению препарата. «Предупреждение» изменилось на «противопоказание» в отношении седации в педиатрии в ICU . В тех педиатрических ICU , где все еще есть разрешение к применению, продолжающееся использование препарата не привело к дополнительным сообщениям о «синдроме инфузии пропофола».
Обзор безопасности
В 1999 году производитель завершил сравнительный обзор безопасности всех неблагоприятных эффектов у детей в ICU , получавших пропофол, и сообщил о базе данных, которая содержала все сообщения о неблагоприятных последствиях, связанных с назначением препарата или, возможно, связанных с применением пропофола. В базе данных проведен поиск отдельных случаев, описанных в сообщениях и синонимов этих случаев, все найденные сообщения были пересмотрены. Из нескольких сообщений, которые соответствовали критериям диагностики синдрома по данным Bray или Cremer , в большинстве сообщений имелись также значимые независимые факторы риска наблюдаемого ухудшения заболевания и развития отдельных симптомов. Шесть больных, у которых сообщалось о мышечном повреждении, имели факторы риска развития мышечного повреждения, включая рефрактерную эпилепсию, температуру 41,5° C (возможно вследствие злокачественной гипертермии), применение преднизолона, а у трех больных было отмечено сочетание сепсиса, гипоперфузии и гипоксемии. Случаи, имеющие место у шести детей, соответствовали, но оставались без удовлетворительного объяснения. В четырех из этих случаев, производитель получил только минимум информации, несмотря на дополнительный запрос. Так как все эти случаи произошли у больных младше 3 лет с тяжелыми вирусными инфекциями дыхательных путей, в аннотацию DiprivanTM было добавлено следующее превентивное противопоказание:
« DiprivanTM противопоказан для проведения седации у детей младше 3 лет с серьезными вирусными инфекциями дыхательных путей, получающих интенсивную терапию».
Анализ опубликованных сообщений
В комментарии к сообщению Parke с соавторами [1], Cook , который участвовал в ведении двух сообщенных больных, осветил ошибки в сообщениях о случаях [11]. В 4-м случае введение пропофола было прекращено за три дня до смерти. В 5-м случае имелись признаки септицемии и почечной недостаточности до развития ухудшения, а быстрое ухудшение произошло после введения первой дозы цефтазидима. Cook также заявил, что упомянутые ICU и университетские отделения педиатрии не нашли доказательств прямого влияния пропофола на любое звено метаболизма у этих больных.
Впоследствии производитель получил дальнейшие данные по 5-му случаю, которые радикально изменили интерпретацию сообщенных результатов, что дало объяснение «неизвестному токсическому эффекту» DiprivanTM . Трое больных с сепсисом респираторного генеза получали стероиды – факт, который не упоминался в первичных представлениях.
Статья Bray [4] сравнивала сообщения 18 больных (включая больных, представленных в более ранней публикации Parke ), о 7 из которых уже сообщалось производителю. Большинство первоначальных сообщений установило или предположило, что DiprivanTM не был вероятной причиной смерти в случаях, так как существовали другие обоснованные и выявленные причины. Для оставшихся, с учетом недостатка представленных деталей, часто нет возможности дать комментарии относительно заявлений, что случаи смерти были следствием тяжелых проявлений заболеваний и их осложнений у этих пациентов.
Bray сделал вывод, что частота «синдрома инфузии пропофола» у пациентов, получавших пропофол в течение более 48 часов в дозах превышающих 4 мг/кг/час, составила 33%. Учитывая недостаток при определении подобного сценария у больных в исследовании 08951 L -0068 Astra Zeneca и многочисленных исследованиях без спонсора, этот вывод не поддерживается.
Cremer с соавторами [6] сообщили о случаях, имеющих место у взрослых пациентов с тяжелыми травмами головы. Известно, что такие травмы вызывают сердечнососудистую нестабильность, аритмии, ишемии и быстро меняющиеся уровни калия [12-14]. Обеспечение больных включает инфузионную терапию при гиповолемии и применение инотропных препаратов, а также сосудосуживающих средств для поддержания церебрального перфузионного давления (ЦПД) на уровне или выше 70 мм рт.ст. Описанные случаи произошли несмотря на то, что средняя назначенная доза пропофола превысила максимально рекомендуемую дозу на ? 25%. Первоначальное дозирование в целом было в пределах рекомендуемых для проведения седации, но прогрессивно было повышено в дальнейшем в два или три раза от рекомендованной дозы. Такие дозы, возможно, использовались не только для седации, но и для контроля внутричерепного давления. Скорость инфузии инотропных препаратов и сосудосуживающих средств повышалась параллельно скорости пропофола, что вероятно отражало рефрактерную природу внутричерепной гипертензии. Сообщение не показало, что улучшенный гемодинамический мониторинг начинался своевременно при ведении в ICU ; у одного больного была проведена катетеризация легочной артерии незадолго до смерти.
Сообщения о нелицензированном применении пропофола при лечении эпилептического статуса или для острой опиатной детоксикации часто описывают очень высокую скорость назначения препарата, иногда достигающую 30-40 мг/кг/час. В этих сообщениях гипотония происходила обычно на второй день применения и лечилась эмпирически инотропными препаратами и/или вазоконстрикторами. Развивались ацидоз и гипоксемия, часто быстро прогрессируя до полиорганной недостаточности и смерти больного. Гемодинамические параметры не сообщались .
Тяжелый сепсис – Есть ряд сообщений о случаях у больных с сепсисом, получавших седацию пропофолом, у которых развилась гипотония, ацидоз, полиорганная недостаточность и впоследствии гибель. Этот сценарий является обычным в ICU и не считается «необычным», пока при ухудшении не будут показаны несоответствующие аспекты. Не описано необычных признаков и в этих сообщениях о случаях. В целом они показали, что повышение доз интропных средств и/или вазоконстрикторов использовалось эмпирически.
Основное впечатление, полученное от опубликованных сообщений, заключается в том, что «синдром» оказался преимущественно связан с недостаточной оксигенацией тканей, вторичной после гемодинамических нарушений и/или сердечнососудистой недостаточности перераспределения. У некоторых больных с дефицитом ? -окисления, пропофол теоретически может нарушать окисление жирных кислот. Снижение потребности в окислении жирных кислот при назначении глюкозы, таким образом, может снижать риск развития случаев, связанных с «синдромом инфузии пропофола».
Физиологический анализ
Частые признаки и частые факторы. Недостаток адекватного усвоения кислорода в тканях или его потребления является самой частой причиной метаболического ацидоза. Изменения в органах в сообщенных случаях, т.е. рабдомиолиз, сердечная недостаточность и липемия, могут быть следствием неадекватной оксигенации скелетных мышц, сердечной мышцы и печени, соответственно (см. ниже) [15-17].
Во всех детализированных сообщениях о случаях подобных «синдрому инфузии пропофола», использовался пропофол или нет (случай сообщался непосредственно в Astra Zeneca J Blummer ; больной в возрасте четыре месяца получал лоразепам для седации в ICU ), были доказательства в пользу недостаточной оксигенации тканей. Большинство сообщений включали факторы, указывающие на сердечнососудистую недостаточность перераспределения с гипоперфузией и/или гипоксемией, например, тяжелый сепсис (особенно, респираторного генеза), травмы головы (с ограничением жидкости, с терапией вазоконстрикторами и инотропными препаратами), пациенты с множественными травмами с неадекватной реанимацией, повторные эпизоды внезапной гипотонии или гипоксии и дисфункция органов, предполагающая гипоперфузию или гипоксию (например, диагностическое повышение концентрации печеночных ферментов, характерное для гипоксического или гипотензивного повреждения печени, липемия и нарушение функции почек).
Сообщения, которые описывали в основном изменение гемодинамического обеспечения с последующим разрешением симптомов «синдрома», предполагают, что гемодинамические аспекты отдельных случаев важны, если не являются причиной. И, наоборот, у больных, у которых основными терапевтическими мероприятиями были только отмена пропофола и эмпирическое повышение дозы инотропных препаратов, обычно отмечалось ухудшение.
Клинические признаки
Сердечно-сосудистая недостаточность. Первичным диагностическим критерием «синдрома инфузии пропофола» у Bray была «сердечная недостаточность». Из пяти больных в первоначальной статье: у двух были признаки перегрузки объемом; в двух сообщениях в Astra Zeneca возможно имел место вирусный миокардит; одному больному требовалась ингаляция 80% кислородом, т.е., у этого пациента была выраженная гипоксемия; один больной имел предшествующую легочную гипертензию и гипоксию вследствие пневмонии, у двух имелся отек головного мозга.
В случаях, в которых синдром предшествовал смерти, лишь в нескольких сообщениях помимо оценки частоты сердечных сокращений, артериального давления и измерения центрального венозного давления, проводился мониторинг сердечной деятельности. Немногочисленные сообщения ссылались на применение эхокардиографии, результаты которой колебались от нормы до моно- (левостороннее или правостороннее) или бивентрикулярных нарушений. Большинство авторов сообщений указали, что инотропные препараты использовались эмпирически без стабильной и/или адекватной реакции.
В сообщениях Cremer [6] прогрессивное повышение доз инотропных препаратов, вазоконстрикторов и пропофола возможно было в ответ на рефрактерную внутричерепную гипертензию и выраженное уменьшение объема. Системные последствия этого режима на гемодинамику оказались значительными. У больных с травмами головы инотропные средства, вазоконстрикторы и пропофол (вазодилататор в дозах, используемых периодически для контроля внутричерепного давления) совместно с гиповолемией еще больше повреждают патологическую внутричерепную сосудистую регуляцию. Однако их эффекты не ограничены церебральным кровотоком и приводят к системному изменению сосудистой авто-регуляторной реакции. Первоначальный вазомоторный результат этого режима на капиллярном уровне будет отражать «феномен колебания» (« hunting phenomenon ») (периодическое раскрытие гипоперфузированного, спазмированного капиллярного русла, что позволяет прерывистую перфузию тканей зависимую от центрального и местного регуляторных механизмов). В конечном счете, результирующее повышение физиологического шунтирования будет приводить к фрагментарной гипоперфузии в тканях [18], подобно гипоперфузии, показанной при сердечнососудистой недостаточности перераспределения при тяжелом сепсисе и описанной Siegemund с коллегами [19].
В миокарде, где уровень метаболизма и клиренс кислорода являются высокими, эффект такого повышенного шунтирования будет вызывать ишемию (в некоторых сообщениях было подозрение на ишемию миокарда), аритмии и в итоге недостаточность.
Некоторые публикации показывают, что травма головы и ее лечение может вызывать тканевую ишемию и некроз [12, 13, 20]. Также было показано, что помимо ишемии сердца и кишечника, возможно развитие ишемии и в других тканях [21]. В некоторых сообщениях о «синдроме инфузии пропофола» упоминались ишемические изменения на ЭКГ, а исследования после выздоровления не выявило никакого патологического процесса. Ишемия сердца нарушает функцию и снижает общую доставку кислорода.
Рабдомиолиз. В каждом сообщении, где была представлена адекватная клиническая информация, можно было выявить явный фактор риска развития рабдомиолиза, который не зависел от пропофола. Мышечное повреждение, повышение уровня креатин фосфокиназы (КФК) и рабдомиолиз были связаны как с длительным, так и однократным назначением высокой дозы стероидов [22, 23]. Публикации четко предполагают, что высокий выход калия может происходить после повреждения головы и может провоцировать начало рабдомиолиза [14].
Небольшое число сообщений были о рабдомиолизе, который провоцировался применением стероидов или выходом калия . В других сообщениях факторы риска включали миопатии (в том числе, злокачественную гипертермию), синдром повышенного давления и судороги.
Во многих других случаях, несомненно, была пролонгированная системная гипоперфузия или гипоксия с или без эпизодов острой гипотонии и/или гипоксии. Эти сообщения не показали, что тщательный гемодинамический мониторинг осуществлялся до развития выраженного гемодинамического коллапса. Однако оказалось маловероятным, что такие установки могли быть адекватно оценены. Неадекватная доставка кислорода в скелетные мышцы приводит к анаэробному метаболизму, продукции кислоты и, если процесс достаточно выражен, то он приводит к повышению уровней КФК, гибели мышечных клеток и рабдомиолизу. Таким образом, оказалось, что острая или хроническая гипоперфузия или гипоксия были факторами риска развития рабдомиолиза у этих критических больных в ICU .
Липемия . Липемия и жировая инфильтрация печени были описаны в некоторых сообщениях, а в дальнейшем случаи описаны в базе данных фармакологического надзора Astra Zeneca . Неповрежденная липидная регуляция и метаболизм в печени требует поступления углеводов. В случае их отсутствия уровни фосфорилированного цитрата снижались, и метаболизм жиров замедлялся. Запасы углеводов обычно расходуются у больных, поступивших в ICU , и на начальном этапе невозможно в достаточной мере их восполнить. Если вводятся липиды (включая пропофол) и регуляция нарушена, то может начинаться накопление, которое через 2-5 дней достигнет уровней интерпретированных как «гиперлипемия» в зависимости от скорости назначения препаратов. Частота и тяжесть гиперлипемии у больных ICU по данным Astra Zeneca коррелировала с более высокой скоростью дозирования пропофола и липидов.
Все факторы, которые повреждают функцию печени, будут усугублять гиперлипемию. Частые причины у критических больных в ICU включают гипоперфузию, сепсис, состояние гиперметаболизма, гипоксию, применение вазоконстрикторов, абдоминальную тампонаду и т.д. Одно или более этих состояний обычно отмечалось в сообщенных примерах гиперлипемии. В некоторых случаях были сообщены повышенные уровни печеночных ферментов, указывающие на гипоперфузию или гипоксемическое повреждение. Оказалось, что пролонгированная гиперлипемия и недостаточно функционирующая печень приводят к жировой дегенерации.
Некоторые сообщения показывают, что у больных, требующих введения повышенных доз пропофола, развиваются признаки «синдрома инфузии пропофола». Эта измененная потребность обычно согласуется с повышенной липемией. Одним из предложенных объяснений этого явного развития толерантности является тот факт, что введенный пропофол, хорошо растворимый в жирах, предпочтительно поглощается жировыми капельками в липемический сыворотке, удаляя препарат из метаболически и клинически активных мест [24]. Такое повышение потребности в препарате, таким образом, может быть показателем липемии, которая в свою очередь является следствием повреждения печени.
Липемия сама по себе может нарушать митохондриальное потребление кислорода, и таким образом, может усугублять проблемы утилизации кислорода, стимулируя развитие признаков «синдрома» и способствуя его рефрактерной природе.
Липемия, происходящая у критических больных, получающих пропофол, предсказуема, поддается терапии и не является следствием неизвестной «токсичности пропофола». Аннотация к DiprivanTM показывает, что скорости инфузии пропофола и других липидных растворов должны быть снижены у больных с неадекватным клиренсом жиров. В большинстве сообщений о «гиперлипемии» в базе данных Astra Zeneca , как в связи с развитием «синдрома инфузии пропофола», так и изолированной, эти рекомендации не последовали.
Возможные метаболические причины
Лабораторные исследования уже показали, что подавление митохондриальных дыхательных ферментов только происходит в концентрациях пропофола вероятно не показали клинически [25, 26]. Эти исследования не принимали в расчет широкое связывание с протеинами плазмы пропофола, что будет in vivo снижать митохондриальное воздействие менее десятой исследованных состояний. Кроме того, эффекты которые такое подавление будет как ожидалось вызывать, не показано на практике. «Синдром» и/или ацидоз как оказалось не происходит при анестезии, где более высокие скорости назначаются; эффекты пропофола быстро уменьшаются после отмены, но отмена не показано как результат в форме выздоровления от случаев включающих «синдром». (Длительный метаболит теоретически допущено, что вызывает «сценарий», но ни один еще не определен.) Пропофол будет снижать потребление кислорода; это так, но для такого же объема как мидазолам [27].
Исследование случая ребенка, у которого развились клинические признаки «синдрома» сообщило об успешной терапии гемофильтрации. До фильтрации, высокие концентрации малонилкарнитина (3,3 мкмоль/л) и C 5-ацилкарнитина (8,4 мкмоль/л) были выявлены которые возвращались к норме после восстановления. Аномалии имели сходства с аномалиями, выявленными с нарушенной митохондриальной функции. Гиперлипемия, которая распознана как причина нарушения метаболизма ацилкарнитина, была показано у этого больного. Дальнейшие сообщения нарушенного окисления жирных кислот подтвердили сосуществование патологического метаболизма ацилкарнитина с признаками по крайней мере подгруппы больных с «синдромом» [28-30].
В статье, Wolf и Potter [30] показали «дети с наследственными дефектами ? -окисления часто не имеют симптомов до такого времени как они подвергаются стрессу, например, голодание (низкий уровень глюкозы) или инфекция». Так как их обычный источник энергии, глюкоза, стала неадекватной они обращались к метаболизму жиров как их единственному источнику энергии. Wolf и Potter в дальнейшем показывают, что «при этих состояниях они могут развивать жизнеугрожающий рабдомиолиз, сердечная и печеночная недостаточность связанная с гипогликемией». Дети с дефицитом ? -окисления страдают острыми состояниями вызванными как недостатком дыхательной цепи, приводя к клеточной гипоксии, и прямому токсическому эффекту накопленных длинноцепочных жирных кислот [31]. Аккумуляция длинноцепочных ацилкарнитинов токсична для сердечной и скелетных мышц [32, 33]. Любые эффекты пропофола на митохондрии будут связаны с воздействием, и синдром почти исключительно показан, где вводятся «высокие» дозы. Следовательно, независимые причинные связи, предусмотрительность предполагает ограниченное дозирование в рекомендациях предписанной информации и соответствующего пополнения углеводов [34].
Клинические последствия и улучшение ведения больных
В контролируемых исследованиях не были найдены ни доказательства влияния пропофола на кислотно-основное состояние, ни частота «синдрома инфузии пропофола». Однако исключить возможность полностью нельзя. Оказалось, что проявления «синдрома» имеют место только у критических больных с тканевой гипоксией. Назначение пропофола в «высокой» дозе может усугубить гипоксию тканей посредством сердечнососудистых эффектов, жировой нагрузки и теоретически посредством нарушения митохондриальной функции. Анализ имеющейся информации предполагает принципы оптимизации ухода за больными в ICU и выявления тех пациентов, у которых может развиваться синдром или его отдельные проявления, независимо от использованных седативных препаратов.
Гемодинамическая и сосудистая функции – Профилактика или лечение «синдрома» зависит от восстановления доставки кислорода на периферию и удаления имеющихся причин при лечении. В большинстве сообщений, нарушенная гемодинамика оказалась первичной причиной недостаточного снабжения кислорода. Несмотря на то, что многие интенсивисты согласны, что мониторинг гемодинамики, доставки и потребления кислорода требуется для оценки сердечнососудистой функции у критических больных, только пять больных (взрослые и дети) из всей базы данных фармакологического надзора Astra Zeneca с фатальными исходами и с признаками «синдрома» получали инвазивный мониториинг. Во всех пяти сообщениях адекватная коррекция выраженной патологической гемодинамики не была успешной, не проводилась или не сообщалась. В некоторых не-фатальных случаях, соответствующее применение мониторинга с терапевтической реакцией приводило к выздоровлению.
Несмотря на технические проблемы в определении упомянутых параметров, особенно у очень маленьких детей, такое мониторирование должно рассматриваться, особенно у больных в очень тяжелом состоянии и если их состояние ухудшается с развитием ацидоза или сердечной недостаточности. У очень маленьких детей более практичным будет применение ультразвуковой оценки аортального потока, компьютеризированного анализа пульсовой волны или импедансных мониторов сердечного выброса в сочетании с эхо-кардиографией, но эти мероприятия не смогут дать полной картины и не будут точными как инвазивный мониторинг.
Мониторинг может выявить неожиданные данные, например, врожденные пороки сердца, легочную гипертензию и моно-желудочковую недостаточность, диагностика которых может оказаться жизненно-важной для успешного ведения. Врачи, не знающие о наличии и интерпретации этих манипуляций и полученных параметрах, будут требовать дополнительного обучения [35].
Стероиды – Значительная часть детей с развитием «синдрома» получала стероиды, тем не менее, необходимость применения стероидов должна тщательно рассматриваться.
Липемия – Ранее описанный физиологический анализ этого состояния предполагает вероятные методы профилактики и ведения. Должна рассматриваться возможность, что липемия является следствием нарушения функции печени и что повреждение может быть следствием недостаточной гемодинамики или доставки кислорода. Одновременное назначение углевода поддерживает липидный метаболизм, при условии адекватной функции печени. Ограничение общей липидной нагрузки может стать необходимым, меньшая скорость введения липидов будет предотвращать развитие «гиперлипемии» или снижать допустимые уровни повышения плазменных липидов. При повышении липидов плазмы необходимо применять меньшие дозы пропофола, что возможно, потребует введения вспомогательных средств, если пропофола будет недостаточно. На некоторых рынках, есть 2% DiprivanTM , который имеет в два раза меньшую липидную дозировку.
Необходимо исключить факторы, неблагоприятно влияющие на функцию печени. В большинстве примеров лечение первичного патологического процесса является правильным подходом и включает лечение состояний гипоперфузии, сепсиса, гиперметаболизма, гипоксии и так далее. Некоторые виды терапии могут неблагоприятно влиять на функцию печени (применение вазоконстрикторов, вентиляция высоким давлением и др.) и должны использоваться с осторожностью.
Пациенты с травмами головы. Ограничение жидкости, необходимое применение вазопрессоров для поддержания ЦПД повышает риск тканевой гипоперфузии и нарушает функцию печени. Zornow и Prough представили доказательства, что выраженные снижения циркулирующего объема крови и связанная потребность в применении ваконстрикторов не улучшают исходы в этой группе больных [36]. Manley с коллегами установили, что факторами, важными для хорошего исхода у этих больных, являются поддержка адекватного ЦПД и предотвращение системной гипотонии [37].
Bingham показывает, что осмолярность сыворотки, превышающая 378 мОсм/кг, в одной группе больных с травмами головы коррелировала со смертельными исходами, и рекомендует верхний предел = 340 мОсм/кг у этих больных [38].
Luerssen и Wolfla [39] описывают «сбалансированный подход» к уходу за больными с травмами головы с тремя уровнями интенсивной терапии и мониторинга для увеличения резистентности повышенного внутричерепного давления; нормоволемия или незначительное повышение внутрисосудистого объема рекомендуется у всех.
Если у больных во время активного лечения с ограничением объема и при применении вазоактивных препаратов развиваются признаки сердечной недостаточности, метаболического ацидоза и т.д., то обеспечение больного должно руководствоваться гемодинамическими параметрами и должно быть нацелено на оптимизацию доставки и утилизации кислорода. Большинство, возможно, будут требовать оптимизации внутрисосудистого наполнения, снижения доз вазоактивных препаратов и снижения доз пропофола или барбитуратов.
Больные с тяжелыми травмами
У всех больных с тяжелыми травмами, у которых имел место синдром подобный «синдрому инфузии пропофола», это состояние развивалось после пролонгированной недостаточной перфузии, часто с эпизодами острой гипоксии или гипоперфузии и последующей инфекции. Не было сообщений о применении гемодинамического мониторинга или оценки доставки кислорода до развития сердечнососудистого коллапса. Соответствующий мониторинг и терапевтические мероприятия могли предупреждать появление таких состояний в некоторых случаях.
Информация в аннотации к препарату
В ответ на сообщения, производитель проанализировал ситуацию и внес поправки в аннотацию к препарату, включив описанные ранее предупреждения. Информация производителя по препарату DiprivanTM сейчас также включает рекомендации по улучшению гемодинамических параметров и параметров доставки кислорода у больных на фоне седации в ICU . Европейские Регулирующие Комитеты будут требовать дополнений в аннотации для всех препаратов пропофола с рекомендациями, что применение пропофола необходимо снизить или прекратить в случае развития метаболического ацидоза, рабдомиолиза, гиперкалиемии и/или быстро прогрессирующей сердечной недостаточности, несмотря на недостаток доказательств эффективности этих мер как изолированного вмешательства.
Вывод
В настоящее время нельзя установить, каким образом пропофол способствует развитию «синдрома инфузии пропофола» или его отдельных проявлений.
Большинство случаев подозрительных на «синдром» объяснялись наличием патологических процессов, которые можно было рационально пролечить. Гемодинамические нарушения и/или недостаточная доставка кислорода должны быть оценены и пролечены. Всякий раз, когда это происходит, липемия и имеющиеся причины должна быть изучены. Возможность митохондриального влияния препарата в высоких дозах требует применения доз в пределах рекомендуемого диапазона, или, по крайней мере, близко к нему. Назначение глюкозы теоретически может помочь при ведении липемии или если есть митохондриальные дефекты.
Авторы надеются, что информация, представленная в этом обзоре, прольет свет на проблемы и физиологию так называемого «синдрома инфузии пропофола» и на его отдельные проявления, а также обеспечит не только понимание самого процесса, но и даст основу для его предотвращения и терапии.
Компания Astra Zeneca приносит извинения за то, что не может сообщить конфиденциальную информацию, касающуюся отдельных больных, входящих в базу данных фармакологического надзора. Обсуждение этой сложной темы было сокращено в целях публикации; Вы можете ответить нам на сайте www . anaesthesia - az . com .
Ссылки
- Parke T.J., Stevens J.E., Rice A.S.C. et al. Metabolic acidosis and fatal myocardial failure after propofol infusion in children: five case reports. BMJ 1992; 305: 613-616.
- Anonymous. Side-effects of propofol (Diprivan). Ugeskr. Laeger 1990; 152(16): 1176.
- FDA Reports 1992; 54: 14.
- Bray R.J. Propofol infusion syndrome in children. Paediatr Anaesth 1998; 8: 491-499.
- Hatch D.J. Propofol-infusion syndrome in children. Lancet 1999; 353: 1117-1118.
- Cremer O.L., Moons K.G.M., Bouman E.A.C. et al. Long-term propofol infusion and cardiac failure in adult head-injured patients. Lancet 2001; 357: 117-118.
- Friedman J.A., Manno E., Fulgham J.R. Propofol. J Neurosurg 2002; 96: 1161-1162.
- Prasad A., Worrall B., Bertram E. et al. Propofol and midazolam in the treatment of refractory status epilepticus. Epilepsia 2001; 42: 380-386.
- Cornfield D.N., Tegtmeyer K., Nelson M.D., Milla C.E., Sweeney M. Continuous propofol infusion in 142 critically ill children. Pediatrics 2002; 110: 1177-1181.
- Pepperman M.L., Macrae D. A comparison of propofol and other sedative use in paediatric intensive care in the United Kingdom. Paediatr Anaesth 1997; 7: 143-153.
- Cook S. Propofol infusion in children. BMJ 1992; 305: 952.
- Cruickshank J.M. Reduction of stress/catecholamine-induced cardiac necrosis by beta 1 selective blockade. Lancet 1987; 2: 585-589.
- Dixit S., Castle M., Velu R.P. et al. Cardiac involvement in patients with acute neurological disease. Confirmation with cardiac Troponin 1. Arch Intern Med 2000; 160: 3153-3158.
- Tse H.-F., Yeung C.-K. From profound hypokalaemia to fatal rhabdomyolysis after severe head injury. Am J Med 2000; 109: 599-600.
- Feinberg M.S., Di Segni E., Freimark D. et al. Transient left ventricular outflow tract obstruction and pseudohypertrophy due to severe hypovolaemia and catecholamine administration in a potential donor for heart transplantation. J Cardiovasc Diagn Proced 1999; 16: 125-129.
- Perkin R.M., Anas N., Lubinsky P. Myocardial ischaemia and disparate ventricular function after paediatric head injury. Crit Care Med 1991; 19: 587-588.
- Schranz D., Stopfkuchen H., Jungst B.K. Hamorrhagisches Lungenodem and Herzkreislaufinsuffizienz nach isoliertem Schadelhirntrauma. Monatsschr Kinderheilkd 1981; 129: 248-250.
- Gustafsson U., Wardell K., Nilsson G.E. et al. Vasomotion in rat skeletal muscle induced by hemorrhage as recorded by laser-Doppler flowmetry. Microvasc Res 1991; 42: 224-228.
- Siegemund M., van Bommel J., Racovitza I. et al. Sepsis, microcirculation and vasodilators. Nederlandse Vereniging voor Intensive Care 2002; 6(5); 12-16.
- Balasubramanian V., Townsend S., Boots R.J. Does splanchnic ischaemia occur in isolated neurotrauma? A prospective observational study. Crit Care Med 1999; 27: 1175-1180.
- Vitale G.C., Larson G.M., Davidson P.R. et al. Analysis of hyperamylasemia in patients with severe head injury. J Surg Res 1987; 43: 226-233.
- Gayan-Ramirez G., Decramer M. The effect of corticotherapy on respiratory muscles. Revue des Maladies Respiratoires 1998; 15: 33-41.
- Reichhart M.D., Lobrinus J.A., Kuntzer T. et al. Acquired neuromuscular disorders in critically ill patients. (Les complications neuromusculaires acquires de reanimation.) Med Hyg 2003; 61: 970-976.
- Knibbe C.A.J., Zuideveld K.P., Dejongh J., Kuks P.F.M., Aarts L.P.H.J., Danhof M. Population pharmacokinetic and pharmacodynamic modeling of propofol for long-term sedation in critically ill patients: a comparison between propofol 6% and propofol 1%. Clin Pharmacol Therap 2002; 72(6); 670-684.
- Rigoulet M., Devin A., Averet N. et al. Mechanisms of inhibition and uncoupling of respiration in isolated rat liver mitochondria by the general anesthetic 2,6-diisopropylphenol. Eur J Biochem 1996; 241: 280-285.
- Schenkman K.A., Yan S. Propofol impairment of mitochondria) respiration in isolated perfused guinea pig hearts determined by reflectance spectroscopy. Crit Care Med 2000; 28: 172-177.
- Kress J.P., O'Connor M.E., Pohlman A.S. et al. Sedation of critically ill patients during mechanical ventilation: a comparison of propofol and midazolam. Am J Resp Crit Care Med 1996; 153: 1012-1018.
- Wolf A., Weir P., Segar P., Stone J., Shield J. Impaired fatty acid oxidation in propofol infusion syndrome. Lancet 2001; 357(9256): 606-607.
- Withington D.E., Decell M.K., Ayed T.A. A case of propofol toxicity, further evidence for a causal mechanism. Pediatr Anesth 2004; 14: 505-508.
- Wolf A.R., Potter F. Propofol infusion in children: when does an anesthetic tool become an intensive care liability? Pediatr Anesth 2004; 14: 435-438.
- Vasile B., Rasulo F., Candiani A., Latronico N. The pathophysiology of propofol infusion syndrome: a simple name for a complex syndrome. Intens Care Med 2003; 29: 1417-1425.
- Corr P.B., Creer M.H., Yamada K.A., Saffitz J.E., Sobel B.E. Prophylaxis of early ventricular fibrillation by inhibition of acylcarnitine accumulation. J Clin Invert 1989; 83: 927-936.
- Bonnefont J.P., Djouadi F., Prip-Buus C., Gobin S., Munnich A., Bastin J. Carnitine palmitoyltransferases 1 and 2: biochemical, molecular and medical aspects. Mol Aspects Med 2004; 25: 495-520.
- Roth M.S., Martin A.B., Katz J.A. Nutritional implications of prolonged propofol use. Am J Health-Syst Pharm 1997; 54: 694-695.
- Wasserberger J., Ordog G.J., Shoemaker W.C. Inadequate critical care curriculum in pediatric emergency medicine fellowships. Acad Emerg Med 1994; 1: 503.
- Zornow M.H., Prough D.S. Fluid management in patients with traumatic brain injury. New Hori Sci Pract Acute Med 1995; 3: 488-498.
- Manley G., Knudson M.M., Morabito D. et al. Hypotension, hypoxia and head injury - frequency, duration and consequences. Arch Surg 2001; 136: 1118-1123.
- Bingham W.E. The limits of cerebral dehydration in the treatment of head injury. Surg Neurol 1986; 25: 340-345.
- Luerssen T.G., Wolfla C.E. Pathophysiology and management of increased intracranial pressure in children (Chapter 4). In: Andrews BT, Hammer GB, eds. Pediatric Neurosurgical Intensive Care. Neurosurgical Topics Series. AANS Publications Committee. The American Association of Neurological Surgeons. New York: Thieme Medical Publishers, 1997. ISBN-10: 1879284456/ 3131324813

