Все ли крахмалы одинаковы?
Фармакокинетика и фармакодинамика гидроксиэтилкрахмалов
Статья опубликована в журнале Transfusion Alternatives in Transfusion Medicine
Volume 9, Number 3, September 2007, ISSN: 1295-9022
Краткий обзор
С появлением третьего поколения гидроксиэтилкрахмалов (ГЭК) эта группа препаратов снова стала предметом научного интереса. Фармакодинамические характеристики ГЭК как коллоида зависят в большей степени от количества онкотически активных молекул, а не от концентрации ГЭК в плазме крови, в то время как эффекты на гемостаз, особенно влияние на VIII фактор свертывания и фактор Виллебранда, зависят от концентрации крахмала в плазме крови и молекулярной массы in vivo. ГЭК с молярным замещением 0,4 и более при повторных введениях накапливаются в плазме крови. Этот эффект наиболее выражен при применении гетакрахмалов (например, ГЭК 670/0,75) и значительно меньше у ГЭК 130/0,4, по сравнению с гетакрахмалами и ГЭК 200/0,5. ГЭК 130/0,4 не накапливается в плазме при повторных введениях, а его плазменный клиренс в 23 раза превышает клиренс гетакрахмалов. Это свойство особенно важно при инфузии ГЭК пациентам с почечной недостаточностью в анамнезе. Отмечено, что при наличии почечной недостаточности средней или тяжелой степени в условиях сохраненного диуреза, общая мочевая экскреция ГЭК 130/0,4 превышает общую почечную экскрецию ГЭК предыдущих поколений у здоровых добровольцев. Применение ГЭК 130/0,4 у пациентов с периоперационной почечной недостаточностью во время хирургических вмешательств на аорте не привело к появлению нежелательных эффектов со стороны почек в сравнении с желатином. Следовательно, ГЭК 130/0,4 может быть рекомендован для использования у пациентов с почечной недостаточностью при сохраненном диурезе. Волемический эффект ГЭК зависит не только от фармакокинетических характеристик. Одинаковая волемическая эффективность была зарегистрирована при сравнении ГЭК 130/0,4 с ГЭК 200/0,5 и ГЭК 670/0,75, несмотря на более длительный период полувыведения последних препаратов. Минимальное влияние на систему гемостаза оказывает ГЭК 130/0,4. По данным последних исследований кровопотеря и необходимость в гемотрансфузии при использовании ГЭК 130/0,4 (С2/С6>8) меньше, чем при применении гетакрахмалов и пентакрахмалов. ГЭК 130/0,4 сочетает в себе высокую клиническую эффективность и безопасность.
Ключевые слова: клиническая эффективность и безопасность, коагуляция, коллоиды, гидроксиэтилкрахмал, фармакокинетика, физико-химические характеристики, коррекция волемического статуса.
Введение
На сегодняшний день гидроксиэтилкрахмалы (ГЭК) нашли широкое применение как эффективные коллоидные препараты для коррекции волемического статуса. Существуют региональные различия в использовании ГЭК. Так в США в качестве волемических препаратов применяют гетакрахмалы (ГЭК 450/0,7 или ГЭК 670/0,75), а ГЭК 200/0,5 используют только для проведения лейкафереза. В Японии применяют ГЭК 70/0,5 (Salinhes®, Kyorin Pharmaceutical Co., Tokyo), в то время как в Европе доступны различные препараты ГЭК.
Когда первое поколение ГЭК было представлено в 1970-х годах, существовало мнение, что длительная циркуляция в сосудистом русле будет способствовать повышению эффективности и безопасности этих препаратов. Несмотря на отсутствие данных о показателях системной гемодинамики наличие гемодилюции при инфузии растворов ГЭК объясняли длительным волемическим действием препаратов. Лишь в последнее время стало очевидно, что некоторые предположения о механизме действия ГЭК были неверными.
Основными характеристиками ГЭК, определяющими их физико-химические свойства являются молекулярная масса, молярное замещение и отношение С2/С6. Молярное замещение определяют как отношение количества гидроксиэтиловых групп к общему количеству молекул глюкозы. Отношение С2/С6 указывает локализацию гидроксиэтиловых групп у определенных атомов углерода в кольце молекулы глюкозы.
Целью данной статьи явилось описание фармакокинетики и фармакодинамики ГЭК, а также проведение сравнительного анализа различных препаратов ГЭК, особенно их клинической эффективности и безопасности. ГЭК синтезируют из кукурузы и картофеля. Крахмалы, изготовленные из кукурузы и картофеля, не являются биоэквивалентными из- за различия в некоторых физико-химических свойствах (например, фосфорилизация картофельных крахмалов). В статье приведены данные о ГЭК, синтезированных из кукурузы.
Физико-химические свойства гидроксиэтилкрахмалов
ГЭК представляют собой последнее поколение коллоидов после желатина и декстранов. Физико-химические свойства, метаболизм и экскреция ГЭК зависят от размера молекул крахмала, но в большей степени от свойств, приобретенных в результате гидроксиэтилирования крахмала. Гидроксиэтилирование – это присоединение гидроксиэтиловых групп к молекулам глюкозы. Важно, что гидроксиэтилирование происходит у определенных атомов углерода – в положении С2 или С6, в меньшей степени возможно гидроксиэтилирование в положении С3. Гидроксиэтилирование крахмала изменяет его физико-химические свойства, и таким образом определяет свойства ГЭК in vivo.1
Растворы ГЭК являются полидисперсными, т.е. состоящими из молекул различного размера. После попадания в кровоток, молекулы ГЭК, которые проникают через почечный барьер (45 – 60кД), быстро элиминируются из организма. Более крупные молекулы подвергаются ферментному расщеплению под действием α-амилазы. Плазменная α-амилаза является эндоамилазой, т.е. расщепление молекулы крахмала происходит под действием этого фермента не с концов молекулы, а с середины цепи полимера. Фрагменты меньшего размера, образовавшиеся вследствие расщепления, выводятся через почечный барьер. Незначительная часть ГЭК временно депонируется в интерстициальных тканях, и, в результате, также элиминируется почками. Экскреция ГЭК через билиарную систему минимальна.3
Фармакокинетику ГЭК в первую очередь определяют молярное замещение и тип замещения (отношение С2/С6). Время нахождения ГЭК в кровотоке определяют не только средняя молекулярная масса in vivo, но и относительное содержание малых молекул, которые изначально способны проникать через почечный барьер и элиминироваться из организма. Гидроксиэтилирование замедляет процесс ферментного разрушения молекул ГЭК, тем самым, продлевая время циркуляции препарата в кровотоке. Схожий эффект оказывает высокое отношение С2/С6, способствуя замедлению гидролиза молекул ГЭК α- амилазой. Jung и соавт. исследовали эффекты внутривенного введения двух растворовГЭК 200/0,5, которые различались только отношением С2/С6 (5,8 и 10,8).1 Молекулярная масса и молярное замещение in vitro были одинаковыми в начале исследования.
Концентрация ГЭК в плазме и молекулярная масса in vivo оказались ниже в группе ГЭК 200/0,5 с более низким отношением С2/С6 уже через 1 час после окончания инфузии. Соответственно, площадь под кривой (AUC) была больше в группе с более высоким отношением С2/С6 (10,8), что соответствовало продолжительности гемодилюции.
Роль молярного замещения в фармакокинетике ГЭК иногда недооценивается. Возможно, это происходит потому, что молекулярную массу указывают на первом месте в описании препарата, а затем следует молярное замещение. Например, описание ГЭК 450/0,7, означает, что средняя молекулярная масса молекулы 450 кДа и на каждые десять молекул глюкозы приходится семь гидроксиэтиловых групп. Молярное замещение, а не молекулярная масса, является этимологической основой названия крахмала: «гетакрахмал» - молярное замещение 0,7, «пентакрахмал» - молярное замещение 0,5, «тетракрахмал» – молярное замещение 0,4.
По молекулярной массе ГЭК разделяют на высокомолекулярные (450 – 670 кДа), среднемолекулярные (130 – 200 кДа) и низкомолекулярные (≤70 кДа). Более значимой является классификация по молярному замещению: высокозамещенные с молярным замещением 0,62 – 0,75, среднезамещенные с молярным замещением около 0,5 и низкозамещенные (степень замещения 0,4 и ниже).
Современные методы определения характеристик ГЭК
Аналитические методы используют для характеристики ГЭК как in vitro, так и in vivo. Для уточнения свойств ГЭК и постоянного контроля качества продукта одинаково важны анализ и исходного сырья, и конечного продукта. Для определения концентрации ГЭК в плазме крови проводят преципитацию крахмала ацетоном, затем при помощи трифлюороацетиловой кислоты растворяют и гидролизуют его до изолированных глюкозных фрагментов, которые определяют при помощи ферментного анализа.34 Наиболее современными методами диагностики концентрации ГЭК in vivo являются узкоугольное рассеивающее лазерное излучение и высокоэффективная жидкая хроматография. Благодаря новым диагностическим методикам стало возможным точно определять молекулярную массу ГЭК. В предыдущие годы из-за недостаточных диагностических возможностей, измеряемая молекулярная масса крахмала не всегда соответствовала действительности, в связи с чем свойства ГЭК могли неправильно трактоваться. Например, гетакрахмал, который изначально маркировали как ГЭК 450/0,7, имел истинную молекулярную массу 670 кДа. После проведения правильного измерения маркировку изменили соответственно уточненным данным. Спецификация новых ГЭК, таких как ГЭК 130/0,4, разрабатывалась при помощи новейших методик. В пробах in vivo (например, плазма крови, моча) необходимо использовать методы оценки, подходящие для конкретной среды организма, и строго соблюдать методологию, например для точного определения концентрации необходимо инактивировать амилазу.
Экспериментальные исследования по накоплению в тканях и безопасности Количество ГЭК, которое временно депонируется в тканях, зависит от дозы введенного крахмала, периода полувыведения и почечной экскреции. Абсолютное количество ГЭК в тканях человека невозможно определить прижизненно. Поэтому для количественного сравнения депонирования ГЭК в тканях осуществляют исследования на животных. Jungheinrich и Neff 5 провели анализ литературы, посвященной экспериментальным исследованиям депонирования ГЭК в тканях. Основными работами являются исследование, проведенное Hulse и Jacobi 6 с использованием ГЭК 450/0,7, и сравнительное исследование ГЭК 130/0,4 и ГЭК 200/0,5, проведенное Leuschner и соавт.7.
Результаты этих исследований могут быть объединены, т.к. протоколы предполагали многократные введения препаратов и измерение накопления ГЭК в тканях при помощи ГЭК, меченных радиоактивным 14С. Данные для исследованных типов ГЭК получены с 8 по 10 день и с 24 по 28 день после окончания введения крахмалов, а для ГЭК 130/0,4 и ГЭК 200/0,5 до 52-го дня после последнего введения ГЭК. Остаточная концентрация в плазме крови была ниже для ГЭК 130/0,4 (10-й день: 0,0005% общей введенной дозы препарата), чем для ГЭК 200/0,5 (0,0021%), и продолжала снижаться до 52 дня после окончания лечения. Поскольку основное количество радиоактивного вещества выделилось ранее, суммированная суточная почечная и билиарная экскреция была низка как для ГЭК 130/0,4, так и для ГЭК 200/0,5: через 10 дней после последней инфузии раствора (0,055% и 0,052% соответственно), с 24 по 28 день после окончания лечения (0,030% и 0,039% соответственно). Дальнейшее снижение экскреции отмечалось до 52-го дня после окончания введения препаратов - 0,017% и 0,020% соответственно.
Соответствующие показатели для ГЭК 450/0,7 на всех этапах исследования составляли около 1% и 0,9%. Накопление ГЭК 450/0,7 в тканях (мягкие ткани, печень, почки, селезенка) было значительно больше по сравнению с ГЭК 130/0,4 и ГЭК 200/0,5, и значительно ниже для ГЭК 130/0,4 в сравнении с ГЭК 200/0,5. Общее депонирование в организме через 52 дня после последнего введения крахмала для ГЭК 130/0,4 составляло всего четверть от депонированного количества ГЭК 200/0,5. Уменьшение содержания ГЭК в тканях особенно значимо, т.к. растворы вводили в течение 18 дней. На 52-й день после окончания лечения абсолютное значение остаточной активности в почках было низкой для двух групп (0,019%), отражая длительную экскрецию остаточного ГЭК даже в случае низкого уровня депонирования в организме ГЭК 130/0,4.
Фармакокинетика гидроксиэтилкрахмалов
В настоящем разделе описаны свойства различных видов ГЭК, начиная с первого поколения ГЭК, гетакрахмалов.
Гетакрахмалы (ГЭК 450/0,7, ГЭК 670/0,75)
В исследовании Wilkes и соавт. проведен анализ фармакокинетики ГЭК 670/0,75 после однократной инфузии у здоровых добровольцев.8 Применяли ГЭК первого поколения в виде препарата с новой формулой раствора носителя (Hextend®, BioTime, Inc., Berkeley, CA, USA), при этом фармакокинетические свойства препарата не изменились вследствие изменения состава раствора. Авторы приводят данные о достоверной разнице между AUC для первых 24 часов после инфузии раствора (AUC24) 209 мг·час/мл и AUC от нуля до бесконечности (AUC∞) 926 мг·час/мл. Такую выраженную разницу можно объяснить тем, что период экскреции ГЭК с большой степенью замещения составляет более 24 часов. Полученные данные получили отражение и в виде низкого плазменного клиренса, составлявшего 0,98 мл/мин. Среднее значение начального периода полувыведения (t1/2α) в первые 8 часов после внутривенного введения растворов составляло 6,3 часа, а среднее значение периода полувыведения в первые 7 дней после инфузии (t1/2α) составило 46,4 часа.
Эти результаты подтвердили данные Yacobi и соавт.9 о медленной элиминации гетакрахмалов, приготовленных на основе солевых растворов. Похожие результаты были получены Boon и соавт. в исследовании на пяти добровольцах, когда 7мл/кг крови были замещены эквивалентным объемом ГЭК 470/0,7.10 Элиминация препарата из плазмы была низкой, а концентрация ГЭК в плазме через 24 часа после инфузии составила 4 мг/мл, что составило более 50% максимальной концентрации (7,4 мг/мл).
Mishler и соавт. получили первые данные о фармакокинетике гетакрахмалов при повторных введениях ГЭК11. Было показано, что последовательная инфузия трех относительно низких доз ГЭК (30 г) приводит к аккумуляции крахмала в плазме, и остаточная концентрация через 24 часа после третьего введения ГЭК больше, чем пиковая концентрация вещества после первого введения раствора. Концентрация ГЭК, измеренная через 20 дней после последнего введения раствора, была достаточно высокой и составила более 2 мг/мл. При этом активность амилазы плазмы крови оставалась высокой. Вывод авторов о том, что пациенты, у которых ГЭК применялись повторно, не должны входить в группу риска аккумуляции коллоида, должен рассматриваться с учетом времени проведения исследования, так как в настоящее время результаты исследования могут быть интерпретированы иначе.
Гексакрахмалы и пентакрахмалы (ГЭК 200/0,62 и ГЭК 200/0,5)
Weidler и соавт.12 провели сравнительное рандомизированное исследование фармакокинетических свойств ГЭК 200/0,62 (6%) и ГЭК 200/0,5% (10%). Вследствие того, что доза ГЭК была изначально разной, максимальная концентрация в плазме после инфузии 500 мл ГЭК 200/0,5 (10%) была выше, чем концентрация ГЭК 200/0,62 (6%) и составила соответственно 8,0 мг/мл и 5,2 мг/мл. Период полувыведения, определенный с использованием двухкомпартментальной модели, был меньше у быстро метаболизируемого ГЭК 200/0,5: t1/2α составил 5,08 часов для ГЭК 200/0,62 и 3,35 часов для ГЭК 200/0,5. Окончательный период полувыведения (t1/2β) составил 69,69 часов для ГЭК 200/0,62 и 30,61 час для ГЭК 200/0,5. Клиренс ГЭК 200/0,62 составил 1,23 мл/мин, что несколько больше клиренса гетакрахмалов и значительно меньше, чем клиренс ГЭК 200/0,5 (9,24 мл/мин).12 Полученные данные сходны с результатами исследования с использованием ГЭК 200/0,513 и ГЭК 450/0,7.8
Asskali и Forster сравнивали фармакокинетику ГЭК 200/0,62 и ГЭК 200/0,5. Растворы вводили ежедневно по 500 мл в течение пяти дней.14 Накопление в плазме отмечали для двух видов ГЭК, начиная со второго дня. Накопление в плазме ГЭК 200/0,62 было больше, чем ГЭК 200/0,5. Концентрация в плазме через 24 часа после окончания последнего внутривенного введения ГЭК 200/0,62 составила 7,8 мг/мл, при этом максимальная концентрация сразу после окончания инфузии первой дозы препарата была 7,0 мг/мл.
Меньшее накопление в плазме наблюдалось при применении ГЭК 200/0,5. В то время как концентрация в плазме ГЭК 200/0,5 через 20 дней после последнего применения ГЭК снижалась до 0,5 мг/мл и менее, на 30-ый день после последнего введения ГЭК 200/0,62 его концентрация в плазме составляла 1,3 мг/мл. При этом доза ГЭК 200/0,5 (250 г) каждый раз превышала дозировку ГЭК 200/0,62 (150г) из-за разной концентрации стандартных растворов (10% и 6%). Другим важным выводом этого исследования стал факт, что период полувыведения ГЭК 200/0,62 значительно возрастает с 8,58 часов в первый день до 28,48 часов на 5-ый день, в то время как повторные эпизоды инфузии ГЭК 200/0,5 не приводят к увеличению периоды полувыведения. При использовании трехкомпартментальной модели конечные периоды полувыведения ГЭК 200/0,62 и ГЭК 200/0,5 составили соответственно 211 и 113 часов.
Низкомолекулярные пентакрахмалы (ГЭК 70/0,5)
Lehmann и соавт. изучали накопление в плазме и особенности почечной элиминации ГЭК 70/0,5 после пяти ежедневных эпизодов инфузии 835 мл ГЭК в день.15 Накопление в плазме было намного ниже по сравнению с ГЭК 450/0,7. Период полувыведения увеличивался в процессе применения раствора и достиг 90 часов на 10-ый день после завершения последнего введения ГЭК. Результаты этого исследования подтвердили значимость молярного замещения, так как эффект накопления ГЭК 70/0,5 был сравним с накоплением ГЭК 200/0,5.
Тетракрахмалы (ГЭК 130/0,4)
Низкозамещенный ГЭК 130/0,4 последний из разработанных ГЭК. Фармакокинетика однократно введенной дозы раствора была описана Waitzinger и соавт.16 Плазменный клиренс составил 31,4 мл/мин для 6% раствора и 26 мл/мин для 10% раствора. Это максимальные значения, описанные у ГЭК. В течение 72 часов после инфузии ГЭК в моче определялось 62 – 68% введенного ГЭК, что больше, чем у других крахмалов. Начальный период полувыведения составил 1,39 часа для 6% раствора и 1,54 часа для 10% раствора. Окончательный период полувыведения ГЭК 130/0,4 (6%) был 12,1 часа и 12,8 часа у ГЭК 130/0,4 (10%). Максимальная концентрация в плазме была выше при инфузии 10% раствора (6,5 против 3,7 мг/мл), но через 24 часа после окончания инфузии концентрация в плазме была ниже 0,5 мг/мл как при использовании 6% так и 10% раствора. Waitzinger и соавт. также изучили фармакокинетику ГЭК 130/0,4 (10% С2/С6>8) при инфузии 500 мл ежедневно в течение 10 последовательных дней.17 Кривые элиминации из плазмы в течение 24 часов после первого и последнего введения раствора оказались практически идентичными. Такие фармакокинетические параметры, как максимальная концентрация в плазме (7,8 и 7,3 мг/мл), площадь под кривой (32,8 мг· час/мл и 35,7 мг· час/мл), клиренс (23,7 мл/мин и 21,8 мл/мин) также были практически одинаковыми после первой и последней инфузии раствора. Мочевая экскреция была стабильной в течение всего времени исследования. Несмотря на большую общую дозу введенного препарата (5 л, что соответствует 500 г непосредственно вещества ГЭК), накопления ГЭК 130/0,4 в плазме крови не наблюдалось.
На рисунке 1 показана концентрация различных видов ГЭК в первые 24 часа после инфузии раствора в процентном отношении к максимальной концентрации ГЭК в плазме в каждом исследовании. Накопление в плазме крови в течение 24 часов происходит при молярном замещении ≥0,5 и максимально выражено у гетакрахмалов.
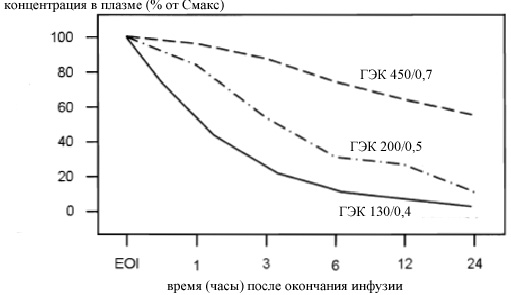 |
| Рисунок 1. Концентрация в плазме крови гидроксиэтилкрахмалов (ГЭК) 450/0,7,11 200/0,5,13и 130/0,416 после однократной инфузии 500 мл каждого раствора здоровым добровольцам. Инфузия ГЭК 450/0,7 и ГЭК 130/0,4 являлась обычной волемической нагрузкой (без предварительной кровопотери). Перед инфузией ГЭК 200/0,5 проводили эксфузию 400 мл крови. Значения концентрации в плазме, указанные в оригинальных публикациях, были переведены в процентные отношения от максимальной концентрации в плазме (% от Смакс) после инфузии ГЭК. |
В таблице 1 представлены значения клиренса различных ГЭК (гетакрахмал, гексакрахмал, пентакрахмал и тетракрахмал) после повторных инфузий растворов. Клиренс ГЭК 130/0,4 был в 23 раза выше, чем клиренс ГЭК 200/0,62 или ГЭК 450/0,7, и почти в пять раз выше, чем клиренс ГЭК 200/0,5.
Таблица 1.
Плазменный клиренс растворов ГЭК
после повторных инфузий здоровым добровольцам.
| Тип ГЭК (сноска) | Протокол инфузии | Общая доза (г) | Плазменный клиренс ГЭК (мл/мин) | Примечания |
| 450/0,711 | 30 г в день в течение 3 дней | 90 | < 1 | - |
| 200/0,6214 | 30 г в день в течение 5 дней | 150 | 0,983 | Средние значения для дней 1 - 5 |
| 200/0,514 | 50 г в день в течение 5 дней | 250 | 4,86 | Средние значения для дней 1 - 5 |
| 130/0,417 | 50 г в день в течение 10 дней | 500 | 22,8 | День1: 23,7; День 10: 21,8 |
Концентрация гидроксиэтилкрахмалов в плазме крови
Данные о концентрации ГЭК в плазме крови, зафиксированные в клинических исследованиях, совпадают с данными, полученными на здоровых добровольцах, при повторных введениях ГЭК. В исследовании Koltringer и соавт. с участием пациентов с поражением периферических артерий зарегистрировали увеличение концентрации ГЭК в плазме крови до окончания 12-ти дневного периода лечения, в течение которого пациентам вводили внутривенно 500 мл ГЭК 200/0,62 (6%) ежедневно.18 Максимальная концентрация в плазме крови составила 8,3 мг/мл. В исследовании, в которое были включены больные с цереброваскулярной патологией, пациентам ежедневно вводили ГЭК 200/0,62 (6%), ГЭК 200/0,5 (10%) и ГЭК 40/0,5 (старая маркировка 70/0,5; 6%).19 Суммарное количество введенного ГЭК составило 7,5 л. Концентрацию ГЭК в плазме крови измеряли до начала введения последней дозы препарата. Она составила 18 мг/мл, 12 мг/мл и 3 мг/мл для ГЭК 200/0,62, ГЭК 200/0,5 и ГЭК 40/0,5 соответственно, т.е. было выявлено накопление всех типов исследованных ГЭК (молярное замещение ≥ 0,5). Kromer и соавт. описали накопление ГЭК 200/0,5 в плазме крови при повторных введениях у пациентов с инсультами.20 Общая доза препарата была 7 л. Зарегистрированная максимальная концентрация в плазме составила 11,7 мг/мл после первого внутривенного введения и увеличилась до 12,4 мг/мл на пятый день лечения. Несмотря на уменьшение дневной дозы к пятому дню терапии, максимальная концентрация ГЭК оставалась стабильной до окончания периода терапии (10-ый день). Эти результаты сопоставимы с данными исследований с участием здоровых добровольцев, в которых подтверждено накопление ГЭК с молярным замещением выше 0,4 в плазме. Treib и соавт. сравнивали эффекты раствора ГЭК 200/0,5 (10%) с отношением С2/С6 5,7 и 13,7 у пациентов с цереброваскулярной патологией.21 Растворы вводили внутривенно до достижения общей дозы 7,5 л. Молекулярная масса вещества in vivo снижалась в двух группах. Выраженное снижение молекулярной массы и концентрации ГЭК в плазме крови на 3-й день в группе ГЭК с более низким отношением С2/С6. (Р< 0,01 для каждой группы). Гемодилюция была более продолжительной в группе ГЭК с более высоким отношением С2/С6. Результаты этой работы и исследования Jung и соавт.1 демонстрируют влияние отношения С2/С6 на фармакокинетические свойства ГЭК.
В результате повторных введений ГЭК 130/0,4 здоровым добровольцам не наблюдалось накопления препарата в плазме крови, в отличие от ГЭК 200/0,62, ГЭК 200/0,5 и ГЭК 70/0,5.17. Эти данные недавно подтвердили результаты другого исследования, в котором пациентам, перенесшим ортопедические операции, внутривенно вводили эквивалентные дозы ГЭК 130/0,4 и ГЭК 200/0,5 и сравнивали концентрацию ГЭК в плазме крови.22 Концентрация препаратов в плазме крови достоверно различалась, начиная с 5-го часа после операции, и в течение первого послеоперационного дня (2,6 мг/мл ГЭК 200/0,5 и 1,0 мг/мл ГЭК 130/0,4, Р< 0,01).
Клиническая эффективность гидроксиэтилкрахмалов
Основными лечебными и профилактическими эффектами внутривенного введения коллоидов являются поддержание и быстрое восстановление объема циркулирующей крови. Помимо гемодинамических эффектов ГЭК оказывают влияние на микроциркуляцию и тканевую оксигенацию, оптимизируя функционирование органа. В исследованиях, проведенных на здоровых добровольцах, ГЭК 130/0,4 (6%), в отличие от кристаллоидных растворов, улучшает тканевую оксигенацию при проведении обширных абдоминальных хирургических вмешательств23 и приводит к более быстрому и выраженному росту напряжения кислорода в тканях по сравнению с другими растворами ГЭК.24 Объяснением данных результатов является тот факт, что ГЭК 130/0,4 не только влияет на гемодинамику, но и снижает вязкость плазмы крови. 25
ГЭК отличаются от других фармакологических препаратов, таких как низкомолекулярные вещества или альбумин, тем, что имеют полидисперсную структуру и их молекулярная масса in vitro и in vivo различается. Фармакокинетические параметры, такие как период полувыведения, не могут быть определены абсолютно точно. Выведение ГЭК и их остаточная концентрация в плазме через 24 часа зависят от молярного замещения и отношения С2/С6, но не от средней молекулярной массы раствора во флаконе. Для ГЭК период полувыведения из плазмы не соответствует 50% снижению эффективности.
Внутрисосудистый объем жидкости зависит от ряда факторов, в том числе и от коллоидно-осмотического давления, которое возрастает вследствие инфузии коллоидных растворов. Длительность и выраженность волемического эффекта зависит не только от свойств вводимого раствора, способа введения, но и от особенностей организма, объема кровопотери, дозы вводимого раствора, скорости его введения. Длительная циркуляция раствора в кровотоке ранее рассматривалась как положительный фактор, который может способствовать увеличению продолжительности волемического эффекта. Ретроспективный анализ результатов исследования Kohler и соавт., проведенного в 1970х годах, не подтвердил данного предположения.26
Несмотря на медленное выведение ГЭК
450/0,7 не было выявлено значимого волемического эффекта через 24 часа после инфузии
у пациентов с нормальной функцией почек и у пациентов, которым проводился
гемодиализ. Эти данные были подтверждены результатами другого исследования, в
котором несмотря на высокую остаточную концентрацию ГЭК в плазме,8,9 волемический
эффект не проявлялся дольше 24 часов после последнего внутривенного введения
раствора. 11,27
Waitzinger и соавт. при помощи меченных радиоактивным хромом (51Cr) эритроцитов изучали выраженность и продолжительность волемического эффекта ГЭК 130/0,4 (6%) при внутривенном введении 500 мл раствора здоровым добровольцам.28 Авторы описали возрастание объема плазмы на период 4 – 6 часов. Изначально объем плазмы увеличился на 380 мл, и вернулся к прежнему значению в периоде между 8 – 24 часом после окончания внутривенного введения. Выявленный волемический эффект соответствовал результатами, полученными в исследовании Kohler и соавт. для ГЭК 200/0,5.13
Увеличение объема плазмы на 100% в условиях острой нормоволемической гемодилюции при введении ГЭК 130/0,4 (6%) было подтверждено результатами исследования с использованием двойной индикаторами метки.29James и соавт. сравнивали выраженность и продолжительность волемического эффекта ГЭК 130/0,4 и ГЭК 670/0,7 (6% раствор) на здоровых добровольцах после эксфузии 10% от расчетного объема крови.30 Отметили, что после кровопотери ГЭК 670/0,7 оказывал менее выраженный волемический эффект по сравнению с ГЭК 130/0,4. В ряде других исследований сравнивали фармакодинамические свойства ГЭК130/0,4 и ГЭК 200/0,5.31-33
Эффективность растворов была сопоставима при заготовки аутокрови в предоперационном периоде,31 при проведении гиперволемической гемодилюции перед кардиохирургическими операциями32и при осуществлении острой нормоволемической гемодилюции.33
В ряде двойных слепых исследований пытались определить объем ГЭК 130/0,4 и ГЭК 200/0,5, необходимый для стабилизации гемодинамики во время и после оперативного вмешательства.22,34,35 Gallandat Huet и соавт. показали, что объем ГЭК, необходимый для стабилизации гемодинамики в течение 16 часов после окончания операции у 59 пациентов с кардиохирургической патологией, составлял 2550 ± 561 мл и 2466 ± 516 мл соответственно.34 Эти результаты были подтверждены Langeron и соавт. при использовании данных растворов ГЭК при хирургических вмешательствах. Для стабилизации показателей гемодинамики у 100 пациентов, подвергшихся ортопедическим хирургическим вмешательствам, потребовалось введение ГЭК в объеме 1662 ± 641 мл и 1696 ± 675 мл в течение 5 часов после окончания операции.35 Во втором исследовании с участием пациентов ортопедического профиля, для стабилизации гемодинамики в первые сутки после операции использовали 2035 ± 446 мл и 2000 ± 424 мл коллоидных растворов.22 В этом исследовании было выявлено, что коллоидно- осмотическое давление оставалось неизменным в обеих группах. Этот факт может быть объяснен тем, что коллоидно-осмотическое давление зависит не от концентрации ГЭК, а от количества онкотически активных частиц. Так как выведение ГЭК 130/0,4 происходило быстрее, и его молекулярная масса in vivo была значительно ниже по сравнению с молекулярной массой ГЭК 200/0,5, то в грамме ГЭК 130/0,4 содержалось большее количество макромолекул, таким образом, компенсируя более быструю экскрецию.
В недавно проведенном в США двойном слепом исследовании Gandhi и соавт. изучали эффективность и безопасность ГЭК 130/0,4 и ГЭК 670/0,75 у пациентов, которым проводили обширные ортопедические операции.36 Внутривенное введение растворов осуществляли согласно разработанному алгоритму, учитывая показатели центрального венозного и артериального давления. Объем раствора, который потребовалось ввести интраоперационно, составил 1613 ± 778 мл в группе ГЭК 130/0,4 и 1584 ± 958 мл в группе ГЭК 670/0,7. Оба коллоидных раствора эффективно обеспечивали стабилизацию гемодинамики. Объем кристаллоидных растворов в составе инфузионной терапии в обеих группах был одинаков.
Клиническая безопасность гидроксиэтилкрахмалов
Фармакокинетические свойства ГЭК влияют на максимальную суточную дозу и безопасность препарата. ГЭК различаются по таким характеристикам, как влияние на коагуляцию, 36-43 накопление в тканях, 6,7 и потенциальное воздействие на функцию почек.4,44-55
Влияние на коагуляцию и накопление в тканях
Gandhi и соавт.36 показали, что после инфузии эквивалентных объемов ГЭК, надир активности фактора VIII через 2 часа после окончания оперативного вмешательства был значительно ниже для ГЭК 670/0,7, чем для ГЭК 130/0,4. Объем эритроцитарной массы, который потребовался для возмещения кровопотери, был значительно больше в группе гетакрахмала по сравнению с группой ГЭК 130/0,4 (13,8 против 8,0 мл/кг). Авторы сделали вывод, что ГЭК 130/0,4 оказывает эквивалентный волемический эффект, но меньше влияет на коагуляцию, по сравнению с ГЭК 670/0,7. Известно, что макромолекулы ГЭК взаимодействуют с тромбоцитами и фактором Виллебранда, способствуя снижению их содержания в плазме крови, и, опосредованно, могут привести к нарушениям гемостаза при введении больших доз медленно метаболизирующегося ГЭК.19,40,41 Последние исследования у пациентов кардиологического, урологического и ортопедического профиля, а также у больных после оперативных вмешательств на аорте и пострадавших с черепно-мозговой травмой показали, что инфузия ГЭК 130/0,4 в дозе 50 – 70 мл/кг не оказывает негативного влияния на гемостаз по сравнению с контрольными группами. 22, 53,55 -57 Важно, что кровопотеря во время кардиохирургических операций была одинаковой при использовании ГЭК130/0,4 и желатина, который обычно используют для уменьшения влияния на гемостаз.42В исследовании, в которое были включены 449 пациентов хирургического профиля, сравнивали объем кровопотери и потребности в гемотрансфузии на фоне применения ГЭК 130/0,4 и ГЭК 200/0,5. Kozek-Langenecker и соавт. выявили значительно меньшие потери эритроцитов (разница: - 149 мл) и, соответственно, меньший объем гемотрансфузии ( - 137 мл) при применении ГЭК 130/0,4. ГЭК 130/0,4 значительно меньше влиял на активированное частичное тромбопластиновое время и фактор Виллебранда по сравнению с ГЭК 200/0,5.
Положительные результаты в исследованиях по безопасности с использованием ГЭК 130/0,4 на взрослых позволили проводить первые исследования в педиатрической практике. Lochbuhler и соавт. сравнивали эффекты ГЭК 130/0,4 и человеческого альбумина у детей младше 24 месяцев при проведении хирургических вмешательств.58 Не было выявлено разницы в объеме раствора, который потребовался для стабилизации гемодинамики (группа ГЭК 130/0,4: 16 мл/кг; группа альбумина 17 мл/кг). Авторы сделали вывод, что применение ГЭК 130/0,4 допустимо и безопасно в исследуемой популяции, особенно учитывая воздействие на гемостаз.
Депонирование ГЭК в тканях зависит от общей дозы введенного раствора, длительности введения59 и вида ГЭК.6,7 Депонирование препарата в тканях и длительная циркуляция в плазме крови должны быть минимизированы. ГЭК 130/0,4, который характеризуется быстрой деградацией, минимально депонируется в тканях и имеет короткий период циркуляции в плазме, по сравнению с другими видами ГЭК. Данные недавно проведенного исследования, в которое были включены пациенты хирургического профиля, с использованием больших доз ГЭК130/0,4 (50 мл/кг) свидетельствуют о незначительном депонировании крахмала в тканях и влиянии на гемостаз (хотя депонирование в тканях организма не может быть измерено у живого человека).
Результаты этого исследования подкреплены данными исследований на животных.56,57 Авторы приведенного исследования56,57 так же, как и Neff и соавт. (до 70 мл/кг/день ГЭК
130/0,4 в течение нескольких дней)53 не отмечали признаков метаболического ацидоза,
хотя препараты приготовлены на основе раствора хлорида натрия. Рисунок 2 подтверждает, что при использовании около 2 л ГЭК 130/0,4 на основе солевого раствора
в ортопедической хирургии не приводит к значительному снижению pH или избытку
оснований (ранее не опубликованные данные Jungheinrich и соавт.22).
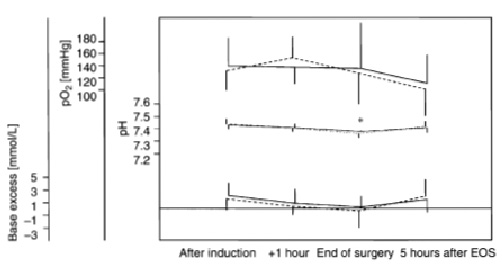 |
| Рисунок 2. Периоперационные показатели газового состава артериальной крови во время ортопедических операций (ранее не опубликованные данные Jungheinrich и соавт.)22 группа ГЭК 130/0,4 в 0,9% р-ре NaCl (сплошная линия), контрольная группа ГЭК 200/0,5 в 0,9% р-ре NaCl (пунктирная линия) *P<0,05 ЕOS, end of surgery – окончание операции base excess (mmol/L) – избыток оснований mmHg – мм рт.ст. аfter induction – после вводного наркоза +1 hour – через один час end of surgery – окончание операции 5 hour after EOS – через пять часов после окончания операции |
Dieterich и соавт. выявили, что ГЭК 200/0,5 с концентрацией в плазме < 30 мг/мл не снижает фагоцитарную активность моноцитов.60 Согласно результатам исследований концентрация в плазме более 25 мг/мл нежелательна даже при повторных введениях больших доз пентакрахмалов или тетракрахмалов.14,22 Влияние ГЭК на почки Результаты некоторых исследований указывают на то, что применение ГЭК может способствовать прогрессированию почечной недостаточности или вызывать морфологические изменения почечной ткани44,47,49 Эти выводы не могут быть отнесены ко всем видам ГЭК или другим группам пациентов.51 Ряд исследований не подтверждает наличие нежелательных эффектов на почки.45,46,52 В исследованиях с применением ГЭК 130/0,4, который быстро метаболизируется и выводится из организма, у пациентов группы риска по почечной недостаточности (предшествующая почечная недостаточность средней и тяжелой степени, пожилые пациенты, терапия высокими дозами ГЭК при черепно- мозговой травме) нежелательных эффектов со стороны почек зарегистрировано не было.4,48,53 Sakr и соавт. (данные проспективного исследования Sepsis Occurrence in Acutely ill Patients (SOAP) study) изучали эффекты ГЭК на почечную функцию у 1057 больных в критическом состоянии.54,61 Показаниями для заместительной почечной терапии являлись причины, не связанные с инфузией ГЭК, такие как рак крови, сепсис, сердечно-сосудистая недостаточность и изначально нарушенная функция почек. Инфузия ГЭК не влияла на функцию почек и не приводила к необходимости проведения заместительной почечной терапии.
Godet и соавт. применяли ГЭК 130/0,4 (6%, С2/С6>8) и 3% раствор желатина у пациентов, с предшествующей почечной недостаточностью, подвергшихся хирургическому вмешательству на брюшном отделе аорты.55 Применение ГЭК 130/0,4 и желатина было одинаково безопасно, периоперационное применение ГЭК 130/0,4 не приводило к прогрессированию почечной недостаточности у пациентов с предшествующим повреждением почек по сравнению с желатином.
Существует несколько причин, по которым в исследованиях с применением медленно метаболизируемых ГЭК (молярное замещение ≥ 0,5) получают различные результаты. Во- первых, существует ограничение максимальной дозы, и противопоказания к использованию препаратов. ГЭК противопоказано применять при анурии, не связанной с гиповолемией, так как почки единственный орган, участвующий в элиминации ГЭК. Во- вторых, следует избегать введения гиперонкотических растворов, не комбинируя инфузионную терапию с кристаллоидными растворами. Гиперонкотическое состояние, особенно спровоцированное введением декстранов или 20% раствора альбумина, может привести к почечной недостаточности. Гломерулярная фильтрация не может происходить, когда градиент гидростатического давления равен или ниже градиента онкотического давления. Раннее лечение этого состояния может разрешить почечную недостаточность.62 В-третьих, необходимо принимать во внимание различия фармакокинетики ГЭК. Депонирование в тканях и длительная циркуляция в плазме не являются специфическими эффектами для определенного вида крахмала, но сильно различаются в первом, втором и третьем поколениях ГЭК.
Заключение
Растворы ГЭК сильно различаются в зависимости от фармакокинетики, максимальной суточной дозы и профиля безопасности. Разработка новых молекул ГЭК преследует цель обеспечения более быстрого и полного выведения препаратов. Для ГЭК последнего поколения (молярное замещение 0,4) клиренс в 23 раза выше, чем у гетакрахмалов первого поколения и в пять раз выше, чем у второго поколения пентакрахмалов. Соответственно, накопление в тканях может быть уменьшено и аккумуляция в плазме будет отсутствовать после многократных введений. В нескольких двойных слепых исследованиях, было показано, что волемический эффект ГЭК 130/0,4 эквивалентен ГЭК 200/0,5 и ГЭК 670/0,75. Ранее сделанное предположение о том, что пролонгированная циркуляция ГЭК в сосудистом русле обусловливает более длительный волемический эффект, не подтвердилось. Медленный метаболизм ГЭК не обеспечивает значимый волемический эффект через 24 часа после последнего введения ГЭК.
Научная дискуссия по поводу возможных побочных эффектов ГЭК на функцию почек не закончена. Наличие фармакологических различий ГЭК, особенно таких, как скорость метаболизма и почечная экскреция, у ГЭК 130/0,4 в сравнении с ГЭК 200/0,5 и ГЭК предыдущих поколений позволяют сделать вывод, что последнее поколение ГЭК оказывает наименьшее влияние на почечную функцию. ГЭК 130/0,4 (С2/С6>8) также оказывает минимальный эффект на систему гемостаза и снижает необходимость в гемотрансфузии по сравнению с ГЭК 200/0,5. Повышение безопасности использования ГЭК130/0,4 было признано Европейскими регуляторными органами63, а максимальная суточная доза возросла до 50 мл/кг, что является самой большой допустимой дозой среди всех растворов ГЭК.
Литература




