European Journal of Anaesthesiology 2006;23:183-189
Обзор
Анестезиологическое участие в операциях орбитальной декомпрессии для лечения эндокринной офтальмопатии
L. Stannard*, R. M. Slater*, B. Leatherbarrow**
* Manchester Royal Infirmary, Department of Anaesthetics;
** Manchester Royal Eye Hospital, Department of Ophthalmology, Manchester, UK
Краткое содержание
В этой статье лечение эндокринной офтальмопатии рассматривается с точки зрения хирургического вмешательства и анестезиологического участия. Здесь представлен опыт отделения, в котором выполняются такие операции
Ключевые слова: анестезия, общая; болезнь Грейвса; заболевания щитовидной железы; экзофтальм; хиругические процедуры, оперативные
Введение
Всё большему числу пациентов с эндокринной офтальмопатией выполняются операции орбитальной декомпрессии под общим наркозом. Безусловным показанием для этой операции, является потеря зрения в связи со сдавлением зрительного нерва, не отвечающим на лекарственную терапию, и наличие других показаний, включающих рецидивирующий подвывих глазного яблока, тяжёлый экзофтальм с кератопатией, необходимость косметической коррекции при выраженном экзофтальме, постоянная, не купируемая препаратами глазная боль и уменьшение выраженности экзофтальма перед удалением наружных глазных мышц (Рис. 1).
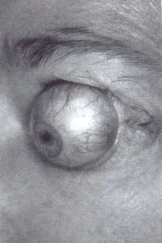
Рис. 1. Подвывих глазного яблока при эндокринной офтальмопатии.
Хирургическое вмешательство может срочно потребоваться при поражении зрительного нерва в результате сдавления, или при тяжёлой кератопатии, или избирательно при других показаниях. Ранее рассматривалось проведение анестезии у пациентов с нарушениями функции щитовидной железы (1), но немного написано об обезболивании при операциях орбитальной декомпрессии. Мы представляем наш собственный опыт проведения таких операций в специализированном центре пластической хирургии глаза.
Патофизиология
Болезнь Грейвса – это аутоиммунное заболевание, которое проявляется гипертиреозом и развитием характерной орбитопатии (2). Частота её составляет 1 - 2% в общей популяции, женщины заболевают чаще, чем мужчины (в соотношении 5-10:1), она развивается в широком возрастном промежутке (16 – 18 лет), средний возраст составляет 40 -50 лет (3 – 5). То же самое касается и эндокринной офтальмопатии, однако соотношение женщин и мужчин здесь другое - 2-5:1 (4, 6, 7), и развивается она более часто в 45 лет (8). Болезнь Грейвса характеризуется продукцией аутоантител, которые воздействуют на рецепторы для тиреотропного гормона (тиреоид-стимулирующего гормона), что приводит к росту щитовидной железы, а также к синтезу и секреции чрезмерных количеств тиреоидных гормонов. Эндокринная офтальмопатия считается близкой патологией, но представляет из себя отдельное органо-специфическое аутоиммунное нарушение с появлением аутоантигенов, которые являются мишенями для циркулирующих аутоантител(9). В результате этого аутоиммунного процесса происходит воспалительная инфильтрация клеток, и наружные мышцы глаза увеличиваются и принимают характерную веретенообразную форму (10). Может быть поражена одна или все наружные мышцы одного или обоих глаз. Затем в мышце происходят дегенеративные изменения и жировая инфильтрация, и, в конце концов, развивается фиброз (11). Также может гипертрофироваться жировая клетчатка орбиты. Орбита имеет форму пирамиды, это костная полость, содержащая наружные мышцы глаза и жировую ткань вместе с глазным яблоком, нервами и сосудами. Так как это закрытое пространство, увеличение этих тканей в объёме вызывает вторичное сдавление, которое в свою очередь отвечает за совокупность симптомов и проявлений офтальмопатии (Рис. 2).
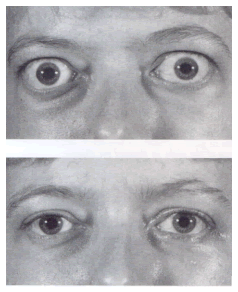
Рис. 2. До и после операции орбитальной декомпрессии по поводу эндокринной офтальмопатии.
Заболевание принимает особое течение, модель которого известна как кривая Rundle (12). Обычно заболевание прогрессивно ухудшается в течение нескольких месяцев, затем останавливается на уровне плато, затем постепенно годами идёт медленное улучшение, хотя полное выздоровление случается редко. У большинства пациентов все симптомы и проявления активности болезни представлены в первые 1 – 2 года. Большая часть пациентов с офтальмопатией имеет гипертиреоз, и, на самом деле, диагноз часто ставят одновременно, хотя небольшой процент пациентов в момент выявления офтальмопатии находятся в гипо- или эутиреоидном состоянии (13, 14).
У многих пациентов в семейном и своём анамнезе помимо болезни Грейвса могут быть другие аутоиммунные нарушения, наиболее часто такие, как сахарный диабет, миастения, пернициозная анемия и болезнь Адиссона. Это подтверждает мнение о том, что болезнь Грейвса является наследственной патологией (15). Однако, роль наследственных факторов в патогенезе ассоциированной офтальмопатии выяснена не окончательно, и не исключено, что факторы окружающей среды могут предрасполагать у некоторых людей с аутоиммунной патологией щитовидной железы к развитию тяжёлой офтальмопатии (16). Стресс (17, 18), инфекция и особенно курение (15, 19-22) являются примерами таких внешних пусковых факторов. Сопутствующие заболевания оказывают на соответствующую анестезиологическую тактику.
Клинические проявления
Эндокринная офтальмопатия может быть представлена множеством симптомов, которые могут появиться резко или развиваться постепенно. Они включают в себя изменения мягких тканей, такие как периорбитальный отёк, гиперемия, ощущение инородного тела, слёзотечение, резь или внешние изменения глаза в связи с экзофтальмом или изменения век (например, оттягивание или отставание век). Другие симптомы связаны с нарушением движения глаза, приводящим к диплопии, или с дисфункцией зрительного нерва, приводящей к снижению остроты зрения. Особенно неприятным симптомом является постоянная, сильная, ноющая боль в глазу.
Многие пациенты попадают к эндокринологу с симптомами заболевания щитовидной железы, до появления симптоматики офтальмопатии, хотя у некоторых могут быть такие тяжёлые проявления, что первым с ними сталкивается офтальмолог, и он распознаёт нарушение функций щитовидной железы.
Хотя диагноз эндокринной офтальмопатии поставить несложно по характерным клиническим проявлениям, рекомендуется провести тщательную оценку объективных показателей (23). Дальнейшее исследование пациента можно провести методами, позволяющими визуализировать орбиту, например, при помощи ультразвука, компьютерной томографии и магнитно-резонансной томографии (24, 25).
Лечение
Целью терапии является сдержать или остановить воспалительный процесс в глазнице, чтобы предотвратить потерю зрения от сдавления зрительного нерва. Последнее случается только у небольшого количества пациентов (4 – 5%) и вызвано повышением давления увеличенных наружных мышц глаза в верхушке орбиты (26). Это приводит к сдавлению зрительного нерва, и при отсутствии лечения может стать причиной необратимой потери зрения. Особому риску подвержены пациенты мужского пола с поздним началом болезни, диабетики и те, у которых отмечается значительная степень увеличения наружных глазных мышц (7,26, 27). Во многих случаях, при условии достижения эутиреоидного состояния, специфического лечения воспаления глаза не требуется, так как болезнь сама себя сдерживает. Однако, приблизительно у трети пациентов с эндокринной офтальмапатией воспалительный процесс может быть достаточно тяжёлым и риск сдавления зрительного нерва настолько высоким, что необходимо дальнейшее лечение.
Изначально пациенты с тяжёлой офтальмопатией ведутся консервативно, получая иммуносупрессивную терапию кортикостероидами, время от времени дополняемую такими антиметаболитами как азатиоприн, циклоспорин, циклофосфамид, которые позволяют уменьшить дозу стероидов. Иногда применяется облучение ретробульбарного пространства. Эти виды лечения эффективны только в активную фазу болезни. Поэтому лекарственная терапия эффективно действует на воспалительные изменения и во многих случаях на сдавление (28), тогда как экзофтальм и рестриктивная миопатия, развивающиеся в исходе или в не актиной стадии заболевания, относительно резистентны к этим видам лечения (29, 30). К хирургической орбитальной декомпрессии прибегают в случаях неэффективности консервативной терапии, и обычно откладывают операцию, пока заболевание в активной фазе или процесс не разрешился. Важным исключением из этого правила является прогрессивное сдавление, которое не отвечает на медикаментозную терапию. В этой ситуации единственным вариантом для предотвращения окончательной потери зрения может быть срочная операция.
Хотя было проведено только несколько рандомизированных контролируемых исследований, сравнивающих различные направления лечения, последние 50 лет применение системных кортикостероидов считается наиболее эффективным вариантом доступного лечения. Внутривенное (в/в) назначение может в чём-то быть более эффективным, с более быстрым ответом и , возможно, меньшим количеством побочных эффектов (31, 32). Около 60% пациентов хорошо отвечают на терапию стероидами, но иногда требуются высокие дозы, превышающие 100 мг/сут преднизолона в течение нескольких месяцев. Могут развиться потенциально опасные побочные эффекты, такие как асептический некроз головки бедра, пептические язвы, сахарный диабет, остеопороз с патологическими переломами, глаукома, катаракта, психические расстройства и предрасположенность к оппортунистическим инфекциям. Также в комбинации со стероидами использовалось облучение орбиты. Стероиды обеспечивают краткосрочный, быстрый эффект, перед тем как разовьётся эффект лучевой терапии. В последствии стероиды постепенно отменяются. Такая комбинированная терапия оказалась лучше, чем применение одних стероидов (33). Этот вариант лечения особенно подходит пациентам, у которых развивается сдавление зрительного нерва, резистентное к одной иммуносупрессивной терапии (или у которых побочные эффекты такой терапии заставляют поменять тактику). Хирургическая декомпрессия при отсутствии противопоказаний является альтернативным методом для этих пациентов.
Хирургическое лечение
Существует два главных подхода к проведению хирургической декомпрессии, оба из которых подразумевают уменьшение давления на содержимое орбиты. Первым способом является удаление жировой клетчатки орбиты, что существенно уменьшает объём содержимого орбиты, а вторым – удаление одной из костных стенок орбиты, что увеличивает объём полости орбиты. Возможна комбинация этих двух вариантов.
Можно использовать различные хирургические доступы к этим костным поверхностям и жировой клетчатке: трансантральный (доступ Caldwell Luc), транскарункулярный, бикорональный, через медиальный угол глаза (Lynch), трансназальный эндоскопический, трансконъюнктивальный через нижнее веко (отворот нижнего века), субцилиарный отворот нижнего или верхнего века или латерального угла глаза. Каждый доступ имеет свои достоинства и преимущества.
В прошлом, хирургическая декомпрессия орбиты выполнялась тем пациентам, которым не удавалось проводить консервативное лечение в активную фазу болезни (в случаях тяжёлой компрессионной невралгии или кератопатии). Однако, всё чаще проводятся плановые операции при рецидивирующем подвывихе глазного яблока, глазной боли и особенно при уродливом экзофтальме (34).
Ретроспективный анализ
Мы провели ретроспективный анализ историй болезни пациентов в нашем отделении, которым была выполнена хирургическая орбитальная декомпрессия одним хирургом за 9-летний период. Всего было сделано 98 операций декомпрессии 60 пациентам (45 женщин, 15 мужчин, возраст 15-76 лет, средний возраст 51 год). Тридцати семи пациентам выполнялась двухсторонняя декомпрессия (причём семи из них были выполнены одномоментные операции, тогда как у тридцати оставшихся оперировали каждый глаз отдельно с промежутком, по крайней мере, в один месяц). Двадцати трём требовалась только односторонняя декомпрессия. Пять из 60 пациентов оперировались повторно по 7 раз.
Основными показаниями для операций в нашей группе пациентов были сдавление зрительного нерва (п = 33), уродующий экзофтальм (п = 24) и кератопатия (п = 23). У тридцати восьми из 60 пациентов было более одного показания для операции.
Всем нашим пациентам выполнялась двухсторонняя (медиальная и латеральная) или трехсторонняя (медиальная, латеральная и нижняя) декомпрессия с удалением или без удаления жировой ткани доступом через веко. Этот доступ был выбран в связи с тем, что он реже вызывает ятрогенную диплопию (34, 35), чем трансантральный (36 – 38), и позволяет безопасно удалить жировую клетчатку орбиты. Удаление медиальных и латеральных стенок с глубоким просверливанием большого крыла клиновидной кости приводит к равномерному пролапсу мышц и оказывает меньшее влияние на подвижность глаза.
Постоперационная диплопия случается с разной частотой при трансантральном доступе и доступе через веко. (34, 39, 40). Эти различия вызваны не только разными хирургическими методиками, но и выборкой пациентов. В нашем исследовании диплопия развивалась у 15% и ухудшалась у 33% пациентов. Пациенты с более тяжёлой предоперационной миопатией более склонны к развитию диплопии после операции, также как и те, у которых имеется компрессионная нейропатия.
Участие анестезиолога
Предоперационная подготовка пациентов перед орбитальной декомпрессией подразумевает вовлечение офтальмолога и эндокринолога, отвечающих за ведение этих пациентов. Это гарантирует, что все пациенты, идущие на операцию (и, следовательно, которым будет дан общий наркоз) будут в эутиреоидном состоянии. В нашем обзоре у 58 из 60 пациентов был гипертиреоз в анамнезе, но перед операцией уровень Т4 и тиреотропного гормона был нормальным. Согласно предыдущим сообщениям (13, 14) у оставшихся двух пациентов был констатирован эутиреоз по клиническим и лабораторным данным.
Наличие других аутоиммунных заболеваний, наиболее часто сахарного диабета, и большая распространённость курения у таких пациентов (с ассоциированными заболеваниями) особенно беспокоят анестезиолога. В нашей группе половина пациентов были умеренными или злостными курильщиками.
Тридцать шесть пациентов относились к I классу по ASA , тогда как у остальных 24 были различные заболевания, а у шести 2 или 3 сопутствующие патологии. К ним относились: сахарный диабет 1 или 2 типа; диагностированные перед назначением высоких доз стероидных гормонов (п = 11), астма (п = 9), хроническая обструктивная болезнь лёгких (п = 8), патологическое ожирение (п = 6), артериальная гипертензия (п = 5), аритмии (п = 5), ишемическая болезнь сердца (п = 3), воспалительные заболевания кишечника (п = 2), и церебро-васкулярные заболевания (п = 1). Высокая частота диабета существенна, поскольку он часто расценивается как фактор риска плохого эффекта на любую терапию (39).
Пациента принимали преднизолон перед 54 из 98 операций декомпрессии в ежедневной дозе от 5 до 80 мг. Низкие дозы назначались не для лечения офтальмопатии, а для лечения хронических лёгочных заболеваний, тогда как высокие дозы были необходимы для уменьшения глазного воспаления. Длительное использование высоких доз стероидов для лечения пациентов, которым планируется общий наркоз, выдвигает некоторые проблемы. Это увеличенный риск инфекции, и, следовательно, все манипуляции должны выполняться со скурпулёзным соблюдением асептики. При наличии диабета может быть затруднён контроль уровня гликемии из-за комбинации операционного стресса и лечения стероидами. Дополнительное введение стероидов во время операции пациентам, получавшим эти препараты в предоперационном периоде, обычно рекомендуется при опасности развития острой надпочечниковой недостаточности. Легко ранимая кожа и ломкость сосудов затрудняют внутривенное введение препаратов, так как повышается риск возникновения кровоподтёков. Это также важно для хирург,поскольку любое интраорбитальное кровотечение является потенциальной угрозой для зрения в связи с давлением ретробульбарных геморрагий. Необходимо предоперационное исследование нарушений свёртываемости, и по возможности надо прекратить приём всех антикоагулянтов.
Необходимость дальнейших исследований зависит от природы заболеваний, выявленных перед операцией. Однако основным является визуализация орбит радиологическими методами. Компьютерная томография позволяет исключить другую патологию, вызвавшую экзофтальм, и помочь хирургу определить относительный вклад в экзофтальм увеличения наружных мышц глаза и гипертрофии жировой ткани. Она также покажет состояние и анатомическую конфигурацию придаточных пазух носа и, что важно, положение решётчатой пластинки, которую можно повредить во время декомпрессии на медиальной стенке глазницы, что может вызвать вытекание спинно-мозговой жидкости.
Продолжительность анестезии варьирует от длительности операции и от того, планируется ли односторонняя или двухсторонняя декомпрессия. Средняя продолжительность анестезии у наших пациентов составила 134 минуты для односторонней и 184 минуты для двусторонней операции. Пациент должен быть, таким образом, подготовлен для пролонгированного наркоза, и особое внимание нужно уделить положению, а именно точкам давления у пациентов с легко ранимой кожей. Пациента нужно держать в тепле и контролировать температуру тела.
Глаз в состоянии экзофтальма можно легко травмировать при введении в наркоз, особенно при слабом закреплении маски, что приводит к давлению на глазное яблоко и задеванию роговицы, которая плохо защищена оттянутыми веками. Пациенты с аксиальной миопией подвержены ещё большему риску. Метод, выбранный анестезиологом, должен подразумевать, что хирургическое вмешательство при оперативной декомпрессии может ограничиться минимальными разрезами кожи, а может быть расширено до углублённого исследования орбиты. Для хирурга важно сразу проверить у пациента остроту зрения в послеоперационном периоде. Ведь главной целью является то, чтобы пациент после операции был внимателен, чувствовал себя спокойно и не испытывал послеоперационной тошноты и рвоты.
В нашей группе мы использовали либо сбалансированное введение летучих агентов (изофлуран, севофлуран или энфлуран), кислород с закисью азота и ремифентанил или фентанил (первый в виде инфузии, второй в виде повторных болюсных введений), либо полностью внутривенный наркоз с использованием ремифентанила, контролируемое введение пропофола и кислорода воздуха. Теоретическое преимущество последней техники заключается в том, что она обеспечивает стабильность сердечно-сосудистой системы и снижает частоту развития послеоперацинной тошноты и быстрого пробуждения.
Во всех описанных случаях применялось обезболивание, обеспечивающее нормальный уровень артериального давления. Хотя иногда рекомендуется индуцировать гипотонию, наша хирургическая бригада просила поддерживать давление на нормальных цифрах, чтобы распознать любое кровотечение и устранить его интраоперационно.
Перед введением в наркоз все наши пациенты получали внутривенно антибиотики и ацетазоламид. Последний препарат уменьшал внутриглазное давление, что позволяло более легко выполнять субпериостальную диссекцию и отодвигать глазное яблоко, так как это улучшало видимость задней части медиальной стенки глазницы. Эндотрахеальная интубация (with a south-facing tube and a throat pack) использовалась во всех случаях для предотвращения риска контаминации дыхательных путей при попадании выделений из носа и крови. Для уменьшения риска носового кровотечения (и для помощи в операции) в ноздрю по направлению к среднему углу глаза помещался тампон, смоченный 5% раствором кокаина. По возможности пациенту придавалось положение с приподнятой головой с шеей в горизонтальном положении для улучшения венозного оттока. При использовании оперативного доступа через веко, как в нашем исследовании, хирург инфильтрирует нижнее веко 0.5% бупивакаином и 1:200000 адреналином (3 мл) за пять минут до начала операции. Это уменьшает интраоперационное кровотечение и обеспечивает обезболивание после операции.
Обезболивание особенно важно для пациентов , которым выполняют декомпрессию, так как это улучшает качество проверки остроты зрения после операции, что очень важно для раннего выявления осложнений. В добавление к сбалансированному обезболиванию, упомянутому ранее, в 34 случаях во время операции внутривенно вводился кеторолак в дозе 10 мг, тогда как внутримышечный миперидин (50 мг) только в трёх. Показатели боли после операции, определяемые, когда пациент попадал в палату, через 10 минут и перед выпиской составили 0 в 84% случаев. Во время пребывания в стационаре, 49% пациентов принимали только лёгкие обезболивающие препараты (смеси парацетамола и кодеина), 27% вообще не требовались анальгетики. Исследования, касающиеся зависимости частоты возникновения послеоперационной боли от хирургического подхода, ещё не опубликованы.
Хирургические манипуляции в области орбиты часто вызывают развитие интраоперационной брадикардии, которая обусловлена глазосердечным рефлексом из-за давления на наружные мышцы глаза, а также послеоперационной тошноты и рвоты. В 30% случаев требовалось назначение таких холиноблокирующих препаратов, как атропин или гликопирролат при возникновении брадикардии при вытягивании глазного яблока во время операции. Послеоперациооная тошнота и рвота не была отмечена в 92% случаев; в 43% случаев во время операции не проводилась терапия антиэметиками. В 64% случаев во время операции внутривенно вводился ондансетрон в дозе 4 мг. После операции 4 мг ондансетрона вводилось в 8 % случаев.
Существует несколько потенциальных осложнений операций орбитальной декомпрессии. Предшествующая диплопия может ухудшиться или развиться после операции, и может потребоваться хирургическая коррекция. Очень редким, но разрушающим осложнением операционной декомпрессии является слепота, которая может развиться после чрезмерного кровотечения, сильного вытягивания глазного яблока или прямого повреждения во время удаления жировой клетчатки глаза. После операции важно постоянно наблюдать за глазом, чтобы вовремя обнаружить внезапную боль, экзофтальм, снижение остроты зрения и развитие относительного афферентного зрачкового дефекта. Ни один из наших пациентов не потерял зрение.
Частым осложнением является временная интраорбитальная анестезия при выполнении декомпрессии дна глазницы. Одиннадцать процентов пациентов в нашем исследовании испытали её в различной степени, но за 12 месяцев у всех эти симптомы прошли. В других исследованиях сообщается о похожих результатах (40, 42, 43). Однако существуют сообщения о случаях необратимой потери чувствительности на лице (41, 44, 45) , два из которых развились после вмешательства трансантральным и один транскраниальным доступом. Риск можно минимизировать при тщательном удалении костей и минимальном использовании диатермии рядом с нервом.
Редким, но особенно важным осложнением, которого должен опасаться анестезиолог, является вытекание цереброспинальной жидкости с риском развития менингита. Вытекание цереброспинальной жидкости произошло в двух из рассмотренных случаев. Анестезиолог устанавливал дренаж в эндолюмбальное пространство, что способствовало закрытию дефекта и заживлению. В одном из случаев дефект прикрывался частью мышцы, заимствованной от круговой мышцы глаза нижнего века. Оба случая закончились благополучно, без последствий, ситуация нормализовалась через 24 часа. Похожий случай был описан в одном исследовании (46), где манипуляция проводилась бикорональным доступом, тогда как в других исследованиях (42, 45) нет указаний на вытекание церебро-спинальной жидкости. Чтобы предотвратить это осложнение, важно обеспечить хорошую визуализацию медиальной стенки глазницы, и чтобы анатомия решётчатой ямки (учитывая её близость к решётчатой пластинке) сканировалась на компьютерном томографе перед операцией.
В нашем обзоре не наблюдались никакие другие потенциальные осложнения орбитальной декомпрессии. К ним относятся: кровотечения, воспаление жировой клетчатки, низкое положение глазного яблока и эпифора. Потери крови составляли менее 10 мл и во время операции требовались только поддерживающие растворы. Однако сообщается о случаях потери 100-200 мл крови (45).
Один из наших пациентов переносил цереброваскулярное осложнение в течение двух дней после операции, и после выписки из больницы, что привело к постоянной утрате трудоспособности. Где-то в другом месте сообщается о лёгком ударе во время операции (44). Пациенту в нашем исследовании выполнялась односторонняя операция при сдавлении зрительного нерва, перед операцией у него не было выявлено никакой существенной патологии, за исключением того, что пациент являлся умеренно злостным курильщиком. В одном исследовании продолжительность госпитализации после операции орбитальной декомпрессии составила 6 дней (45), но 72% пациентов в нашем обзоре были выписаны в первый послеоперационный день. Остальных выписывали домой на второй день. После операции нашим пациентам назначался недельный курс системных антибиотиков и курс системных кортикостероидов с постепенным снижением дозы. Их обучали массажу нижнего века в первый день после операции, и рекомендовали делать его как минимум 6 недель. Все осматривались через неделю после операции. В дальнейшем наблюдение зависело от ситуации. Определённому количеству наших пациентов выполнялась хирургическая коррекция косоглазия, и операция по поводу репозиции век, перед тем как они полностью избавились от орбитопатии.
Признание
Краткий обзор нашей работы был представлен на ежегодном собрании Общества Британской Офтальмологической Анестезиологии.
Список литературы
1. Farling РА. Thyroid disease. ВуJ Anaesth 2000; 85: 15-28.
2. Weetman АР. Thyroid-associated еуе disease: pathophysiology. Lancet 1991; 338: 25-28.
3. Tunbridge WMG, Everend DC, Наll R et al. The spectrum of thyroid disease in а community: the Whickham survey. Clin Endocrinol 1977; 7: 481--493.
4. Jacobson DH, Gorman СА. Endocrine ophthalmopathy: current ideas concerning etiology, pathogenesis and treatment. Endoc Rev 1984; 5: 200-220.
5. van der Wal KGH, de Visscher JGAM, Boukes RJ, Smeding В. Surgical treatment of Graves orbitopathy: а modified balanced technique. Int J Оrаl Maxillofac Surg 2001; 30: 254-258.
6. Marcocci С, Bartalena L, Bogazzi F, Panicucci М, Pinchera А. Studies оn the occurrence of ophthalmopathy in Graves’ disease. Acta Endocrinol 1989; 120: 473--478.
7. Perros Р, Crombie AL, Matthews JNS, Kendall- Taylor Р. Age and gender influence the severiry of thyroid-associated ophthalmopathy: А study of 101 patients attending а combined thyroid-eye clinic. Clin Endocrinol 1993; 38: 367-372.
8. Bartley GB, Fatourechi V, Kadrmas EF et al. Тhе incidence of Graves’ ophthalmopathy in Olmsted County, Minnesota. Ат J Ophthalmology 1995; 120: 511-517.
9. Atabay С, Tyutyunikov А, Scalise D. Serum antibodies reactive with еуе muscle membrane antigens are detected in patients with non-specific orbital inflammation. Ophthalmology 1995; 102: 145-153.
10. Prummel MF, Suttorp SM, Wiersinga WM, Verbeck АМ, Mourits МР, Koornneef L. А new ultrasonographic method to detect disease activity and predict response to immunosuppressive treatment in Graves’ ophthalmopathy. Ophthalmology 1993; 100: 556-561.
11. Weetman АР, Cohen S, Gatter КС, Fells Р, Shine В. Immunohistochemical analysis of the retro-bulbar tissues in Graves’ ophthalmopathy. Clin Ехр Immunol1989; 75: 222-227.
12. Rundle FF, Wilson CW. Development and course of exophthalmos and ophthalmoplegia in Graves’ disease with special reference to the effect of thyroidectomy. Clin Science 1945; 5: 177-194.
13. Solomon DH, Chopra IJ, Chopra U, Smith FJ. Identification of subgroups of eurhyroid Graves’ ophthalmopathy. New Engl J Med 1977; 296: 181-185.
14. Lazarus JН. Relation Between Thyroid Еуе Disease and Туре of Treatment of Graves’ Hyperthyroidism. Thyroid 1998; 8: 437.
15. Carey С, Skosey С, Pimmananeni КМ, Barsona СР, DeGroot L. Thyroid abnormalities in children of parents who have Graves’ disease: possible pre-Graves’ disease. Metabolism 1980; 29: 369-376.
16. Villanueva R, Inzerillo АМ, Tomer Y et al. Limited genetic susceptibility to severe Graves’ ophthalmopathy: nо role for CТLA-4 but evidence for an environmental etiology. Thyroid 2000; 10: 791-798.
17. Hadden DR, McDevitt А. Environmental stress and thyrotoxicosis: absence of an association. Lancet 1974; 2: 577-578.
18. Winsa В, Adamii НО, Bergstrom R. Stressful life events and Graves’ disease. Lancet 1991; 338: 1475-1479.
19. Prummel MF, Wiersinga WM. Smoking and risk of Graves’ disease.JAMA 1993; 269: 479--482.
20. Pfeilschifter J, Ziegler R. Smoking and endocrine ophthalmopathy: Impact of smoking severity and current vs. lifetime cigarette consumption. Clin Endocrinol 1996; 45: 477-481.
21. Mann К. Risk of smoking in thyroid-associated orbitopathy. Ехр Clin Endocrinol Diabetes 1999; 107: 164-167.
22. Tallstedt L, Lundel G, Таubе А. Graves’ ophthalmopathy and tobacco smoking. Acta Endocrinol 1993; 129: 147-150.
23. Anonymous. Classification of еуе changes of Graves’ disease. Thyroid 1992; 2: 235-236.
24. Utech CI, Кhatibnia U, Winter PF, Wulle KG. MR Т2 relaxation time for the assessment of retro-bulbar inflammation in Graves’ ophthalmopathy. Thyroid 1995; 5: 185-193.
25. Bailey СС, Kabala J, Laitt R et al. Magnetic resonance imaging in thyroid еуе disease. Еуе 1996; 10: 617-619.
26. Neigel JМ, Rootman J, Belkin RI et al. Dysthyroid optic neuropathy: Тhе crowded orbital арех syndrome. Ophthalmology 1988; 95: 1515-1521.
27. Kendler DL, Lippa J, Rootman J. Тhе initial clinical characteristic of Graves’ orbitopathy vary with age and sex. Аrсh Ophthal1993; 111: 197-201.
28. Perros Р, Kendall-Taylor Р. Medical Treatment for Thyroid Associated Ophthalmopathy. Thyroid 2002; 12: 241-244.
29. Вurсh НВ, Wartofsky L. Graves’ ophthalmopathy: current concepts regarding pathogenesis and management. Endocr Rev 1993; 14: 747-793.
30. Claridge KG, Ghabrial R, Davis G et al. Combined radiotherapy and medical immunosuppression in the management of thyroid еуе disease. Еуе 1997; 11: 717-722.
31. Werner Sc. Prednisone in emergency treatment of malignant exophthalmos. Lancet 1966; 1: 10004-10007.
32. Kendall-Taylor Р, Crombie AL, Stephenson АМ, Hardwick М, Hall К. Intravenous methylprednisolone in the treatment of Graves’ ophthalmopathy. Br Med J 1988; 297: 1574-1578.
33. Bartelena L, Marcocci С, Chiovato L et al. Orbital cobalt irradiation combined with systemic corricosteroids for Graves’ ophthalmopathy: Comparison with systemic corricosteroids alone.J Clin Endocrinol Metab 1983; 56: 1139-1144.
34. McCord CD. Current trends in orbital decompression. Ophthalmology 1985; 92: 21-31.
35. Leone CR, Piest KL, Newman RJ. Medial and lateral wall decompression for thyroid ophthalmopathy. Ат J Ophthalmol 1989; 108: 160-166.
36. Fatourechi V, Garrity JА, Bartley GB. Graves’ ophthalmopathy: results of transantral orbital decompression performed primarily for cosmetic indications. Ophthalmology 1994; 101:938-942.
37. Garrity JA, Fatourechi V, Bergstralh ЕJ et al. Results of transantral orbital decompression in 428 patients with severe Graves’ ophthalmopathy. Ат J Ophthalmol 1993; 116: 533-547.
38. Shorr N, Neuhaus RW, Baylis HI. Ocиlar motility problems after orbital decompression for dysthyroid ophthalmopathy. Ophthalmology 1982; 89: 323-328.
39. Mourits МР, Koornneef L, Wiersinga WM, Prummel MF, Berghout А, vаn der Gaag R. Orbital decompression for ТАО bу inferomedial, bу inferomedial plus lateral, and bу coronal approach. Ophthalmology 1990; 97: 636-641.
40. Hutchinson ВМ, Kyle РМ. Long-term visual outcome following orbital decompression for dysthyroid еуе disease. Еуе 1995; 9: 578-581.
41. Tallstedt L, Papatziamos G, Lundblad L, Anggard А. Results of transantral orbital decompression in patients with thyroid-associated ophthalmopathy. Acta Ophthalmol Scand 2000; 78: 206-210.
42. McNab АА. Orbital decompression for thyroid orbitopathy. Aust N Z J Ophthalmol 1997; 25: 55-67.
43. Paridaens D, Hans К, vаn Buitenen S, Mourits МР. Тhе incidence of diplopia following coronal and translid orbital decompression in Graves’ orbitopathy. Еуе 1998; 12: 800-805.
44. Linnet J, Hegedus L, Bjerre Р. Results of а neurosurgical two-wall orbital decompression in the treatment of severe thyroid associated ophthalmopathy. Acta Ophthalтol Scand 2001; 79: 49-52.
45. Michel О, Oberlander N, Neugebauer Р, Neugebauer А, Rubmann W. Follow-up of transnasal orbital decompression in severe Graves” ophthalmopathy. Ophthalmology 2001; 108: 400-404.
46. Goldberg RA, Weinberg DA, Shorr N, Wirta D. Maximal, three-wall, orbital decompression through а coronal approach. Ophthalmic Surg Lasers 1997; 28: 832-843.

