
двухмесячный научно-образовательный журнал
"Тольяттинский медицинский консилиум" 2011г. № 3-4Микробиологический мониторинг – основа рациональной стратегии
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
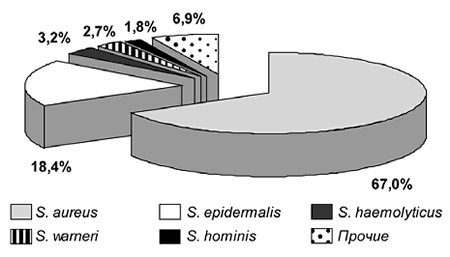 |
Рис. 1. Видовая структура стафилококков при парапротезной инфекции. |
Частота выделения метициллинорезистентных штаммов S. aureus (MRSA) составила 31,2%, S. epidermidis (MRSE) 55,7%. Наиболее активными в отношении штаммов стафилококков были ванкомицин, фузидиевая кислота, рифампицин (рис.2). Активность ампициллина/сульбактама и амоксициллина/клавуланата в отношении грамположительных бактерий существенно не различалась, что позволило объединить данные по этим АМП. Частота выделения штаммов S. aureus и S. epidermidis, резистентных к ИЗ-аминопенициллинам, соответствует частоте выделения штаммов MRSA и MRSE. Таким образом, при выделении метициллино-чувствительных штаммов стафилококков ИЗ-аминопенициллины, с учетом хорошей биодоступности форм для перорального применения, могут быть препаратами выбора для длительных курсов антибактериальной терапии при парапротезной инфекции.
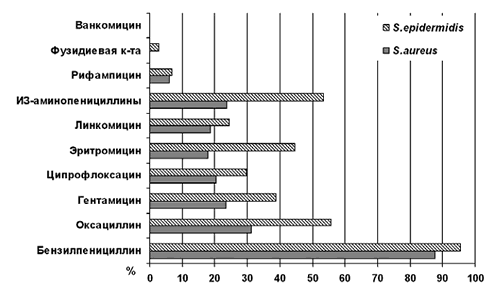 |
Рис. 2. Антибиотикорезистентность (%) госпитальных штаммов S.aureus (n=372)и S.epidermidis (n=102) за период 2007-2009 гг. |
Как видно из рисунка 2 штаммы S. epidermidis по сравнению с изолятами S. aureus характеризуются большей резистентностью ко всем исследуемым антимикробным препаратам за исключением ванкомицина. Анализ антибиотикорезистентности других видов коагулазонегативных стафилококков не проводился в связи с малым количеством выделенных штаммов (суммарно за 3 года от 3 до 13 штаммов).
Частота выделения штаммов Enterococcus spp. при парапротезных инфекциях, вызванных грамположительными микроорганизмами, за исследуемый период составила 10,9%, из них 59,1% - штаммы E. faecalis, 21,1% – E. fecium, остальные виды выделены из раневого отделяемого в 19,8% случаев. Большинство изолятов Enterococcus spp. входили в состав микробных ассоциаций (63,4%). Наиболее активными в отношении изолятов E. faecalis (таб.1) были ванкомицин, имипенем/циластатин. ИЗ-аминопенициллины показали большую активность в отношении данного микроорганизма по сравнению с ампициллином. Установлено, что большая часть (60-70%) штаммов E. faecalis сохраняют чувствительность к ципрофлоксацину, гентамицину и ампициллину. Штаммы E. faecium отличались более высокой резистентностью к исследуемым антибактериальным препаратам за исключением ванкомицина (таб. 1).
Таблица 1.
Уровень антибиотикорезистентности штаммов E. faecalis и E. faecium за 2007-2009 гг.
| Антибиотики | Уровень резистентности (%) | |
| E. faecalis (n=36) | E. faecium (n=15) | |
| Ампициллин | 26,5 | 70 |
| ИЗ-аминопенициллины | 10,3 | 60 |
| Ванкомицин | 0 | 0 |
| Гентамицин | 36,8 | 50 |
| Имипенем/циластатин | 11,0 | 45,5 |
| Меропенем | 75,7 | 100 |
| Ципрофлоксацин | 33,0 | 45,5 |
Как видно из таблицы 2, все выделенные штаммы основных представителей грамположительных возбудителей парапротезной инфекции были чувствительны к линезолиду. Хорошую активность в отношении стафилококков показали фосфомицин, моксифлоксацин. Кроме того, большинство выделенных штаммов были чувствительны к ко-тримоксазолу и тетрациклину. Высокий уровень резистентности установлен для клиндамицина.
Таблица 2
Резистентность ведущих грамположительных возбудителей парапротезной инфекции
к дополнительному перечню антибактериальных препаратов в 2009 гг.
| Антибактериальный препарат | Резистентность (%) | ||
| S.aureus (n=102) |
S.epidermidis (n=23) |
E.faecalis (n=16) |
|
| Клиндамицин | 22,5 | 68,2 | 100 |
| Линезолид | 0 | 0 | 0 |
| Моксифлоксацин | 16,3 | 5 | 38,5 |
| Бисептол | 2 | 22,2 | - |
| Фосфомицин | 8 | 9,5 | - |
| Тетрациклин | 22,8 | 40,9 | 76,9 |
Ведущее положение в спектре грамотрицательных возбудителей глубокой ИОХВ после эндопротезирования коленного или тазобедренного суставов занимает семейство энтеробактерий (в среднем 6,6%), в т. ч. штаммы E.cloacae – 3,2%, E.coli – 1,7%, K. pneumoniae – 1,7%. Неферментирующие бактерии представлены штаммами P.auroginosa и A.calcoaceticus/baumannii complex, доля которых составила 3,5 и 4,4% соответственно.
Высокая резистентность изолятов E. cloacae отмечена к ампициллину, приперациллину, доксициклину, цефазолину, цефтазидиму. АМП с ингибиторами ?-лактамаз показывают несколько большую активность в отношении данного микроорганизма (таб.3), однако, чувствительность выделенных штаммов к амоксициллину/сульбактаму остается низкой. Наиболее эффективными были пиперациллин/тазобактам, цефоперазон/сульбактам, цефепим, ципрофлоксацин, карбапенемы, тобрамицин, диоксидин и колистин, хорошая чувствительность сохраняется к цефалоспоринам 3 поколения. Выделенные изоляты E.coli обладают наибольшей резистентностью к пенициллинам, ампициллину/сульбактаму, цефалоспоринам, гентамицину, ципрофлоксацину, доксициклину, тетрациклину и ко-тримоксазолу. Максимально активным в отношении E. coli были цефоперазон/сульбактам, карбапенемы, амикацин, тобрамицин, диоксидин и колистин, к которым были чувствительны все штаммы данного микроорганизма. Большинство штаммов E.coli было чувствительно к нетилмицину. Выделенные изоляты K. pneumoniae обладают наибольшей среди представленных видов энтеробактерий резистентностью к АМП (таб.5). Наибольшую активность против штаммов K. pneumoniae сохраняют пиперациллин/тазобактам, карбапенемы, диоксидин и колистин.
Таблица 3
Антимикробная резистентность (%) изолятов энтеробактерий, выделенных от пациентов
с парапротезной инфекцией за период 2007-2009 гг.
| Антимикробный препарат | Микроорганизм | ||
| Enterobacter cloacae (n=22) |
Escherichia coli (n=14) |
Klebsiella pneumoniae (n=13) |
|
| Пенициллины и ингибиторзащищенные пенициллины | |||
| Ампициллин | 84,2 | 66,7 | 100 |
| Ампициллин/сульбактам | 38,4 | 46,6 | 50 |
| Пиперациллин | 50 | 57,1 | 80 |
| Пиперациллин/тазобактам | 0 | 0 | 18,2 |
| Цефалоспорины и ингибиторзащищенный цефалоспорин | |||
| Цефотаксим | 12,5 | 41,7 | 66,7 |
| Цефтриаксон | 13,3 | 42,8 | 75 |
| Цефтазидим | 26,1 | 28,6 | 53,3 |
| Цефоперазон | 18,2 | 66,7 | 100 |
| Цефоперазон/сульбактам | 0 | 0 | 50 |
| Цефепим | 0 | 28,6 | 40 |
| Карбапенемы | |||
| Имипенем | 0 | 0 | 0 |
| Меропенем | 0 | 0 | 0 |
| Аминогликозиды | |||
| Гентамицин | 27,3 | 38,5 | 85,7 |
| Нетилмицин | 13,3 | 13,3 | 72,7 |
| Амикацин | 9 | 0 | 57,1 |
| Тобрамицин | 0 | 0 | 0 |
| Фторхинолоны | |||
| Ципрофлоксацин | 4,3 | 57,1 | 64,3 |
| Другие АМП | |||
| Диоксидин | 0 | 0 | 0 |
| Доксициклин | 33,3 | 28,6 | 25 |
| Ко-тримоксазол | 16,7 | 35,2 | 85,7 |
| Колистин | 0 | 0 | 0 |
| Тетрациклин | 0 | 50 | 12,5 |
Выделенные штаммы P.aeruginosa отличались высоким уровнем резистентности к амикацину, гентамицину, пиперациллину, цефалоспоринам III-IV поколений, ципрофлоксацину, меропенему, азтреонаму (таб.4). Наиболее активными в отношении P.aeruginosa являлись тобрамицин, пиперациллин/тазобактам, цефоперазон/сульбактам, колистин, имипенем. Высокую активность в отношении выделенных штаммов показал диоксидин.
Таблица 4
Антибактериальная резистентность изолятов P.aeruginosa, выделенных у пациентов
с парапротезной инфекции за период 2007-2009 гг.
| Антибактериальный препарат |
Резистентность (%) n=40 |
| Аминогликозиды | |
| Тобрамицин | 4,0 |
| Амикацин | 25,6 |
| Гентамицин | 39,5 |
| Антисинегнойные пенициллины | |
| Пиперациллин/Тазобактам | 6,7 |
| Пиперациллин | 21,1 |
| Карбапенемы | |
| Имипенем | 10,7 |
| Меропенем | 51,5 |
| Антисинегнойные цефалоспорины | |
| Цефоперазон/сульбактам | 12,5 |
| Цефтазидим | 17,5 |
| Цефепим | 22,5 |
| Цефоперазон | 24 |
| Фторхинолоны | |
| Ципрофлоксацин | 47,5 |
| Другие | |
| Диоксидин | 0,25 |
| Колистин | 6,2 |
| Азтреонам | 45,5 |
Выделенные штаммы A. calcoaceticus/baumannii complex отличались высоким уровнем резистентности к аминогликозидам, пиперациллину, цефалоспоринам III-IV поколений, ципрофлоксацину (таб.5). Наиболее активными в отношении данных патогенов являлись карбапенемы, колистин, диоксидин.
Таблица 5
Антибактериальная резистентность изолятов A. calcoaceticus/baumannii complex,
выделенных у пациентов с парапротезной инфекции за период 2007-2009 гг.
| Антибактериальный препарат |
Резистентность (%) n=21 |
| Аминогликозиды | |
| Амикацин | 40,9 |
| Тобрамицин | 60 |
| Гентамицин | 66,7 |
| Антисинегнойные пенициллины | |
| Пиперациллин/Тазобактам | 50,0 |
| Пиперациллин | 75,0 |
| Карбапенемы | |
| Меропенем | 12,5 |
| Имипенем | 13,3 |
| Антисинегнойные цефалоспорины | |
| Цефоперазон/сульбактам | 33,3 |
| Цефоперазон | 69,2 |
| Цефтазидим | 73,6 |
| Цефепим | 85,7 |
| Фторхинолоны | |
| Ципрофлоксацин | 57,1 |
| Другие | |
| Колистин | 0 |
| Диоксидин | 4,7 |
Обсуждение. Этиология инфекционных болезней является основой для формирования стратегии и тактики антибактериальной терапии. Однако, несмотря на значительное разнообразие возбудителей, основную группу (около 70% в среднем за исследуемый период), на которую приходится подавляющая часть этиологии глубокой ИОХВ после эндопротезирования крупных суставов, составляют грамположительные микроорганизмы, в основном штаммы Staphylococcus spp. и Enterococcus spp..
Штаммы стафилококков способны продуцировать значительное количество факторов вирулентности (поверхностные белки, способствующие колонизации тканей, полисахаридная капсула, белок А, каротиноиды, каталазу, токсины, экзотоксины и др.) большинство из которых встречается у S. aureus. При условии целостности эпителиальных покровов иммунокомпетентный организм успешно противостоит развитию стафилококковых инфекций. Однако, в условиях травмы, хирургического стресса на фоне тяжелой операции, к которым относят эндопротезирование суставов и реконструктивные операции на костях, особенно сопровождающиеся массивной кровопотерей, снижением иммунореактивности, условно-патогенные микроорганизмы проявляют свои вирулентные свойства и вызывают развитие гнойно-септических инфекций.
Несмотря на то, что в настоящее время описано более 30 видов стафилококков, основное клиническое значение, как наиболее вирулентный, имеет S. aureus, штаммы которого в данном исследовании были изолированы в 67% случаев выделения стафилококковой флоры. S .epidermalis и другие коагулазонегативные стафилококки по данным литературы характеризуются значительно меньшей клинической значимостью [4]. Теми немногими факторами вирулентности, которые имеют данные микроорганизмы, являются капсульные и другие адгезины, обеспечивающие прикрепление микроорганизмов к белкам внеклеточного матрикса (фибриногену, фибронектину и др.). Отложение данных белков практически на всех имплантатах создает благоприятные условия для адгезии стафилококков и формирования биопленки, в составе которой становятся недоступными для воздействия факторов иммунной системы пациента и антибактериальных препаратов. Микроорганизмы в составе биопленок обладают повышенной выживаемостью в присутствии антибиотиков как за счет снижения доступа препарата, так и перераспределения генов антибиотикорезистентности через внеклеточную ДНК и/или прямую передачу генов из клетки в клетку [5]. По-видимому, именно это свойство приводит к тому, что, санация гнойного очага при парапротезной инфекции без удаления компонентов эндопротеза, как правило, неэффективна даже на фоне этиотропной АБТ, и зачастую приводит в последующем к рецидиву гнойно-септического процесса.
Из 372 изолятов S.aureus, выделенных от пациентов с парапротезной инфекцией, более 80% были резистентны к бензилпенициллину, а, следовательно, к амино-, карбокси- и уреидопенициллинам. Стафилококковые β-лактамазы эффективно подавляются ингибиторами (клавуланатом, сульбактамом), в связи с чем ИЗ-аминопенициллины в ходе исследования показали в отношении золотистого и эпидермального стафилококка существенно большую активность чем бензилпенициллин (рис. 2). Остальные β-лактамы с потенциальной антистафилококковой активностью (цефалоспорины I, II и IV поколений и карбапенемы) сохраняют активность в отношении β-лактамазпродуцирующих штаммов.
По данным Л.С. Страчунского (2002) в России частота выделения изолятов MRSA в травматолого-ортопедических отделениях составила 41,6%. Согласно результатам, полученным в настоящем исследовании (рис. 2), устойчивость к оксациллину возбудителей парапротезной инфекции составила для S. aureus 31,2%, для S. epidermidis – 55,7%. Аналогичная ситуация наблюдается и в отношении других групп антибактериальных препаратов – в 1,5-2 раза выше резистентность изолятов S. epidermidis в отношении эритромицина, ципрофлоксацина, гентамицина, что, по-видимому, свидетельствует о перекрестной резистентности штаммов MRSE к препаратам разных групп. Таким образом, выделение штаммов MRSE из гнойного очага при парапротезной инфекции является неблагоприятным прогностическим признаком для эффективности антибактериальной терапии, так как длительное введение ванкомицина или прием линезолида в амбулаторных условиях представляется крайне затруднительным.
В ходе исследования было показано (рис.2), что около 70-80% изолятов S.aureus сохраняют чувствительность к гентамицину, ципрофлоксацину, эритромицину, линкомицину. В то же время, их применение существенно ограничивается тем, что, во-первых, все перечисленные препараты уступают β-лактамам в антистафилококковой активности, а, во-вторых, как уже говорилось выше, отмечается крайне высокая частота перекрестной резистентности у штаммов метициллинорезистентных стафилококков.
Несмотря на многолетнее использование в терапии парапротезной инфекции ванкомицина, до настоящего времени в клинике института не выявлено штаммов стафилококков, резистентных к данному препарату, и он остается препаратом выбора для АБТ инфекций, вызванных метициллинорезистентными стафилококками. Кроме того, установлено, что возможно расширить спектр антимикробных препаратов c антистафилококковой активностью для комбинированной этиотропной терапии парапротезной инфекции стафилококковой этиологии за счет моксифлоксацина, ко-тримоксазола, фосфомицина, доксициклина при подтвержденной чувствительности к ним выделенных возбудителей (таб.2).
Микробиологический мониторинг в отделении гнойной хирургии показал, что около 10% случаев инфекций протезированных суставов протекают с участием энтерококков. При этом в 63,4% случаев данные микроорганизмы входят в состав микробных ассоциаций, что подтверждает данные литературы о том, что при развитии клинически выраженной инфекции энтерококки могут участвовать в ее начальной стадии, индуцируя воспалительную реакцию при синергидных взаимодействиях с другими микроорганизмами, в дальнейшем не влияя на течение процесса [5, 6,]. Таким образом, только около 5% случаев парапротезных инфекций имеют энтерококковую этиологию, в связи с чем нецелесообразно говорить об эмпирической терапии энтерококковых инфекций после эндопротезирования крупных суставов, а при установленном участии штаммов Enterococcus spp. антибактериальная терапия должна быть этиотропной.
Наиболее активным в отношении энтерококков до настоящего времени остается ванкомицин. Остальными препаратами, обладающими антиэнтерококковой активностью в порядке её снижения, являются имипенем/циластатин, ампициллин/сульбактам, ципрофлоксацин, гентамицин и ампициллин. Однако все перечисленные препараты оказывают в отношении энтерококков только бактериостатическое действие. Необходимость в назначении схем АБТ, оказывающих бактерицидное действие в клинике травматологии и ортопедии возникает при развитии инфекции на фоне нейтропении или при невозможности удаления эндопротеза. Наиболее выраженный бактерицидный эффект можно получить при комбинированной терапии β-лактамами или ванкомицином в сочетании с аминогликозидом (гентамицином) [7], однако, надо учитывать, что последнее сочетание обладает крайне высокой нефротоксичностью, и при необходимости его применения требуется регулярный контроль клиренса креатинина у пациента, чтобы не допустить развитие острой почечной недостаточности.
Для терапии рецидивирующих глубоких ИОХВ после эндопротезирования крупных суставов, вызванных полирезистентными грамположительными микроорганизмами, можно применять линезолид, к которому в течение 2009 г. не было выделено ни одного резистентного штамма, и высокая эффективность которого при лечении инфекции костей и суставов показана в ряде исследований [8, 9, 10]. Однако надо учитывать, что рекомендуемая продолжительность приема линезолида – 28 суток, является недостаточной для терапии парапротезной инфекции.
В результате проведенного анализа показано, что грамотрицательные микроорганизмы гораздо реже являются возбудителями парапротезной инфекции. Выявлено, что из ?-лактамных антибиотиков наибольшую активность в отношении выделенных изолятов энтеробактерий сохраняют пиперациллин/тазобактам, цефоперазон/сульбактам и карбапенемы. При этом установлено, что полученные штаммы E. cloacae обладают лучшей чувствительностью к цефалоспоринам III поколения и ципрофлоксацину по сравнению с изолятами E.coli и K. pneumoniae. Чувствительность энтеробактерий к аминогликозидам различается в зависимости от вида микроорганизма: наибольшая резистентность к данной группе установлена у штаммов K. pneumonia, и антибактериального препарата: наименьшей активностью обладает гентамицин, наибольшей тобрамицин и амикацин (за исключением штаммов K. pneumonia). Кроме того, для пролонгированной антибактериальной терапии инфекций, вызванных энтеробактериями, при подтвержденной чувствительности, можно использовать в составе комбинированной терапии доксициклин и ко-тримоксазол.
Наибольшая антисинегнойная активность была установлена у тобрамицина, пиперациллина/тазобактама, цефоперазона/сульбактама, имипенема. При этом надо отметить, что наличие в составе АМП ингибиторов β-лактамаз повысило их активность в отношении штаммов A. calcoaceticus/baumannii complex: к пиперациллину резистентны были 75% изолятов, к пиперациллину/тазобактаму – 50%, к цефоперазону и цефоперазону/сульбактаму соответственно 69,2 и 33,3% штаммов. Наибольшая активность в отношении Acinetobacter spp. установлена для карбапенемов.
Высокоактивными АМП в отношении грамотрицательных патогенов являются колистин и диоксидин – антисептик, разрешенный для системного применения. Однако, колистин в настоящее время не зарегистрирован в РФ для системной антибактериальной терапии, а диоксидин обладает низким профилем безопасности и его назначение может быть оправданно, только выделением штамма, резистентного ко всем остальным антибиотикам.
В 20% случаев парапротезной инфекции были выделены ассоциации микроорганизмов, при этом около половины ассоциаций имели в своем составе грамотрицательные бактерии, что необходимо учитывать при назначении эмпирической терапии пациентам в случае острой клинической ситуации. На основе полученных результатов бактериологического мониторинга и анализа антибиотикорезистентности определен перечень антибактериальных препаратов для этиотропной терапии глубокой ИОХВ после эндопротезирования крупных суставов (табл. 6).
Таблица 6
Перечень антибактериальных препаратов для этиотропной терапии парапротезной инфекции
| Возбудитель | Препараты выбора | Альтернативные препараты |
| MSSA, MSSE |
оксациллин; цефалоспорины I-II поколения |
ампициллин/сульбактам амоксициллин/клавуланат клиндамицин* |
| MRSA, MRSE |
ванкомицин | ципрофлоксацин (±)1 моксифлоксацин (±)1 доксициклин (±)1 линезолид |
| Ампициллино- чувствительные Enterococcus spp. |
ампициллин (амоксициллин) (±)2 | ампициллин/сульбактам амоксициллин/клавуланат ципрофлоксацин* (±)2 |
| Ампициллино- резистентные E.faecalis |
ампициллин/сульбактам (±)2 | ванкомицин (±)2 имипенем/циластатин (±)2 моксифлоксацин (±)2 линезолид |
| Ампициллино- резистентные E.faecium |
ванкомицин (±)2 | линезолид |
| Enterobacteriacae spp.(E. cloacae, E. coli, K. pneumonia) |
ципрофлоксацин (±)3 цефтриаксон (±)3 пиперациллин/тазобактам (±)3 |
имипенем/циластатин (±)3 меропенем (±)3 |
| P. aeruginosae | цефтазидим + ципрофлоксацин или (±)3 цефоперазон + ципрофлоксацин или (±)3 |
цефоперазон/сульбактам (+)3 имипенем/циластатин (+)3 меропенем (+)3 |
| A. calcoaceticus/ baumannii complex |
цефтазидим цефоперазон ципрофлоксацин |
цефоперазон/сульбактам пиперациллин/тазобактам имипенем/циластатин, меропенем |
Примечание:
* - при аллергии на β-лактамные антибиотики;
1 - в комбинации с рифампицином или ко-тримоксазолом или фосфомицином;
2 - в комбинации гентамицином;
3 - в комбинации с амикацином, тобрамицином
Заключение. При отсутствии выраженных признаков гнойного процесса и интоксикации назначение АБТ инфекции протезированного сустава до проведения хирургического лечения является нерациональным и неэффективным. Применение АМП в таких случаях должно быть основано на результатах бактериологического исследования раневого отделяемого, аспирата или костного биоптата. В случае тяжелого состояния пациента препаратами выбора для незамедлительного назначения эмпирической АБТ парапротезной инфекции являются ванкомицин или линезолид, в сочетании с цефоперазоном/сульбактамом, пиперациллином/тазобактамом или карбапенемом, с последующим пересмотром антибактериальной терапии после идентификации возбудителя.
Таким образом, внедрение в клиническую практику рационально ограниченного списка антибиотиков является одним из способов управления антимикробной терапией в стационаре. Основой построения формуляра должны быть нозологическая структура пациентов, микробный пейзаж возбудителей инфекции и уровень их антибиотикорезистентности.
Литература
- Розенсон О.Л. Страчунский Л.С. Оценка стоимости и эффективности антибактериальной терапии. Русский медицинский журнал. 1998; 6(4): С. 251-258.
- Страчунский Л.С., Дехнич А.В., Белькова Ю.А. и др. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения в отношении Staphylococcus aureus: результаты российского многоцентрового исследования. КМАХ. 2002; 4(2): С. 157-163.
- Зайцев А. А. Анализ методов снижения расходов на антибактериальную терапию в стационаре. ГлавВрач. 2008; 11: С. 83-86.
- Сидоренко С.В. Микробиологические аспекты хирургических инфекций. Инфекции в хирургии 2003; 1: С. 22-27.
- Eaton T.J., Gasson M.J. Molecular screening of Enterococcus virulence determinants and potentional for genetic exchange between food and medical isolates. Appl. Environ. Microbiol. 2001; 67: Р. 1628-1635
- Сидоренко С.В., Яковлев С.В. Инфекции в интенсивной терапии. М.: Бионика. 2003; 208 с.
- Рак А.В. Амирасланов Ю.А., Борисов И.В. Хирургические инфекции опорно-двигательного аппарата. Остеомиелиты. В: Хирургические инфекции: практическое руководство под ред. И.А.Ерюхина, Б.Р. Гельфанда. С.А.Шляпникова. М.: Литтерра. 2006; С. 635-678.
- Rao N., Ziran B.H., Hall R.A., et al. Successful treatment of chronic bone and joint infections with oral linezolid. Clin. Orthop. Relat. Res. 2004; 427: Р. 67–71.
- Rayner C.R., Baddour L.M., Birmingham M.C. et al. Linezolid in the treatment of osteomyelitis: results of compassionate use experience. Infection. 2004; 32: Р. 8–14.
- Till M., Wixson R.L., Pertel P.E. Linezolid treatment for osteomyelitis due to vancomycin-resistant Enterococcus faecium. Clin.Infect Dis. 2002; 34: Р. 1412-1414