
двухмесячный научно-образовательный журнал
"Тольяттинский медицинский консилиум" 2012г. № 5-6Мониторинг газообмена и оксигенации
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
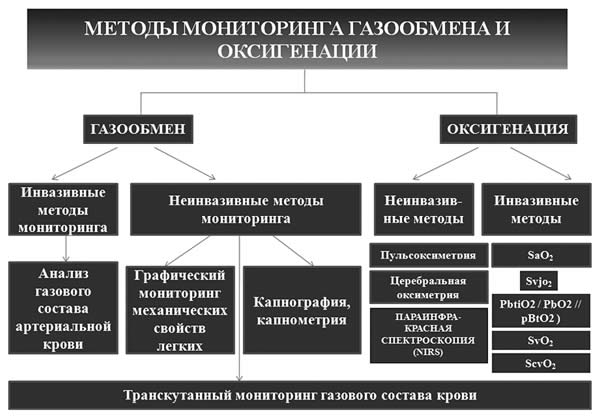 |
Рис. 1. Методы мониторинга газообмена и оксигенации в ОРИТ |
Для оценки оксигенации широко используются пульсоксиметрия, церебральная оксиметрия, параинфракрасная спектроскопия и ряд других методик, представленных на схеме, которые мы детально обсуждали в статье, посвященной мониторингу кислородного статуса у детей в критическом состоянии, поэтому мы позволим себе здесь не останавливаться на них подробно [8].
В последние годы широкое распространениев педиатрической, а также неонатальной реаниматологии и интенсивной терапии получили методики транскутанного измерения парциального давления кислорода в тканях и церебральной оксиметрии, что обусловлено их высокой степенью достоверности, возможностью оценки процессов оксигенации на тканевом уровне и малой инвазивностью.
Транскутанное измерение парциального давления кислорода в тканях отражает не только состояние процессов оксигенации на тканевом уровне, но и является скрининговым методом оценки нарушений кровообращения, что особенно важно в педиатрической практике, где использование инвазивных методов мониторинга гемодинамики крайне ограничено [9].
Существенным достоинством данных методов является возможность длительного проведения исследования (в течение нескольких суток) у детей всех возрастных групп, при этом врач имеет возможность комплексной оценки показателей оксигенации тканей и динамической оценки функционального состояния исследуемого органа.
Интегральный анализ сатурации гемоглобина пульсирующей крови (SpO2), парциального напряжения кислорода в артериальной крови и тканях, температуры тела и церебральной оксигенации (SctO2, %) позволяет предотвратить как гипо-, так и гипероксию, что крайне актуально для новорожденных в кри тическом состоянии.
При проведении церебральной оксиметрии необходим мониторинг температуры тела, особенно при проведении сеансов церебральной гипотермии у новорожденных в критическом состоянии, так как снижение температуры тела приводит к существенному снижению потребления кислорода.
Необходимо отметить, что референтные физиологические показатели церебральной оксигенации (SctO2, %) у новорожденных и детей старшего возраста, которые могут быть рекомендованы для широкого использования в клинической практике, в настоящее время отсутствуют, хотя у взрослых они известны и составляют 60-90%.
Снижение уровня церебральной оксигенации до 50-60% является пограничным и требует активного поиска причин снижения оксигенации головного мозга. Очень важно учитывать время, в течение которого у пациента отмечались указанные нарушения, так как вероятность неблагоприятного исхода прямо про порциональна времени гипоксемии.
Снижение показателей церебральной оксигенации до 50% и ниже является критическим уровнем и требует проведения незамедлительных терапевтических мероприятий, направленных на повышение SсtO2.
В ряде исследований, посвященных анализу эффективности церебральной оксиметрии у новорожденных в критическом состоянии, было продемонстрировано, что использование мониторинга оксигенации тканей головного мозга позволяет существенно уменьшить содержание кислорода в дыхательной смеси при проведении ИВЛ и оказывает благоприятное влияние на исход заболевания в целом.
Так, В.В. Эстрин и А.В. Симонова [10, 11] показали, что применение церебрального оксиметра позволяет существенно снизить длительность искусственной вентиляции, способствует уменьшению летальности и предотвращает гипероксию, о чем свидетельствуют низкие концентрации свободных радикалов кислорода и продуктов перекисного окисления липидов. В качестве референтных значений авторы использовали SctO2 для левого полушария около 80%, а для правого – около 85%.
Однако, в работе, выполненной P. Benni et al. [12] были получены данные, свидетельствующие о том, что можно придерживаться более низких показателей SctO2. Исследовав 30 новорожденных, длительность мониторинга которых составила более 1200 часов, авторы оценивали показатели SctO2 и SpO2. Было выяв лено, что средние значения SctO2 у пациентов в стабильном состоянии составили 65-90%, а значения SрО2 колебались при этом в диапазоне от 88 до 100%.
Авторы полагают, что столь значимые различия обусловлены тем, что церебральный оксиметр в большей степени оценивает сатурацию гемоглобина кислородом венозной крови, в то время как при пульсоксиметрии исследуется сатурация гемоглобина кислородом пульсирующей (артериальной крови).
Все указанные значения церебральной оксигенации, как в работе В.В. Эстрина и А.В. Симоновой [10, 11], так и P. Benni et al. [12] были получены на фоне нормальной температуры тела. В условиях гипо- или гипертермии показатели будут иными, что необходимо учитывать при интерпретации результатов.
Также было установлено, что использование церебральной оксиметрии позволяет избежать гипероксии, в то время как при проведении пульсоксиметрии это практически неосуществимо.
Одним из достоинств церебральной оксиметрии является возможность оценки оксигенации тканей в условиях тяжелой гипотермии, при выраженных нарушениях микроциркуляции, декомпенсированном метаболическом ацидозе и остановке сердца.
Аналогичные данные были получены в многочисленных исследованиях, посвященных применению церебральной оксиметрии у новорожденных, нуждающихся в экстракорпоральной мембранной оксигенации [13, 14, 15, 16].
Таким образом, церебральная (тканевая) оксиметрия является неинвазивным высокочувствительным методом мониторинга состояния регионарного кровотока и оксигенации тканей головного мозга или другого органа. Использование церебральной (тканевой) оксиметрии оправдано у всех пациентов, нуждающихся в искусственной вентиляции легких или любой другой респираторной поддержке с дотацией кислорода.
Одним из критериев оценки тяжести поражения дыхательной системы и эффективности газообмена и оксигенации у детей в критическом состоянии является широко используемое в клинической практике исследование газового и кислотно-основного состояния артериальной крови, которое позволяет оценить не только статус пациента в данный момент, но и отражает динамику течения патологического процесса [17].
Данный метод мониторинга состояния дыхательной системы является одним из наиболее достоверных, однако, он характеризуется достаточно высокой степенью инвазивности, что ограничивает его использование в педиатрической практике. Кроме этого, в большинстве стационаров первого и второго уровней нет необходимого лабораторного оборудования, что делает необходимым поиск других методовоценки газообмена и оксигенации.
В последние годы появился ряд работ, свидетельствующих о возможности использования в клинической практике различных эмпирических индексов, среди которых наиболее часто применяют индекс оксигенации и вентиляционный индекс.
Так как, в настоящее время среди клиницистов существует некоторая путаница при использовании этих индексов, мы опишем их более подробно. Следует также отметить, что в ряде случаев имеется несколько формул для расчета одного и того же индекса (напр. вентиляционного индекса), которые были предложены разными авторами (табл. 1).
Таблица 1
Эмпирические индексы для оценки эффективности вентиляции
| Индекс оксигенации | IO = (MAP x FiO2x 100%)/PaO2 |
| Индекс гипоксемии (индекс Горовица) | PaO2/FiO2 илиSpO2/FiO2 |
| Сатурационный индекс оксигенации | [FiO2 x MAP]/SpO2 |
| Индекс эффективности вентиляции | |
| Автор | Формула для расчета |
| Михельсон В.А., 1995 | ИВ = 3800/(PIP - РЕЕР) •f• pCO2 |
| Rivera RA, Butt W, Shann F. 1990 | ИВ= PaCO2x f x PIP / 1000 |
| Bohn D, Tamura M, et al., 1987; 1996 | ИВ = MAP x f |
| Фракция мертвого альвеолярного пространства | PаСО2– PETCO2 / PаСО2 |
В педиатрической практике наиболее широкое распространение для оценки эффективности газообмена и оксигенации тканей получил индекс гипоксемии или индекс Горовица, хотя некоторые авторы называют его индексом оксигенации.
Кроме этого, на сегодня имеется значительное количество исследований, которые доказали, что использование сатурации гемоглобина кислородом, измеренной с помощью датчика пульсоксиметра является высокоэффективным и достоверным методом расчета индекса гипоксемии [18, 19, 20, 21].
Особого внимания заслуживает исследование, выполненное Thomas N.J. et al. [22], где для оценки степени тяжести поражения легких использовали индекс гипоксии или индекс Горовица (SpO2/FiO2), индекс оксигенации ([FiO2x MAP]/PaO2) и сатурационный индекс оксигенации ([FiO2x MAP]/SpO2).
Авторами было доказано, что сатурационный индекс оксигенации обладает достаточно высокой чувствительностью и специфичностью, что позволяет использовать его для диагностики СОПЛ/ОРДС у детей. Одним из достоинств данного индекса является неинвазивность способа оценки сатурации и широкая доступность пульсоксиметрии в любом лечебно-профилактическом учреждении [22].
Кроме индексов, отражающих оксигенацию и вентиляционного индекса с целью оценки тяжести поражения паренхимы легкого и эффективности газообмена можно использовать исследование фракции мертвого альвеолярного пространства в конце вдоха, формула для расчета которой также представлена в табл. 2.
А.К. Ghuman et al. [23] продемонстрировали, что данный показатель является независимым критерием, позволяющим выявить пациентов с гипоксемической дыхательной недостаточностью и высоким риском летального исхода.
Одним из факторов, отражающих тяжесть поражения легких и эффективность проводимой терапии, является концентрация кислорода в дыхательной смеси, а также положительное давление конца выдоха, оценка которых также широко доступна в клинической практике [24].
Наиболее часто для оценки эффективности газообмена в клинической практике используется капнометрия и капнография – измерение парциального давления углекислого газа в конце выдоха.
Прообраз первого современного капнографа был создан в начале 50-х годов анестезиологом J. O. Elam и исследователем M. Liston на основе патента, попавшего в США из Германии после окончания второй мировой войны. К сожалению, первый прибор оказался очень громоздким и не был востребован. Клиническое применение инфракрасной спектроскопии стало востребованным после того, как Данию и США охватила эпидемия полиомиелита и множество пациентов нуждались в длительной искусственной вентиляции легких [25 26, 27].
В 1992 году капнометрия была включена в стандарт безопасности анестезии, рекомендованный Всемирной федерацией анестезиологов.
В настоящее время капнометрия и капнография используется не только для мониторинга эффективности газообмена, но и для диагностики правильного положения эндотрахеальной трубки, тромбоэмболии легочной артерии и оценки эффективности сердечно-легочной реанимации.
Наиболее часто капнометрия используется для диагностики гипо- и гипервентиляции, периодов апноэ и рециркуляции углекислого газа в контуре аппарата ИВЛ.
При гипервентиляции отмечае тся увеличение PETCO2более 43 мм рт. ст. и нарастание высоты волн капнограммы на дисплее. Следуе тотметить, что внезапная гиповентиляция регистрируется капнографом не сразу, а спустя несколько минут, в течение которых отмечается значительное повышение давления углекислого газа в тканях, крови и альвеолах, что является одним из существенных недостатков капнометрии и требует применения других методов оценки эффек-
тивности газообмена. В тоже время, при постепенном снижении минутного объема дыхания и
нарушениях газообмена измеряемая величина PETCO2 абсолютно достоверно отражае т степень
гиповентиляции.
Для гипервентиляции характерно значительное снижение PETCO2 менее 34 мм рт. ст. и уменьшение высоты волн капнограммы на дисплее.
Единственным и абсолютно достоверным критерием апноэ при проведении капнометрии и капнографии является отсутствие волн на капнограмме.
В ряде случаев капнометрия является методом диагностики тромбоэмболии легочной артерии и прогрессирующей гиповолемии, которые, также как и гипервентиляция, характеризуется снижением парциального давления углекислого газа в конце выдоха и уменьшением высоты волн капнограммы.
При появлении на дисплее капнографа признаков гиповентиляции необходимо проводить дифференциальную диагностику между увеличением альвеолярного мертвого пространства (гиповолемия) и гипервентиляцией, обусловленной параметрами искусственной вентиляции легких. В данной ситуации наиболее надежным методом диагностики является исследование газового состава и кислотно-основного состояния артериальной крови. При гипервентиляции разница между парциальным давлением углекислого газа в артерии и в конце выдоха будет нормальной, а при тромбоэмболии легочной артерии и гиповолемии она значительно увеличится.
Особое значение капнометрия и капнография имеют при проведении сердечно-легочной реанимации. На фоне остановки кровообращения при сохраненном дыхании (самостоятельном или искусственном) отмечается значительное уменьшение парциального давления углекислого газа в конце выдоха вплоть до нуля. При проведении непрямого массажа сердца уровень PETCO2 существенно снижен из-за уменьшения перфузии в малом круге кровообращения и образования мертвого альвеолярного пространства на фоне низкого сердечного выброса.
При проведении сердечно-легочной реанимации уровень PETCO2 обычно составляет 0,5-2,5%. Непрямой массаж сердца считается эффективным, если парциальное давление углекислого газа в конце выдоха превышает один процент.
В случаях, когда при проведении СЛР этого достичь не удается, необходимо исключить ситуации, препятствующие проведению эффективной СЛР (гиповолемия, тампонада сердца, напряженный пневмоторакс, массивная тромбоэмболия легочной артерии, гипервентиляция и др.).
Повышение уровня парциального давления углекислого газа в конце выдоха до 2,5% и выше при проведении непрямого массажа сердца свидетельствует об эффективности реанимационных мероприятий и восстановлении самостоятельного кровообращения. В тоже время следует помнить и о возможности увеличения PETCO2 на фоне инфузии раствора натрия гидрокарбоната, что требует проведения дифференциальной диагностики с помощью других методов мониторинга.
В ряде случаев при проведении сердечно-легочной реанимации возникают ситуации, когда на фоне биоэлектрической активности сердца самостоятельное кровообращение пациента не восстанавливается, что известно, как электромеханическая диссоциация. Капнографическим критерием электромеханической диссоциации является отсутствие быстрого и значительного повышения уровня PETCO2 на фоне восстановления сердечного ритма, что требует продолжения реанимационных мероприятий.
Существенным недостатком капнометрии и капнографии является отсутствие возможности использовать их у пациентов, нуждающихся в неинвазивной респираторной поддержке, например в неонатальной практике, где широко используется методика поддержания постоянного положительного давления в дыхательных путях с помощью назальных канюль и масок.
Одним из наиболее простых и неинвазивных методов оценки эффективности вентиляции является графический мониторинг состояния дыхательной системы с анализом основных показателей биомеханики легких, которые включают в себя комплайнс, резистентность и константу времени (табл. 2).
Таблица 2
Показатели внешнего дыхания и биомеханические свойства
| Характеристика | Новорожденные | Дети | Взрослые |
| Частота дыханий, мин | 20-60 | 20-30 | 12-20 |
| Дыхательный объем, мл/кг | 4-8 | 4-8 | 6-8 |
| Жизненная емкость легких, мл | 120 | 870-3100 | 4000 |
| Функциональная остаточная емкость, мл/кг | 25 | 35 | 40 |
| Комплайнс, мл/см H2O/кг | 1,5-2,0 | 2,5-3,0 | 100 |
| Резистентность, см H2O/л/с | 40 | 20 | 4-5 |
| Минутная вентиляция, мл/кг/мин | 240-480 | 70 | |
| Альвеолярная вентиляция мл/кг/мин | 100-150 | - | 60 |
| Константа времени, с | 0,12 | - | 0,5 |
Кроме вышеперечисленных показателей, особого внимания требует мониторинг дыхательного объема на выдохе, поскольку именно он отражает тот объем дыхательной смеси, который был доставлен в дыхательную систему пациента и использовался в процессе газообмена.
При проведении графического мониторинга крайне важно оценивать форму петли «Давление – Объем», анализ которой в настоящее время доступен при использовании практически любого аппарата искусственной вентиляции легких.
Указанная кривая имеет типичную «сигмовидную» форму с двумя точками перегиба: нижней и верхней, которые отражают минимальный и максимальный дыхательные объемы, поступающие в легкие пациента (рис. 2).
Нижняя точка перегиба отражает давление, необходимое для раскрытия и поддержания в расправленном состоянии ателектазированных альвеол, что позволяет подобрать оптимальный уровень положительного давления в конце выдоха (ПДКВ).
Экспериментальные и клинические исследования показали, что положительное давление в конце выдоха должно быть установлено выше нижней точки перегиба как минимум на 2 см Н2О, что предотвращает коллабирование альвеол на выдохе. Если ПДКВ установлено ниже нижней точки перегиба, то развивается ателектотравма.
Верхняя точка перегиба демонстрирует давление в альвеолах, которое возникает в момент доставки максимального дыхательного объема. Превышение показателей верхней точки перегиба может стать причиной гипервентиляции, волюмо- и баротравмы легкого. Дыхательный объем должен быть подобран таким образом, чтобы давление, возникающее при его поступлении в легкие пациента, не превышало значений верхней точки перегиба, чтобы не допустить перерастяжения альвеол.
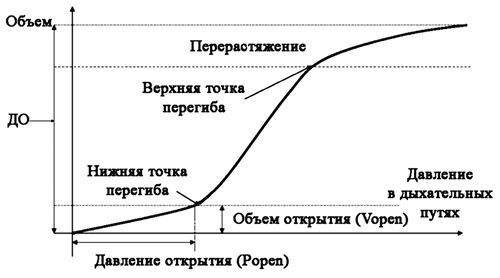 |
Рис. 2. Инспираторная часть статической кривой «давление – объем» (PV) |
Графический мониторинг петли «Давление – Объем» особенно важен при проведении маневра мобилизации альвеол, так как именно он отражает эффективность проводимого маневра и обеспечивает его безопасность для пациента [11].
Кроме указанных методов оценки эффективности газообмена в последние годы широко стали применять транскутанный мониторинг парциального давления углекислого газа в тканях, который имеет высокую степень корреляции с парциальным давлением углекислого газа в крови. Это позволяет избежать частых заборов проб крови для исследования газового состава крови и свидетельствует о необходимости широкого внедрения данного метода мониторинга в рутинную практику отделений реанимации и интенсивной терапии новорожденных [28].
Инновационными технологиями мониторинга газообмена и эффективности ИВЛ являются измерение внутриплеврального давления и электроимпедансная томография, позволяющие подобрать минимально необходимые и максимально безопасные параметры респираторной поддержки для конкретного пациента. Измерение внутриплеврального давления осуществляется путем введения специального датчика в нижнюю треть пищевода и обеспечивает оптимизацию положительного давления в конце выдоха, что особенно важно у пациентов c гипоксемической дыхательной недостаточностью [29].
При использовании электроимпедансной томографии аппарат подает микротоки и измеряет результирующее напряжение, которое отражает изменения импеданса в срезе грудной клетки, связанное с вентиляцией. Это позволяет получить томографические изображения и параметры, интерпретация которых дает возможность оценить регионарное распределение вентиляции, а также краткосрочные изменения объема легких в конце выдоха в определенном срезе грудной клетки [30].
Завершая обсуждение методов мониторинга эффективности газообмена и оксигенации у детей в критическом состоянии, можно сделать вывод, что на сегодня имеется множество вариантов неинвазивного и малоинвазивного мониторинга, позволяющих оптимизировать респираторную поддержку у данной категории пациентов и существенно улучшить результаты интенсивной терапии в целом.
Выбор конкретных методов мониторинга определяется возможностями стационара, квалификацией врача и особенностями течения заболевания у конкретного пациента.
Следует подчеркнуть, что использование только одного метода оценки эффективности респираторной поддержки у детей в критическом состоянии не позволяет своевременно и адекватно оценить происходящие изменения «вентиляционного» статуса пациента, что требует комплексного подхода и интегрального анализа всех имеющихся данных мониторинга вентиляции, газообмена и оксигенации.
Для корреспонденции:
- Александрович Юрий Станиславович – доктор медицинских наук, профессор, заведующий кафедрой анестезиологии-реаниматологии и неотложной педиатрии ФПК и ПП ГБОУ ВПО СПбГПМА Минздравсоцразвития России
e-mail: Jalex1963@mail.ru
Почтовый адрес: 195220 г. Санкт-Петербург, ул. Фаворского дом 15, корп.1, кв.131 - Пшениснов Константин Викторович – к.м.н., доцент кафедры анестезиологии-реаниматологии и неотложной педиатрии ФПК и ПП ГОУ ВПО СПбГПМА
e-mail: Psh_K@mail.ru
Почтовый адрес: 194291, г. Санкт-Петербург, ул. Руднева, д. 5 корп. 1, кв. 142.
Список литературы
- Гордеев В.И., Александрович Ю.С., Паршин Е.В. Респираторная поддержка у детей. Руководство для врачей. СПб.: ЭЛБИ-СПб. - 2009. - 176.
- Зильбер А.П. Этюды критической медицины. M.: МЕДпресс-информ. - 2006. - 568 с.
- Wolfler A., Calderoni E., Ottonello G. et al. Daily practice of mechanical ventilation in Italian pediatric intensive care units: a prospective survey./ Pediatr Crit Care Med. - 2011. - 12(2) :141-6.
- Santiago С.M. The practice of mechanical ventilation in pediatrics: Science, art, or a simple routine?/ Pediatric Critical Care Medicine. - 2011. 12 (2). P. 219-221.
- Crow Sheri, Oliver, William Jr. Prolonged mechanical ventilation: Does shorter duration of mechanical ventilation equal morbidity reduction for congenital heart disease patients?/ Pediatr Crit Care Med. - 2011. - 12 (3). - P. 368-369.
- Ventre K.M., Wolf G.K., Arnold J.H. Pediatric respiratory diseases: 2011 update for the Rogers’ Textbook of Pediatric Intensive Care./Pediatr Crit Care Med. - 2011. - 12 (3). - P. 325-338.
- Monteverde E., Fernandez A., Poterala R. et al. Characterization of pediatric patients receiving prolonged mechanical ventilation./Pediatr Crit Care Med. - 2011. 12 (6). - P. 287-291.
- Александрович Ю.С., Пшениснов К.В. Мониторинг кислородного статуса при критических состояниях у детей./ Тольяттинский медицинский консилиум. - 2011. - №5-6. - С. 7-13.
- Антонов А.Г., Ф.Ю. Рындин Транскутанный мониторинг газов крови. М.: 2010. - 48 c.
- Estrin V.V., Simonova A. V. Transcranial cerebral oximetry in newborn infants on mechanical ventilation as a method for prevention of hyperoxia and oxidative stress./ Crit Care. 2012; 16 (Suppl 1): P293.
- Эстрин В.В., Симонова А.В., Каушанская Е.Я. и др. Подбор режимов искусственной вентиляции легких у новорожденных с респираторным дистресс-синдромом с помощью транскраниальной церебральной оксиметрии// Материалы IV ежегодного конгресса специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество», 2009. С. 74
- Benni P., Chen B., Fenik J. et al. Cerebral and pulse oximetry monitoring of newborns – clinical observations./ Adv Exp Med Biol. 2005; 566: 195-201.
- Rais-Bahrami K., Rivera O., Short B.L. Validation of a noninvasive neonatal optical cerebral oximeter in veno-venous ECMO patients with a cephalad catheter./ J Perinatol. 2006; 26(10): 628-35.
- Fenik J.C., Rais-Bahrami K. Neonatal cerebral oximetry monitoring during ECMO cannulation./ J Perinatol. 2009. 29 (5). 376-81.
- Kim H.J., Park J.H. Cerebral and somatic oxygenation monitoring during pediatric aortic coarctation repair using near infrared spectroscopy.// European Journal of Anaesthesiology. 2011. 28 (48). 154
- Kussman B.D., Wypij D., DiNardo J.A. et al. Cerebral oximetry during infant cardiac surgery: evaluation and relationship to early postoperative outcome.// Anesth Analg. 2009. 108 (4). 1122-31.
- Хеннеси А.А.М., Джапп А.А. Анализ газов артериальной крови понятным языком./ пер. с англ. под ред. В.Л. Кассиля – М.: Практическая медицина, 2009. 140 с.
- Comparison of the SpO2/FIO2 ratio and the PaO2/FIO2 ratio in patients with acute lung injury or ARDS./ T.W. Rice, A.P. Wheeler, G.R. Bernard et al.// Chest. – 2007. – Vol. 132. – №2. – P. 410-
- Marraro G.A. SpO2/FiO2 vs PaO2/FiO2: are we ready to establish less invasive indicators for early diagnosis of acute respiratory distress syndrome?/ Pediatr Crit Care Med. – 2010. – Vol. 11. – №1. – P. 143-4.
- Derivation and validation of SpО2/FiО2 ratio to impute for PaО2/FiО2 ratio in the respiratory component of the Sequential Organ Failure Assessment score./ P.P. Pandharipande, A.K. Shintani, H.E. Hagerman// Сrit Care Med. – 2009. – Vol. 37. – №4. – P. 1317-21.
- Assessment of the pediatric index of mortality 2 with the PaO2/FIO2 ratio derived from the SpO2/FIO2 ratio: A prospective pilot study in a French pediatric intensive care unit./ S. Leteurtre, M. Dupre, A. Dorkenoo et al.// Pediatr Crit Care Med. – 2011. – Vol. 12. – №4. – e184-186.
- Thomas N.J., Shaffer M.L., Willson D.F. et al. Defining acute lung disease in children with the oxygenation saturation index./ Pediatr Crit Care Med. 2010. 11(1):12-7.
- Ghuman A.K., Newth C.J., Khemani R.G. The association between the end tidal alveolar dead space fraction and mortality in pediatric acute hypoxemic respiratory failure./ Pediatr Crit Care Med. 2012; 13(1): 11-5.
- Britos M., Smoot E., Liu K.D. et al. The value of positive end-expiratory pressure and FiОa criteria in the definition of the acute respiratory distress syndrome./ Crit Care Med. 2011. 39 (9): 2025-30.
- Зислин Б.Д., Чистяков А.В. Мониторинг дыхания и гемодинамики при критических состояниях. Екатеринбург, Сократ. 2006; 336 с.
- Шурыгин И.А. Мониторинг дыхания в анестезиологии и интенсивной терапии. СПб.: «Издательство «Диалект». 2003; 416 с.
- Базовый курс анестезиолога: учебное пособие/ под ред. Э.В. Недашковского, В.В. Кузькова – Архангельск, Северный государственный медицинский университет. 2010; 224 с.
- Александрович Ю.С., Печуева О.А., Пшениснов К.В. Маневр мобилизации альвеол в интенсивной терапии респираторного дистресс-синдрома у новорожденных./ Анестезиология и реаниматология. 2011. №1. С. 66-68.
- Ventre K.M., Wolf G.K., Arnold J.H. Pediatric respiratory diseases: 2011 update for the Rogers’ Textbook of Pediatric Intensive Care./ Pediatr Crit Care Med. 2011. 12 (3). 325-338.
- Talmor D., Sarge T., Malhota A. et al. Mechanical ventilation guided by esophageal pressure in acute lung injury./ N. Engl. J. Med. 2008; 359: 2095-2104