"Тольяттинский медицинский консилиум" 2014г. № 1-2
Трудности эмпирической деэскалационной терапии сепсиса
(клиническое наблюдение)
Ю.Л. Кецко, И.Г. Труханова, Е.В. Петровская, А.В. Лямин, А.Д. Гуреев
ГБОУ ВПО «СамГМУ» МЗ РФ, Клиники СамГМУ
Difficulties deescalation of empirical therapy for sepsis
«Концепция деэскалационной терапии содержит доказательства необходимости применения у пациентов с тяжелыми нозокомиальными инфекциями наиболее эффективных антимикробных препаратов в режиме стартовой терапии»
Белобородов В.Б.
Резюме
В статье представлены материалы клинического наблюдения со сравнительной оценкой эффек тивности деэскалационной эмпирической и индивидуальной (целенаправленной) антибактериальной терапии у иммунокомпрометированного пациента. Рассматривается вопрос актуальности ранней бактериологической диагностики, её влияние на прогноз у пациентов, изменение микробиологического пейзажа многопрофильного ОРИТ.
Ключевые слова: деэскалационная антибактериальная терапия, сепсис, ускоренные методы бактериологического анализа.
По современным рекомендациям (Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and SepticShock, 2012) антибактериальная (АТ) терапия входит в «стандарт золотого часа» лечебных назначений при тяжелом сепсисе и септическом шоке [1]. Выбор группы антибактериальных (АБ) препаратов для эмпирической антибактериальной терапии (ЭАТ) производится, исходя из предполагаемого характера возбудителя (вид нозологии), если это возможно [2].
При проведении ЭАТ используют все «постулаты», доступные для конкретного ЛПУ: раннее начало, оптимальность комбинированного использования, длительное введение время зависимых АБ (или введение АБ в соответствии с особенностями фармакодинамики и фармакокинетики), динамический контроль маркеров воспалительного процесса, контрольные микробиологические исследования биоматериала, короткий курс терапии - до 3 - 5 суток и т.д. [3, 4].
В качестве обсуждения приводим клиническое наблюдение:
Больной К., 74 года, поступил с диагнозом ОРВИ в Клинику инфекционных болезней 01.02.13 г. с жалобами на лихорадку до 40,20С, озноб, резкую слабость.
Из анамнеза: Заболел остро 31.01.13 г. Заболевание проявлялось ознобом, сухим надсадным кашлем, разбитостью, болями в суставах. С 2002 года находится под наблюдением у гематолога по поводу макроглобулинемии Вальденстрема и альдостеромы, страдает постоянной формой фибрилляции предсердий.
При поступлении состояние средней тяжести. Одышка до 25 в минуту, аускультативно - ослабление дыхание слева в нижних отделах, SpO2 = 91 – 93 об%.
Заключение по данным рентгенографии лёгких от 02.02.13 г.: Левосторонняя нижнедолевая пневмония. Признаки пневмосклероза и эмфиземы легких. Данные лабораторных исследований:
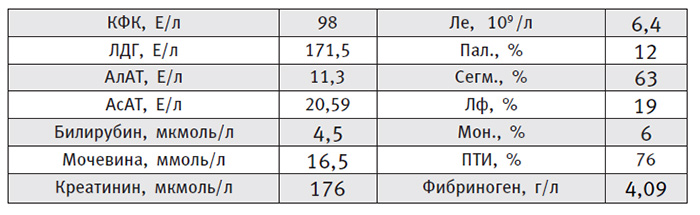
Назначено: обильное питьё, ингаляции с муколитиками, Виферон 1000 тыс. ЕД/сутки, Ципрофлоксацин - 800мг/сутки.
05.02.13 г. в 14.45 состояние больного ухудшилось (угнетение сознания, усиление одышки, снижение АД до 100 и 65 мм рт.ст.). После осмотра реаниматолога переведен в ОРИТ.
Объективный статус при поступлении: состояние тяжелое, Глазго = 11 баллов, SOFA = 7 баллов, выраженная одышка до 32 в минуту, температура - 38,60С. Аускультативно – влажные хрипы с обеих сторон, ЧСС 126 в минуту, пульс аритмичный, АД 100 и 40 мм рт.ст. Почасовой диурез – 15 мл.
Результаты скрининговых лабораторных исследований:
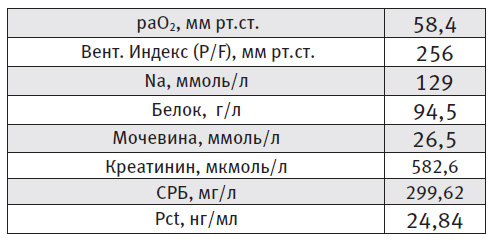
Заключение по контрольной рентгенограмме от 05.02.13 г.: Двусторонняя пневмония (тотальная правосторонняя с множественными сливными очагами, билобарная левосторонняя). КТ лёгких от 06.02.13 г.: Двусторонняя инфильтрация легочной ткани на фоне интерстициального отека («феномен матового стекла»).
В связи с выраженностью интоксикационного синдрома, быстротой нарастания легочного поражения взята кровь на экспресс - анализ ПЦР AH1N1. Получен положительный результат.
Выставлен клинический диагноз: Высокопатогенный грипп (АH1N1). Двусторонняя вирусно - бактериальная пневмония. Инфекционно - токсический шок. ОРДСВ 1 стадия, ОПН. Макроглобулинемия Вальденстрема. ИБС, мерцательная аритмия, тахисистолическая форма.
Определена стратегия интенсивной терапии:
- обеспечение сосудистого доступа (v. jugularis interna dextra - HF 1215V, B.Braun; v. subclavia sinistra SB 720, В.Вraun; ЦВД = 9 мм рт.ст.);
- вазопрессорная поддержка до уровня АДс 90 мм рт.ст. (АД комфорта для пациента 140 и 70 мм рт.ст.), норадреналин – 0,45 мкг/кг/мин, контролируемые дозы внутривенных ß-блокаторов (эсмолол);
- заместительная почечная терапия с профилированием Na и ультрафильтрацией под контролем ЦВД (гемодиализ [ГД]: 5.02.13 г., 6.02.13 г., 7.02.13 г.; постоянная вено - венозная гемодиафильтрация [CVVHDF]: 9.02.13 г.; суммарный объём ультрафильтрации составил 8,5 литров);
- противовирусная терапия (Осельтамивир 150 мг/сутки);
- деэскалационная эмпирическая антибактериальная терапия (Тиенам 2 г/сутки – инфузионно);
- гепаринотерапия (НФГ) под контролем АЧТВ;
- небулайзерная терапия (лазолван);
- ранняя нутриционная поддержка (сиппинг гиперкалорических смесей);
- мониторинг SpO2, КЩС в связи с высоким риском перевода больного на ИВЛ.
06.02.13 г. проведена лечебно - диагностическая ФБС. Заключение: Фибринозно - геморрагический трахеобронхит. Произведена санация (густая слизисто - гнойная мокрота). Бронхиальное лаважное содержимое взято на посев для микробиологического исследования и определения микрофлоры, ее чувствительности к антимикробным химиопрепаратам. До результатов исследования микрофлоры эффективность терапии отслеживалась по критериям шкалы SOFA, динамике лейкоформулы и лихорадки.
За период эмпирической антибактериальной терапии состояние больного сохранялось стабильно тяжёлым (Диаграмма 1): Глазго = 12 баллов, SOFA = 7 - 6 баллов, вазопрессорная поддержка (норадреналин – 0,45 - 0,37 мкг/кг/мин), заместительная почечная терапия, самостоятельное дыхание увлажненным кислородом (фракция кислорода на вдохе [FiO2] - 30%).
Диаграмма 1
Динамика SOFA и её компонентов с 1 по 4 сутки лечения в ОРИТ
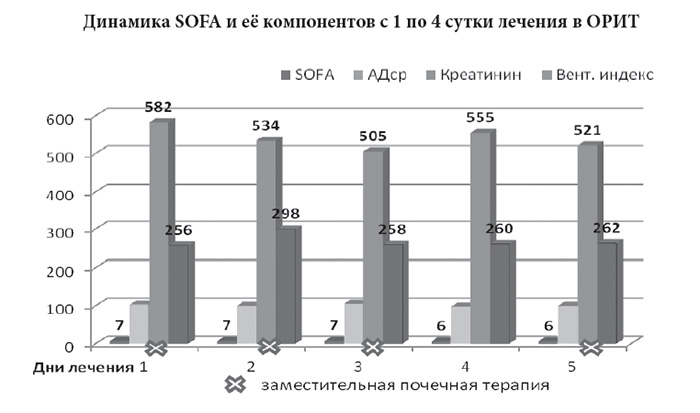
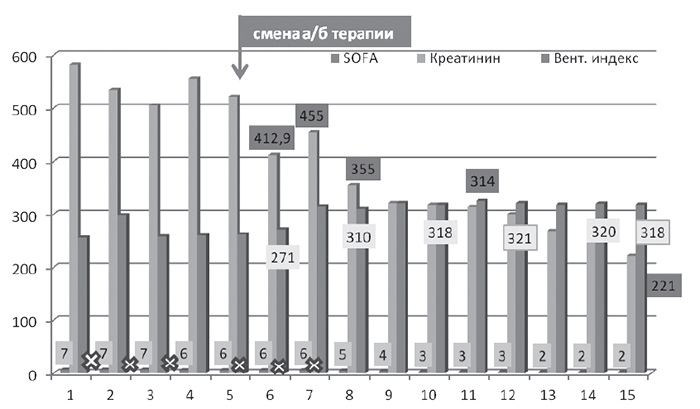
Полученные результаты микробиологического исследования (09.02.13 г.: Acinetobacter spp., Staphylococcus aureus (MRSA), Саndida albicans) позволили изменить схему антибактериальной терапии и дополнительно назначить противогрибковую терапию по максимальной чувствительности: Тигециклин 100 мг/сутки, Микафунгин 100 мг/сутки. Коррекция антибактериальной терапии в течение суток привела к стабилизации гемодинамики, отмене вазопрессорной поддержки, росту сатурации и вентиляционного индекса. Нормализация уровня острофазных белков и маркеров сепсиса происходила отсрочено, в интервале 3 - 6 дней (Диаграмма 2).
Диаграмма 2
Динамика маркеров воспаление в связи с целенаправленной антибактериальной терапией
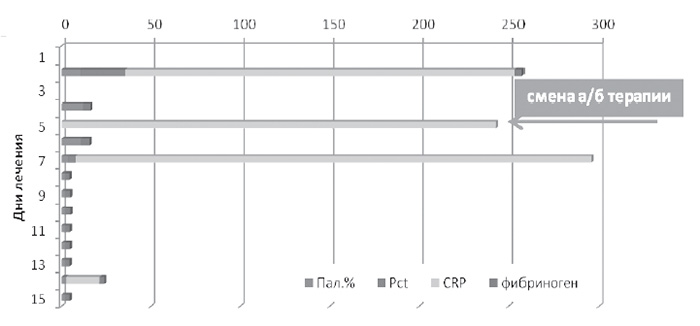
Динамическое наблюдение показывает явное преимущество индивидуальной целенаправленной антимикробной терапии (ИЦАТ) в сравнении с деэскалационной широкопрофильной, что проявляется достоверным снижением суммарной оценки тяжести пациента по шкале SOFA, уровня креатинина, ростом вентиляционного индекса (Диаграмма 3).
Сеанс заместительной почечной терапии Обсуждение Логика лечения сепсиса диктует необходимость раннего устранения септического очага (если это возможно), поддержания витальных функций (в соответствие со стандартами), предупреждения развития полиорганной недостаточности, ранней ИЦАТ.
Использование адекватного мониторинга, методов активной гемодинамической поддержки, своевременной заместительной терапии практически всегда позволяет временно стабилизировать состояние пациента. Насколько необходима ЭАТ? Вполне возможно, для узкоспециализированных ОРИТ такой вопрос не стоит, особенно в ЛПУ с отлаженной системой контроля микробиологического пейзажа. Однако, широкое использование ЭАТ без определения минимальной подавляющей концентрации приводит к росту полирезистентной нозокомиальной флоры (MRSA, VRE, ESBL, IMP-R, CPE-R), распространенность которой зависит от характера возбудителя, организации санитарно - эпидемиологического режима в ЛПУ и составляет от 2,1 до 66,5% [5-12].
Ряд современных обзоров доказывают ограниченные показания (перитонит, медиастенит, травматический сепсис, уровень оценки по APACHE II) использования при сепсисе агрессивной ЭАТ, сравнительно большую эффективность наиболее коротких курсов ЭАТ [13, 14], а в ряде случаев – повышение летальности при ЭАТ в сравнении с ИЦАТ [15-19].
Классические методы определения чувствительности микроорганизмов к антибиотикам (метод серийных разведений, метод бумажных дисков и т.д.) с учётом времени, необходимого для выделения чистых культур, позволяет получить результат через 48 - 72 часов. Существующие высокоинформативные, ускоренные, малозатратные методы (масс - спектрометрия, дисково - диффузный) позволяют сократить время от начала исследования до получения результатов в среднем до 6 - 8 часов. Насколько это важно? Ряд исследований достоверно подтверждают, что сокращение среднего времени исследования от 44,4 до 39,2 часов сопровождается уменьшением: коечного дня с 12,6 до 10,7 суток; летальности – от 9,6% до 7,9%; средней стоимости лечения пациента с 6677 до 4927 долларов США, что для России составляет среднюю стоимость трехкомпонентной деэскалационной терапии на 72 часа [20, 21].
Мы рассмотрели лишь частный пример.
За период 2012 - 2013 гг. 98 пациентов поступали в ОРИТ с признаками тяжелого сепсиса и септического шока.
До получения результатов посева им осуществляли синдромную терапию («соблюдая стандарт»). АТ назначали с учётом основной нозологии (если это было возможно) не меняя, либо отменяя АТ (в связи с явной неэффективностью), в зависимости от степени бактериальной опасности предполагаемого возбудителя.
Срок получения результатов по характеру микрофлоры и чувствительности к антибиотикам – 72 часа.
По результатам микробиологического исследования биоматериала от пациентов: процент высеваемых полирезистентных штаммов составил 38,6%, ошибка по назначенному спектру ЭАТ - 68,2%. Расчеты показали, что дальнейшая ИЦАТ позволила снизить длительность пребывания пациентов на 2,7 коечного дня и относительную летальность на 3,1%.
Выводы
1. Нерациональная антимикробная химиотерапия (без учета особенностей вероятных возбудителей), некорректный подбор доз при АТ (без учета особенностей фармакокинетики и фармакодинамики препаратов), сопутствующие коморбидные состояния, иммунокомпроментированность пациентов, поступивших в ОРИТ - определяют трудности выбора наиболее эффективных антимикробных препаратов в режиме стартовой АТ.
2. Назначение (смена) антибактериальной терапии у больных в ОРИТ оптимально проводить на основании клинико - лабораторного подтверждения микробного характера воспаления, идентификации возбудителя и определения его антибиотикорезистентности.
3. Одним из направлений снижения уровня полирезистентной бактериальной флоры в ОРИТ является знание данных локального микробиологического мониторинга отделения (и стационара в целом), снижение длительности курса ЭАТ (или оценка эффективности АТ через 48 - 72 часа) и уменьшение количества использованных АБ за счёт индивидуального подбора.
Литература
-
Dellinger, R. P., Mitchell, M. Levy, Rhodes, А., Annane D., Gerlach, H., Opal S. M. et all. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock / R. P. Dellinger, M. Levy Mitchell, А. Rhodes, D. Annane, H. Gerlach, S.
M. Opal et all // Intensive Care Med. – 2013. Vol. 39. – P. 165 - 228.
- Hatala, R., Dinh, T., Cook, D. J. Once-daily aminoglycoside dosing in immunocompetent adults: A meta-analysis. / R. Hatala, T. Dinh, D.
J. Cook // Ann Intern Med. – 1996. Vol. 124. – P. 717 – 725.
- Mouton, J. W. Impact of pharmacodynamics on breakpoint selection for susceptibility testing / J. W. Mouton// Infect Dis Clin North Am. – 2003. – Vol. 17. –P. 579 - 598.
- Choi, G., Gomersall, C. D., Tian, Q., Joynt, G. M., Li, A. M., Lipman, J. Principles of antibacterial dosing in continuous renal replacement therapy / G. Choi, C. D. Gomersall, Q. Tian, G. M. Joynt, A. M. Li, J. Lipman // Blood Purif. – 2010. – Vol. 30. – P. 195 - 212.
- Angus, D. C., Linde-Zwirble, W. T., Lidicker, J., et all. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care / D. C. Angus, W. T. Linde-Zwirble, J. Lidicker et all. // Crit Care Med. – 2001. – Vol. 29. – P. 1303 - 1310.
- Esteban, A., Frutos-Vivar, F., Ferguson, N. D. et all. Sepsis incidence and outcome: contrasting the intensive care unit with the hospital ward / A. Esteban, F. Frutos-Vivar, N. D. Ferguson et all. // Crit Care Med. – 2007. Vol. 35. – P. 1284 - 1289.
- Alberti, C., Brun-Buisson, C., Burchardi, H., Martin, C., Goodman, S. et all. Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study / C. Alberti, C. Brun-Buisson, H. Burchardi, C. Martin, S. Goodman et all. // Intensive Care Med. – 2002. – Vol. 28. – P. 108 - 121.
- Ferrer, R., Artigas, A., Suarez, D., Palencia, E., Levy, M. M. Effectiveness of treatments for severe sepsis: a prospective, multicenter, observational study / R. Ferrer, A. Artigas, D. Suarez, E. Palencia, M. M. Levy // Am J RespirCrit Care Med. – 2009. – Vol. 180. – P. 861 - 866.
- Garnach–Montero, J., Garcia-Garmendia, J. L., Barrero-Almodovar, A., Jimenez et all. Impact of adequate empirical antibiotic therapy on the outcome of patients admitted to the intensive care unit with sepsis / J. Garnach–Montero, J. L. Garcia-Garmendia, A. BarreroAlmodovar, Jimenez et all. // Crit Care Med. – 2003. – Vol. 31. – P. 2742 - 2751.
- Dellinger, R. P., Levy, M. M., Carlet, J. M., Bion, J. et all. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock / R. P. Dellinger, M. M. Levy, J. M. Carlet, J. Bion et all // Intensive Care Med. – 2008. – Vol. 34. – P. 17 - 60.
- Al-Hasan, M. N., Wilson, J. W., Lahr, B. D., Thomsen, K. M., Eckel-Passow, J. E. et all. Beta-lactam and fluoroquinolone combination antibiotic therapy for bacteremia caused by gram-negative bacilli / M. N. Al-Hasan, J. W. Wilson, B. D. Lahr, K. M. Thomsen, J. E. EckelPassow et all. // Antimicrob Agents Chemother. – 2009. – Vol. 53. – P. 1386 - 1394.
- Vincent, J. L., Bihari, D. J., Suter, P. M., Bruining, H. A., White, J., Nicolas-Chanoin, M. H., Wolff, M., Spencer, R. C., Hemmer, M. The prevalence of nosocomial infection in intensive care units in Europe. Results of the European Prevalence of Infection in Intensive Care (EPIC) Study / J. L. Vincent, D. J. Bihari, P. M. Suter, H. A. Bruining, J. White, M. H. Nicolas-Chanoin, M. Wolff, R. C. Spencer, M. Hemmer .// EPIC International Advisory Committee. JAMA. – 1995. - Aug 23-30. – Vol. 274(8). – P. 639 - 644.
- Morel, J., Casoetto, J., Jospe, R. et all. De-escalation as part of a global strategy of empiric antibiotherapy management. A retrospective study in a medico-surgical intensive care unit. / J. Morel, J. Casoetto, R. Jospe et all. // Critical Care. – 2010. N. - 14:R225 doi:10.1186/ cc9373.
- Article Review: Must-read article on study of ICU-acquired infections JAMA. – 1995. - Aug 23-30. – Vol. 274(8). – P. 639 - 644.
- Garnacho Montero, J., Garcia Garmendia, J. L., Barrero Almodovar, A. et all. Impact of adequate empirical antibiotic therapy on the outcome of patients admitted to the intensive care unit with sepsis / J. Garnacho Montero, J. L. Garcia Garmendia, A. Barrero Almodovar et all. // Crit Care Med. – 2003.
- Clec´h, C., Timsit, J. F., De Lassence, A. et all. Efficacy of adequate early antibiotic therapy in ventilator-associated pneumonia: influence of disease severity / C. Clec´h, J. F. Timsit, A. De Lassence et all. // Intensive Care Med. – 2004.
- Díaz-Martín et all. Antibiotic prescription patterns in the empiric therapy of severe sepsis: combination of antimicrobials with different mechanisms of action reduces mortality / Díaz-Martín et all. // Critical Care. – 2012. – N. 16:R223
- Kumar, A., Zarychanski, R. Early combination antibiotic therapy yields improved survival compared with monotherapy in septic shock:
a propensity-matched analysis / A. Kumar, R. Zarychanski // Crit Care Med. – 2010. – Vol. 38. – P. 1773 - 1785.
- Ibrahim, E. H., Sherman, G., Ward, S. et all. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting. / E. H. Ibrahim, G. Sherman, S. Ward et all. // Chest. – 2000.
- Barie, P. S., Hydo, L. J., Shou, J., Larone, D. H., Eachempati, S. R. Influence of antibiotic therapy on mortality of critical surgical illness caused or complicated by infection / P. S. Barie, L. J. Hydo, J. Shou, D. H. Larone, S. R. Eachempati // Surg Infect (Larchmt). - 2005.
- Савельев, В. С., Гельфанд, Б. Р., Яковлев, С. В. и соавт. Стратегия и тактика применения антимикробных средств в лечебных учреждениях России / В. С. Савельев, Б. Р. Гельфанд, С. В. Яковлев и соавт // Российские национальные рекомендации. – Москва. – 2012.
|

