двухмесячный научно-образовательный журнал
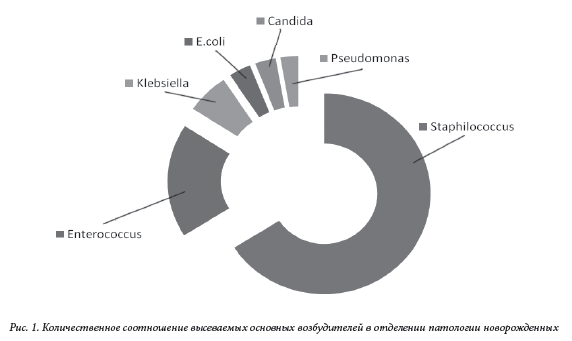
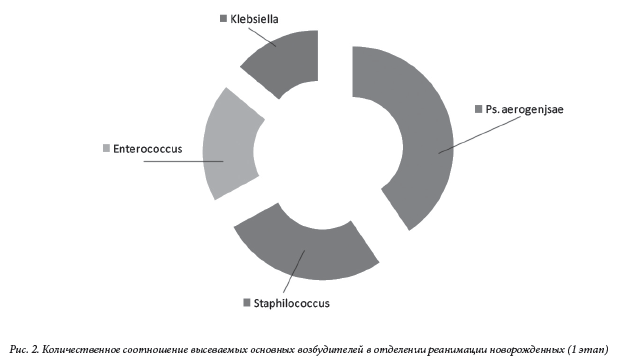
"Тольяттинский медицинский консилиум" 2016г. № 3-4Мониторинг микробного пейзажа как средство управляемой антибиотикотерапииМ.В. Фридман, Н.Э. Раваева, Н.М. Мартьянова, Е.В. Алексеевнин ГБУЗ СО ТГКБ№5 ( главный врач-к.м.н. Н.А. Ренц) Monitoring of microbial landscape as an antibiotic stewardship researchM.V. Fridman, N.E. Ravaeva, N.M. Martyanova, E.V. Alekseevnin Резюмеобсуждение проблемы рациональной антибиотикотерапии инфекционных заболеваний в педиатрической и неонатологической практике, основанной на принципах мониторинга микробного пейзажа. Ключевые слова: новорожденный, инфекция, антибиотикорезистентность, микробный пейзаж, рациональная антибиотикотерапия Проблема антибиотикорезистентности стала особенно актуальной и тревожной в XXI веке. В большинстве регионов мира, в том числе и в России, получили широкое распространение нозокомиальные штаммы микроорганизмов, характеризующиеся устоичивостью к большинству антимикробных препаратов (полирезистентность), а иногда и ко всем (панрезистентность). Полирезистентность обычно характерна для нозокомиальных штаммов как грамположительных бактерии (стафилококки, энтерококки), так и грамотрицательных бактерий (энтеробактерии, P. aeruginosa, Acinetobacter spp.). В стационарах нашеи страны традиционно превалируют резистентные стафилококки (MRSA) и энтеробактерии, устойчивые к цефалоспориновым антибиотикам в результате продукции бета-лактамаз расширенного спектра. В последние пять лет очень тревожной стала ситуация в ОРИТ с ацинетобактериями, которые постепенно стали доминирующими возбудителями нозокомиальных инфекции, проявляют слабую чувствительность к большинству антибиотиков, включая карбапенемы [1]. С другой стороны, в последние годы отмечена устойчивая тенденция к количественному снижению на рынке новых антимикробных препаратов (АМП), преодолевающих антибиотикорезистентность. Перспективы разработки принципиально новых антибиотиков для лечения нозокомиальных инфекции выглядят удручающе. В этой связи решение проблемы лечения в стационаре инфекций, вызванных полирезистентными бактериями, связано в основном не с ожиданием рождения новых АМП, а с разработкой и внедрением решительных и адекватных мер по сдерживанию антибиотикорезистентности. Антибиотики относятся к числу лекарственных средств, наиболее часто назначаемых новорожденным. Безусловное показание к назначению антибактериальной терапии новорожденным – это инфекционно-воспалительный процесс любой степени тяжести (включая и ограниченные локализованные процессы) [2]. В этой связи целью исследования явился постоянный мониторинг микрофлоры отделений реанимации и патологии новорожденных Межрайонного перинатального центра ГБУЗ СО «ТГКБ №5» с определением резистентности и чувствительности различных штаммов микроорганизмов. Методы исследованияПредпринятое нами исследование представляет собой ретроспективный анализ результатов бактериологического мониторинга, проведенного в отделении реанимации новорожденных, и отделении патологии новорожденных и выхаживания недоношенных детей за период 2013-2015 гг. Определение возбудителей производилось в следующих локусах: кровь, ликвор, зев, кишечник, кожа, глаза, верхние дыхательные пути, моча. Исследования проводились на MASS - SPECTROMETRIC. Всего было взято в исследование 4872 образца, из них 2320 проб оказались положительными. Результаты исследованияВ «стерильных» локусах (кровь, ликвор) чаще определялись Staphilococcus epidermidis и стафилококки других групп (Staphilococcus hominis, heamolyticus, saprophyticus). Посев ликвора во всех случаях не дал роста микрофлоры. Анализируя высевы из других локусов, по данным нашего исследования, преобладающая микрофлора представлена также группой стафилококков- 41,5% (от всех положительных высевов). В России в отделениях с интенсивным использованием АМП частота выделения Staphilococcus aureus среди всех грамположительных возбудителей составляет 75% [3] . На втором месте энтерококки-11,4%, на третьем месте клебсиелла-4.1%. Pseudomonas aeruginosa, candida albicans, E.coli выделяются соответственно в 1,7%; 2,0%; 2,1%. (см. рис.1) Картина микробного пейзажа в ОРИТН меняется. Здесь преобладает грамотрицательная флора. На 1 этапе 1 место занимает Pseudomna aerogenosa (6,3%); 2 место группа Staphilococcae (4,1%); 3 место Enterococcusae (2,9%); 4 место Klebsiellae (2,1%) (см. рис. 2).
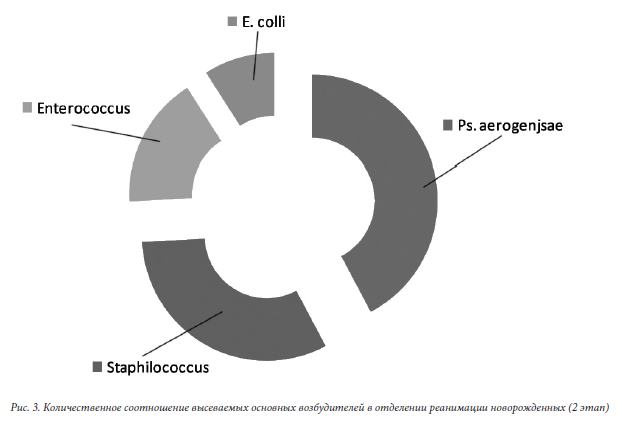
Картина II этапа лечения несколько отличается: 1-ое место принадлежит Klebsiellae (19,8%); 2-е место заняла группа Staphilococcae(14,5%); 3-е место Enterococcusae (7,6%); 4-ое место E. coli (4,1%) (рис.3).
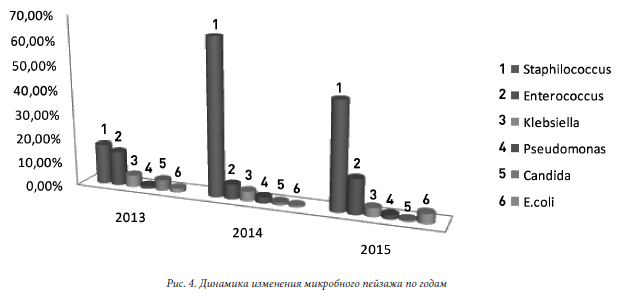
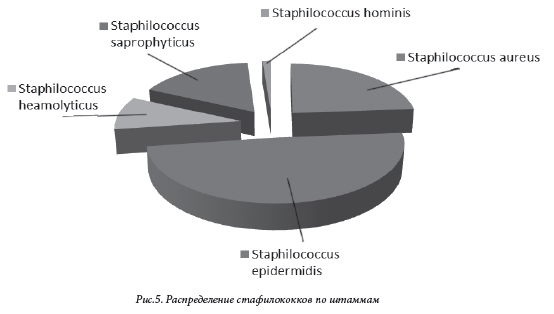
Динамика изменения микробного пейзажа по годам представлена ниже (см. рис. 4) Как видно из диаграммы, основными возбудителями, высеваемыми из различных локусов являются стафилококки. Известно, что из 16 видов стафилококков, связанных с человеком, золотистый стафилококк характеризуется наибольшей токсичностью, образуя токсины суперантигенного характера. Эпидермальный стафилококк имеет более низкую токсичность, однако имеет более хорошую способность к колонизации, особенно на искусственных материалах введенных в организм [4]. Распределение стафилококков в зависимости от штаммов выглядит следующим образом: Staphilococcus aureus-23,7%, Staphilococcus epidermidis-49%, Staphilococcus heamolyticus-9,4%, Staphilococcus saprophyticus-16,7%, Staphilococcus hominis-1,2% (рис.5). Несмотря на то, что согласно мировым данным, β- гемолитические стрептококки группы В вызывают колонизацию 20-25% родовых путей беременных женщин и являются одной из самых частых причин инфекции у новорожденных, в нашем отделении Streptococcus agalactiea не высевается [4, 5]. Распространенность другого вида грамположительных бактерий – энтерококков, составляет 11,4% от всех выделенных возбудителей. Основная локализация высева энтерококков: кожа, глаза, пупочная ранка. Грамотрицательные бактерии опасны формированием антибиотикорезистентности и чаще всего являются причиной заражения в ОРИТ. Чаще всего это Pseudomonas aerugenosa, Acinetobacter baumanii, E. Coli. Две первые имеют очень высокую степень резистентности к антимикробным препаратам и создают большие терапевтические проблемы. По данным разных авторов, частота инфекций вызванных Pseudomonas aerugenosa составляет от 10,8% до 22,3%. Особенностью этих микроорганизмов является их способность вызывать тяжелые вентилятор-ассоциированные пневмонии. Фактором вирулетности этих патогенов является способность образовывать экзотоксин, ангиген LPS-OВ защищающий от литического действия комплимента и способность образовывать защищающие от фагоцитоза оболочки [4,8]. В нашем отделении на первое место по частоте выявления выходит Klebsiella spр.-4.1%, второе и третье место делят E.coli-2.1% и Pseudomonas aerugenosa-1,7%. Грибковые инфекции представлены в основном грибами рода Candida и высеваются только из поверхностных локусов: кишечник, кожа, слизистые. Количественное выделение Candida состовляет 2,0%. К сожалению, антибиотикорезистентность характерна не только для нозокомиальных штаммов микроорганизмов. В Россииском пилотном многоцентровом исследовании этиологии и антибиотикорезистентности возбудителеи перитонитов установлено, что E. coli и Klebsiella spp. являлись наиболее частыми возбудителями перитонитов как внебольничной , так и нозокомиальнои этиологии. Обобщенные данные свидетельствуют о более высоком профиле антибиотикорезистентности нозокомиальных штаммов возбудителеи по сравнению с внебольничными: продукция БЛРС была выявлена у 21% внебольничных и 59% нозокомиальных штаммов, причем первое является достаточно неожиданным и неприятным сюрпризом [7]. В нашем отделении соотношение внебольных и внутрибольничных штаммов составляет 18,7% и 81,3 % соответственно. Анализируя чувствительность различных микроорганизмов к антибиотикам хочется отметить сохранения чувствительности стафилококков к цефоперозона сульбактаму в 100% (в 2013г.) и 95% ( в 20142015 гг.); к амикацину в 80%(в 2013г.), 50% (в 2014г.) и 75% (в 2015г.). Pseudomonas aerugenosa сохраняет чувствительность к тобрамицину-100%(в 2013г.) 85%(в 2014г.) и 100% (в 2015г.) и ципрофлоксацину-100% (в 2013-2014гг.) и 95%(в 2015г.), к цефоперозона сульбактаму чувствительность несколько снизилась от 100% (в 2013г.) до 90% (в 2014г.) и 86% (в 2015г.). Klebsiella сохраняет хорошую чувствительность к карбопенемам: имипинем- 100% (в 2013г.), 94% (в 2014г.) и 98% (в 2015г.). Меронем показывает такие же цифры чувствительности. Цефоперозона сульбактам также не сдает позиции, к нему чувствительность составляет соответственно 96% (в 2013г.), 65% (в 2014г.) и 98% (в 2015г.) ВыводыВ неонатологии особое значение имеет эмпирическая антибактериальная терапия, так как инфекционные заболевания у новорожденных не имеют, как правило, специфических патогномоничных признаков, а, следовательно, отсутствует возможность быстрого микробиологического обследования, в то время как решение о начале антибактериальной терапии необходимо принимать незамедлительно. Поэтому выбор эмпирической антибактериальной терапии необходимо основывать на ретроспективном анализе результатов бактериологического мониторинга [6]. Особое значение имеет разработка внутренних протоколов назначения антимикробных препаратов, так как нерациональное использование антибиотиков может иметь не только медицинские неблагоприятные последствия, но и социальные, юридические, деонтологические и экономические. Литература
|