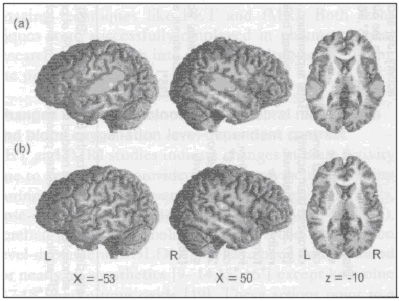
Цель обзора: Этот обзор представляет просмотр современных данных, связанных с изменениями активности мозга с углублением анестезии, главным образом, полученных с помощью изображения мозга и электрофизиологических методов у человека. Современные данные: Текущие исследования выявили, что головной мозг в целом не подвержен влиянию такой же степени анестезии, но отдельные области мозга (и особенно когнитивные процессы, опосредованные этими областями) более чувствительны к анестезии и седации, чем другие. Подавление активности в мультимодальной ассоциативной коре (такой как теменная и предлобная ассоциативная кора) седативными концентрациями анестетиков вызывает амнезию и нарушение внимания, тогда как активность в унимодальной коре и в таламусе остается, главным образом, без изменений при применении низких доз анестетиков. Активность в ретикулярной формации среднего мозга, таламусе и унимодальной коре, как, оказалось, подавляется только концентрацией анестетиков, вызывающей бессознательное состояние. Помимо этих региональных супрессивных эффектов, анестетики поражают функциональные связи между нейронами в распределённых и таламокортикальных сетях, что также способствует установлению анестезии. Резюме: Анестетики вызывают изменения в поведенческом состоянии пациента, влияя на активность мозга посредством, по крайней мере, двух механизмов: доза-зависимое общее и регионально специфическое подавление нейронной активности и распределения функциональной интерактивности в пределах распределённых нейронных сетей. Сокращения ВведениеВ прошлом, методы для оценки эффектов анестезии на активность головного мозга были основаны только на измерении поведенческих исходов или на электрофизиологических данных, таких как запись электроэнцефалограмм ( EEG ) или вызванных потенциалов [1]. В прошлой декаде прогресс в нейро-научных методов расширил этот предел методов, включив позитронную эмиссионную томографию ( PET ) и функциональное изображение магнитного резонанса ( fMRI ) [2]. Эти методы определяют место гемодинамических и метаболических изменений, вызванных анестезия-индуцированными изменениями активности головного мозга, в то время как электрофизиологические методы отражают электрическую активность коры с высокой временной, но низкой пространственной разрешающей способностью. В клиническом образце, текущие разработки нейромониторинга (например, биспектрального индекса ( BIS )) позволяют дать общую оценку нейронной активности во время операции [3]. Эти методы, однако, не прогнозируют движения или гемодинамические реакции на стимуляцию, но они не могут прогнозировать точно, когда отдельные пациенты будут восстанавливать сознание [4]. Отсюда, информированность (т.е. эксплицитная память) [5] и формирование имплицитной памяти наблюдается [6] даже при предположительно адекватной анестезии, руководствуясь нейромониторингом. Таким образом, важные аспекты церебральной функциональности во время анестезии остаются неизвестными [7]. С помощью дополнительных возможностей электрофизиологических методов и методов изображения мозга, этот пробел отчасти закрыт в современные годы при исследовании эффектов препаратов на нейронные связи, вовлекаемые в формирование внимания, процесс слуховой обработки данных, памяти и сознания. Более того, детальные исследования с четким контролем гипнотического состояния, адресованные бессознательному формированию памяти, уже выполнены. Таким образом, этот обзор суммирует современные данные, полученные различными методами исследования, и представляет систему взглядов, которая интегрирует текущую информацию. Активность головного мозга во время анестезии, измеренная с помощью функционального нейроизображенияФункциональное нейроизображение - это в основном современные методы изображения головного мозга, такие как PET и fMRI . Оба метода успешно применяются в фармакологических исследованиях и при исследовании действия анестетиков в последнее десятилетие. Изменения церебрального кровотока , церебрального метаболизма и оксигенации крови уровень-зависимым контрастомИсследования PET и fMRI показывают изменения активности мозга вследствие действия анестетиков, при условии, что сохраняются нейроваскулярные связи при анестезии [8]. С помощью этих методов, доза-зависимое снижение церебрального кровотока ( CBF ), церебрального метаболизма глюкозы и оксигенации крови доза-зависимым ( BOLD ) сигналом показано примерно для всех анестетиков [9-14,15,16], за исключением кетамина [17,18] и закиси азота [19]. Эти действия указывают на общее снижение нейронной активности при углублении анестезии. Эффективность при снижении активности головного мозга предположительно одинакова для внутривенных и ингаляционных анестетиков, что оценивались относительно схожими снижениями церебрального метаболизма на сопоставимых уровнях анестезии севофлюраном и пропофолом [19]. Потеря сознания происходит при церебральном метаболизме глюкозы примерно 60-65% [20]. За исключением общего снижения нейронной активности, некоторые области головного мозга, расположенные в пределах ассоциативных полей коры головного мозга (например, теменная и лобная ассоциативная кора), таламусе и в среднем мозге, показывают заметно более выраженное снижение церебрального кровотока, церебрального метаболизма или сигнала BOLD при сравнении с общим снижением [9-14, 15, 16, 19, 21-24] (смотри таблицу 1). Эти действия показывают специфические эффекты анестетиков для создания бессознательного состояния, амнезии и нарушения внимания: существуют убедительные доказательства, что таламус играет ключевую роль при анестезия-индуцированном бессознательном состоянии [25, 26], так как относительное метаболическое снижение регионального метаболизма глюкозы [12, 25] и CBF [27] наблюдалось в этой области при адекватной анестезии. И наоборот, низкие концентрации анестетиков, как оказалось, не оказывают или оказывают только небольшой эффект на таламус [22] и области, вовлеченные в первичную обработку информации (рис. 1 и 2).
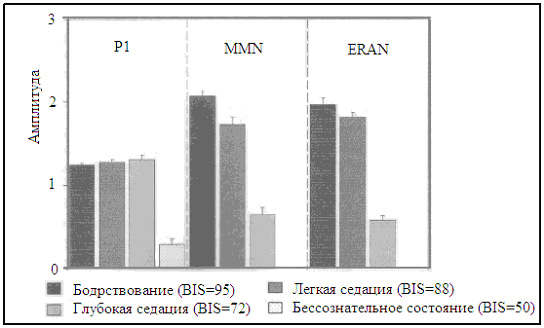
Низкие дозы препаратов, однако, как предполагается, вызывают амнезию либо посредством относительно неспецифической депрессии нейронной активности преимущественно в коре [28] или специфическими успокоительными эффектами на гипокамп [29], островковую долю большого мозга [22, 30], мозжечковую миндалину [31] и предлобную кору [30]. Эти действия анестетиков, как оказалось, поражают память путем нарушения кодирования новой информации в память (неспецифический эффект препарата вследствие седации) и путем нарушенного сохранения кодированного материла в долговременную память. Последний эффект, как, оказалось, является независимым от седации и вероятно отражает специфическое амнестическое действие анестетиков [32]. Хотя эти данные отчасти объясняют бессознательное состояние и амнезию, они не обеспечивают никакой информацией о нейронной активности, связанной с сенсорной стимуляцией во время анестезии. Исследования на животных предполагают, что спровоцированная активность коры может быть выявлена даже во время глубокой анестезии [33]. У человека, нейронная активность уже отмечалась с помощью функционального нейроизображения, вызванного другими стимуляторами [15, 30, 34], зрительным [13] или вредными стимулами [35] при поверхностной и адекватной стадиях анестезии (таблица 1). Например, мы наблюдали функциональную активность в обеих височных долях вызванную слуховым процессом обработки данных при эффективной местной концентрации пропофола выше 1,51 мкг/мл (рис. 1). Эта активация исчезала при концентрации, превышающей 3,35 мкг/мл. Подобным образом, севофлюран снижал слуховую спровоцированную функциональную активацию по доза-зависимому манеру. При сравнении с бодрствованием, остаточная активация была отмечена с двух сторон в верхней височной извилине, таламусе, стриатуме и левой лобной коре при 1% севофлюране, в то время как эта активность полностью подавлялась при 2% севофлюране [34]. В настоящее время, показано, что седативные дозы пропофода и тиопентала не изменяют повышения CBF , вызванного слуховыми стимулами, несмотря на 15% снижение общего CBF (gCBF) [41]. Даже при невосприимчивости (средний BIS = 66), реакция регионального CBF ( rCBF ) в левой височной доле была отмечена (хотя явно сниженная). В целом, эти данные предполагают, что слуховая стимуляция все еще вызывает активность коры, хотя и сниженную, во время поверхностных стадий анестезии. Суммарно: анестезирующее действие на активность мозга в покое, спровоцированная активность мозга и когнитивные функции в зависимости от глубины анестезии. Глубина анестезии показана по BIS , эффекту местной концентрации пропофола и минимальной альвеолярной концентрации ( MAC - это минимальная альвеолярная концентрация ингаляционных анестетиков при давлении в одну атмосферу, необходимая для предотвращения движения в ответ на хирургический разрез кожи у 50% пациентов). gCBF – общий церебральный кровоток; gCMR glu – общая церебральная скорость метаболизма глюкозы; aERP – слуховой спровоцированный потенциал; MMN - неподходящая отрицательность; ERAN – ранняя правая передняя отрицательность . Подобно слуховым стимулам, соматосенсорные стимулы могут также вызывать активность коры во время невосприимчивости, но это вероятно зависит от использованных стимулов. Вибротактильные стимулы не активируют кору и вызывают только активность таламуса при концентрации пропофола 1,5 мкг/мл [39]. И наоборот, вредные (жар) стимулы повышают CBF в соматосенсорной и средне-островковой коре даже при концентрации пропофола 3,5 мкг/мл (т.е., во время бессознательного состояния) [35]. Интересно, что передняя поясная кора – область, включающаяся в болевое восприятие [42], активируется жарой при более низких концентрациях пропофола. Таким образом, островковая доля большого мозга может быть активирована даже во время бессознательного состояния (хотя не вызывает болевого восприятия, а это скорее автономные реакции), в то время как другие структуры, отвечающие за болевое восприятие, оказались подавленными при концентрациях пропофола, вызывающих бессознательное состояние [35]. Эффекты кетамина на CBF [17] и церебральный метаболизм глюкозы [17, 18, 43] при активности мозга в покое ясно характеризуется для других анестетиках. Субанестезирующие дозы кетамина вызывают общее повышение rCBF , наиболее глубокие изменения в структурах головного мозга, связанных с процессом обработки боли [17]. Под вредной стимуляцией, однако, субанестезирующие дозы кетамина снижают болевые и стимулы, вызывающие активность мозга, с наибольшим снижением, наблюдаемым в таламусе и островковой доле большого мозга [44]. Помимо этих эффектов обезболивания, кетамин, как оказалось, в низких дозах влияет на активность головного мозга, связанную с «рабочей» памятью, в областях мозга, включающих лобную и теменную области коры и скорлупу [45], а также на активность, связанную с кодированием и восстановлением случайной информации в лобной и в гиппокампальной областях [46]. Изменения функциональной комплексности во время анестезииНейроны в головном мозге, как считается, взаимодействуют друг с другом, например, для передачи информации между областями коры и для связи отдельных перцепционных свойств в единый, сознательный результат [37, 47]. Разрыв этих функциональных связей в пределах нейронных путей возможно важен для эффектов препаратов таких как амнезия и бессознательное состояние [48]. Исследования нейроизображения показывают, что функциональная связность может быть исследована под анестезией, и что анестезия может быть связана с изменениями связности сети [26, 38]. White и Alkire [26] показали нарушенную кортико-кортикальную и таламо-кортикальную связность при концентрациях анестетика, вызывающих бессознательное состояние. Более современно, уже показано, что снижение комплексности в моторных путях посредством 0,5 минимальной альвеолярной концентрацией ( MAC ) севофлюрана вызывает функциональный разрыв между двумя полушариями (т.е., связь была ограничена только одним полушарием). При MAC севофлюрана = 1, моторная связность сети была полностью устранена [38]. Эти данные предполагают доза-зависимое снижение синхронизированной височной взаимосвязи между нейронами в пределах функциональных связей во время анестезии. Гипотеза, что прерывание связности является механизмом, который снижает активность мозга и вызывает поведенческие изменения, также подтверждается современной работой по EEG , показывающей электрический разрыв различных отделов головного мозга анестетиками [49]. Эти исследования показали, что помимо региональных супрессивных действий анестетиков, разъединяющие эффекты оказались равно важными для получения анестезии и подавления нейронной активности. Активность мозга во время анестезии, оцененная электрофизиологическими методамиТак как анестетики влияют на EEG характерным образом, существуют разнообразные методы, предоставляющие индексы глубины анестезии, выведенные по EEC или спровоцированной потенциалами форме волны [4, 50]. Хотя они позволяют дать общую оценку активности мозга, они не могут в достаточной мере быть точными при различии между уровнями седации или при оценке специфической функции мозга во время назначения препаратов. Запись длительной задержки слуховых спровоцированных потенциалов ( LLAEPs ) или слуховых спровоцированных потенциалов мозга ( AERPs ) обеспечивает путь для различия между уровнями седации [51] и для точной оценки когнитивного состояния больного во время седации. В отличие от слуховых потенциалов со средней задержкой, регистрация, которых главным образом отражает активность в пределах первичной слуховой коры, LLAEPs (или AERPs ) отражают нейронные механизмы, которые могут также вовлекать другие области коры (такие механизмы лежат в основе, например, слуховой сенсорной памяти, музыкальном и языковом процессе обработки данных и ориентации на нестандартные стимулы) [52, 53]. Первое положительное отклонение на форме волны LLAEP - это P1, за которым следует отрицательное отклонение, N1. P1 отражает сенсорную кодировку слуховых стимулов признаков [52, 54], в то время как N1, как оказалось, отражает сознательное определение отдельных изменений в любом субъективном измерении слуховой среды [55]. Амплитуда N1 снижается при увеличении седации [36, 56, 57], но определяется у индивидуумов, не реагирующих на речевые команды [36]. И наоборот, амплитуда P1 поражается только при бессознательном состоянии, но как оказалось, не изменяется во время глубокой седации (рис. 2) [36]. Наличие P1 и N1 при BIS , показывающем бессознательное состояние (нервные генераторы обоих компонентов получены как расположенные в слуховой коре, хотя оба компонента получают вклады от различных нервных структур), подтверждается исследованием нейроизображения [15, 30, 34], показывая нейрональную активность в слуховой коре во время поверхностной стадии анестезии (рис. 1 и 2). AERP , которая в некоторых исследованиях использовалась для изучения эффектов седации на процесс обработки слуховых данных – это отрицательность несоответствия (MMN) [52, 58]. MMN извлекается путем отклоненных от нормы стимулов, которые возникают в исследованиях повторяющихся стандартных стимулов (например, в повторяющийся серии стандартных звуков, частота отклонения от нормы дает MMN). Считается, что MMN отражает операции слуховой сенсорной памяти, преаттентивное краткосрочное сохранение звуковой информации. В настоящее время, доза-зависимая поломка слуховой сенсорной памяти показана при регистрации MMN [36, 51, 56, 57]. Амплитуда MMN снижается с ростом седации и не определяется при BIS = 50 (рис. 2) [36]. Это предполагает длительное снижение нейрональной активности в пределах MMN -генерирующих связей, расположенных в височной и лобной областях мозга с ростом седации, а также провал этой системы памяти во время бессознательного состояния. Вследствие методологических трудностей, эффекты седативных препаратов на обработку лингвистической информации не исследовались с AERPs . Интересно однако, что обработка синтаксической информации исследовалась с помощью музыкальных стимулов. Музыкальные синтаксические неравномерности вызывают раннюю правую переднюю отрицательность (ERAN); этот компонент вырабатывается в областях мозга, которые также обеспечивают обработку синтаксической информации. Современные исследования показывают, что ERAN , как и MMN , постоянно снижается с ростом седации, вызванной пропофолом (рис. 2), и что ERAN исчезает при более высоких значениях BIS (выше 68), чем MMN (S. Koelsch , W. Heinke , D. Sammler , D. Olthoff , неопубликованные данные). Последние данные предполагают, что лингвистические функции нарушаются более низкими дозами седативных препаратов, чем функции лежащие в основе слуховой сенсорной памяти, и что нервные механизмы важные для синтаксической обработки данных не работают при значениях BIS около 68. Другой спровоцированный потенциал (ERP), который широко используется для оценки когнитивной функции - это P3. Вообще, этот ERP компонент, как предполагается, отражает перенос информации в сознании, процесс, который вовлекает различные области мозга [59]. Классическое париетальное распределенное P3 (часто обозначается как P3b ) происходит только когда индивидуумы сознательно обнаруживают целевой стимул. Это ERP принимается для отражения операций механизма, который модернизирует модель внешней среды или контекст в рабочей памяти [60]. Независимо от внимания, однако, определенные стимулы могут, тем не менее, вызывать более раннее, фронтальное распределение P3 (обозначается как P3a ) [6 l ], которое взято для отражения непроизвольного переключения внимания на непредвиденные или важные стимулы [62, 63]. В настоящее время, эффект пропофола на P3 полностью исследован: когда индивидуумы слушали пассивно серии звуков, P3 a была установлена путем отклонения стимулов во время бодрствования и легкой седации, но исчезает во время глубокой седации [36]. В другом эксперименте, в котором индивидуумы тренировались отвечать на отклонения стимулов посредством нажатия кнопки ответа, однако, Р3 a (а не Р3 b ) была видима (хотя явно сниженной) даже при глубокой седации (среднее BIS = 68; на этом уровне, индивидуумы не реагировали поведением на задачу) (S. Koelsch , W. Heinke , D. Sammler , D. Olthoff , неопубликованные данные). Резюмируя, эти данные показывают, что нервные процессы, расположенные на уровне первичной слуховой коры, остаются интактными во время седации. В противоположность, когнитивные процессы, лежащие в основе генерации MMN , ERAN и P3 (которые вовлекают нервные генераторы, расположенные за пределами уровня первичной сенсорной коры), значительно поражаются седацией. Процессы, лежащие в основе генерации MMN и P3 поддаются наблюдению, хотя ясно снижаются при BIS = 68. Тотальная поломка механизма этих процессов происходит при значениях BIS ниже 68, предположительно в пределах BIS между 68 и 50. Активность мозга во время анестезии, оцененная по поведенческим тестамМногочисленные исследования изучали эксплицитную и имплицитную память после анестезии. Эксплицитная память, главным образом, являются результатом неадекватной анестезии [5, 7, 64]. В противоположность, возможность формирования имплицитной памяти остается спорной. Очень тщательный контроль глубины анестезии ( BIS = 50-55), однако, предотвращает формирование имплицитной памяти [40]. Это соответствует нейроизображению и исследованиям EEG , показывающим недостаток активности мозга под соответствующей анестезией, и противопоставляется предшествующим исследованиям, сообщая о возможности формирования памяти во время бессознательного состояния [6, 65, 66]. Большинство исследований ERP и исследований изображения, однако, наблюдали волонтеров при отсутствии операции и таким образом не исключили риск формирования имплицитной памяти, спровоцированной хирургической стимуляцией под адекватной анестезией [65, 67]. ВыводФункциональное нейроизображение служит дополнением к электрофизиологическим и поведенческим оценкам активности головного мозга во время анестезии, обеспечивая лучшее понимание того, как глубина анестезии поражает нейронные связи, вызывающие специфические когнитивные функции. Ссылки и рекомендации для чтения
|
||||||||||||||||||||||||||||